临床-影像组学列线图对非小细胞肺癌肺门与纵隔淋巴结转移的预测研究*
2023-12-03刘长林万学东谢宗玉
徐 鹤 王 伟 刘长林 万学东 谢宗玉 周 辉,*
1.安徽省凤阳县人民医院医学影像科 (安徽 凤阳 233100)
2.蚌埠医学院第一附属医院放射科 (安徽 蚌埠 233004)
肺癌是我国和世界范围主要癌症之一,其中80%为NSCLC[1]。肺门与纵隔淋巴结状态是NSCLC患者治疗方式的重要决定因素,例如Ⅰ、Ⅱ期NSCLC推荐外科手术根治性切除,而根治性同步放化疗是不可切除Ⅲ期NSCLC的主要治疗方式[2]。另外,研究表明LNMs也是NSCLC患者预后的独立预测因素[3]。所以准确识别阳性淋巴结至关重要。传统影像学检查(如CT、MR、PET/CT)以及病理学活检因其自身的局限性,往往带来一定的弊端[4]。影像组学则是从影像图像中高通量地提取大量影像信息,将视觉影像信息转化为深层次的定量影像特征来进行量化研究,用于疾病的诊断及预后评估[5-6]。本文旨在探究临床-影像组学列线图对NSCLC患者肺门及纵隔LNMs的预测价值,以便早期评估NSCLC患者病情。
1 资料与方法
1.1 一般资料选取我院及某三甲医院2020年1月至2023年2月收治的190例NSCLC患者。收集患者性别、年龄、吸烟史以及CEA指标。
纳入标准:患者首次进行肿瘤完全切除与系统性淋巴结清扫;肺部CT检查与手术时间间隔不超过两周;CT图像可识别原发病灶,且肿瘤边界清晰可见;患者无其他肿瘤病史。排除标准:未进行根治性手术治疗;患者之前接受过放、化疗;肺部CT检查与手术时间间隔超过两周;肺部未发现原发病灶或原发病灶无法判定;无法判定原发肿块的具体边界;患者同时患有其他肿瘤。本研究经医院伦理委员会审核通过。
1.2 图像采集与重建CT检查前训练患者呼吸。患者取仰卧位,采用GE Optima 680 Series 64排CT,管电压120kV,管电流339mA,视野(FOV) 444mm×444mm,窗宽1500HU,窗位-450HU;从颈根部开始扫描,范围至双侧肋膈角最下缘,包含全部肺组织。扫描层厚5mm,扫描层间距5mm,重建层厚1.25mm。
1.3 CT征象评估由一名中级职称放射医师与另一名高级职称放射医师单独阅片,阅片结果出现分歧时,经协商达成一致。阅片内容包括:(1)病灶形态;(2)病灶类型;(3)病灶位置;(4)病灶最大长径(轴位测量);(5)病灶成分,包括磨玻璃为主或实性成分为主;实性成分为主指实性成分占比>50%,反之磨玻璃为主。(6)病灶相关征象,包括空泡征、毛刺征、分叶征、瘤内钙化、瘤内液化坏死、胸膜牵拉征、空气支气管征、血管集束征、周围肺气肿以及胸腔积液。
1.4 研究队列分组我院133例NSCLC患者作为训练组(LNMs 58例,无LNMs 75例),另外一家医院57例作为外部验证组(LNMs 25例,无LNMs 32例)。
1.5 提取影像组学特征、特征降维及筛选为避免高密度造影剂干扰影像组学特征提取,选取患者平扫图像进行研究。将图像导入影像组学科研平台,所导入图像为肺窗薄层DICOM格式。由两名放射医师沿病灶边界手动逐层勾画ROI,生成三维感兴趣容积(volume of interest,VOI)并提取特征(图1),筛选组内相关系数(intraclass correlation coefficient,ICC)大于0.75的影像组学特征。数据预处理采用“最大绝对值归一化”,该组件通过除以所有样本中每维特征的最大绝对值将每一维度特征线性映射到[-1,1]之间,无需配置参数,不会移动和中心化数据,因此不会破坏任何的稀疏性。LASSO-Logistic回归筛选出少数最具有预测意义的影像组学特征。
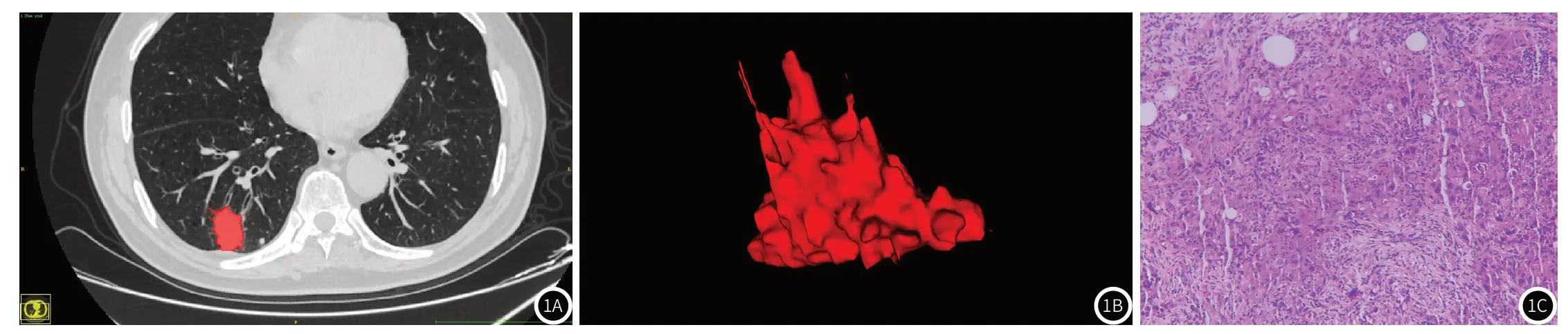
图1A-图1C 男,68岁,NSCLC患者;图1A ROI勾画示意图;图1B 病灶VOI示意图;图1C 患者纵隔淋巴结病理图片,可查见癌细胞(HE染色,20×20倍)
1.6 建立模型、验证模型预测效能采用Logistic回归,使用筛选出的特征构建影像组学模型,以Radscore表示。临床资料与CT征象构建临床模型。结合临床资料、CT征象以及Radscore构建临床-影像组学列线图模型。外部验证组用于验证模型预测效能。
1.7 统计学分析采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料,采用独立样本t检验,以“”表示;不符合正态分布的计量资料,采用Mann-Whitney U检验,以“中位数(第一四分位数-第三四分位数)”表示。计数资料采用卡方检验或Fisher's精确概率法,以“例数(百分占比)”表示。单因素和多因素Logistic回归分析LNMs的独立预测因素。AUC评估预测效能。Delong检验评估AUC差异。R语言(Version 4.2.2)绘制校准曲线评估一致性,DCA评估临床适用性。双侧P<0.05认为差异具有统计学意义。
2 结果
2.1 一般资料训练组中,LNMs和无LNMs在CEA、病灶成分、分叶征、毛刺征以及空泡征方面具有统计学差异(P<0.05)(表1)。
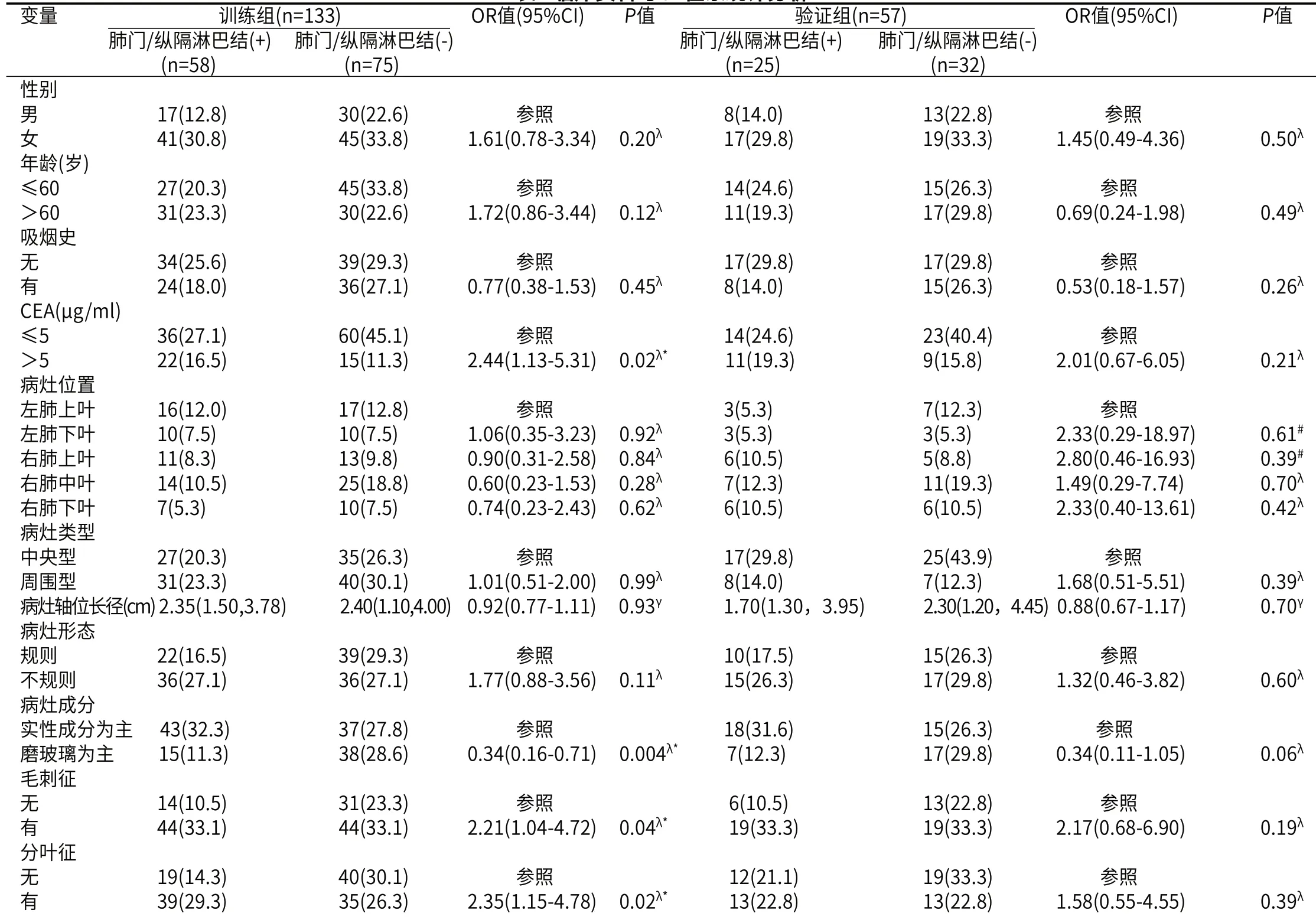
表1 临床资料与CT征象统计分析
2.2 模型构成及预测效能共提取1781个特征维度(ICC>0.75),最终入组6个特征维度构成影像组学模型,分别为高灰度区域强调(HighGrayLevelZoneEmphasis)、小尺寸区域分布强调(SmallAreaEmphasis)、逆方差(InverseVariance)、最大特征值(Maximum)、最小轴长度(LeastAxisLength)、联合平均(JointAverage),Radscore=+1.066×HighGrayLevelZoneEmpha sis+0.843×SmallAreaEmphasis+0.789×InverseVariance+0.701×Maximum+0.545×LeastAxisLength+0.473×JointAverage -2.093(图2)。临床模型由毛刺征、病灶成分以及CEA构成(表2)。临床-影像组学列线图模型由毛刺征、病灶成分以及Radscore构成(表3)。训练组中,临床模型、影像组学模型以及临床-影像组学列线图模型AUC分别为0.762(95%CI:0.680~0.831)、0.759(95%CI:0.677~0.829)及0.840(95%CI:0.767~0.898)(图3A)。外部验证组中,三种模型AUC分别为0.729(95%CI:0.595~0.838)、0.730(95%CI:0.596~0.839)及0.800(95%CI:0.673~0.894)(图3B)。Delong检验显示,临床-影像组学列线图模型与另外两种模型在训练组中的AUC差异存在统计学意义(P<0.05),在外部验证组中无统计学差异(P>0.05)(表4)。
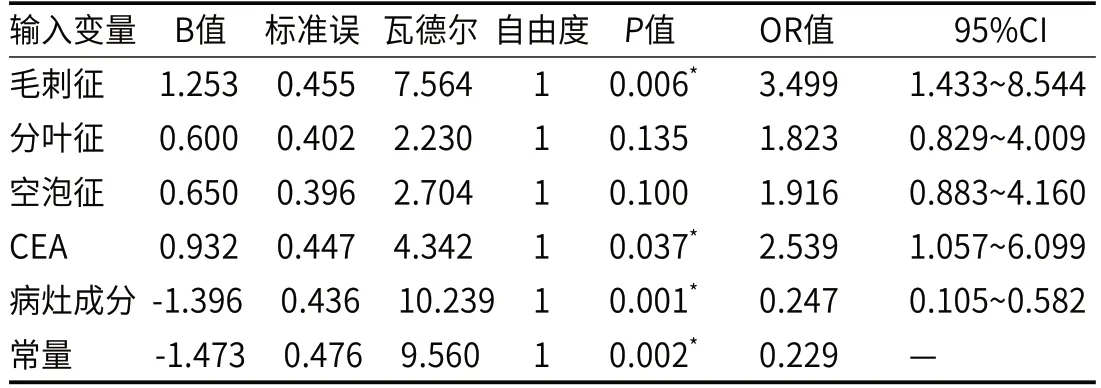
表2 临床模型输入变量多因素Logistic回归分析
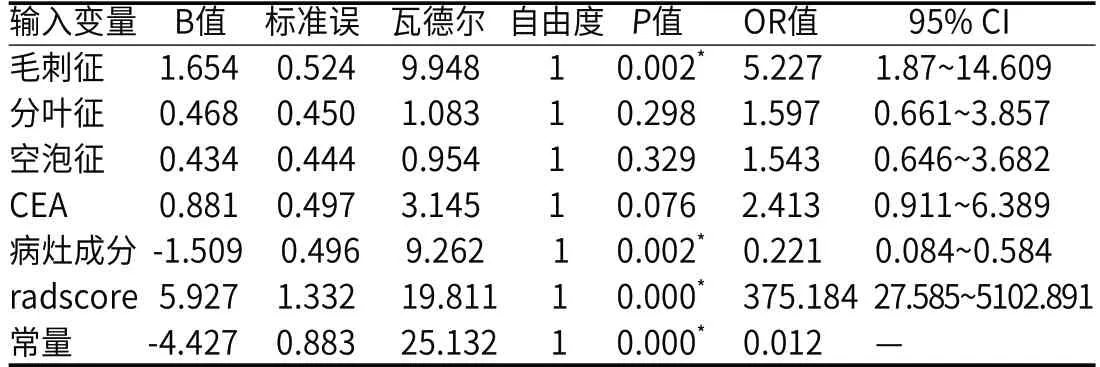
表3 临床-影像组学列线图模型输入变量多因素Logistic回归分析
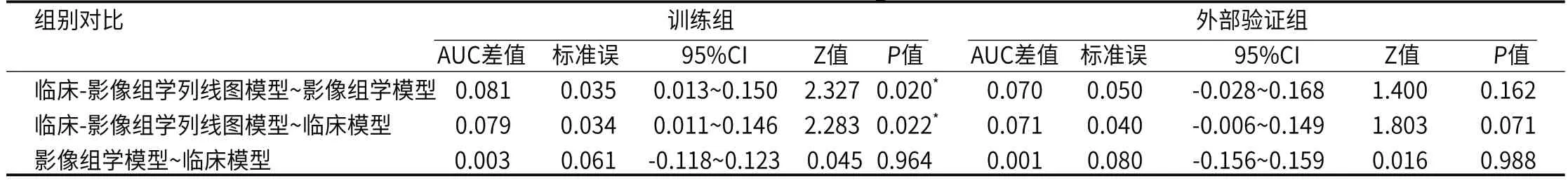
表4 模型间AUC差异Delong检验分析
2.3 临床-影像组学列线图、校准曲线及DCA绘制列线图(图4)。Hosmer-Lemeshow检验及校准曲线均显示,列线图模型在训练组与外部验证组中对肺门与纵隔淋巴结的预测与实际淋巴结状态之间具有较好的一致性(P>0.05)(图5)。训练组和外部验证组中的DCA均显示,在大部分阈值范围内,列线图模型的净收益大于所有患者接受干预以及无患者接受干预(图6)。

图5A-图5B 临床-影像组学列线图模型校准曲线;图5A 训练组;图5B 外部验证组;Actual Probability:真实概率;Predicted{LN=1}:淋巴结转移预测概率;Apparent:实际预测概率;Bias-correted:矫正预测概率;Ideal:理想预测概率图6A-图6B 三种模型的DCA;图6A 训练组;图6B 外部验证组;clinical_model:临床模型;radiomics_model:影像组学模型;nomogram_model:临床-影像组学列线图模型
3 讨论
本研究构建了三种预测模型,用以对NSCLC患者的肺门与纵隔LNMs进行预测。研究者对比分析了三种模型的预测效能,以临床-影像组学列线图模型最高,并通过外部验证组验证了该模型的有效性。另外,该列线图模型具有较好的校准度与良好的临床适用性。
在影像组学模型中,高灰度区域强调预测价值最大,其次为小尺寸区域分布强调。二者均为灰度大小区域矩阵(gray level size zone matrix,GLSZM)特征,这些参数表达了特定图像中像素之间的不均匀性,提示NSCLC肺门及纵隔淋巴结转移可能与肿瘤的异质性相关[7]。此外,逆方差、最大特征值、最小轴长度、联合平均亦与NSCLC肺门及纵隔LNMs相关。在临床模型与临床-影像组学列线图模型中,毛刺征与病灶成分均可作为NSCLC肺门及纵隔LNMs的独立预测因素,与先前研究一致[8-9]。肿瘤对周围小血管、小支气管以及小淋巴管的浸润是肺癌毛刺形成的原因之一,研究表明毛刺征是肺亚实性结节浸润性的独立危险因素[10]。由此猜想,具有毛刺征的NSCLC比无此征象者可能具有更高的恶性生物学行为,进一步表明此征象与LNMs相关。病灶实性成分占比越大,肿块内活跃的肿瘤细胞比例就较多,侵袭性更强,这可能是实性成分占与LNMs呈正相关的原因。CEA水平在临床模型中也是淋巴结转移的独立预测因素,与陈、Wang等的研究一致[11-12]。NSCLC患者血清中CEA水平随临床分期的进展而升高,血清CEA持续升高,提示预后不良[13]。通常,邻近病灶的胸膜出现牵拉征象往往与脏层胸膜侵犯相关[14]。而脏层胸膜富含淋巴网络,出现胸膜侵犯的肿瘤可能有着更高的LNMs发生率[15]。然而,Liu[16]等的研究表明无胸膜牵拉征象是cN0期周围型肺癌淋巴结受累的指标,本研究也显示胸膜牵拉与LNMs之间无必然联系。确切原因尚不得知,可能是因为受牵拉的胸膜并不一定存在胸膜侵犯。另外,我们所观察到的胸膜牵拉实际也可能是肿瘤阻塞周围小气道而出现的局灶性肺不张。He[17]等的研究显示,年龄、肿瘤直径以及肿瘤位置是可切除NSCLC患者LNMs的独立预测因素,本研究与之不同,造成这种差异的原因可能是研究样本存在偏差。
在训练组中,临床-影像组学列线图模型预测效能最高(AUC=0.840),高于影像组学模型(AUC=0.759)以及临床模型(AUC=0.762)。Delong检验显示具有统计学差异(P<0.05),表明在预测NSCLC患者LNMs方面,列线图模型与另外两种模型存在显著差异。在外部验证组中,虽然临床-影像组学列线图模型与其他两种模型之间的AUC差异无统计学意义(P>0.05),但是临床-影像组学列线图模型的AUC(0.800)仍高于影像组学模型(AUC=0.730)以及临床模型(AUC=0.729),表明影像组学与临床因素可以相互配合,进一步提高模型的预测效能。临床-影像组学列线图模型校准曲线显示,实际预测曲线与矫正预测曲线的实验点均分布于理想预测曲线附近,并且部分实验点几乎与理想预测曲线重合,说明该模型具有较高的校准度。虽然列线图模型对肺门及纵隔淋巴结转移具有良好的预测效能,但是并不能以此充分确定其临床可用性。为此,研究者使用DCA得出,无论是训练组还是外部训练组,在大部分阈值范围内,列线图模型在预测淋巴结转移方面比所有患者接受干预以及无患者接受干预更有利。
本研究不足之处:(1)未对增强图像进行影像组学研究,并与平扫图像进行对比分析;(2)未探索瘤内结合瘤周影像组学对淋巴结转移的预测效能;(3)未纳入基因组特征,如间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)。研究证实,与ALK阴性的N0期肺腺癌相比,ALK重排与隐匿性淋巴结转移的发生率显著升高相关[18]。(4)回顾性研究,存在选择偏倚。
影像组学可以作为预测NSCLC肺门及纵隔淋巴结状态的重要补充手段,结合临床资料、肿瘤标志物以及CT征象构建预测模型,可能比单一的影像组学表现更好。通过列线图将模型的回归方程可视化,提升可读性,方便对NSCLC患者淋巴结状态进行评估。
