3.0T-MRI表观扩散系数在乳腺癌预后和病理分型的应用价值
2023-12-03曾辉辛娟陆鹏王红
曾 辉 辛 娟 陆 鹏 王 红
新疆医科大学第二附属医院医学影像中心 (新疆 乌鲁木齐 830063)
有研究报道[1],发达国家中每8位妇女就有1位乳腺癌患者。我国女性乳腺癌发病率也逐年递增,且增长速度比发达国家高1%~2%[2-3]。虽然超声及钼靶X线摄片作为乳腺癌的传统影像诊断方式,提高了乳腺癌检出及诊断率,但对良恶性病变特别是致密型乳腺的鉴别仍有很大局限性,亚洲女性大多乳腺结构致密,乳腺脂肪含量较少,极易误诊漏诊[4]。乳腺癌在分子水平呈高度特异性,不同病理分型表现出不同生物学行为,预后差异也较大[5]。相比于传统影像学技术,磁共振成像(MRI)技术对软组织分辨率较高,已被广泛应用于临床实践中。3.0T-MRI是全球最先进的超高场磁共振机器,具有图片更加清晰,定位更加准确,可处理超高分辨率图像数据流,安全性能好等优点[6-7]。随着MRI领域的开拓,扩散加权成像(DWI)技术也逐渐被应用于乳腺疾病诊断中,其基本原理是通过检测机体组织中水分子布朗运动来判断乳腺疾病,再通过表观扩散系数(ADC)值对这种运动进行量化,从分子水平上鉴别异常乳腺与正常乳腺。自Englander[8]首次将DWI应用于乳腺病变诊断以来,已有很多学者[9]探讨DWI在乳腺病变中的应用价值以及ADC与雌激素受体(ER)、孕激素受体(PR)等不同预后因子的相关性。此外,目前大多研究只运用单一b值DWI-ADC参数与乳腺癌预后因子进行分析,且结果有所不同[10]。然而,鲜有研究探讨ADC值对乳腺癌预后复发的预测价值。本研究旨在探讨不同b值下ADC值对乳腺癌病理分型的诊断价值,以及ADC值对乳腺癌预后复发的预测价值,旨在为临床实践提供理论依据。
1 资料与方法
1.1 病理资料回顾性收集2018年2月至2022年1月于我院诊断为乳腺癌患者136例纳入试验组。
纳入标准:肿瘤边缘距乳头距离大于3cm;临床资料完整;长期随访资料完整;经病理及影像学确诊为乳腺癌;病理活检前行DWI检查,可明确测量病灶ADC值。排除标准:病灶总数>2个,单病灶直径<1cm;术前有接受其他抗肿瘤治疗或放、化疗治疗;诊断时出现局部区域复发或远处转移;MRI图像质量差、伪影重;病灶不能同时被T2WI、DWI和DCE-MRI序列检出。同期选择术后病理证实良性肿瘤136例为对照组。本研究已经我院伦理委员会批准,并经患者知情同意。
1.2 一般资料收集收集患者的年龄、婚姻情况、生育情况、月经状况、肿瘤家族史、病程、T分期(T1期、T2期、T3期)、肿瘤位置(左乳、右乳)、肿瘤直径、病理分型、淋巴结转移、激素受体(ER、PR、HER2、Ki-67)、ADC值。
1.3 MRI检查所有患者均采用philips 3.0 MRI扫描仪进行扫描,使用乳腺专用线圈。患者取俯卧位,乳房自然下垂,矢状位平扫时进行单侧乳房扫描,平扫冠状面和横断面时双侧乳房同时进行扫描。扫描参数:均采用T1WI-SPGR序列、T2WI-SPAIR序列及DWI序列、T2WI-FSE序列扫描,然后将图像上传到后处理工作站,使用感兴趣区(ROI)分别测量病变的ADC值。
1.4 诊断标准图像分析:由2名高职影像医师,使用双盲法对MRI图像阅片,若意见不一,经过讨论得到同意诊断结果;在后处理时选择ROI并测量ADC值。DWI:选取5个避开钙化、出血、液化、坏死及囊变病灶较清晰的ROI,计算不同b值下ADC平均值。
1.5 随访随访从初次确诊为乳腺癌开始至患者死亡或截止2022年1月随访结束。术后2年每3个月复查1次,术后第3年开始每6个月复查1次。根据术后随访情况分为未复发组(104例,无局部复发和远处转移)和复发组(32例,局部复发或/和远处转移)。
1.6 统计学方法数据分析采用SPSS 22.0软件。计量资料采用()表示,采用t检验分析,计数资料采用率(%)的形式表示,组间比较采用χ2检验。采用Logistic回归分析乳腺癌术后复发因素;ROC曲线分析ADC对乳腺癌病理分型以及术后复发的预测价值;使用Kaplan-Meier法分析不同ADC值患者术后5年内复发情况。检验水准α=0.05。
2 结果
2.1 乳腺癌患者MRI-DWI检查情况图1为一名41岁女性患者,左乳占位,T1WI可见左乳外上象限类圆形肿块,病灶呈低信号影,见图1A;T2WI可见病灶信号不均匀,中心高信号影,见图1B;DWI病灶弥散受限呈高信号影,见图1C;图1D为b=1000s/mm2时ADC值,显示较好的背景抑制,病变显示清晰,图1E为b=2000s/mm2时测得的ADC值,亦取得较好的背景抑制,但病变显示较b=1000s/mm2时欠清晰;该患者术后病理证实为浸润型导管内癌,见图1F。
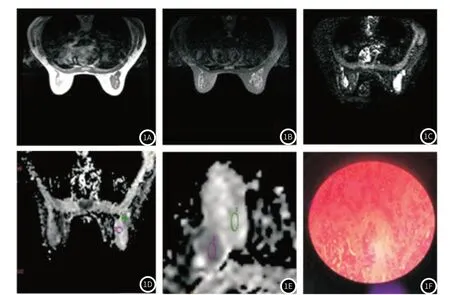
图1 乳腺癌患者MRI-DWI检查情况
2.2 乳腺癌患者DWI信号强度情况分析试验组134例出现高信号,其中45例呈混杂高信号,2例呈现等信号,89例呈弥漫高信号,无低信号。对照组患者72例呈现低信号,60例患者呈现等信号,4例患者呈现混杂高信号。试验组与对照组DWI信号强度差异有统计学意义(P<0.05)。见表1。b=1000s/mm2时,对照组患者的ADC值(1.214±0.531)×10-3mm2/s明显高于试验组(0.637±0.311)×10-3mm2/s,且差异有统计学意义(t=10.563,P<0.001)。
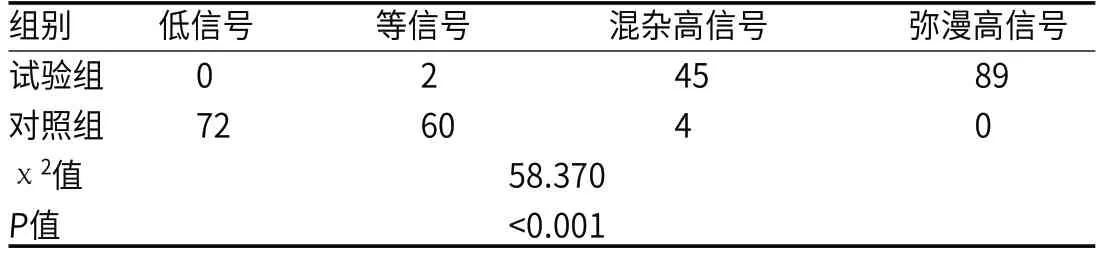
表1 乳腺癌患者DWI信号强度情况分析[例(%),n=136]
2.3 不同病理类型ADC值比较b分别为1000s/mm2、2000s/mm2时试验组均表现为,浸润型癌(小叶原位癌、导管内原位癌)平均ADC值明显低于非浸润型癌(浸润型导管癌、浸润型小叶癌),差异有统计学意义(P<0.05);小叶原位癌与导管内原位癌间ADC值差异无统计学意义(P>0.05)。不同病理类型均表现为,b=2000s/mm2时ADC值明显低于b=1000s/mm2时ADC值,差异有统计学意义(P<0.05)。见表2。
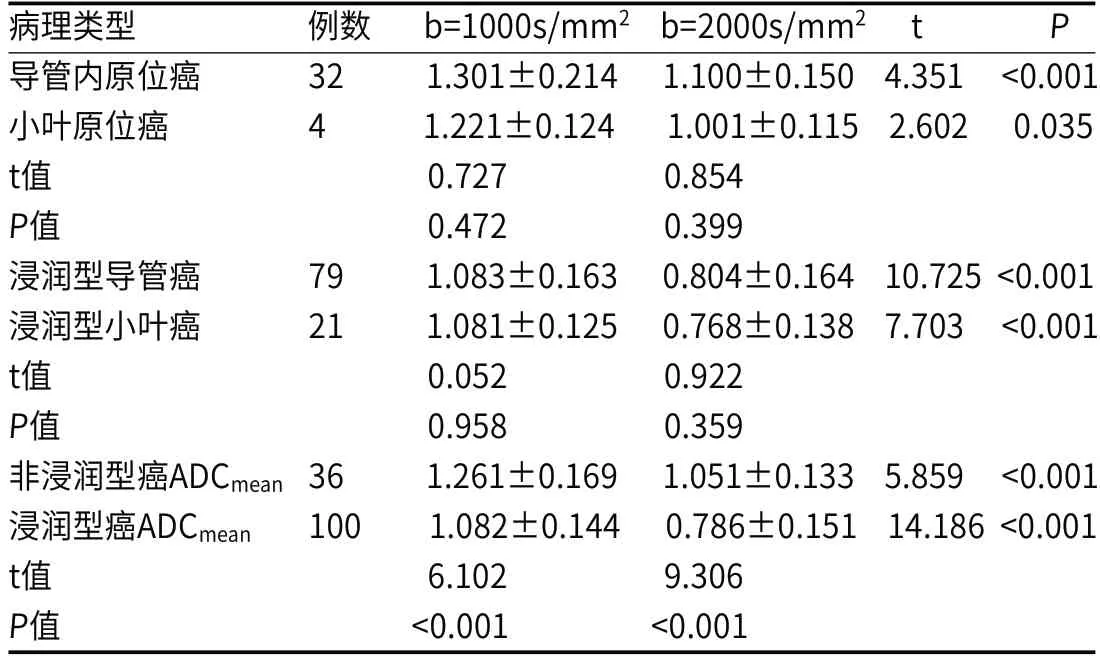
表2 不同病理类型乳腺癌ADC平均值(×10-3mm2/s)
2.4 ROC曲线分析ADC对乳腺癌病理分型的预测价值ROC曲线分析ADC对乳腺癌病理分型的预测价值,结果显示,b值分别为1000s/mm2、2000s/mm2时的AUC分别为0.718(95%CI:0.692~0.852,P<0.001)、0.846(95%CI:0.724~0.872,P<0.001)。见表3、图2。

表3 ROC曲线分析ADC对乳腺癌病理分析的预测价值
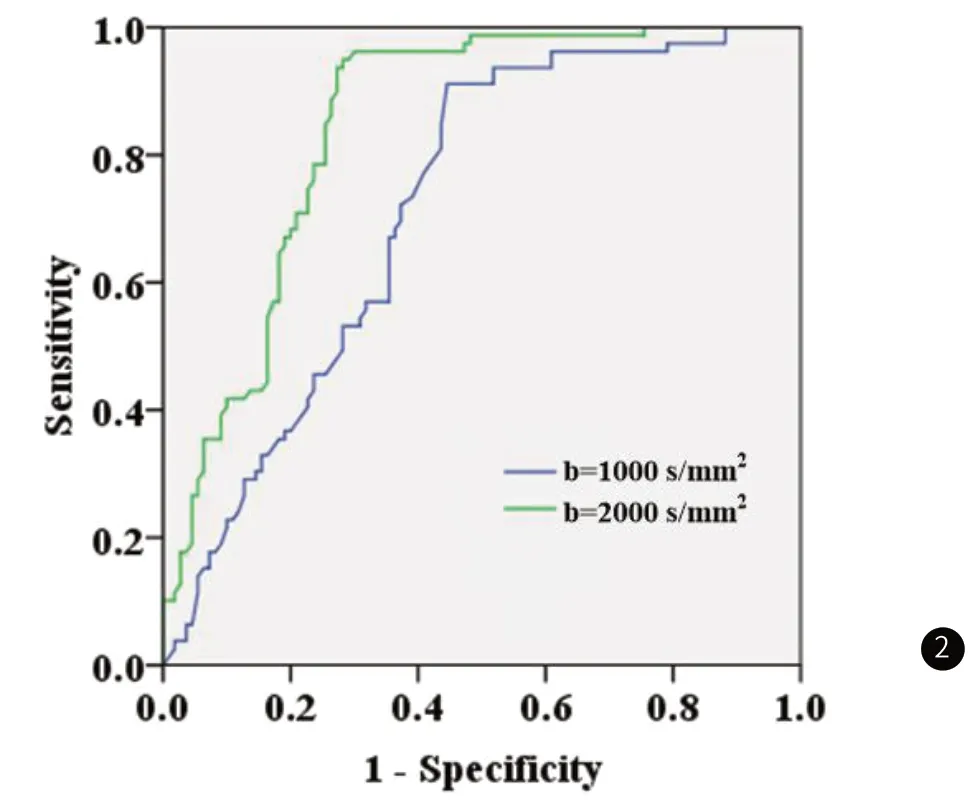
图2 ROC曲线分析ADC对乳腺癌病理分型的预测价值
2.5 2组临床资料比较比较复发组和未复发组的一般临床资料,结果发现,2组的T分期、病理分型、淋巴结转移、激素受体(ER、PR、HER2)、Ki-67表达及ADC值差异有统计学意义(P<0.05)。见表4。

表4 2组临床资料比较(例)
2.6 乳腺癌患者术后复发的Logistic回归分析将以上P<0.05的变量纳入多因素Logistic回归分析,以是否复发为因变量,结果发现,T分期、病理分型、淋巴结转移、ER、ADC值均能是乳腺癌患者术后复发的独立影响因素,具体见表5、图3。

表5 赋值变量表
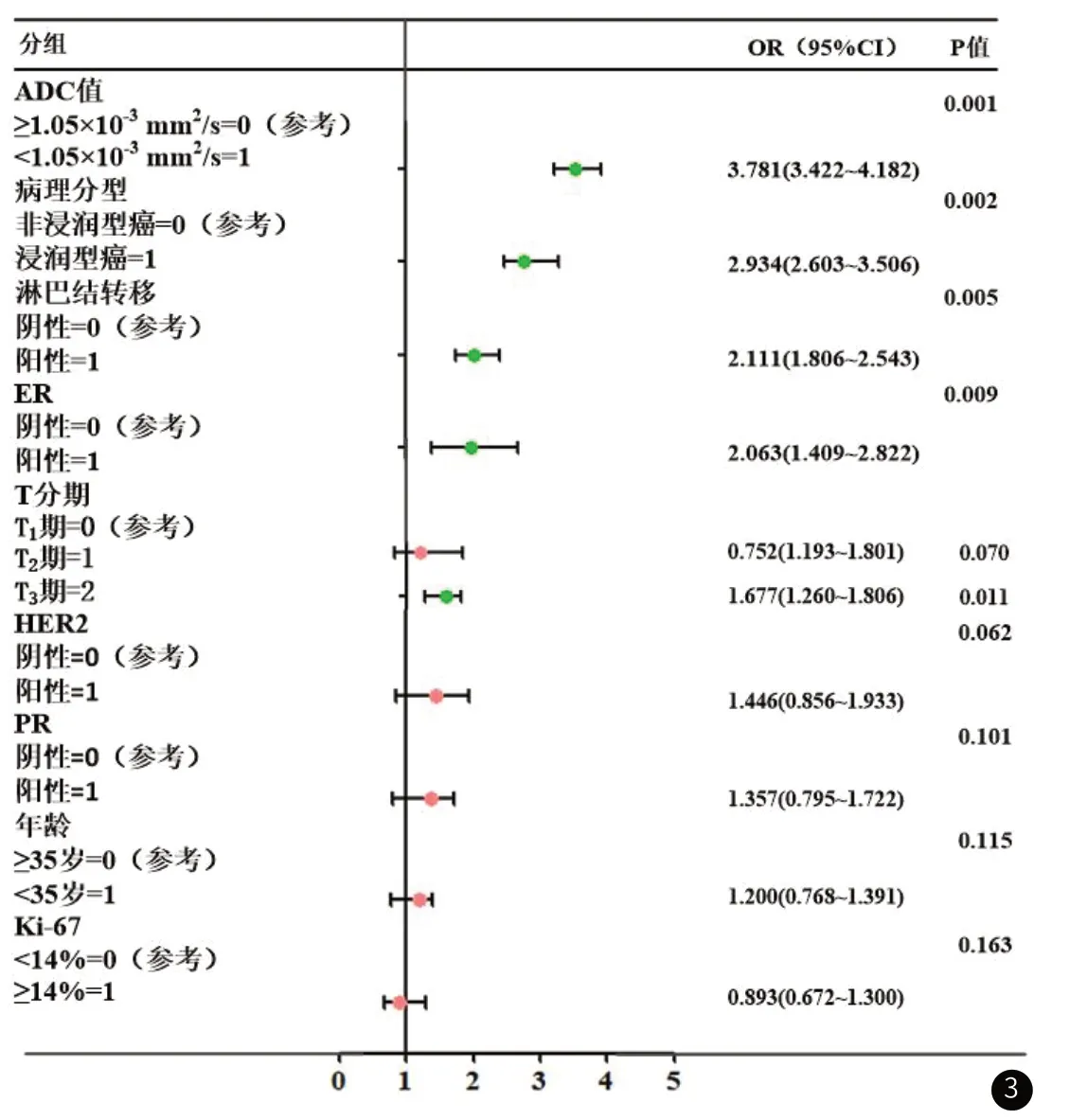
图3 乳腺癌患者术后复发的Logistic回归分析森林图
2.7 ROC曲线分析ADC值对乳腺癌患者术后复发的预测价值ROC曲线分析ADC值对乳腺癌患者术后复发的预测价值,结果发现,ADC值取1.046×10-3mm2/s时,具有较高的敏感度(83.46%)和特异度(76.33%),ROC曲线下面积(AUC)为0.718。见图4。
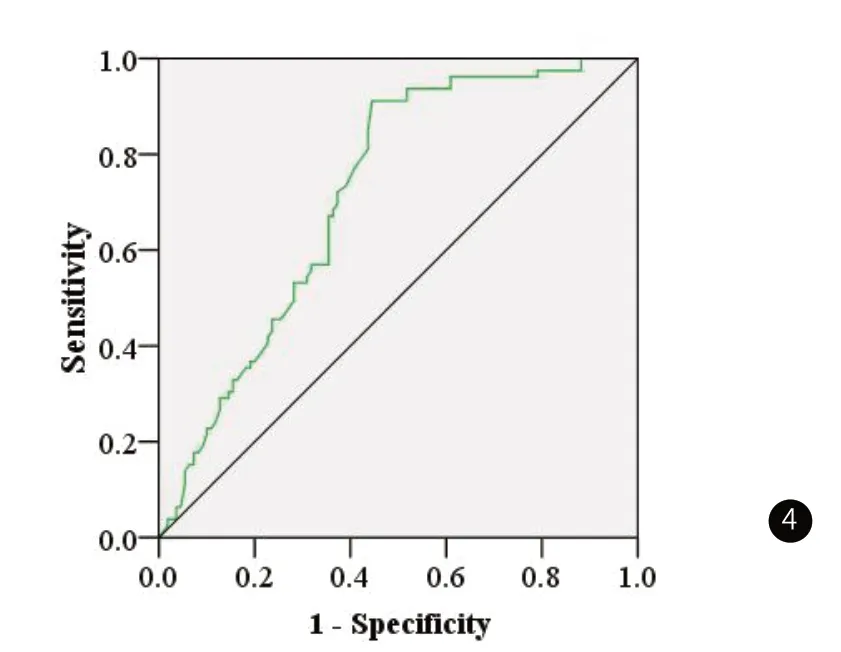
图4 ROC曲线分析
2.8 预后分析依据ROC曲线获得的预测乳腺癌患者术后复发的ADC值的最佳临界值,将ADC值≤1.046×10-3mm2/s的患者纳入高风险组(38例),将ADC值>1.046×10-3mm2/s的患者纳入低风险组(98例),采用Kaplan-Meier法分析两组5年复发情况,结果如图5所示,高风险组患者5年复发风险为92.11%(35/38)明显高于低风险组76.53%(75/98),差异有统计学意义(Log-Rank χ2=8.502,P=0.003)。
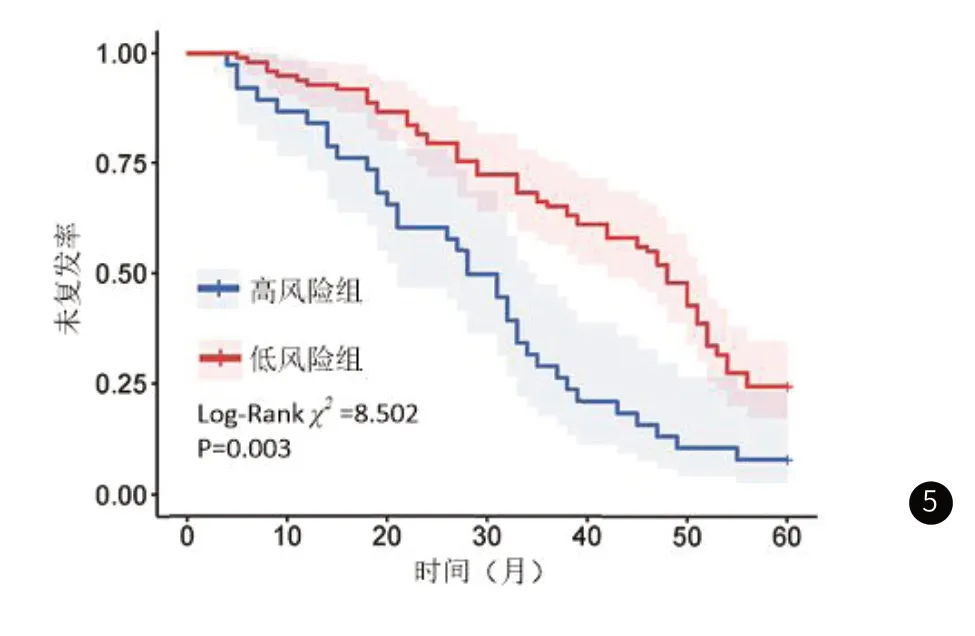
图5 生存曲线分析乳腺癌患者术后复发情况
3 讨论
ADC值可定量分析组织细胞水分子布朗运动情况[11]。由于恶性肿瘤比良性病灶的细胞密度高,细胞间隙小,水分子运动受限,导致DWI采集的信号强度较良性病灶高,测得的ADC值降低[12]。与本研究结果一致。b值作为DWI关键参数,其会影响图像质量、ADC值[13]。已有大量学者报道[14],b值≤1000s/mm2时,ADC值以1.0×10-3mm2/s作为界定标准,对肿瘤良恶性具有较大诊断价值。本研究136例受试者均采用稳定参数值,再次证实了以往研究结果。此外,本研究在传统常规b值基础上,采用b值=2000s/mm2时测得恶性肿瘤的ADC值。
相比于其他病理类型乳腺癌,浸润型乳腺癌较为常见。相比于非浸润型癌,浸润型癌具有多形性较明显、癌细胞大小形态各异等特点,导致组织间水分子扩散差,DWI呈现高信号,这种表现随着b值增大,ADC值越低[15]。本研究136例乳腺癌患者中,基本表现为DWI高信号,仅2例患者为等信号,b值为1000s/mm2时病变清晰;b值为2000s/mm2时病变结构及范围欠清晰及缩小。已有研究报道[16],b值越大,ADC值越小,且浸润型癌与非浸润型癌差异越明显。本研究也有相同发现。目前,虽然MRI设备不断改进,但高b值下图像清晰度会降低,病变范围也会缩小,高b值获取仍有较大争议。已有研究报道[17-18],浸润型乳腺癌较乳腺良性病灶的ADC值低。本研究也发现,b值取2000s/mm2和1000s/mm2时,浸润型乳腺癌较非浸润型乳腺癌的ADC值较低,且ADC值对乳腺癌病理分型的预测价值均较高,b值取1000s/mm2时,便可很好的鉴别浸润型与非浸润型乳腺癌,且病变图像显示清晰。此外,对于一些较难鉴别病例,本研究则选取高b值进行鉴别。
目前,多数研究探讨ADC值与病理因素和恶性程度的关系[19],然而较少有研究ADC值与患者预后之间的联系。本研究通过长期随访分析首次就诊患者的ADC值与患者预后间关系发现,复发组的首次就诊ADC平均值明显低于无复发组,且ADC值为乳腺癌术后复发的独立因素,提示较低的首次就诊ADC值可能预测乳腺癌患者术后较差预后,与以往研究结果一致[20]。本研究进一步通过ROC曲线分析发现,ADC值≤1.046×10-3mm2/s的患者在随访5年内发生复发的可能性更大;COX风险回归分析发现,ADC值≤1.046×10-3mm2/s是预测乳腺癌患者预后复发的有效指标,且病灶ADC值越低提示患者复发风险越高。提示越低的ADC值反映乳腺癌有较多的癌细胞数量及较强的侵袭性,与患者预后相关。因此,本研究认为,利用乳腺癌ADC值可有效评估乳腺癌患者预后的潜在复发风险,对于高复发风险的患者在临床治疗时应更加重视或强化治疗。
综上所述,DWI对乳腺癌评估有一定的临床意义;乳腺癌DWI以高信号为主;不同b值下ADC值对于乳腺癌病理分型有一定的临床诊断意义,且可为预测乳腺癌患者术后5年复发情况提供依据。因此,3.0-MRI-ADC值在乳腺癌术前病理类型及预后复发评估中值得推广。本研究局限性:样本量较少,且为单中心研究,可能存在选择偏倚;检测机型、b值选择与以往研究可能不同,导致研究结果存在一定偏差。后续会加大样本量,采取多中心研究。
