TiO2/g-C3N4水吸收耦合光催化降解异丙醇废气
2023-12-02金丽丽王文洁於建明陈建孟卢晗锋
金丽丽, 王文洁, 周 瑛, 於建明, 陈建孟,卢晗锋, *
(1. 中煤科工集团杭州研究院有限公司, 浙江 杭州 311201; 2. 浙江工业大学 化学工程学院, 浙江 杭州 310014;3. 浙江工业大学 环境学院, 浙江 杭州 310014)
0 引 言
挥发性有机化合物(VOCs)可以从许多不同的源中释放,包括汽车尾气、工业排放、溶剂、油漆、清洁剂、建筑材料和家具等,已经成为我国主要的大气污染物之一,对环境和人体健康都有潜在的负面影响[1-6]。异丙醇作为一种典型的挥发性有机化合物,是电子等行业生产过种中使用的较为廉价的清洗去油剂,其用量及应用范围越来越大,对人体造成严重危害,对周边大气环境造成污染。目前针对异丙醇废气的主要治理方法有吸收法、燃烧法、生物降解法、光催化法等[7-17]。由于异丙醇能与水任意比混溶这一特性,吸收法是工业上最常用的异丙醇废气治理方法,但如何克服吸收后对水体造成的二次污染,实现异丙醇废气连续吸收净化,是亟需解决的一个问题。论文在水相吸收法的基础上提出了一种新的治理方法——水吸收耦合光催化技术,既保持了吸收法具有的能耗低、效果好、实用范围广等优点,又利用光催化技术降解水吸收后水相的异丙醇,从而实现循环吸收目的,而这一技术最为关键的是高效光催化剂的选择。
TiO2是发现时间最早且性能较好的光催化剂之一[18],由于其具有成本低、无毒、氧化能力强、性能稳定、无二次污染等优点,已被广泛应用于环境领域[19]。然而,由于TiO2的光谱响应范围窄,导电性差,以及在迁移过程中光产生的电子-空穴对的快速重组,其催化效率非常有限,严重制约了其在光催化领域的发展[20]。为了提高TiO2的光催化效率,基于TiO2的半导体复合光催化材料成为近年来的一个研究热点。碳纳米管、石墨烯、氮化碳等碳基材料具有良好的导电性和优异的化学稳定性等,引起了人们的广泛关注[21]。类石墨烯碳氮化合物(g-C3N4)具有窄带隙宽度、良好的热稳定性和化学稳定性,已经成为一个有前途的光催化剂候选者[22]。g-C3N4与传统的光催化剂如TiO2相比,具有约2.7 eV[23]的相对窄的禁带宽度,具有优异的可见光响应性能,且在电子转移过程中,其离域共轭p结构也提供了相对缓慢的电荷复合和快速的光诱导电荷分离,从而使该材料成为设计高效可见光驱动光催化剂的敏化剂候选材料。因此,构建TiO2/g-C3N4复合材料是提高光催化反应量子效率的有效策略。
本研究合成了一系列不同TiO2含量的TiO2/g-C3N4复合材料,并测试了其在可见光照射下对异丙醇的光催化性能,分析了电荷转移机制,提出了可能的催化机理,并进行了水吸收耦合光催化技术净化异丙醇废气的应用,研究结果对VOCs废气水相吸收治理具有一定的借鉴价值。
1 实验材料及方法
1.1 材 料
尿素、甲醇、乙二胺四乙酸二钠为分析纯,购于中国医药集团化学试剂有限公司;锐钛矿相纳米二氧化钛、L-抗坏血酸为分析纯,购于上海阿拉丁生化科技有限公司;异丙醇为分析纯,购于衢州巨化试剂有限公司,实验用水为自制去离子水。
1.2 催化剂的制备
g-C3N4制备:尿素在管式炉中以5 ℃/min的升温速率加热到550 ℃,并在60 mL/min的N2流量下保持4 h,得到的产物为浅黄色块状g-C3N4,然后用玛瑙研钵将其研磨成粉末备用。
TiO2/g-C3N4的制备:首先将2 g g-C3N4和2 g TiO2分别加入2 L去离子水中,分别搅拌1 h后超声分散1 h,分别制得TiO2和g-C3N4悬浮液。在磁力搅拌条件下,将不同体积的g-C3N4悬浊液分别滴加到TiO2悬浊液中,混合物连续揽拌12 h,然后采用8 000 r/min转速离心20 min,所得固体产物在200 ℃氮气环境下热处理2 h,得到TiO2/g-C3N4复合光催化剂。本研究制备了TiO2粉末质量分数分别为20%、40%、60%、80%的TiO2/g-C3N4复合材料。
1.3 催化剂表征
分析样品的晶体结构,采用多功能X射线衍射仪(X′Pert PRO 型,荷兰PNAlytical公司),使用Cu Kα辐射(波长λ=0.154 nm)为射线源,工作电压为60 kV,工作电流为55 mA,扫描速率为5(°)/min,扫描范围为5°~80°;样品的表面形态用扫描电子显微镜(S-4700(II),日本Hitachi公司)进行表征。采用傅里叶红外光谱分析仪(VERTEX-70型,德国Bruker公司)分析样品表面的基团,其扫描范围为4 000~400 cm-1,并采用溴化钾压片法进行压片制样;使用配备积分球的UV-2700分光光度计(Shimadzu,日本)记录紫外可见漫反射吸收光谱,以BaSO4为基准。
1.4 光催化性能测试
1.4.1 光催化实验
在玻璃石英反应器中,分别加入体积分数为0.5%的异丙醇溶液100 mL及一定量的光催化剂,在黑暗条件下搅拌30 min以达到吸附-解析动态平衡,采用300 W的氙灯作为光源,并固定在液体表面上方20 cm处。在氙灯照射期间,使用外部循环水系统对反应系统中的溶液进行持续冷却以保持恒温。每隔10 min取一次样品,并进行离心,异丙醇溶液浓度通过气相色谱顶空法测定并按公式计算目标物的降解率(η):
(1)
式(1)中,η为降解率,%;C0为异丙醇溶液的初始浓度,mg/cm3;C为某一时刻异丙醇溶液的瞬时浓度,mg/cm3。
1.4.2 捕获剂实验
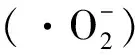
1.5 水吸收耦合光催化实验
水吸收耦合光催化实验主要有3部分:气路分配、水吸收耦合光催化反应器和色谱检测。为了产生气态的异丙醇作为模拟的VOC,在0 ℃下用空气吹泡液态的异丙醇,流量由质量流量控制器控制,通过与一定流量的空气混合并通过一个缓冲瓶,得到所需浓度的稀释的模拟气体VOCs。气流空速在12 000 mL·g-1·h-1通入到30 ℃的水吸收耦合光催化反应器中,吸收液为水,用量为10 mL,催化剂用量为0.05 g。使用配备氢火焰电离检测器的气相色谱仪(GC1620-FID型,捷岛科技)对入口和出口异丙醇的浓度进行在线监测。
净化率(φ)根据方程式计算,如下:
(2)
式(2)中,φ为净化率,%;C′0为异丙醇气体的入口浓度即初始质量浓度,mg/cm3;C′为异丙醇气体的出口浓度,mg/cm3。
2 结果与讨论
2.1 TiO2/g-C3N4催化剂的结构和形貌
TiO2/g-C3N4复合材料是通过静电吸附和热处理过程的简单组合而合成的。合成的样品的晶体结构和相纯度由XRD图谱来确定。如图1所示,纯TiO2样品在衍射角2θ为25.3°、37.8°、48.0°、53.9°、55.0°和62.6°处均出现衍射峰,分别对应于锐钛矿相TiO2(101)、(004)、(200)、(105)、(211)和(204)晶体平面,衍射峰尖锐,表明晶相纯度很高。XRD图谱中,纯g-C3N4样品大约在13.1°和27.4°两处表现出明显的衍射峰,后一个衍射峰是最强的,对应于(002)晶面,这是一个共轭芳香族化合物的层间堆积产生的特征峰[24]。13.1°的衍射峰对应于(100)晶面,表明该样品是层状类石墨相氮化碳。TiO2/g-C3N4复合材料XRD图谱显示,两个样品衍射峰与TiO2图谱一致,2θ=27.4°的峰重叠,几乎没有观察到衍射峰偏移,说明TiO2与g-C3N4之间具有良好的复合效果。
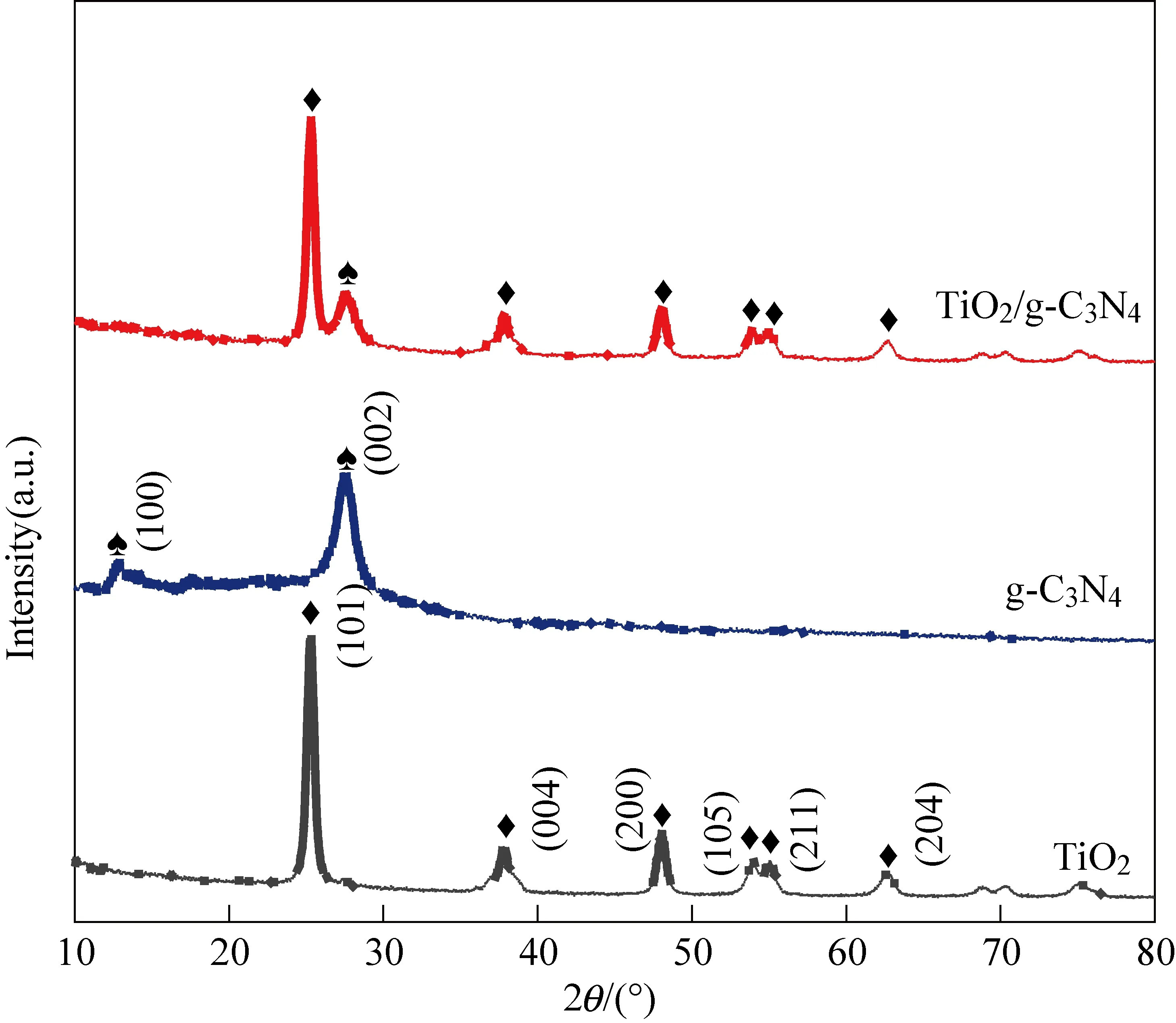
图1 TiO2、g-C3N4和TiO2/g-C3N4复合材料XRD图谱Fig. 1 XRD patterns of TiO2, g-C3N4 andTiO2/g-C3N4 composites
TiO2、g-C3N4和TiO2/g-C3N4的SEM表征结果如图2所示。图2(a)显示,锐钛矿相的TiO2具有球形的形状和非常明显的聚集,平均粒径约为25 nm。图2(b)显示,g-C3N4的微观片状结构是由许多纳米层堆积在一起。图2(c)和图2(d)显示了TiO2/g-C3N4复合材料的SEM图像。从图2可以看出,粉末的颗粒大小略有减小,在层状结构上紧密地负载着许多纳米颗粒。层状结构不仅为锐钛矿相的TiO2颗粒提供了负载点,而且还防止了颗粒的聚集,确保了复合材料的光催化性能。
2.2 催化剂的红外光谱分析

2.3 催化剂半导体特性
用紫外-可见漫反射光谱法(UV-Vis DRS)测量样品的吸光度,相应的光谱如图4所示。可以看出,TiO2对紫外光有强烈响应,但对于波长大于400 nm的可见光几乎没有明显的吸收。g-C3N4的光吸收边缘位于450 nm,这与报道的带隙宽度2.70 eV基本一致[31]。二元复合材料TiO2/g-C3N4表现出的光吸收边缘移动到可见光范围,位于TiO2和g-C3N4之间,与TiO2相比,显示出优异的可见光响应。究其原因可能是锐钛矿相TiO2和g-C3N4纳米片层间形成了异质结构,导致带隙调整。
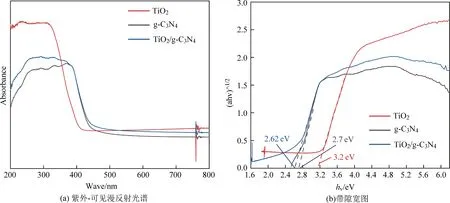
图4 TiO2、g-C3N4及TiO2/g-C3N4复合材料紫外-可见漫反射光谱和带隙宽图Fig. 4 UV-Vis diffuse reflectance spectra and bandgap width diagrams of TiO2, g-C3N4 and TiO2/g-C3N4 composites
由于半导体的吸收光谱范围与它的禁带宽度严格成反比,即:
Eg·λ=1 240
(3)
式(3)中:Eg为禁带宽度,eV;λ为吸收波长,nm。半导体的禁带宽度是衡量其光催化性能的重要指标之一。半导体材料的禁带宽度可以通过结合UV-Vis DRS光谱和Tauc公式来有效估算,如图4所示。Tauc公式为[32]:
(ahν)n=A(hν-Eg)
(4)
式(4)中:A为吸收系数;α为比例常数;hν为光子能量,eV;n与半导体是间接带隙还是直接带隙半导体有关,TiO2和g-C3N4是间接带隙半导体,因此n取1/2。计算出TiO2、g-C3N4和TiO2/g-C3N4(TiO2质量分数为40%)的禁带宽度分别为3.15、2.62、2.70 eV。g-C3N4的掺入和相互作用力的产生降低了TiO2/g-C3N4复合材料的禁带宽。与纯TiO2相比,该复合材料在分离光产生的电子-空穴对方面具有更高的效率。
2.4 催化剂的可见光催化活性
图5(a)为不同催化剂(催化剂质量相同)在可见光照射条件下对异丙醇溶液的降解率随时间的变化曲线。从图中可以看出,样品在70 min内对于异丙醇的去除能力从高到低依次为40%-TiO2/g-C3N4复合材料(降解率29.3%)、60%-TiO2/g-C3N4复合材料(降解率25.9%)、20%-TiO2/g-C3N4复合材料(降解率18.1%)、g-C3N4(降解率15.7%)、80%-TiO2/g-C3N4复合材料(降解率14.4%)和TiO2(降解率6.9%)。结果表明,TiO2/g-C3N4复合材料中TiO2的质量分数对光催化活性有明显影响。采用Langmuir-Hinshelwood拟一级动力学模型[33]分析了光催化降解动力学,该模型可表示为:
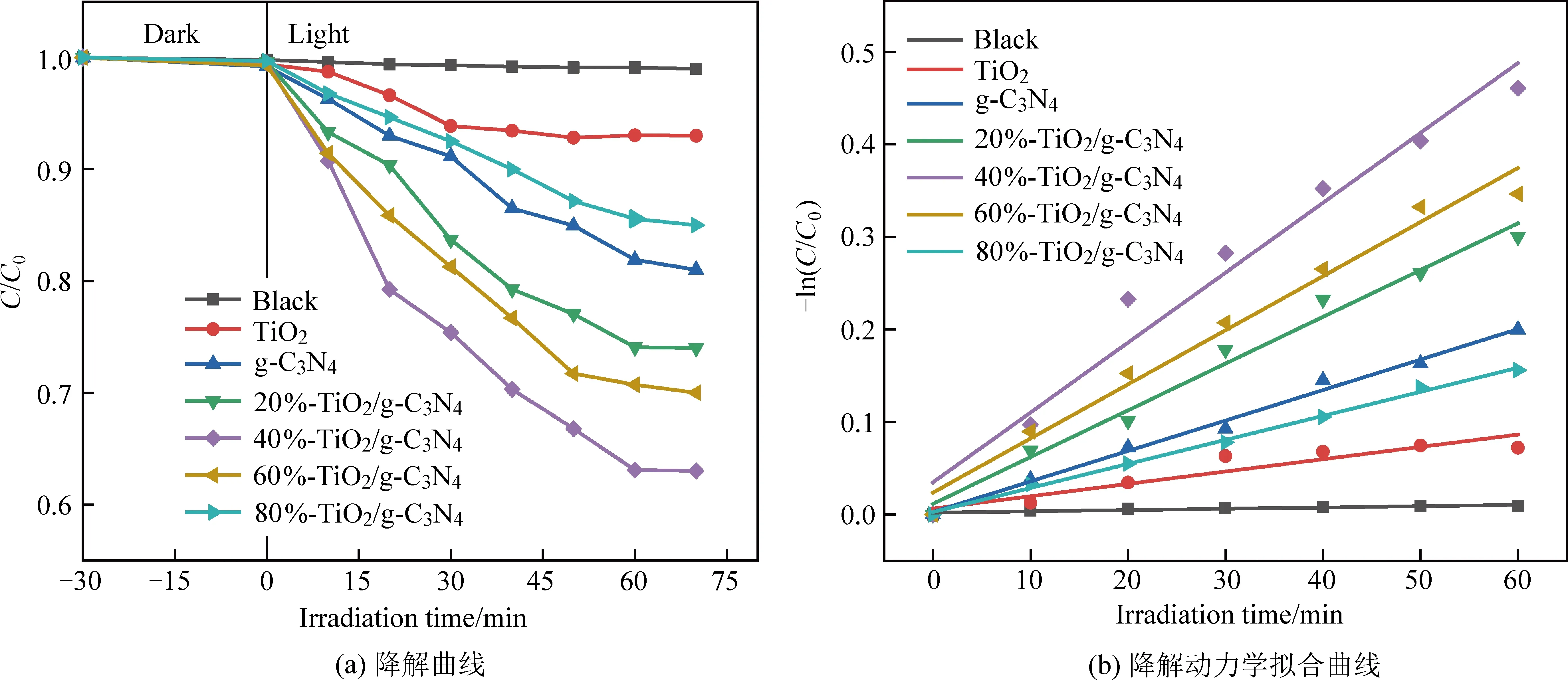
图5 TiO2、g-C3N4及TiO2/g-C3N4复合材料对异丙醇溶液的降解曲线和降解动力学拟合曲线Fig. 5 The degradation curves and kinetic fitting curves of isopropanol solution by TiO2,g-C3N4 and TiO2/g-C3N4 composites
ln(c0/ct)=kt
(5)
式(5)中:c0是建立吸附平衡后异丙醇的初始浓度,mg/m3;ct是时间t时异丙醇的浓度,mg/m3;kt是表观拟一级速率常数,min-1。
如图5(b)所示,kt与t之间的线性关系表明,异丙醇的光催化降解过程可以通过拟一级模型很好地拟合。随着TiO2/g-C3N4复合材料中TiO2质量分数从20%增加到80%,光催化速率常数先增大后减小,当TiO2含量占TiO2/g-C3N4复合材料的40%时,其光降解速率最好。
2.5 催化剂的光催化机理研究
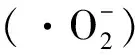
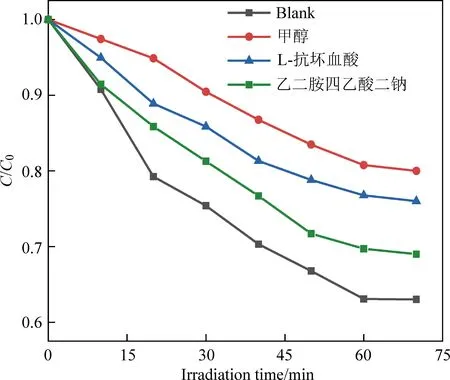
图6 40%-TiO2/g-C3N4复合材料的活性物质捕获实验Fig. 6 Active material capture experiment of 40%-TiO2/g-C3N4 composites
图7提出了在可见光照射下,在TiO2/g-C3N4界面上一种电子空穴分离和输运的机理。TiO2和g-C3N4的导带(CB)和价带(VB)电位可以通过公式确定[34]:

图7 可见光照射下TiO2/g-C3N4复合材料界面光激发电子空穴分离和输运过程的机理示意图Fig. 7 Schematic diagram of the mechanism of photoexcitedelectron-hole separation and transport processes at theinterface of TiO2/g-C3N4 compositesunder visible light irradiation
EVB=χ-Ee+1/2Eg
(6)
ECB=EVB-Eg
(7)
式(6~7)中:ECB、EVB和Eg分别是半导体的导带电位、价带电位和带隙;χ是Sanderson电负性;Ee是氢标的自由电子能电极电势(4.50 eV)[34]。其中,TiO2和g-C3N4的χ分别为5.81 eV[35]、4.73 eV[36],TiO2和g-C3N4的导带电位为-0.35 eV、-1.17 eV,TiO2和g-C3N4的价带电位为2.8 eV、1.45 eV。由于g-C3N4(-1.17 eV)的导带电位比TiO2(-0.35 eV)更负,因此g-C3N4中的电子可以很容易地通过紧密的界面连接转移到TiO2的导带中,而空穴仍然存在于g-C3N4的价带中。这种从g-C3N4到TiO2的电子转移可以降低电子空穴复合的概率,从而导致有效的电荷分离和光催化活性的提高。

(8)
(9)
(10)
e-+H2O2→·OH+OH-
(11)
因此,生成的·OH和·O2-作为有效氧化剂将与异丙醇分子反应,生成最终产物CO2和H2O。然而,由于标准氧化还原电位E0(·OH/OH-,1.99 eV)[37]比g-C3N4(1.45 eV)的价带电位更大,因此g-C3N4的价带中的光诱导空穴不能氧化OH-或H2O形成·OH,这表明光生空穴不是本研究中异丙醇降解的主要活性物质。
2.6 催化剂的吸收耦合光催化应用
为了探究水吸收耦合光催化技术净化异丙醇废气可行性,以及探究TiO2/g-C3N4复合材料的质量比对水吸收耦合光催化性能的影响,考察了在光催化作用下水吸收异丙醇的性能。图8是温度为30 ℃,初始质量浓度为5 000 mg/m3的异丙醇在不同催化剂条件下的净化率随时间的变化,以及温度为30 ℃,异丙醇初始质量浓度为5 000 mg/m3,TiO2/g-C3N4复合材料中的TiO2质量分数分别为20%、40%、60%和80%时异丙醇的吸收耦合光催化净化率变化。

图8 异丙醇在不同催化剂以及不同质量比TiO2/g-C3N4复合材料条件下的吸收耦合光催化净化曲线Fig. 8 Absorption-coupled photocatalytic purification curves of isopropanol under different catalystsand different mass ratios of TiO2/g-C3N4 composites
结果表明,选择不添加光催化剂、添加纯TiO2和纯g-C3N4作为对比,可见光照射180 min后,TiO2/g-C3N4复合材料对异丙醇废气的净化率较空白实验、TiO2和g-C3N4均有大幅提高。随着TiO2含量的增加,对异丙醇废气的净化效果呈现出先上升后下降的趋势,原因可能是随着TiO2含量的增加,能响应可见光的g-C3N4含量过低,从而致使催化剂的催化效果下降。其中,质量分数40%-TiO2/g-C3N4复合材料的水吸收耦合光催化净化异丙醇废气的性能最优异,该结果与单一的光催化降解异丙醇实验中,40%-TiO2/g-C3N4复合材料降解异丙醇效果最佳的结果一致。
为了探究pH对水吸收耦合光催化净化性能的影响,图9是温度为30 ℃,异丙醇初始质量浓度为5 000 mg/m3,不同pH时TiO2/g-C3N4复合材料水吸收耦合光催化净化异丙醇废气的净化率变化。结果表明,酸性条件下,由于水分解朝逆方向进行,导致光催化效果受到抑制,因此水吸收耦合光催化净化效果较中性环境更差。弱碱性条件下,提供了更多的OH-,产生了更多的·OH,因此其净化率更高,而强碱性条件下,TiO2会与强碱反应生成钛酸盐,使催化剂失活从而导致净化效果变差。

图9 异丙醇在不同pH下的吸收耦合光催化净化曲线Fig. 9 Absorption-coupled photocatalytic purificationcurves of isopropanol at different pH
2.7 TiO2/g-C3N4复合材料的稳定性和重复性
光催化剂除了光催化性能外,其重复性和稳定性在实际应用中也具有重要意义。在相同的实验条件下,5次循环均使用TiO2质量分数40%的TiO2/g-C3N4复合材料光催化剂。每次循环后,样品用无水乙醇和去离子水彻底清洗,在60 ℃下烘干,然后在300 ℃下焙烧1 h后再使用。在可见光照射180 min后,催化剂对异丙醇废气的净化率分别为61.7%、62.6%、60.8%、60.0%、61.1%。从图10中可以看出,5次循环后复合材料对异丙醇废气的净化效果没有明显下降,说明催化剂在光催化反应过程中具有一定的稳定性。

图10 TiO2质量分数为40%的 TiO2/g-C3N4复合材料水吸收耦合光催化净化异丙醇循环实验Fig. 10 Cyclic experiments on water absorption-coupledphotocatalytic purification of isopropanol using TiO2/g-C3N4composite material with 40% TiO2 mass fraction
3 结 论
(1)通过静电吸附法和热处理工艺合成的TiO2/g-C3N4复合材料,复合程度较好,层状结构的g-C3N4可为TiO2颗粒提供位点,还可以使其均匀负载。相对纯TiO2、TiO2/g-C3N4复合材料的光生电子-空穴对分离效率更高。
(2)相比单一的TiO2和g-C3N4、TiO2/g-C3N4复合材料对可见光具有良好的吸收利用率和对异丙醇的光催化活性,光催化性能提高4.24倍和1.9倍,TiO2质量分数40%的TiO2/g-C3N4催化活性最佳。
