补阳还五汤联合脊髓间充质干细胞移植对大鼠脊髓外伤性截瘫后功能恢复的影响
2023-11-30郭德华吴成林许洋张国福江西中医药大学南昌330004江西中医药大学附属医院南昌330006
★ 郭德华 吴成林 许洋 张国福(.江西中医药大学 南昌 330004;.江西中医药大学附属医院 南昌 330006)
随着现代社会交通、工业的不断发展,脊髓损伤(spinal cord injury,SCI)的发病率正呈现逐年增高趋势[1],但目前临床上治疗SCI 主要依靠药物和外科手术,虽可在一定程度上缓解病情,但解决不了病患的根本问题[2]。SCI 不仅严重影响患者的生活质量,甚至影响社会的安定[3]。因此,寻找到有利于脊髓损伤后神经功能恢复的治疗方法是当今基础和临床研究的热点之一。研究发现,脊髓间充质干细胞(bone marrow stromal cells,BMSCs)、神经干细胞、脐血干细胞等干细胞移植有望成为治疗SCI 的最佳方法[4]。与其他移植细胞比较,BMSCs 具有显著的营养神经、调控节免疫系统平衡、抗凋亡、抗氧化应激、跨胚层分化的能力,促进神经网络构建,改善后肢运动功能,且体内移植不良反应和免疫排斥少、不存在伦理道德问题等优点,这些特性使BMSCs 成为治疗SCI 的理想候选细胞,被广泛用于神经系统损伤修复领域中[5-6]。目前治疗脊髓损伤是以积极预防治疗继发性损伤为主,但该损伤是由多因子和多因素相互作用所致,单一治疗某一方面的药物都不能从整体上修复脊髓损伤。研究发现,中药复方是通过多方面进行治疗,并且能为神经生长提供适应的环境,还因中药毒副作用少、价格经济等更易被患者接受[7]。研究表明,补阳还五汤(Buyang Huanwu decoction,BYHWD)的有效成分比较丰富,在治疗脊髓损伤方面发挥了中医整体观念的优势,能通过多路径、多层次和多靶位的作用机制,在多方面抑制继发性脊髓损伤的病理因素,改善SCI 后的局部微环境,促进SCI 的修复和重建[7-8]。本研究前期研究发现,单纯BMSCs 移植和补阳还五汤对脊髓损伤均具有治疗作用[9-11]。但补阳还五汤能否促进BMSCs 在体内迁移,中药联合BMSCs 移植对脊髓损伤能否产生协同增效的作用,值得深入研究。近年来研究发现,用鼠的MSCs 用Brud 标记注射到胎鼠侧室,处死小鼠后发现MSCs 能迁移到海马嗅球等神经元分布丰富的部位;多功能细胞因子IL-6 在脑组织中表达较少,在神经疾病脑组织中高表达,可见IL-6 可介导神经系统疾病的神经元修复;且gp130是IL-6 等多种细胞因子受体中的共用信号传导链[12-14]。gp130 本身不具有酪氨酸激酶活性,其可通过介导IL-6 进行信号转导;但具体作用于脊髓损伤的机制尚未明确。因此,在前期研究基础上,本研究采用改良Allen 重物打击法制备脊髓损伤模型,通过改良Tarlov 评分和斜板试验,评价补阳还五汤联合BMSCs 移植对脊髓损伤外伤性截瘫后功能恢复的影响;通过HE 染色、免疫组化及蛋白免疫印迹法,观察中药联用对脊髓损伤局部损伤情况、局部损伤组织中Brdu 含量及gp130、IL-6 蛋白表达的影响,探讨其可能的作用机理。
1 材料
1.1 动物
50 只8~10 周龄SPF 级大鼠和5 只6 周龄大鼠,购于湖南斯莱克景达实验动物有限公司,实验动物许可证编号:SCXK(湘)2019-0004,雌雄不限,200~250 g,饲养于洁净环境中,温度(23±2)℃,湿度40%~70%,自由饮食摄水,12 h 光暗交替,所有动物适应性喂养7 d 后开始正式试验。
1.2 药物
补阳还五汤组成:生黄芪60 g(批号210606),当归10 g(批号210419),地龙10 g(批号210226),赤芍10 g(批号020410),川芎10 g(批号210722),桃仁10 g(批号210427),红花10 g(批号210526),以上饮片均购于江西中医药大学附属医院中药房,均为江西江中中药饮片有限公司产品,经江西中医药大学附属医院中药库李晓芳副主任中药师鉴定,均符合2015 年版《中国药典》质量标准。
1.3 仪器与试剂
戊巴比妥钠麻醉剂(美国Sigma 公司);尿嘧啶脱氧核苷(Brdu)、鼠抗人尿嘧啶脱氧核苷(Brdu)单克隆抗体、DAB 显色试剂盒(北京中山生物技术有限公司);山羊抗兔β-actin 多克隆抗体、gp130 抗体、IL-6 抗体(武汉博士德生物工程有限公司);免疫组化试剂盒(上海酶联生物科技有限公司);荧光显微镜、倒置显微镜(日本OLYMPUS公司)。
2 方法
2.1 脊髓损伤模型的建立
将50只大鼠分为假手术组10只和造模组40只,采用改良Allen 重物打击法制备脊髓损伤模型,可保持硬膜完整性,造成大鼠脊髓重度损伤,即完全性截瘫。各组大鼠均以2%戊巴比妥钠腹腔注射麻醉(50 mg/kg),俯卧位固定大鼠,在背部以T10 为中心,纵向切一3 cm 的小口,充分暴露T10 段脊髓。在T10 脊髓的表面放置一个直径为3 mm 的圆形薄片,用重10 g 的砝码自由坠落12.5 cm 打击该垫片,造成T10 段脊髓的冲击伤,逐层缝合大鼠皮肤。当撞击脊髓时大鼠出现身体抖动,打击局部脊髓表面迅速呈瘀紫色,术后双下肢出现完全瘫痪时视为脊髓损伤模型制备成功。手术结束后,将所有大鼠均置于25 ℃的动物房内统一饲养,将垫有锯末的平板置于大鼠笼中,以防肢体或骶部压疮及吸收排尿,并及时更换。手术结束后人工排尿,2 次/d,各大鼠均连续排尿2 周,直至大鼠恢复自主排尿时停止。假手术组大鼠只暴露T10 段脊髓并不打击脊髓,其余步骤和其他各组大鼠相同。
2.2 补阳还五汤的制备
根据《中国药典》制定剂量范围内的临床常用剂量称取中药材,补阳还五汤药物组成:川芎10 g,芍药10 g,生黄芪60 g,地龙10 g,桃仁10 g,当归10 g,红花6 g。按照中药煎药规定,将药汤浓缩至200 mL 备用,相当于临床等效生药量药物浓度为0.6 g/mL[11]。
2.3 BMSCs 制备与鉴定
以2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉6 周龄大鼠并安乐死处死,取大鼠双侧下肢胫骨骨髓,将单核细胞单独分离,接种单核细胞于培养瓶中,培养箱培养细胞3 d,将未贴壁的细胞弃掉,流式细胞仪检测细胞表面标记物。将证实的BMSCs 细胞扩增培养,取第三代BMSCs 细胞用于体内移植。移植前一天,将Brdu 标记加入到20 μmol/L 细胞中,洗涤细胞后,在细胞中加入0.25%胰蛋白酶消化,1 000 r/min 离心4 min,将PBS 溶液加入到细胞中重悬,调整细胞浓度为1×106/mL 备用。
2.4 分组和给药
将50 只大鼠随机分为5 组,即假手术组(灌胃等量生理盐水)、空白对照组(灌胃等量生理盐水)、补阳还五汤组[分上、下午2 次灌胃25 g/kg 补阳还五汤[11](课题组前期实验得出的最佳实验浓度)]、BMSCs 移植组(尾静脉注射1 mL 1×106BMSCs)、补阳还五汤+BMSCs 组(灌胃25 g/kg 补阳还五汤,同时尾静脉注射1 mL 1×106BMSCs),每组10 只。
2.5 行为学评估
采用双盲、双人独立观察记录,在术后1、3、5 周进行行为学评分观察,采用改良Tarlov 评分和斜板试验。
2.5.1 改良Tarlov 评分 0 和1 分:没有自主性的运动,只限于非反射性的髋、膝关节运动;2 分:髋、膝、踝3 个关节的肢体运动;3 分:行走时可主动支撑体重和不协调步态或偶尔出现协调步态;4 分:活动时呈现前后肢协调步态,行动时有趾间关节的肢体运动;5 分:正常步态。
2.5.2 斜板试验 取一块长方形木板,将2 mm 的橡胶垫垫于木板上,将大鼠头向前,身体纵轴与斜面板纵轴垂直放置,将木板与水平面之间的角度逐渐增大,直至大鼠在原定位置上刚好可以维持 5 s,将这一个角度称为倾斜平面临界角度。
2.6 HE 染色
将各组大鼠分别于造模干预后1、3、5周,以2%戊巴比妥钠腹腔注射麻醉(50 mg/kg)并开胸,大鼠心脏用4%多聚甲醛灌注固定,将损伤区的脊髓组织切取2~3 mm,用中性福尔马林溶液固定,石蜡包埋后制成3 μm 的切片,将切片经二甲苯脱蜡,梯度酒精脱水,然后浸入焦油紫染液中。将染色缸放入56 ℃烤箱中1 h,蒸馏水冲洗2 min,用分化液分化约2 min,直至背景接近于无色为止。依次脱水、透明、中性树胶封片。取各组大鼠5 周后的样本切片置于显微镜下观察脊髓损伤的情况。
2.7 免疫组化分析
取BMSCs 组、补阳还五汤+BMSCs 组,分别于造模干预后1、3、5 周,以2%戊巴比妥钠腹腔注射麻醉(50 mg/kg)大鼠并开胸,大鼠心脏用4%多聚甲醛灌注固定,将损伤区的脊髓组织切取1.5 cm,用中性福尔马林溶液固定,石蜡包埋后制成3 μm 的切片,用免疫组化法检测Brdu 阳性标记的细胞数量。取各BMSCs 移植组大鼠5 周后的样本,观察Brdu的阳性细胞数量。用“ImageJ”软件进行免疫组化半定量分析。
2.8 Western blot 法检测
处死各组大鼠,取20 mg 脊髓组织,在冰上研磨组织呈粉末状,将裂解液加入到组织中,制成组织悬液后离心,对蛋白样本总浓度进行测定。转移蛋白样品至PVDF 膜,加入5%脱脂奶粉,封闭样品2 h。蛋白样品中分别加入一抗gp130、IL-6 和内参β-actin 蛋白,孵育后洗涤蛋白样品,将二抗(1∶2 000)加入到蛋白样品中,室温孵育1 h。用ECL 液显色,Image J 软件观察条带灰度值并计算蛋白表达。
2.9 统计学方法
采用SPSS 20.0 软件进行统计学分析。结果采用均数±标准差()表示。2 组定量数值采用独立样本t检验,多组定量数值采用单因素方差分析。以P<0.05 为差异有统计学意义。
3 结果
3.1 BMSCs 的培养和鉴定
显微镜下可见,BMSCs 原代细胞多呈星形和多角形,细胞集落样生长。后继续生长,直至细胞融合率为80%,姬姆萨染色显示,第3 代BMSCs细胞呈短梭形,以旋涡状或放射状排列分布。见图1。
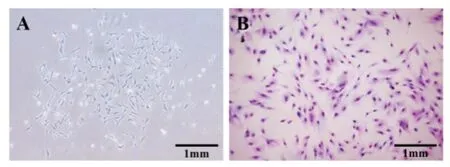
图1 大鼠原代BMSCs形态(×40)
3.2 流式细胞仪鉴定BMSCs 表面标志物
取生长良好的第3 代BMSCs 进行表面标志物鉴定,结果显示,BMSCs 表达间充质干细胞标志CD90、CD105,不表达造血干细胞标志CD14,具有BMSCs 特性。见图2。
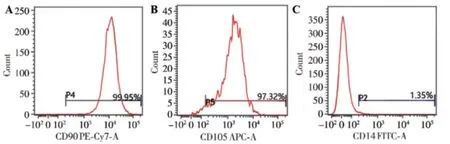
图2 流式细胞仪鉴定BMSCs表面标志物
3.3 行为学结果
3.3.1 改良Tarlov 评分结果 与模型组比较,各治疗组大鼠的改良Tarlov 评分均明显上升;与BMSCs组比较,补阳还五汤+BMSCs 组大鼠的Tarlov 评分显著上升,差异具有统计学意义。见表1。
表1 各组大鼠损伤后改良Tarlov评分结果(,n=10)
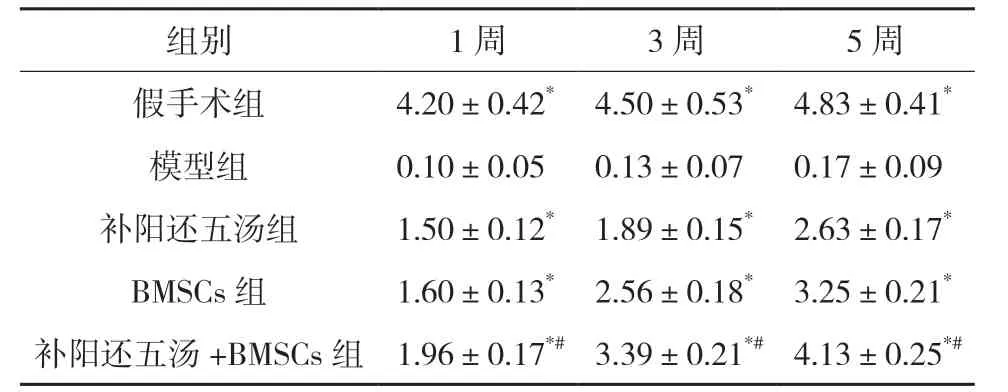
表1 各组大鼠损伤后改良Tarlov评分结果(,n=10)
注:与模型组比较,*P<0.05;与BMSCs组比较,#P<0.05。
?
3.3.2 斜板试验结果 通过斜板实验观察脊髓损伤后神经功能恢复情况,与模型组比较,各治疗组大鼠的斜板实验倾斜角度均明显增大;与BMSCs组相比,补阳还五汤+BMSCs 组大鼠的斜板实验角度显著增大(P<0.05)。见表2。
表2 各组大鼠损伤后斜板试验结果(,n=10) °
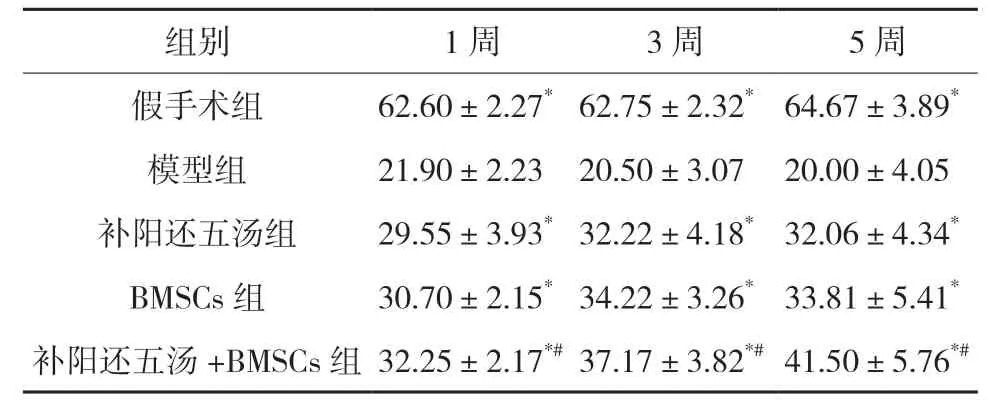
表2 各组大鼠损伤后斜板试验结果(,n=10) °
注:与模型组比较,*P<0.05;与BMSCs组比较,#P<0.05。
?
3.4 免疫组化观察BMSCs 的迁移情况
假手术组、模型组、补阳还五汤组中脊髓组织无Brdu 标记的阳性细胞;各BMSCs 移植组脊髓组织中均可见棕黄色Brdu 标记的阳性细胞;在BMSCs 移植1 周后迁移细胞数量大量成活,移植3~5 周时脊髓组织中仍有较多BMSCs 存活。移植5 周时,补阳还五汤+BMSCs 组Brdu 标记阳性细胞数为(8.64±0.92)个,明显多于BMSCs 组的(9.87±0.25)个(P<0.05)。见图3。
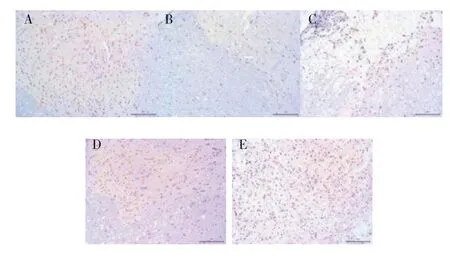
图3 免疫组化检测各组大鼠中脊髓组织Brdu水平(倒置显微镜,×200)
3.5 HE 染色观察脊髓损伤的情况
在5 周时,假手术组见脊髓组织结构清晰,未见明显细胞结构的破坏;模型组灰质破坏溶解,胶质疤痕形成,少见完整的细胞结构,灰、白质较难区分;各治疗组脊髓组织结构较清晰,灰质中坏死区较小,白质有存留,胶质疤痕少。见图4。
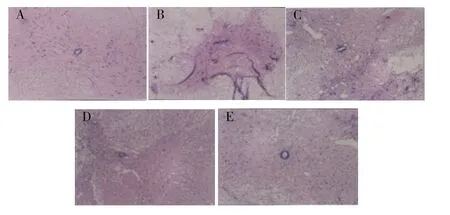
图4 HE染色观察脊髓损伤的情况(×100)
3.6 补阳还五汤联合BMSCs 移植对脊髓损伤大鼠影响的相关机制研究
与模型组比较,各治疗组中的gp130、IL-6 的蛋白表达水平均显著下调;与BMSCs 组比较,补阳还五汤+BMSCs 组中的gp130、IL-6 的蛋白表达水平均显著下调(P<0.05)。见表4、图5。
表4 Western blot检测各组大鼠脊髓损伤组织中gp130、IL-6蛋白表达(,n=10)
表4 Western blot检测各组大鼠脊髓损伤组织中gp130、IL-6蛋白表达(,n=10)
注:与模型组比较,*P<0.05;与BMSCs组比较,#P<0.05。
?
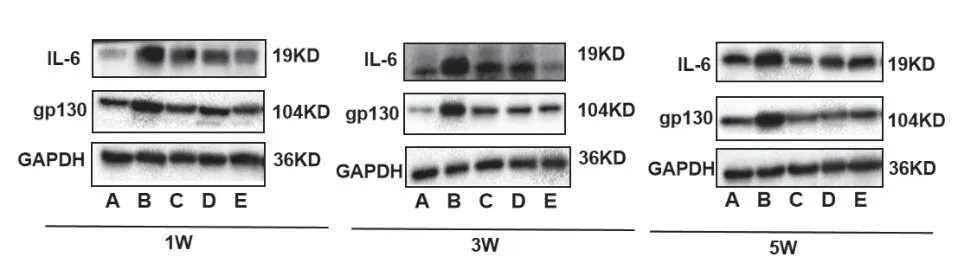
图5 各组大鼠脊髓损伤组织中gp130、IL-6蛋白表达
4 讨论
据世卫组织的数据统计,全球每年由于跌倒、暴力或交通事故等外伤导致的脊髓损伤患者大约有25~50 万人[15]。目前,临床常以手术治疗脊髓损伤,但治疗效果并不是十分理想,且治疗费用相对较高,导致患者及家庭难以接受。对于治疗脊髓损伤尚未形成系统的方案,因此亟需研究一种更安全、可靠和有效的治疗方法。
中药复方体现了中医药治病辨证施治和整体观念的特点,其作用效果往往是多途径、多靶点的,配伍有效的中药复方在治疗脊髓损伤时,可能会提供更有利于脊髓恢复的环境。中医药治疗脊髓损伤已有数千年的历史,其中补阳还五汤是促进血液循环、通经活络的代表方,用于修复脊髓损伤神经功能有着数百年的历史[16-17]。本实验结果显示,补阳还五汤与模型组比较,改良Tarlov 评分、斜板试验倾斜角度均明显上升,HE 染色见脊髓组织结构较清晰灰质中坏死区较小,白质有存留,胶质疤痕少,且抑制了gp130 及IL-6 的蛋白表达,充分说明其促进了大鼠脊髓损伤后神经功能的恢复,其机制可能是改善损伤后组织的炎症反应、抑制细胞的死亡并保护神经细胞。相关研究证实,对脊髓损伤患者给予补阳还五汤治疗后发现,患者的临床疗效显著升高[18-19]。通过前期实验研究发现,补阳还五汤可以促进移植的BMSCs 迁移,进而有效地恢复脊髓功能,但目前关于其迁移的具体机制尚不清楚[11]。
BMSCs 能对脊髓损伤区的微环境进行改变,可刺激神经生长,促进神经再生,并可通过对神经元和胶质细胞进行分化,进而补充细胞结构,起到促进血管新生和抑制炎症等生物学作用[20]。有研究显示,BMSCs 经静脉注射通过自行特异性迁移而植入受损部位[21]。其中体外培育扩增的BMSCs移植后,能够抑制脊髓损伤局部的炎症反应,减轻脊髓神经细胞的凋亡,显著改善脊髓损伤后局部的病理表现和下肢功能[22]。本研究通过建立SCI大鼠模型,结果发现BMSCs 移植能增加SCI 大鼠Tralov 评分和倾斜平面临界角度,且中药联用比单纯BMSCs 移植使用效果更显著。聂颖等[23]研究证实,补阳还五汤联合骨髓间充质干细胞移植对保护SCI 气虚血瘀证脊髓局部轴突、改善前肢运动功能可产生协同增效作用。
中枢神经系统中细胞需经过迁移才能到达损伤部分,进而发挥生物学作用,如不能正常进行迁移,就可导致神经发育的异常,出现多种疾病。目前神经细胞可通过胶质细胞的纤维辐射状迁移和不依赖胶质细胞而作正切方向迁移,迁移方向是由导向因子所引导。有研究发现,用鼠的MSCs用Brud 标记注射到胎鼠侧室,处死小鼠后发现MSCs 能迁移到海马嗅球等神经元分布丰富的部位[12]。本研究将Brud 标记的BMSCs 通过尾静脉注射到SCI 大鼠体内,结果表明带Brud 标记移植的BMSCs 在术后1 周可通过血液循环在宿主体内迁移至脊髓损伤部位,5 周后补阳还五汤可明显促进移植的BMSCs 迁移成活,说明补阳还五汤促进BMSCs 向脊髓损伤局部迁移。但本实验中假手术组未能检测到BMSCs,说明移植的BMSCs 不向正常的脊髓组织迁移,而各细胞移植组中就能检测到BMSCs,说明BMSCs 能向损伤后的脊髓组织迁移,猜测这与创伤部位的炎症或修复等因素相关。
目前BMSCs 体外迁移的导向因子有多种,其中gp130 及IL-6 均介导脊髓损伤的发生发展。相关研究表明,IL-6 作为炎症细胞分化的重要影响因子,而gp130 作为IL-6 等多种细胞因子的信号传导链,均参与了神经系统的调节过程及急性SCI 的继发性损害[24-25]。本研究结果显示,补阳还五汤和BMSCs 移植均能抑制SCI 大鼠脊髓组织中gp130、IL-6 蛋白表达,且中药联合细胞移植更显著地抑制gp130、IL-6蛋白表达。因此,我们猜测补阳还五汤促进BMSCs迁移,进而恢复大鼠后肢功能,改善脊髓损伤是通过减低脊髓损伤局部的gp130 及IL-6 实现的。
综上所述,补阳还五汤促进BMSCs 迁移,补阳还五汤联合BMSCs 移植提高了脊髓损伤大鼠的改良Tarlov 评分、斜板实验倾斜角度,同时抑制了IL-6及gp130 蛋白的表达,改善脊髓损伤,促进了大鼠脊髓外伤性截瘫后运动功能的恢复,明确了补阳还五汤联合BMSCs 移植具有治疗脊髓损伤的作用,并证明其作用机制可能与促进BMSCs 迁移、抑制脊髓损伤局部IL-6 及gp130 的表达相关。然而补阳还五汤是通过调控哪些导向因子及信号通路促进BMSCs迁移和抑制IL-6、gp130 表达,进而促进大鼠脊髓外伤性截瘫后运动功能的恢复,达到修复脊髓损伤的作用,其详细作用机制有待进一步深入研究。
