非结核分枝杆菌核酸玻璃珠法提取和磁珠法提取的差异
2023-11-30王培兴谢青云曾江张润兰彭海英
王培兴 谢青云 曾江 张润兰 彭海英
基金项目:江西省赣州市卫健委课题(2020-2-27)
作者简介:王培兴,男,本科,主管技师。
【摘要】 目的 探讨非结核分枝杆菌核酸玻璃珠提取法和磁珠法提取的差异。方法 选择2021年1月—2022年4月赣州市第五人民医院就诊的68例非结核分枝杆菌感染患者为对象,采集非结核分枝杆菌患者痰液或肺部灌洗液,分别采用玻璃珠提取法(观察组)和磁珠法(对照组)提取核酸,在荧光定量PCR仪检测下非结核分枝杆菌核酸为阳性,比较2组检出率。结果 观察组玻璃珠法提取检出率为77.94%略高于对照组磁珠法75.00%,但是2种提取方法检出率比较差异无统计意义(P>0.05)。结论 非结核分枝杆菌核酸玻璃珠提取法和磁珠法提取差异较小,但玻璃珠法提取检出率略高,可为临床诊疗提供参考依据。
【关键词】 非结核分枝杆菌;玻璃珠提取法;磁珠法;荧光定量PCR仪
中图分类号:R446.1 文献标识码:A
文章编号:1672-1721(2023)31-0102-03
DOI:10.19435/j.1672-1721.2023.31.034
非结核分枝杆菌是指结核分枝杆菌、牛分枝杆菌及麻风分枝杆菌以外的分支杆菌,与结核分枝杆菌相比,具有其独特的特点,能耐受临床常用的抗结核药物,但是病菌生长条件较为严格,对于生长温度的耐受性亦不如结核分枝杆菌[1]。非结核分枝杆菌能引起结核样病变,且抗原与结核分枝杆菌存在交叉,成为当前研究的热点。磁珠法是分子诊断实验中常用的提取方法,该方法能实现自动化、大批量的实验操作,具有操作简单、用时短、安全无毒及符合环保理念等优点[2]。磁珠与核酸的特异性结合,能提高核酸的纯度及浓度。该提取方法具有传统DNA提取方法难以比拟的优势,广泛用于血液、组织、拭子、鼻咽分泌物等样本中[3]。而玻璃珠提取法具有高分散性、流动性较好的特点,质量较轻,具有良好的吸水性、绝缘性、化学性及导热性,且硬度强度均较好,用于核酸检测中精度和准确度较高[4]。但是,临床上非结核分支杆菌核酸提取过程中选择何种方法缺乏统一的标准[5]。本研究以非结核分支杆菌感染患者为对象,探讨非结核分枝杆菌核酸玻璃珠提取法和磁珠法提取的差异,报告
如下。
1 资料与方法
1.1 一般资料 选择2021年1月—2022年4月赣州市第五人民医院收治的68例非结核分枝杆菌感染患者,男性27例,女性41例,年龄33~82岁,平均(67.96±6.79)岁;体质量指数(body massindex,BMI)18~29 kg/m2,平均(22.51±3.59)kg/m2;治療方式,门诊治疗3例,住院治疗65例;科室来源,感染科门诊
1例,胸外科2例,结核科门诊2例,感染科23例,骨科2例,呼吸危重二区7例,结核科一单元9例,结核科二单元17例,结核科三单元5例。本研究已获得医院医学伦理委员会批准,患者及家属签署同意书。
1.2 纳入及排除标准 纳入标准:符合临床关于非结核分枝杆菌感染相关标准[6],并最终获得确诊;均能配合完成标本采集,标本类型以灌洗液、伤口分泌物、痰液及支气管刷检为主,患者均可耐受;病情尚稳定,能进行沟通和交流。排除标准:认知障碍、确诊的器质性疾病或伴有自身免疫系统疾病者;中途放弃诊疗或伴有全身感染性疾病者;检查前行抗结核方案治疗或中转上一级医院者。
1.3 方法 采集非结核分枝杆菌患者痰液或肺部灌洗液,分别采用玻璃珠提取法(观察组)和磁珠法(对照组)提取核酸,在荧光定量PCR仪检测下非结核分枝杆菌核酸为阳性,比较2组检出率。
1.3.1 仪器设备及试剂 全自动核酸提取仪Smart32 型,购自于中山大学达安基因股份有限公司;直径为0.5 mm玻璃珠,购自于美国Sigma公司;Trizol试剂,购自于Invitrogen公司;分枝杆菌核酸检测试剂盒(PCR-荧光探针法),购自于成都博奥晶芯生物科技有限公司(国械注准20173401341)。
1.3.2 磁珠法 (1)加样。取灌洗液、伤口分泌物、痰液及支气管刷检等标本,连同蛋白酶K置入样本中进行处理,借助蛋白酶K的辅助作用,消化蛋白质为不同的小片段,加速核酸与蛋白酶的分离。(2)上机。待样本处理完毕后,将样本处理板放入全自动核酸提取仪(Smart32型)及安装磁力套。全自动核酸提取仪带有磁力棒,借助磁力棒吸附磁珠,并在使用前常规安装磁力套,避免样本之间发生交叉污染。(3)裂解及结合。借助机械臂运动及加热实现反应液的充分混合均匀,促进细胞的裂解,并释放核酸;释放磁珠并充分混匀后,利用磁珠在高盐低pH值下对核酸具有较强的亲和力特点,完成核酸的吸附。(4)洗涤、干燥及洗脱。机械臂移动到洗涤液中,充分混合均匀后,去除各种杂质;待上述操作完毕后,静置机械臂5 min,使得磁力棒吸附的磁珠晾干。机械臂移动到洗脱液中,充分混合均匀后,实现核酸和磁珠的分离,最终获得的洗脱液即提纯后的核酸[7]。
1.3.3 玻璃珠提取法 (1)样本处理。常规加入和痰等量的质量分数4%NaOH溶液,充分振荡混合均匀后,室温下静置30 min(对于较浓的痰液可适当延长时间)。取1 mL液化后的液体,放入1.5 mL的无菌离心管中,离心5 min,12 000 r/min,去除上层清液;加入洗液1 mL,充分涡旋后离心5 min,12 000 r/min,去除上层清液。加入核酸提取液50 μL,充分涡旋后加入核酸提取管中,放入核酸提取仪(Extractor36),最大转速下振荡5 min。95 ℃水浴锅中放置5 min,离心1 min,5 000 r/min,备用,在(-20±5)℃下保存1个月。(2)阴性对照品准备。取阴性对照品50 μL,将其放置在核酸提取管中,放入核酸提取仪,最大速度下振荡
5 min,水浴锅中放置5 min,离心1 min,5 000 r/min,置于-20 ℃冰箱中,备用。(3)阳性对照品的准备。精确程度阳性对照品50 μL,将其放置在核酸提取管中,放入核酸提取仪,最大转速下振荡5 min,95 ℃下水浴锅中放置5 min,操作完毕后振荡1 min,5 000 r/min,置于-20 ℃冰箱中,备用。(4)扩增试剂的准备。取扩增反应液,将其放置在冰盒上,解冻,每个样本取2 μL,加入扩增反应液管中,每次检测时设阴性、阳性对照,加入量均为2 μL。(5)PCR扩增程度。37 ℃下300 s,循环数1;94 ℃下180 s,循环数1;94 ℃下15 s、60 ℃下30 s,循环数40;50 ℃下10 s,循环数1。选择FAM与HEX通道,荧光采集点选择60 ℃ 30 s。根据分析后的图像调整基线、阈值线。基线选择2~15个循环的荧光信号,亦可根据情况进行调整[8-9]。
1.4 统计学方法 采用SPSS 24.0统计学软件处理数据,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
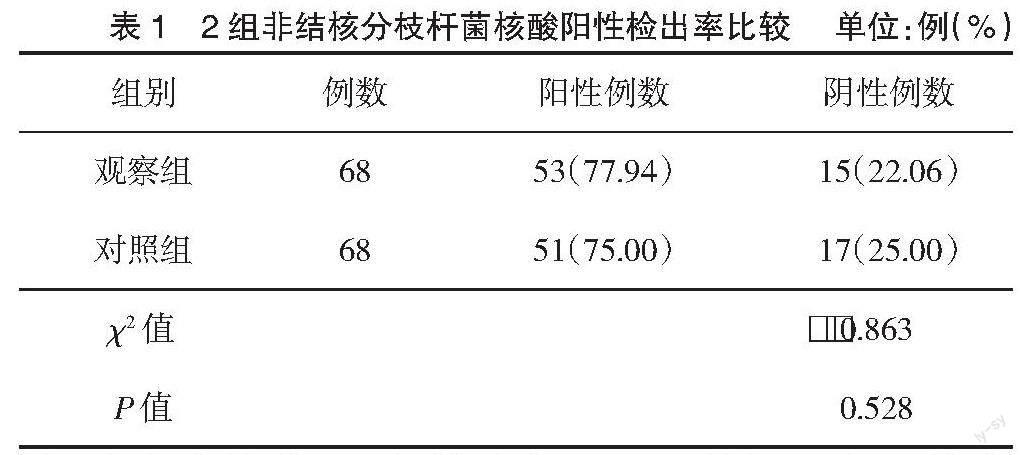
观察组玻璃珠法提取检出率为77.94%,略高于对照组磁珠法的75.00%,2组检出率比较差异无统计学意义(P>0.05),见表1。
3 讨论
目前,临床上已经发现150多种非结核分枝杆菌,只有少数非结核分枝杆菌对人类致病。钟业腾等[10]研究表明,非结核分枝杆菌在自然环境中存在,如土壤、自来水管等,人类传染主要通过接触空气环境中的非结核分枝杆菌引起发病;非结核分枝杆菌肺病常继发于合并肺部基础疾病,如支气管扩张、先天性肺囊肿、继发结核等,在结构性肺病基础上均容易继发肺结核分枝杆菌肺病。国外学者调查结果表明,非结核分枝杆菌在人与人之间传染相对较少,且致病后起病相对缓慢,全身重度症状相对较轻。随着医疗技术的不断发展,基因组DNA分子在科研、临床及法医界中使用较为广泛,检验过程中以DNA样本作为研究对象的PCR、Southern Blot及RFLP等技术使用较多,如何选择合适的DNA提取方法对指导临床诊疗具有重要的意义。李崇斌等[11]研究表明,可借助抗煮沸试验进行区分及鉴别非结核分枝杆菌是否具备致病性。结核分枝杆菌与非结核分枝杆菌的鉴别,除热触酶试验外,亦可将菌苔置入含有盐水小滴的玻片上进行研磨,前者不容易发生乳化而后者乳化较为明显。目前,临床上常用的从组织中提取DNA的方法相对较多,包括蛋白酶K法、TKM法等,分别采用不同的试剂裂解细胞去除蛋白质,然后再采用乙醇完成核酸的沉淀。但是,上述方法操作均相对繁琐、对仪器及设备要求较高,难以在基层医院推广应用。
磁珠法是临床上常用的分离培养方法。借助纳米技术,能实现超顺磁性纳米颗粒表面的改良及修饰,并将其制作为超顺磁性氧化硅纳米磁珠。从微观角度看,超顺磁性氧化硅纳米磁珠能与核酸分子特异性的结合并实现其识别。核酸结合到磁珠上主要依靠静电作用、疏水作用及氢键作用,在盐酸胍、异硫氰酸胍及外磁场的作用下,从血液样本中分离RNA,并除去非特异性吸附的杂质,获得纯化后的DNA。从上述分析结果看出,磁珠法核酸提取具有传统DNA提取方法无法比拟的优势,广泛用于血液、组织等标本检测中。
磁珠法在实现DNA提取时亦存在一定的不足,主要表现在以下方面。(1)技术发展较为滞后。当前磁珠法提取DNA时仍停留在chelex-100法,并未能研发出新的检测方法。(2)价格昂贵。尽管磁珠法经过不同厂家的改善及升级优化,核酸提取成本得到明显降低,但该检测方法价格仍相对较高。
玻璃珠法核酸提取用于非结核分枝杆菌中,能获得较为理想的PCR扩增模板,具有操作简单、耗时短、省力的优点,可获得良好的经济效益。LI Y等[12]研究表明,磁珠法核酸提取用于非结核分枝杆菌中,每个标本只需7~8粒玻璃珠即可获得所需的DNA。本研究中,观察组玻璃珠法提取检出率为77.94%略高于对照组磁珠法75.00%,但是2种提取方法结果差异无统计学意义(P>0.05)。从本研究结果看出,非结核分枝杆菌核酸玻璃珠提取法和磁珠法提取差异较小,且不同提取方法各有优缺点。
玻璃珠提取法用于非结核分枝杆菌中具有以下优点。(1)高分散性、流动性较好。购置玻璃珠时需了解其分散性、流动性,尽可能选择分散性及流动性较好的玻璃珠。该方法具有操作简单、省时省力,能实现不同标本中DNA的提取。(2)质量相对较轻。玻璃珠的质量相对较轻,在实际使用过程中由于质量轻的优势进一步拓展其应用场合,且提取过程中能获得较为理想的PCR扩增模板。(3)玻璃珠的吸水率较低。优质的玻璃珠吸水率较低,绝缘性、隔音性亦相对较低,化学性质较为稳定。玻璃珠法提取基因组DNA的,经济性相对较强,提取操作过程中仅需要7~8粒玻璃珠即可提取所需的DNA。(4)导热性较低、硬度强度良好。非结核分枝杆菌核酸玻璃珠提取法能获得更加完整的RNA,能为后续PCR检测奠定基础。非结核分枝杆菌DNA提取過程中,应根据医院及实验室的医疗设备、医生的专业技能等,选择合适的提取方法,以提升非结核分枝杆菌提取准确性、科学性。
综上所述,非结核分枝杆菌核酸玻璃珠提取法和磁珠法提取差异较小,但玻璃珠法提取检出率略高,可为临床诊疗提供参考依据。
参考文献
[1] 戴广明,王芬,曹廷明,等.实时荧光定量PCR检测不同结核标本及其联合玻璃珠磨菌法检测价值的初步研究[J].中
国防痨杂志,2022,44(5):450-454.
[2] WEI Y,GUPTA P,BRADY E,et al.S2067 endoscopic repair of a novel bronchoscopic complication: esophageal perforation following endobronchial ultrasound-guided transbronchial needle aspiration[J].Am J Gastroenterology,2020,115(1):
S1086.
[3] 孙晴,黄海荣,王桂荣.贝达喹啉、氯法齐明和德拉马尼对常见致病性非结核分枝杆菌体外抑菌活性及耐药机制的研究进展[J].中国防痨杂志,2020,42(8):880-884.
[4] SRIVASTAVA S,CHAPAGAIN M,GUMBO T.Effect of specimen processing, growth supplement, and different metabolic population on mycobacterium tuberculosis laboratory diagnosis[J].PLoS One,2020,15(4):e0230927.
[5] 徐茂鎖,刘亚隽,张慧,等.MALDI-TOFMS自建数据库对非结核分枝杆菌鉴定的应用价值[J].临床检验杂志,2022,40(3):194-199.
[6] RiICOTTA E E,ADJEMIAN J,BLAKNEY R A,et al.extrapulmonary nontuberculous mycobacteria infections in hospitalized patients, United States,2009-2014[J].Emery
Intect Dis,2021,27(3):845-852.
[7] SAINTG L,THOMAS M F,ZAINAL ABIDIN N,et al Treating nontuberculous mycobacteria in children with cystic fibrosis: a multicentre retrospective study[J].Arch Dis Child,2022,107
(5):479-485.
[8] 阎庆虎,崔嘉,杨传彬,等.CT放射组学分析空洞特征在鉴别非结核分枝杆菌肺病与肺结核中的价值[J].山东大学学报(医学版),2020,58(6):41-46.
[9] CHO E H,Ki C S,Sun AY,et al.Genetic analysis of Korean adult patients with nontuberculous mycobacteria suspected of primary ciliary dyskinesia using whole exome sequencing[J]. Yonsei Med J ,2021,62(3):224-230.
[10] 钟业腾,陈灼霖,王洁莹,等.海南省肺部感染患者非结核分枝杆菌的菌种鉴定分析[J].疾病监测,2022,37(8):1-6.
[11] 李崇斌,尹航,方鹏,等.6种结核分枝杆菌检测方法在不典型肾结核早期诊断中的应用价值比较[J].国际流行病学传染病学杂志,2022,49(3):183-187.
[12] LI Y,XU P,WAN Z,et al.Single-tube detection of nine bacterial antibiotic-resistance genes by a 2-dimensional multiplex qPCR assay based on fluorescence and melting temperature[J].Mol Biol Rep,2020,47(10):7341-7348.
(收稿日期:2023-06-18)
