血清白细胞介素-35在脑梗死合并肺部感染患者中的动态变化及意义
2023-11-30田杰沈蓉冯倩周华
田杰 沈蓉 冯倩 周华

作者简介:田杰,女,本科,主治医师。
通信作者:周华
【摘要】 目的 研究脑梗死及脑梗死合并肺部感染患者血清白细胞介素-35(interleukinIL-35)动态演变,为临床研究提供依据。方法 回顾性选取苏州市立医院神经内科2019年12月—2020年12月住院的脑梗死患者60例,其中30例合并肺部感染者为A组,另30例未合并肺部感染者为B组,再随机抽取同期健康人员30名为C组;A、B组患者分别于发病后24 h、48 h、7 d抽取静脉血清IL-35,C组健康人员于入组当天空腹抽取静脉血清IL-35;比较A+B、C组IL-35指标的差异及A、B组24 h、48 h、7 d的变化规律。结果 A、B组发病后24 h血清IL-35浓度低于C组,差异有统计学意义(P<0.05),随后呈动态上升的趋势,至发病后7 d接近正常水平;A、B组各时间点比较发现,A组血清IL-35浓度发病后24 h、发病后48 h及发病后7 d均比B组低,差异有统计学意义(P<0.05)。结论 脑梗死发生后,患者血清中IL-35的浓度在发病后24 h最低,随后逐渐上升,至发病后7 d升高到接近正常水平,且合并肺部感染者,血清IL-35浓度降低更明显。
【关键词】 脑梗死;白细胞介素-35;肺部感染
中图分类号:R743.32 文献标识码:A
文章编号:1672-1721(2023)31-0053-03
DOI:10.19435/j.1672-1721.2023.31.018
流行病学调查研究显示,脑卒中已超过缺血性心脏病、肺癌等,居于我国致死疾病之首[1-3],而急性脑梗死是我国脑卒中的常见类型,占脑卒中的69.6%[4],且致残率及致死率高,给居民造成了严重的经济负担[3,5]。中风诱发的免疫抑制综合征(stroke-induced immunodepression syndrome ,SIDS)不止能减轻炎症反应,保护脑组织,还能削弱人体抵抗力,导致感染[6]。肺部感染是急性脑梗死的常见感染并发症,不仅延长了住院时间及增加住院费用,给患者造成严重的经济负担,还增加了脑梗死患者的病死率[7]。IL-35为抑制性细胞因子,是IL-12家族中的一员,由EBI3和IL-12P35亚基非共价结合组成,由调节T细胞和B细胞分泌[8-9],在促炎细胞因子(肿瘤坏死因子-α、干扰素-γ、IL-1β)引起炎症后,IL-35可以在人非T细胞中上调[10-11]。而相关研究证实,TNF-α、IL-6的水平与脑动脉狭窄程度相关[12];小鼠动物模型研究显示,IL-35在脑缺血再灌注损伤早期呈下降趋势,损伤后12 h达最低,12 h~7 d呈缓慢恢复趋势[13]。故根据上述研究结论,进一步研究IL-35在脑梗死及脑梗死合并肺部感染患者血清中的变化规律,为卒中后脑保护临床药物开发提供新的依据。
1 对象与方法
1.1 一般资料 回顾性选取2019年12月—2020年12月苏州市立医院神经内科住院的脑梗死患者60例,30例合并肺部感染者为A组,30例未合并肺部感染者为B组,另选取同期健康人群30名为C组。3组研究对象的一般资料比较,差异无统计学意义(P>0.05)(见表1),具有可比性。
纳入标准:根据患者临床表现和有新发神经系统缺损体征,结合头颅CT排除外脑出血及颅内占位,诊断为脑梗死,且后期经头颅磁共振成像(MRI)确诊为脑梗死(诊断标准参考《中国急性缺血性脑卒中诊治指南2018》);患者脑梗死发病到入院时间小于24 h,且能在发病24 h内完成首次IL-35抽血化验;向患者及家属讲解本次研究的目的和方法,并获得患者及家属的同意并签署同意书;A组患者除符合上述标准外,需合并咳嗽、咳痰症状,经胸部CT证实合并肺部感染。排除标准:合并严重心肺肝肾功能不全者;合并其他部位感染者;合并恶性肿瘤者;合并系统性红斑狼疮、多发性硬化及其他自身免疫性疾病者。所有研究对象均知晓本研究情况并签署知情同意书。本研究经该院医学伦理委员会审核批准(编号:KL901191)。
1.2 方法 A、B组患者于发病后24 h、发病48 h、发病后7 d分别抽取静脉血清检测IL-35,C组健康人员于入组当天空腹抽取静脉血清检测IL-35。测定血液收集及IL-35,抽取靜脉血2 mL,用肝素抗凝,
1 500 r/min,离心半径15 cm,离心10 min,完全分离血浆,按照统一要求标准编号,保存于-80 ℃冰箱中待检测,所有标本收集完成后,采用美国Adlitteram daignostic Laboratories 提供的双抗夹心酶联免疫吸附(ELISA)试剂盒检测血浆IL-35浓度,检测方法严格按照试验设计的步骤进行。
1.3 观察指标 观察A、B组24 h与C组血浆IL-35浓度是否有差异,A、B组24 h、48 h及7 d血浆IL-35浓度变化规律及有无差异。
1.4 统计学分析 采用SPSS 22.0统计学软件进行数据分析,计量资料用x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,重复测量资料采用重复测量方差分析;计数资料用百分比表示,组间比较采用χ2检验,P<0.05为差异有统计学
意义。
2 结果
2.1 脑梗死患者(24 h)与非脑梗死患者IL-35质量浓度比较 脑梗死组(A+B组)发病后24 h的血清IL-35质量浓度为(69.75±12.67)pg/mL,低于C组的(106.97±11.56)pg/mL,差异有统计学意义(t=9.85,P<0.001)。
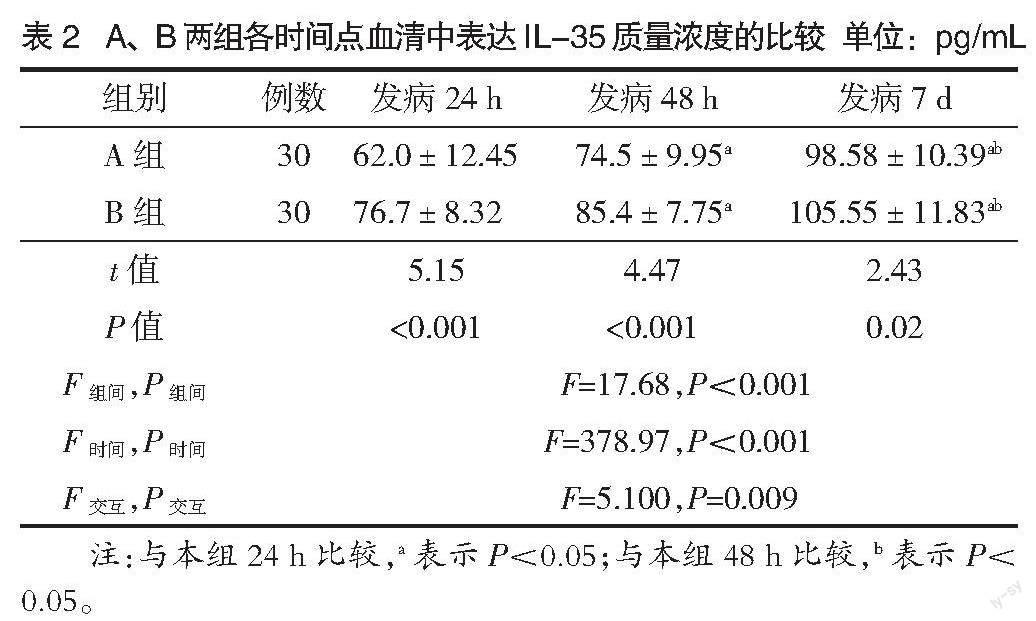
2.2 A、B 2组患者3个时间点IL-35浓度比较 整体分析发现,2组患者时间、组间、交互作用比较差异有统计学意义(P<0.05)。组内比较,2组患者发病后24 h、48 h、7 d的IL-35水平逐渐升高;组间比较,A组患者发病后24 h、48 h、7 d的IL-35水平均低于B组,差异有统计学意义(P<0.05),见表2。
3 讨论
脑梗死是目前我国居民主要死亡原因之一,特别是对于合并肺部感染的患者,有较高的致残率,给国民经济造成严重的负担。脑组织发生缺血后,死亡和损伤的细胞通过释放DAMPs激活小胶质细胞、巨噬细胞等,导致一系列的炎症细胞因子释放[14-15],其中以IL-1、IL-6和TNF-α升高最为明显[16],在脑组织缺血后12~24 h达高峰[17]。IL-35是2007年新提出的细胞因子,为一种抑制性细胞因子,属IL-12细胞因子家族中的一员,与IL-12同享IL-12p35亚基,与IL-27同享EBI3亚基[11]。研究表明,IL-35在多发性硬化、系统性红斑狼疮、类风湿关节炎等自身免疫性疾病中分泌减少[18],而在许多恶性肿瘤疾病中表达升高,并被证实和胃癌进展及肺部转移相关[19-20]。目前IL-35与脑血管病的研究尚少,部分研究认为,IL-35的表达与颈部血管斑块的稳定性相关,IL-35高表达提示颈部血管斑块稳定性更差[21-22]。动物模型研究显示,脑组织灌注损伤后,脑组织中IL-35 mRNA及蛋白表达呈先降低后升高的趋势[23]。但是,脑梗死患者对IL-35表达如何,是否与动物模型表达相似,目前未见类似研究。本研究以动物模型为基础,开展了脑梗死患者发病后各时间点对IL-35表达的研究,结果显示,与动物模型相似,脑梗死患者对IL-35表达亦呈先降低后升高的趋势,发病后24 h最低,随后逐渐升高,至发病后7 d脑梗死未合并肺部感染组血清IL-35接近正常水平,而脑梗死合并肺部感染组亦呈先降低后升高趋势,但比脑梗死未合并感染组降低更为明显,至发病7 d仍低于正常水平。感染后,炎症细胞因子释放增加,可促进B细胞分化,使IL-35表达增加。本研究提示,脑梗死合并肺部感染组发病早期IL-35降低更为明显,考虑可能与使用抗生素治疗导致B细胞数量下降相关[23]。
脑梗死后患者的IL-35表达减低,且脑梗死合并肺部感染组IL-35降低更明显,是否提示脑梗死早期IL-35表达越低,越易并发肺部感染呢?IL-35在脑梗死中扮演什么样的角色?是否可以像治疗自身免疫性疾病那样,通过rIL-35干预来改善脑梗死患者的预后及降低肺部感染并发症的发生率呢?进一步动物模型研究中采用rIL-35对脑缺血动物模型进行干预,结果显示,于预后减小了梗死面积及改善了神经功能恢复,提示rIL-35在缺血脑组织中有保护作用,且干预后可使炎症因子IL-1、IL-6表达减少,提示rIL-35对脑组织的保护作用可能是通过减少炎症因子来实现的[23]。这为临床研究提供依据。在脑梗死患者中,rIL-35是否具有保护缺血脑组织,减小梗死面积及改善神经功能恢复的作用,需待进一步的临床研究证实。
综上所述,IL-35作为一种抑制性细胞因子,在脑梗死发病后早期呈下降趋势,随后逐渐上升,至发病后7 d接近正常水平,且血清IL-35水平与脑梗死患者并发肺部感染密切相关,这一发现有助于探讨脑梗死患者并发肺部感染的发生机制及开发防治肺部感染的药物。本研究样本量偏少,在今后研究中可进一步扩大样本量,延长随访时间,并探索可升高IL-35的药物,从而降低脑梗死患者肺部感染的发生率,促进脑梗死患者早日恢复,降低死亡率及致残率。
参考文獻
[1] ZHOU M G,WANG H D,ZENG X Y,et al.Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the global burden of disease study 2017[J].Lancet,2019,394(10204):1145-1158.
[2] HU S,CUI B,MLYNASH M,et al.Stroke epidemiology and stroke policies in China from 1980 to 2017: a systematic review and meta-analysis[J].Stroke,2020,15(1):18-28.
[3] WU S M,WU B,LIU M, et al. Stroke in China: advances and challenges in epidemiology, prevention and management[J].Lancet Neurol,2019,18(4):394-405.
[4] WANG W Z,JIANG B,SUN H,et al.Prevalence, incidence and mortality of stroke in China: results from a nationwide population-based survey of 480 687 adults[J].Circulation,2017,135(8):759-771.
[5] WANG Y,ZHOU L,GUO J,et al.Secular trends of stroke incidence and mortality in China,1990 to 2016: the global burden of disease study 2016[J].Stroke Cerebrovasc Dis,
2020,29(8):104959.
[6] LIU D D,Chu S F,CHEN C,et al.Research progress in stroke-induced immunodepression syndrome (SIDS) and stroke-associated pneumonia(SAP)[J].Neurochem Int,2018(114):42-54.
[7] KOENNECKE H C,BELZ W,BERFELDE D, et al. Factors influencing in-hospital mortality and morbidity in patients treated on a stroke unit[J].Neurology,2011,77(10):965-972.
[8] CAI X L,ZHOU L,ZHOU C R, et al.A bibliometric analysis of IL-35 research from 2009 to 2018[J].Peer J,2019(7):
e7992.
[9] TEDDER T F ,LEONARD W J.Autoimmunity: regulatory B cells:IL-35 and IL-21 regulate the regulators[J].Nat Rev
Rheumatol,2014,10(8):452-453.
[10] LI X Y,MAI J T, VIRTUE A,et al.IL-35 is a novel responsive anti-inflammatory cytokine:a new system of
categorizing anti-inflammatory cytokines[J].PLoS One,2012,7(3):e33628.
[11] LI X Y, FANG P,WANG H,et al. IL-35, as a newly proposed homeostasis-associated molecular pattern,plays three major functions including anti-inflammatory initiator, effector, and blocker in cardiovascular diseases[J].Cytokine,2019(122):154076.
[12] 鄭海波.急性脑梗死患者脑动脉狭窄程度与TNF-α、
IL-6、IMA水平的关系[J].现代养生(下半月版),2022,22(6):988-990.
[13] 徐晨.IL-35在脑缺血再灌注损伤模型中的表达及作用机制[D].南京:南京医科大学,2018.
[14] 张建文,王萍,任超,等.缺血性卒中中后期炎症反应机制研究进展与新药研发的契机[J].中国药理学通报,2019,
(4):468-473.
[15] SINGH V,ROTH S,VRLTKAMP R,et al.HMGB1 as a key mediator of immune mechanisms in ischemic stroke[J].
Antioxid Redox Signal,2016,24(12):635-651.
[16] LAMBERTSEN K L, BIBER K,FINSEN B.Inflammatory cytokines in experimental and human stroke[J].Cereb Blood
Flow Metab,2012,32(9):1677-1698.
[17] KNIPPENBERG S,PEELEN E,SMOLDERS J, et al. Reduction in IL-10 producing B cells (Breg) in multiple sclerosis is accompanied by a reduced naive/memory Breg ratio during a relapse but not in remission[J].Neuroimmunol,2011,239(1/2):80-86.
[18] WANG K,LIU J M , LI J S.IL-35-producing B cells in gastric cancer patients[J].Medicine(Baltimore),2018,97
(19):e0710.
[19] OLKHANUD P B, DAMDINSUREN B,BODOGAI M, et al .Tumorevoked regulatory B cells promote breast cancer metastasis by converting resting CD4+ T cells to T-regulatory cells[J].Cancer Res,2011,71(10):3505-3515.
[20] 李燕华,范秉林,韦俊杰等.急性脑梗死患者血清IL-35、MMP-9与颈动脉粥样硬化斑块稳定性的关系[J].中风与神经疾病杂志,2017,34(7):597-599.
[21] 黄宝丰,骆瑜.老年急性缺血性脑卒中患者血清hs-CRP、IL-12、IL-35与颈动脉粥样硬化斑块稳定性的关系研究[J].医学理论与实践,2018,31(20):3009-3011.
[22] XU C,ZHU H,SHEN R,et al.IL-35 is a protective
immunomodulator in brain Ischemic injury in mice[J].
Neurochem Res,2018,43(7):1454-1463.
[23] ROSSER E C,OLEINIKAK,TONON S, et al. Regulatory B cells are induced by gut microbiota-driven interleukin-1beta and interleukin-6 production[J].Nat Med,2014(11):1334- 1339.
(收稿日期:2023-08-04)
