天然含铁锰矿对砷的高效去除性能与机制研究
2023-11-30田周炀郑倩杜晓丽陈成李传维涂书新
田周炀,郑倩,杜晓丽,陈成,李传维,涂书新*
1.华中农业大学资源与环境学院
2.武汉芳笛环保股份有限公司
3.北京建工环境修复股份有限公司
砷(As)是一种具有高毒性和致癌性的类金属元素,广泛分布于多种环境介质中,人类长期摄入砷污染的饮用水可能会导致皮肤病、肝肾疾病甚至癌症等严重的健康问题[1-2]。随着人们对砷毒性和致癌性的认识不断提高,1993 年世界卫生组织(WHO)将饮用水中砷的浓度限值从50 µg/L 降至10 µg/L[3]。在自然水体中,无机砷化合物毒性是有机砷化合物毒性的100 倍,其中无机砷包含砷酸盐〔As(Ⅴ)〕和亚砷酸盐〔As(Ⅲ)〕2 种重要的氧化态。在pH 为6.0~8.5 的地下水中,还原条件下As(Ⅲ)以不带电的H3AsO3为主,而氧化条件下As(Ⅴ)以H2AsO4-和HAsO42-的形式出现[4-5]。研究表明,As(Ⅲ)比As(Ⅴ)具有更大的毒性、溶解性和迁移性,将As(Ⅲ)氧化为As(Ⅴ)后再去除被认为是一种可行、高效的除砷方法[6-7]。
吸附技术由于其效率高、操作简单、去除效果好等优点而被认为是最有效的除砷手段[8-13],开发高效、廉价、环境友好的砷吸附剂被广泛报道,例如水钠锰矿、针铁矿、二氧化锰、活性炭和水铁矿等。然而,单一金属氧化物材料对重金属的吸附去除效果远不如多金属材料的吸附效果,因此,为了提高吸附剂从水相中去除砷的能力,大量研究人员利用多金属双元氧化物,如Fe-Al[14]、Fe-Mn[15]、Fe-Ni[16]等作为吸附剂氧化和吸附As(Ⅲ),其中Fe-Mn 双金属材料因其效率高、亲和力强、比表面积大,是最常用的吸附剂之一。大量试验表明,Fe-Mn 双金属氧化物结合了锰氧化物的氧化性能和铁氧化物的高吸附能力,对重金属有更高的吸附能力和去除效率[17-18]。据报道,具有丰富羟基的MnFe2O4对As(Ⅲ)表现出良好的吸附性能,其吸附容量为718 µg/g,而Fe3O4和Mn3O4的吸附容量分别只有32.2 和8.9 µg/g[19]。然而,合成双金属氧化物去除砷的成本高,操作复杂,对环境不友好,目前关于利用天然含铁锰矿除砷的研究报道较少,其机制也尚不明确。因此,笔者以天然含铁锰矿(NFM)为研究对象,评估其对砷的吸附性能,探讨其对砷的吸附行为与机制,以期为天然矿物修复水体砷污染技术的开发提供科学依据。
1 材料与方法
1.1 试验材料
NFM 采自湖南某地的天然含铁锰矿石,经水洗、自然风干后研磨至100 目。As(Ⅲ)储备液采用碱溶三氧化二砷(As2O3)制备而成。化学试剂NaNO3、KMnO4、Fe(NO3)3∙9H2O、FeSO4∙7H2O、HCl、NaOH、As2O3等均为分析纯,购于国药化学试剂有限公司。所有水溶液均使用18.25 MΩ·cm 的超纯水配制。
1.2 FMO、Bir 和Goe 的合成
采用以化学法合成的铁锰二元复合氧化物(FMO)、水钠锰矿(Bir)和针铁矿(Goe)作为对比材料。FMO 依据Zhang 等[20]报道的方法合成:按锰铁 摩 尔 比 为1∶3.4 称 取 一 定 量 的FeSO4∙7H2O 和KMnO4, 分 别 溶 解 后 将FeSO4∙7H2O 溶 液 倒 入KMnO4溶 液 中,同 时 用5 mol/L NaOH 调 节 溶 液pH 为7~8,在室温下搅拌1 h 后得到的沉淀物即为FMO。Bir 根据Mckenzie[21]报道的方法合成:将35 mL 浓 盐 酸 以0.7 mL/min 加 入 到500 mL 的0.4 mol/L KMnO4溶液中,反应得到的沉淀即为水钠锰矿。Goe 采用Fe(NO3)3∙9H2O 溶液在70 ℃条件下老化72 h 得到[22]。
1.3 等温吸附曲线
在等温吸附试验中,首先称取0.15 g 吸附剂粉末于50 mL 离心管中,然后分别加入初始浓度为10、20、40、80、160、240、400、800 mg/L 的As(Ⅲ)溶液15 mL;在298 K、pH 为7.0±0.2 的条件下,密封并置于恒温振荡器(180 r/min)中反应24 h,每个试验做3 个平行。反应结束后,悬浮液经0.45 µm 的滤膜快速过滤,并采用原子荧光光谱仪(AFS, 北京吉天)测定滤液中的剩余砷浓度。根据式(1)计算砷吸附容量:
式中:qe为吸附剂的砷吸附容量,mg/g;C0和Ce分别为As(Ⅲ)溶液的初始和剩余浓度,mg/L;V为As(Ⅲ)溶液的体积,L;m为吸附剂质量,g。
使用Freundlich[23]和Langmuir 等温线模型[24]来描述As(Ⅲ)在吸附剂上的吸附情况,分别由式(2)和式(3)表示:
式中:Kf为Freundlich 常数,mg/g;n为非均质系数;b为Langmuir 常数,L/mg;qm为平衡时吸附剂的砷吸附容量,mg/g。
1.4 吸附热力学
在吸附热力学试验中,称取0.15 g 吸附剂粉末于50 mL 离心管中,与15 mL 240 mg/L 的As(Ⅲ)溶液混合;然后分别在温度为278、298 和308 K 条件下,将离心管密封并置于恒温振荡器(180 r/min)中振荡12 h,每个试验做3 个平行。反应结束后,悬浮液经0.45 µm 的滤膜快速过滤,并采用AFS 测定滤液中的剩余砷浓度。根据以下公式计算吸附As(Ⅲ)的热力学参数ΔG0(吉布斯自由能)、ΔH0(焓)和ΔS0(熵):
式中:R为理想气体常数,8.314 J/(mol·K);T为溶液的温度,K;Kc为吸附平衡常数;Cs为吸附剂上As(Ⅲ)的平衡浓度,mg/L。
1.5 吸附动力学
在吸附动力学试验中,首先称取0.15 g 吸附剂粉末于50 mL 离心管中,与15 mL 240 mg/L 的As(Ⅲ)溶液混合;然后在298 K、pH 为7.0±0.2 的条件下,将离心管密封并置于恒温振荡器(180 r/min)中反应,分别于10、30 、60 、120、240、480、960、1 440和2 880 min 取样,每个试验做 3 个平行。反应结束后,悬浮液经0.45 µm 的滤膜快速过滤,并采用AFS 测定滤液中的剩余砷浓度。
采用准一级动力学模型[25]和准二级动力学模型[26-27]来拟合吸附数据,如式(7)和式(8)所示:
式中:qt为时间t时吸附剂对As(Ⅲ)的吸附量,mg/g;K1为准一级动力学模型吸附速率常数,min-1;K2为准二级动力学模型吸附速率常数,g/(mg∙min)。
1.6 pH 影响试验
在探究初始溶液pH 对NFM 去除As(Ⅲ)的影响试验中,首先称取0.15 g 吸附剂粉末于50 mL 离心管中,与15 mL 20 mg/L As(Ⅲ)溶液混合,然后利用0.1 mol/L HCl 或0.1 mol/L NaOH 溶 液 将 初 始pH 分 别 调 至1、 3、 5、 7、 9, 并 以0.01 mol/L NaNO3作为背景离子;在298 K 条件下,将离心管密封并置于恒温振荡器(180 r/min)中反应12 h,每个试验做3 个平行。反应结束后,悬浮液经0.45 µm 的滤膜快速过滤,并采用AFS 测定滤液中的剩余砷浓度。
1.7 吸附/解吸试验
在吸附/解吸试验中,首先称取0.15 g 吸附剂粉末于50 mL 离心管中,然后加入15 mL 20 mg/L As(Ⅲ)溶液,在298 K、pH 为7.0±0.2 的条件下,将离心管密封并置于恒温振荡器(180 r/min)中反应24 h,每个试验做3 次平行。反应结束后,悬浮液经0.45µm 的滤膜快速过滤,保留上清液。然后用饱和氯化钠清洗固体样品2 次,再分别添加15 mL 0.1 mol/L NaOH 溶液进行解吸试验,在298 K 条件下,将离心管密封并置于恒温振荡器(180 r/min)中反应24 h。反应结束后,悬浮液经0.45 µm 的滤膜快速过滤,保留上清液。采用AFS 测定解吸前后上清液中的剩余砷浓度。砷的去除率(η)按下式计算:
1.8 元素测定及物相表征
称取150 mg 固体吸附剂于50 mL 锥形瓶中,加入10 mL 混酸(HNO3与HCl 体积比为1∶3)后在电热板上进行消解,采用原子吸收光谱仪(AAS, AA-240, Agilent, 美国)测试NFM、FMO、Bir 和Goe 中的铁和锰元素含量,采用AFS 测试溶液中的总砷浓度。
比表面积(SSA)通过Brunauer-Emmett-Teller(BET)方法计算;采用VEGA3 XMU(Tescan,中国)扫描电镜(SEM)分析吸附剂的形貌特征;傅里叶变换 红 外 光 谱 仪(FTIR)采 用Bruker Equinor 55(Bruker,德国)和OPUS 软件测试,光谱范围为400~4 000 cm-1; 利 用 X 射 线 光 电 子 能 谱( XPS)(XSAM800,Kratos,英国)检测吸附剂表面的结合能,并通过Avantage 软件以C1s 峰(284.8 eV)作为校正标准进行拟合;X 射线衍射仪(XRD)(D8 ADVANCE,荷兰)用于检测吸附剂的晶体结构。
2 结果与讨论
2.1 材料表征
吸附剂的元素组成如表1 所示。NFM 中主要含有Fe、Mn、Al、Ca、Si、P 等元素,且Fe 和Mn 的含量占总量的84.1%,表明天然铁锰矿以Fe、Mn 为主,同时含有部分杂质的矿物材料,可能是由于天然铁锰矿形成条件复杂导致的。比表面积测试结果表明,NFM(280.4 m2/g)的比表面积最大,其次是FMO(268.8 m2/g)、Bir(102.9 m2/g)和Goe(95.8 m2/g);且相比FMO,NFM 铁锰比更高(表2)。
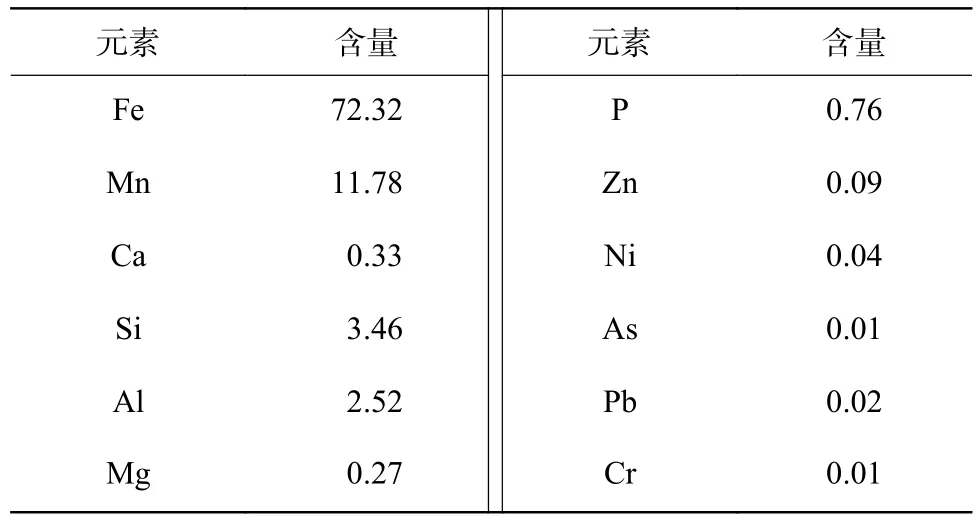
表1 NFM 元素含量分析Table 1 Percentage content of each element of NFM %
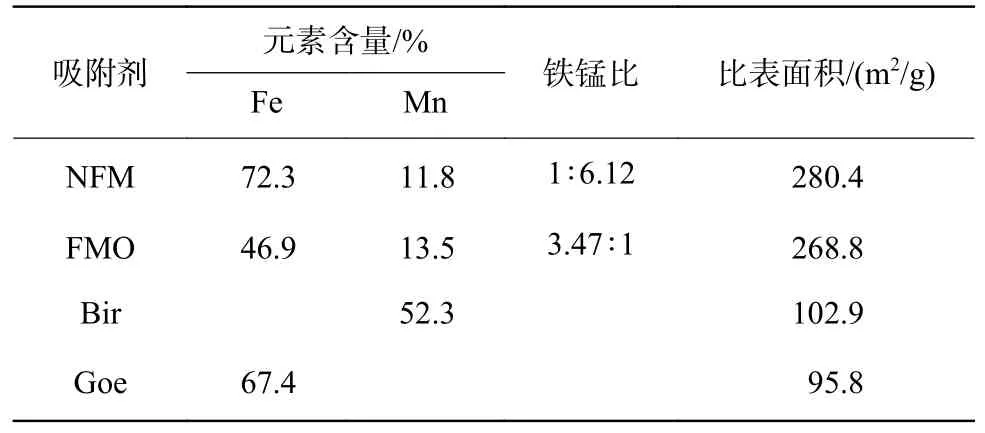
表2 吸附剂的Fe、Mn 含量和比表面积Table 2 Fe, Mn content and specific surface area of the adsorbent
对NFM、FMO、Bir 和Goe 的XRD 图谱〔图1(a)〕的分析结果表明,NFM 和FMO 的结晶性较差,锰氧化物和铁氧化物是其主要成分。NFM 是各种矿物的混合物,包括针铁矿(FeOOH,JCPDS 01-0401)、软 锰 矿(MnO2,JCPDS 12-0716)和 赤 铁 矿(Fe2O3,JCPDS 24-0072),并含有少量石英(SiO2,JCPDS 46-1045)〔图1(a)〕。这与Allard 等[28]观察到的结论相似,由于在自然条件下形成,天然氧化锰中含有1.96%的SiO。

图1 吸附剂的XRD 与FTIR 图谱Fig.1 XRD spectrum and FTIR spectra of original absorbents
FTIR 图 谱〔图1(b)〕表 明,在3 379~3 415 和1 629~1 634 cm-1处的峰分别对应H—O—H 的拉伸振动和弯曲振动,显示了吸附剂表面存在物理吸附的水分子[29-30];在1 382 、1 383 和1 384 cm-1处的峰对应NO3-的振动,这是由于NaNO3作为溶液背景电解质得到的[20];在458、471 和445 cm-1的特征峰分别为NFM、FMO、Bir 结构中Mn—O 的振动[31]。研 究 表 明[32],920 cm-1处 的 特 征 峰 很 可 能 是Mn—Mn—OH,并随着Co2+离子交换反应而减少,这与918 cm-1处的峰类似。889、976~1 122 和790~898 cm-1处的峰被认为是NFM、FMO 和Goe 中包含的铁(氢)氧化物内的Fe—O 弯曲振动[33]。
2.2 吸附剂性能及影响因素
2.2.1 等温吸附曲线
在298 K、pH 为7.0±0.2 的条件下,As(Ⅲ)在吸附剂上的吸附等温线如图2 所示。FMO 和NFM 对As(Ⅲ)的qm分别为67.28、47.8 mg/g;而Bir 和Goe显示出较低的吸附能力,其qm分别为31.09 和45.57 mg/g。Joshi 等[34]也报道了类似的现象,对于芳香族有机砷的吸附,FMBO(铁和锰的二元氧化物)比FeOOH 和MnO2具有更高的降解效率。
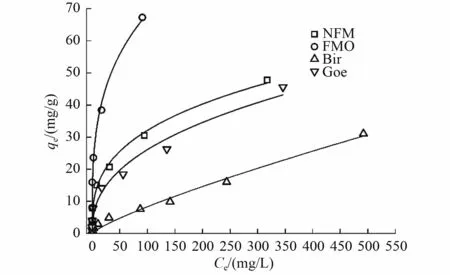
图2 吸附剂对As(Ⅲ)的吸附等温线Fig.2 Adsorption isotherm plot of As(Ⅲ) on adsorbents
采用Freundlich 和Langmuir 模型拟合吸附数据,吸附参数见表3。Freundlich 等温线模型比Langmuir 等温线模型更能解释As(Ⅲ)在NFM、Bir和Goe 上的吸附,其R2均大于0.97;而在FMO 上,Langmuir 等温线模型更适合,R2为0.973。对于4 种吸附剂,Freundlich 模型的R2很高,说明吸附过程中存在着非均匀表面吸附。此外,FMO 和NFM 较高的吸附能力可能首先归因于其表面有比Bir 和Goe 表面更多的活性位点,这也被表2 中的比表面积所证明。综上,NFM 作为吸附剂对砷的去除能力明显高于纯铁或锰氧化物。
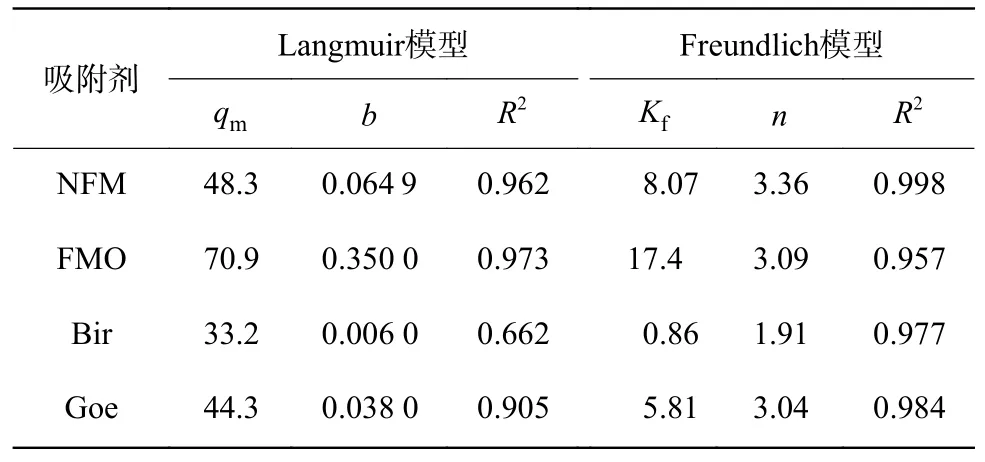
表3 吸附剂对As(Ⅲ)的吸附的Langmuir 和Freundlich模型参数Table 3 Langmuir and Freundlich model parameters for adsorption of As(Ⅲ) on adsorbents
2.2.2 吸附热力学
为了探究温度对As(Ⅲ)在不同吸附剂上吸附的影响,在278、298 和308 K 下进行了热力学试验,结果如图3 所示。As(Ⅲ)在NFM、FMO、Bir 和Goe上的吸附能力随温度的升高而增加,随着1/T的增加,各热力学曲线均呈下降趋势,说明温度的升高有利于As(Ⅲ)在吸附剂上的吸附,这是因为分子的运动速度加快,As(Ⅲ)与吸附剂之间碰撞的机会增加导致的[35]。由表4 可见,ΔH0均大于0,表明吸附过程为吸热反应,升高温度有利于吸附反应的进行;ΔG0均为负值,且其绝对值随着温度的升高而增加,表明As(Ⅲ)的吸附反应是自发进行的,且反应温度越高,吸附剂与As(Ⅲ)的吸附作用力越强[36]。
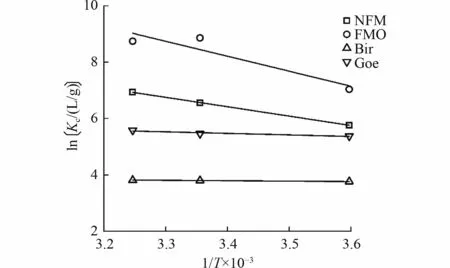
图3 ln Kc 与1/T×10-3 的拟合线Fig.3 Fitting plot of ln Kc versus 1/T×10-3
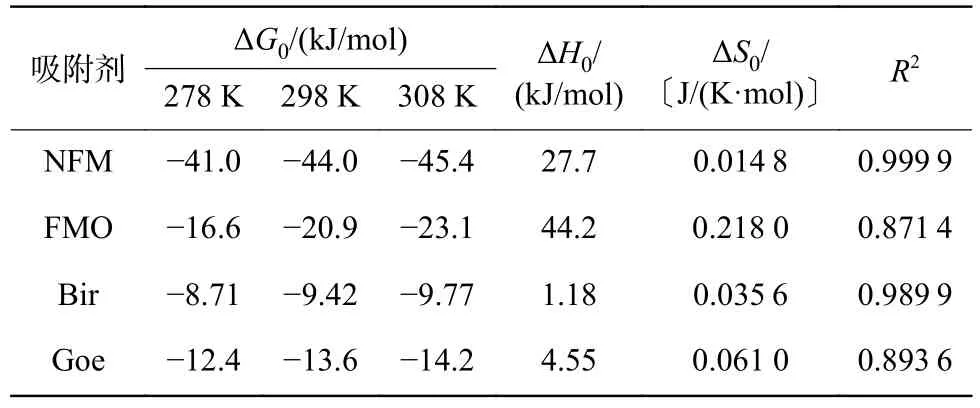
表4 不同温度下As(Ⅲ)在吸附剂上吸附的热力学参数Table 4 Thermodynamic parameters of As(Ⅲ) adsorption on adsorbents at different temperatures
2.2.3 吸附动力学
吸附动力学是确定吸附剂对As(Ⅲ)吸附效率的最重要特性之一。如图4 所示,As(Ⅲ)浓度为240 mg/L 时,在0~360 min 的初始反应阶段内,As(Ⅲ)的吸附量迅速增加,在反应180 min 后达到了吸附平衡状态。当反应4 h 时,观察到NFM 上的qt为16.99 mg/g,达到其饱和吸附容量的72.35%。经动力学拟合发现,NFM 的As(Ⅲ)吸附容量比Bir 和Goe 高,仅次于FMO。即NFM 的As(Ⅲ)饱和吸附容量为21.78 mg/g,FMO 为23.82 mg/g,Bir 为7.44 mg/g,Goe 为17.57 mg/g。试验数据由准一级动力学模型和准二级动力学模型拟合,其动力学参数和相关系数(R2)见表5。由表5 可知,准二级动力学(R2大于0.99)比准一级动力学更适合说明As(Ⅲ)在吸附剂上的吸附情况。从图4 可以看出,在初始阶段(<60 min),快速吸附可能是由于吸附剂外表面有很多可用的吸附点;在下一阶段(120~240 min),As(Ⅲ)的吸附和氧化逐渐耗尽了吸附剂表面的活性位点,导致As(Ⅲ)去除率下降。
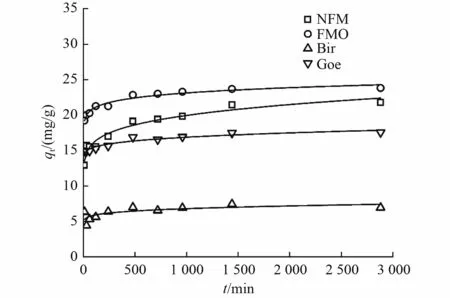
图4 吸附剂对As(Ⅲ)的吸附动力学Fig.4 Adsorption kinetics of As(Ⅲ) on adsorbents
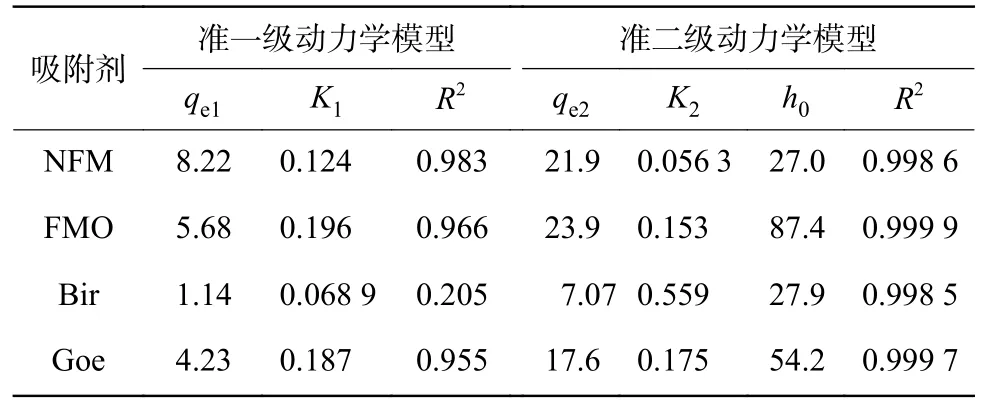
表5 准一级动力学模型和准二级动力学模型拟合参数Table 5 Fitting parameters of pseudo-first-order and pseudosecond-order kinetic models
2.2.4 p H 影响试验
溶液的初始pH 会影响砷和吸附剂的表面特性。图5 显示初始pH 为1.0~9.0 范围内As(Ⅲ)在不同吸附剂上的吸附情况。FMO、NFM、Bir、Goe 的电荷零点依次为7.02、5.92、2.27 和7.30。当溶液的初始pH 在1.0~9.0 范围内时,As(Ⅲ)主要以中性(H3AsO3)状态存在。初始pH 对NFM 和FMO的吸附效果无明显影响。在反应体系pH 为1.0 时,As(Ⅲ)在FMO 和NFM 上的吸附量分别为23.23 和20.84 mg/g,但在Bir 和Goe 上的最大吸附量仅为9.879 和18.45 mg/g。As(Ⅲ)在Bir 上的吸附量随着溶液pH 的增加而减少,这可能是由于Bir 表面的羟基去质子化而带负电,导致Bir 表面吸附的砷被有效解吸[37]。Goe 对As(Ⅲ)的吸附能力明显高于Bir,在pH 为1.0~5.0 的范围内,吸附量随着pH 的增加而迅速增加,随后又缓慢增加。这可能是由2 个因素造成的:1)在酸性条件下(pH 小于5.0),Goe 的结合面存在大量的氢离子(H3O+),导致砷氧阴离子的去除率迅速增加;2)在较高的pH 条件下(pH 为9.0),Goe 的表面带负电荷与砷物种之间存在静电排斥,这与Jaiswal 等[38]的研究结果相似。此外,As(Ⅲ)的吸附被吸附剂表面羟基形成的内球表面复合物所抑制[39],导致对其吸附速率降低。
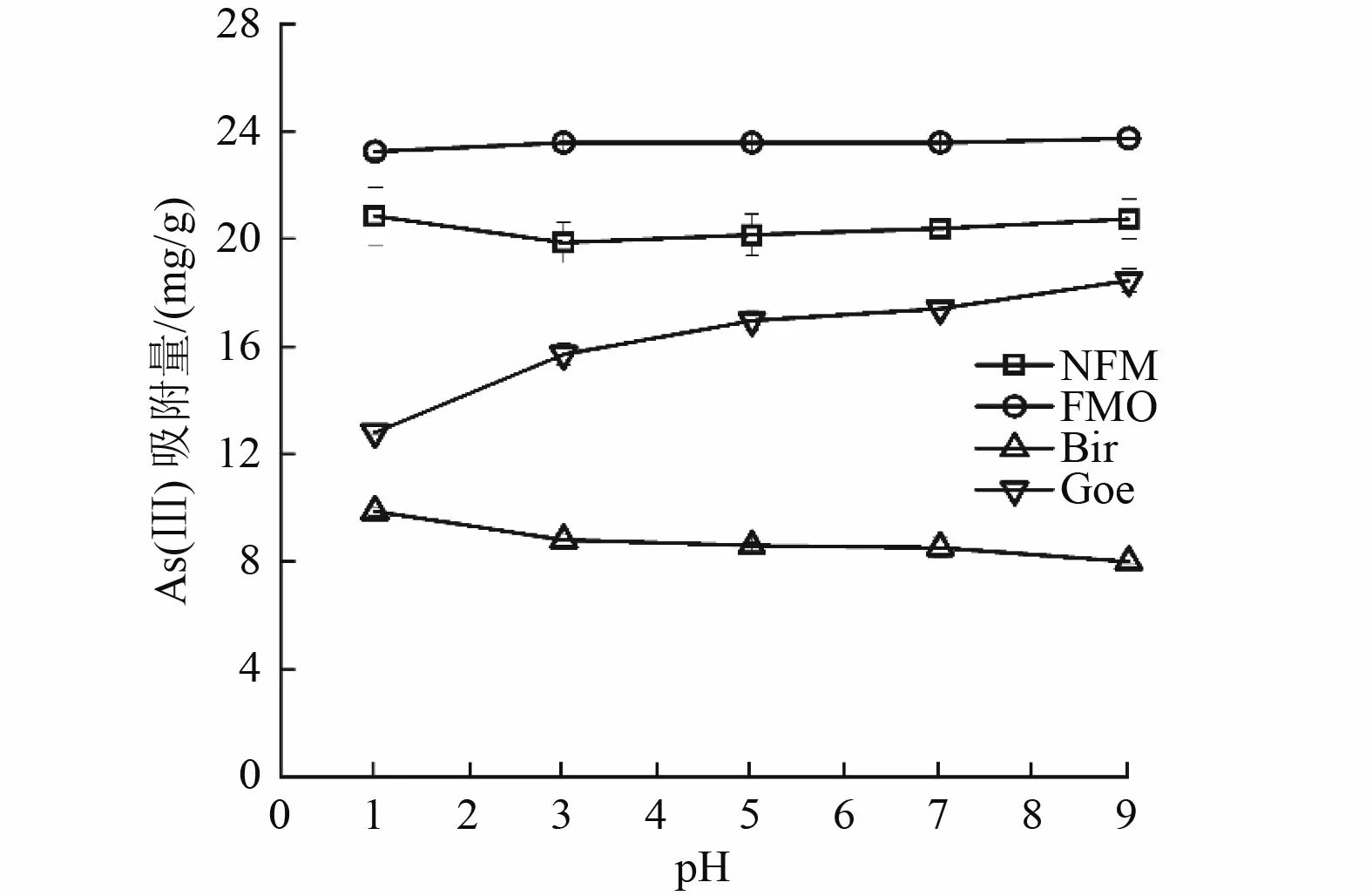
图5 pH 对吸附剂吸附As(Ⅲ)的影响Fig.5 Effect of pH on the adsorption of As(Ⅲ) on adsorbents
2.2.5 稳定性试验
As(Ⅲ)可以通过离子交换、物理吸附或化学键的方式吸附在吸附剂上。为了检验吸附剂吸附As(Ⅲ)后的稳定性,用0.1 mol/L 的NaOH 对As(Ⅲ)进行解吸,结果见图6。NFM、FMO、Bir 和Goe 对As(Ⅲ)的吸附率分别为88.2%、99.6%、41.6%和78.8%,采用0.1 mol/L NaOH 解吸后,其解吸率分别为43.3%、47.3%、32.4%和36.8%。这可能是由于NaOH 提供了大量的OH-阴离子,使其与吸附在吸附剂表面的砷物种产生强烈的竞争效应导致的[40]。
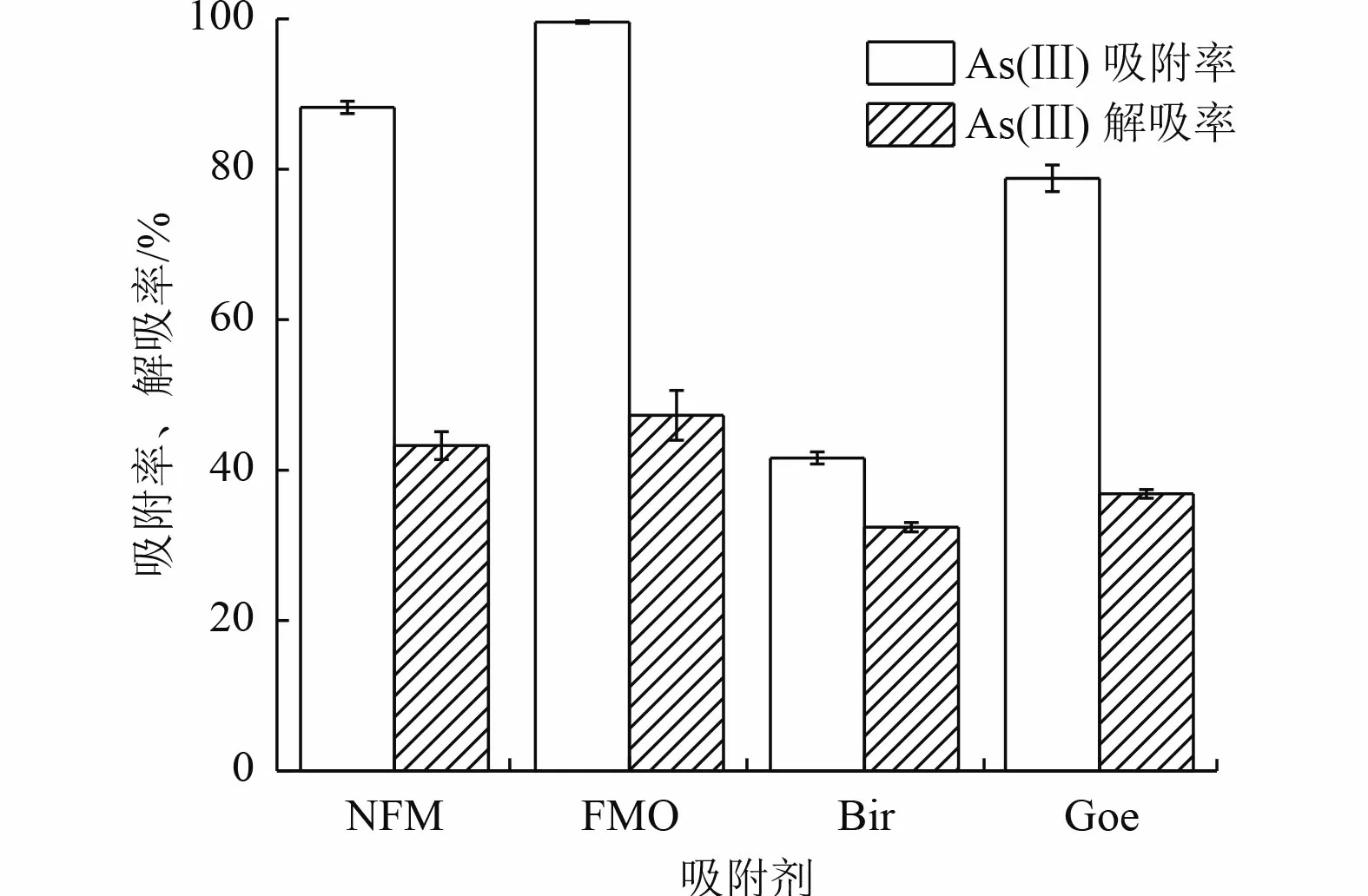
图6 吸附剂对As(Ⅲ)的吸附和解吸Fig.6 Adsorption and desorption of As(Ⅲ) on adsorbents
2.3 NFM 去除As(Ⅲ)机制
前期试验结果表明,NFM 作为吸附剂对水相中的砷具有良好的吸附性能,在中性条件下(pH 为7.0)NFM 的吸附能力较高。为深入了解NFM 与水体砷的界面关系,应用XRD、FTIR、SEM 及XPS 等表征手段进行分析。图7 为As(Ⅲ)在4 种吸附剂上吸附前后的XRD 图谱。由图7 可见,NFM 是各种矿物的混合物,包括针铁矿(FeOOH,JCPDS 01-0401)、软锰矿(MnO2,JCPDS 12-0716)和赤铁矿(Fe2O3,JCPDS 24-0072),并含有少量石英(SiO2,JCPDS 46-1045)。然而,当吸附As(Ⅲ)后,Bir 和Goe 上观察到吸附As(Ⅲ)后MnO2和FeOOH 的峰强度较弱,这与NFM和FMO 相似,显示出MnO2和FeOOH 在As(Ⅲ)的吸附中占主导作用。
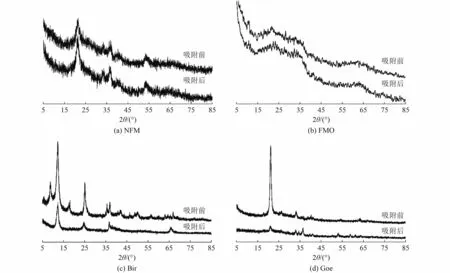
图7 吸附剂吸附As(Ⅲ)前后的XRD 图谱Fig.7 XRD spectrum of absorbents before and after absorption of As(Ⅲ)
图8 为As(Ⅲ)在FMO、NFM、Bir 和Goe 上吸附前后的FTIR 光谱。由图8 可见,与吸附As(Ⅲ)前相比,吸附后的FTIR 图谱在3 379、3 383、3 387 和3 415 cm-1处观察到更宽的特征峰,表明吸附剂表面有丰富的H—O—H 官能团,这可能是由氢氧化物形成[41]。NFM 和FMO 吸附As(Ⅲ)后,观察到Fe—O和Mn—O 的峰强度降低,揭示了这些官能团在As(Ⅲ)的吸附过程中起了重要作用。值得一提的是,793 cm-1〔图8(a)〕和797 cm-1〔图8(b)〕处的峰为砷物种中As—O 的拉伸振动[27],这些峰的存在也证实了As(Ⅲ)在NFM 和FMO 表面发生了吸附作用。

图8 吸附剂吸附As(Ⅲ)前后的FTIR 光谱Fig.8 FTIR spectra of absorbents before and after absorption of As(Ⅲ)
采用SEM 观察4 种吸附剂吸附As(Ⅲ)前后的表面形貌(图9)。反应前,吸附剂的表面形貌均为不规则的块状〔图9(a)~图9(d)〕,且NFM 表面光滑,而FMO、Bir 和Goe 呈现出粗糙的表面形貌。当吸附剂吸附As(Ⅲ)后,其表面形貌产生了明显的差异,4 种吸附剂表面均出现明显的粗糙形貌改变,该团聚现象表明砷物种被吸附在吸附剂表面。

图9 吸附剂吸附砷前后的SEM 图谱Fig.9 SEM micrographs of absorbents before and after absorption of As(Ⅲ)
为进一步分析As(Ⅲ)的吸附和氧化行为,采用XPS 光谱来确定NFM 表面的元素含量和氧化情况。表6 为吸附剂中Mn、Fe 和As 的原子占比。NFM 吸附As(Ⅲ)前后的情况如图10 所示。图10(a)中位于66.1、540.2、652.1 和721.5 eV 的峰,分别对应于As3d、O1s、Mn2p 和Fe2p 的特征峰[34-35]。基于多峰高斯拟合,O1s 光谱可以分解为3 个峰,分别在529.39、530.9 和532.6 eV 左右,这分别归因于金属(氢)氧化物(M—O/M—OH)和NFM 表面吸附的H2O 的存在[42-43]。M—OH 的峰面积大于其他物种,表明NFM 表面出现了大量的氢氧化物,如FeOOH。此外,吸附As(Ⅲ)后,M—O 的峰面积比从30.70%升至53.97%,M—OH 的峰面积比从48.42%降到23.35%,与在FMO、Bir 和Goe 上吸附的As(Ⅲ)有相同的趋势,这与FTIR 关于M—O—As 键形成的结果一致。
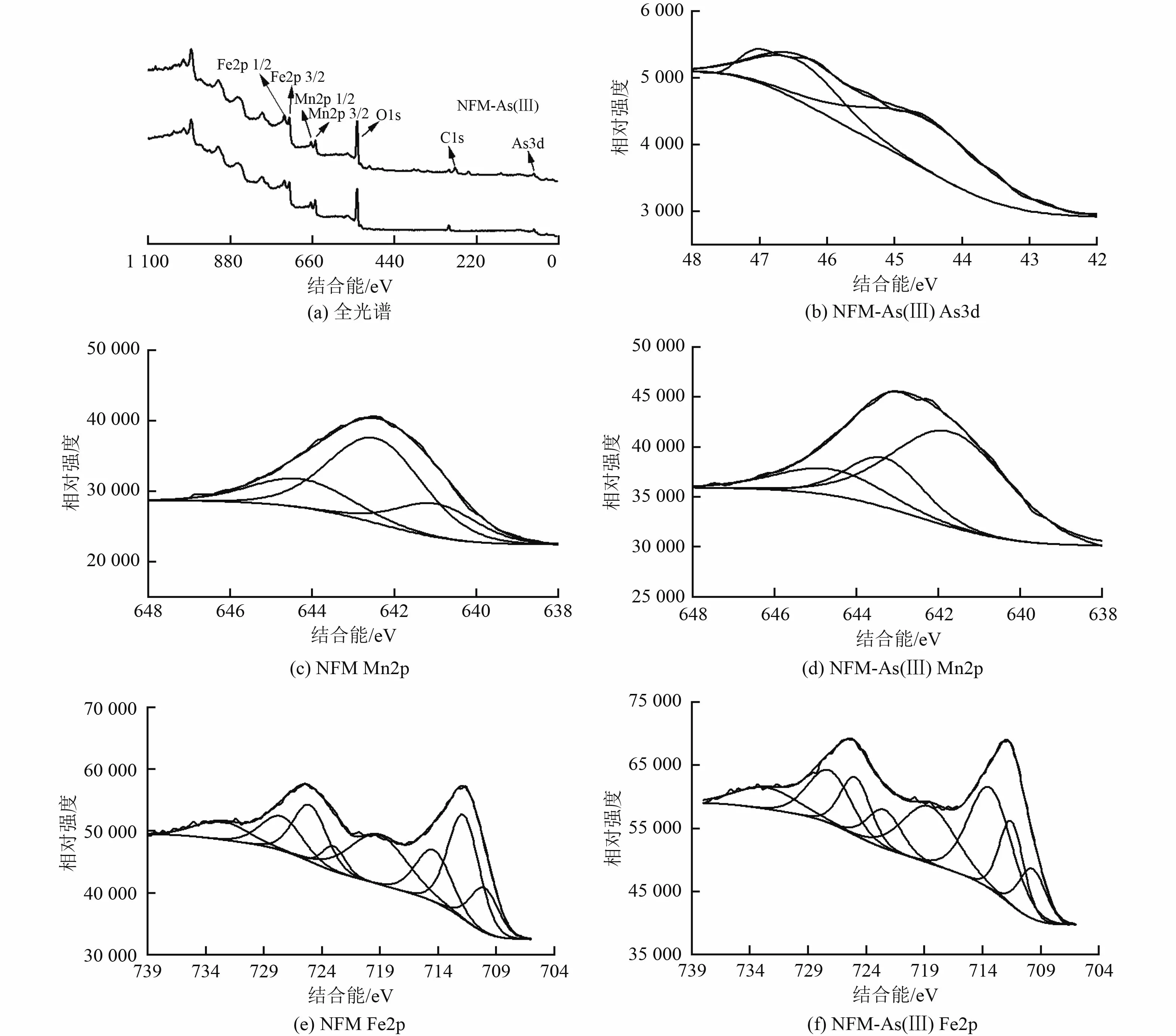
图10 NFM 吸附As(Ⅲ)前后的XPS 图谱Fig.10 XPS spectra of NFM before and after adsorption of As(Ⅲ)
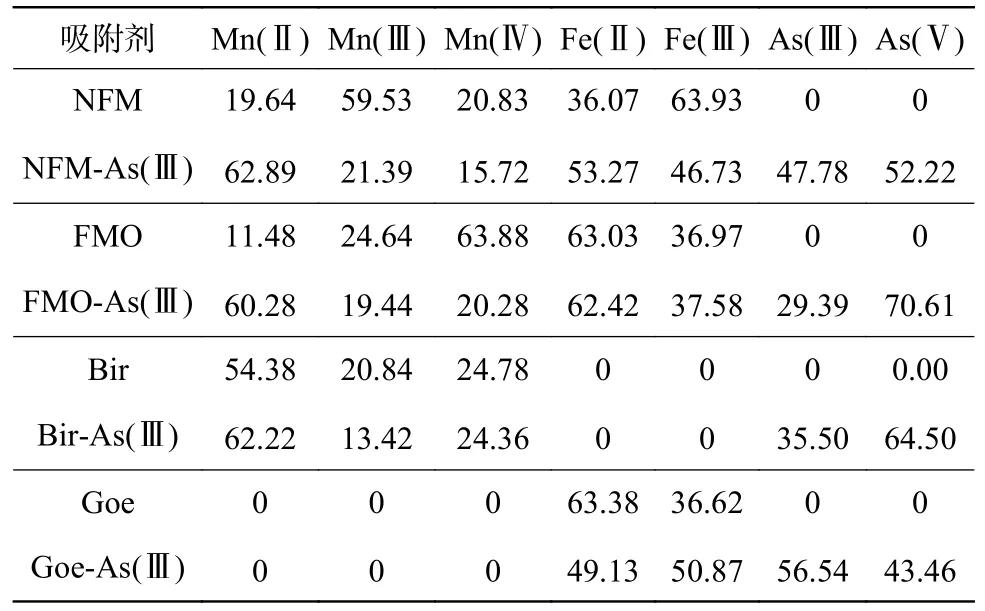
表6 吸附剂中不同价态Mn、Fe、 As 的原子占比Table 6 Atomic percentages of the different valence of Mn, Fe, As in absorbents %
NFM 对水相中As(Ⅲ)的去除过程是复杂的,包括吸附和氧化行为。已有研究观察到,表面结合的—OH 可以与砷物种产生内球表面络合物,与扩展X 射线吸收精细结构光谱(EXAFS)的结果一致[37,40]。NFM 界面上的羟基可以与砷物种结合形成表面络合物,达到从水溶液中去除砷的目的,这也导致了M—O 峰面积的增加。同时,NFM 在吸附As(Ⅲ)后,Mn(Ⅲ)和Mn(Ⅳ)的原子占比下降,而Mn(Ⅱ)的原子占比上升(表6),这可能是由于As 在NFM表面的吸附后被Mn 氧化所致。与NFM 相比,FMO和Bir 中Mn(Ⅲ)和Mn(Ⅳ)占比在与As(Ⅲ)反应后也有所下降,说明As(Ⅲ)和Mn(Ⅲ)/Mn(Ⅳ)发生了还原反应〔式(10)~式(12)〕[27,44-45]。高价Mn〔Mn(Ⅲ)和Mn(Ⅳ)〕可 以 首 先 氧 化As(Ⅲ),然 后 转 化 为Mn(Ⅱ)和MnOOH*。MnOOH*也显示出对As(Ⅲ)的氧化作用,然后根据式(12)生成Mn(Ⅱ)。根据这些结论,可以合理地推测As(Ⅲ)在NFM 表面的氧化机制与Bir 的氧化机制相同。通过XPS 结果探讨了As(Ⅲ)在Goe 表面的主导机制,表6 表明,As(Ⅲ)在Goe 上负载后,Fe(Ⅱ)的原子占比下降,而As(Ⅴ)的原子占比上升,说明Fe—O 被As 物种所覆盖,从式(13)可以看出,表面形成了单齿单核内层络合物[46]。
基于上述结论,发现铁氧化物具有很强的亲和力,锰氧化物对砷物种表现出明显的氧化性能。因此,铁氧化物和锰氧化物的协同作用赋予了NFM 高的吸附能力。在NFM 去除As(Ⅲ)的过程中,最初的去除机制是通过铁氧化物表面的羟基进行吸附。然后,锰氧化物中的Mn(Ⅲ)和Mn(Ⅳ)对As(Ⅲ)有明显的氧化作用,导致As(Ⅴ)的生成和高价态Mn 的还原,As(Ⅴ)和Mn(Ⅱ)占比的增加证明了这个过程的发生〔图10(b)~图10(c)〕。NFM 的表面出现了As(Ⅴ),表明新生成的As(Ⅴ)又被吸附剂表面吸附(表6)。
其中MnOOH*是中间反应产物。
3 结论
(1)NFM 的主要成分为铁氧化物和锰氧化物,对水相中的As(Ⅲ)表现出很强的亲和力和较高的吸附能力(47.8 mg/g)。在NFM 对As(Ⅲ)的吸附试验中,试验数据可以较好地被Freundlich 模型和准二级动力学模型拟合。
(2)FTIR、XRD 和XPS 分析结果表明,NFM 去除As(Ⅲ)的主要机理包括3 个步骤:FeOOH 的羟基在表面吸附砷物种;高价Mn 将As(Ⅲ)氧化成As(Ⅴ);As 在NFM 表面形成球内表面络合物。此外,吸附的砷物种,包括As(Ⅲ)和As(Ⅴ),均可用NaOH 溶液解吸,即可以重复利用。
