FeS2 强化微生物燃料电池阳极反硝化脱氮与产电特性
2023-11-30葛丹丹吴兵党杨晶晶许晓毅吴玮黄天寅
葛丹丹,吴兵党,2,杨晶晶,2,许晓毅,2,吴玮,2,黄天寅,2*
1.苏州科技大学环境科学与工程学院
2.苏州市海绵城市技术重点实验室
微生物燃料电池(microbial fuel cell,MFC)通过微生物活动消耗有机质并将化学能转化为电能[1]。MFC 与污水处理相结合可以同步实现废水处理和电能回收,这使得MFC 成为一种有前途的废水处理技术,而受到广泛关注[2-3]。近年来,许多研究者尝试采用MFC 处理含硝酸盐废水,取得了较好的污染物去除及产电效果[4-5]。然而,MFC 阳极反硝化对碳氮比(C/N)依赖性强,高C/N 条件下有利于硝态氮及亚硝态氮废水降解[6]。因此,增加低C/N 阳极反硝化脱氮产电的能力显得尤为重要。
为了增强MFC 处理低C/N 废水的效能,研究人员已通过电刺激或添加硫化物、铁、氢等无机化合物引入自养反硝化的方式,降低了对碳源的依赖性[7-9]。Tong 等[10]发现异养-自养反硝化能引起异养菌与自养菌之间的协同作用,提高反硝化效率和处理能力,降低电能消耗和有机碳源消耗。Liu 等[11]研究表明,在较低的外加电流下,微生物和电流之间的协同作用增强,反硝化作用得到改善。Ai 等[12]开发了以醋酸盐和硫化物(Na2S)作为电子供体的阳极混合营养型反硝化微生物燃料电池,结果表明,在不同碳氮硫比条件下硝酸盐去除率达到91.37%~98.75%,硫化物被证明既是反硝化又是发电的有效电子供体。但现有研究鲜有将生物脱氮与电化学相结合以提高体系在低C/N 下脱氮性能的报道,且报道中所添加的硫化物(H2S、HS-、S2-等)多为常见的水体污染物,对环境和人类会产生一定危害。FeS2是固态硫源,来源广泛,较其他硫源硫酸盐释放量更低,理论上以FeS2为电子供体的自养反硝化每去除1 g NO3-生成4.57 g SO42-,而以单质硫和硫化物为电子供体的自养反硝化生成的SO42-含量分别是FeS2的1.65 倍和1.21 倍。此外,FeS2可以刺激反硝化微生物和产电微生物的生长,有望强化MFC 实现低C/N脱氮。研究表明,FeS2在生物反应器中是一种很有前途的基质,可以在缺乏足够的可生物降解有机碳的情况下提高废水中硝酸盐的去除率[13-14]。此外,FeS2有利于提高胞外电子转移能力,也有利于电化学活性细菌的富集与生长[15]。然而,FeS2在微生物燃料电池中强化脱氮产电的应用和机理分析的相关研究较少,因此亟须探究FeS2对MFC 脱氮产电的可行性与作用,尤其是对低C/N 下MFC 运行的影响。
笔者将FeS2引入阳极反硝化微生物燃料电池中,构建FeS2-微生物燃料电池脱氮体系(pyritesmicrobial fuel cell,Pyr-MFC)。研究FeS2的加入对阳极反硝化MFC 脱氮产电的作用以及探究减少有机碳源的投加对Pyr-MFC 体系稳定运行的影响,并通过高通量测序技术分析Pyr-MFC 阳极微生物群落运行前后特征变化,通过各项表征和铁硫元素贡献解析等分析FeS2强化体系低C/N 下的脱氮机理,以期为低C/N 下MFC 反硝化脱氮提供可能。
1 材料与方法
1.1 试验装置与材料
试验采用H 型双室微生物燃料电池(图1)。阳极室和阴极室均采用有机玻璃制成,尺寸为5 cm×5 cm×8 cm,有效容积为200 mL。两极室均为独立装置,中间用阳离子交换膜隔开(4 cm×4 cm,CMI-7000,Membranes International Inc,美国)。阳极和阴极电极使用钛丝导线相连,外电路负载1 000 Ω 电阻,同时连通数据采集器。数据采集器每5 min 收集1 次实时电压,每个数据取6 次测量平均值,反应器放置于磁力搅拌器上并置于(30±1)℃的生化培养箱中。
阳离子交换膜在使用前先用去离子水浸泡24 h进行预处理。阳极和阴极电极均采用碳纤维刷(直径3 cm×长度3 cm)。在组装MFC 前,对碳纤维刷进行预处理:在丙酮中浸泡12 h,取出后放在无水乙醇中超声冲洗3~5 次;接着分别用1 mol/L 的HCl和1 mol/L 的NaOH 浸泡4 h;然后用蒸馏水超声冲洗至中性,置于烘箱中于80 ℃烘干;最后,用砂纸打磨去除钛丝表面的金属氧化层。
阳极室投加的材料为酸洗的天然FeS2粉末,其预处理方式如下:天然FeS2粉碎过200 目筛后,用无水乙醇超声5 min,除去粉末中的细颗粒和表面杂质;然后用1 mol/L HNO3洗涤5 min 约2~3 次,接着用蒸馏水和乙醇冲洗至中性;最后于25 ℃真空干燥箱干燥,并保存在干燥箱中。通过浓硝酸消解方式测得0.1 g 材料可释放SO42-约0.2 kg/L。在衍射角(2θ)为20°~80°的范围内测定材料的X 射线衍射(XRD)扫描光谱(图2),根据Jade 软件匹配得到该材料对应的衍射峰与黄铁矿相FeS2的标准卡片(PDF#42-1340)基本一致。证明材料的主要成分为FeS2,晶体结构相似度较高。

图2 FeS2 材料XRD 图Fig.2 XRD diagram of FeS2 material
1.2 接种污泥与MFC 的启动
MFC 的接种污泥采用苏州某市政污水厂缺氧段反硝化污泥,接种量为40 mL。MFC 采用序批式培养方式运行,所有条件下均平行运行2 组MFC 反应器。MFC 阳极微生物起初以C/N 为15 培养,便于脱氮产电菌快速培养启动,接着以C/N 为5 稳定培养,然后不断降低C/N(分别为4、3、2、1)探究其对MFC 运行性能的影响。每次试验前,阳极液需氮吹30 min 去除水中溶解氧,待运行后出水COD 或硝态氮测量值各自相差小于5%时(认为是1 个周期)更换阳极液和阴极液。当MFC 的输出电压与脱氮效果在3 个周期内稳定时,即认为启动成功。
试验设置不加FeS2的空白对照组(C-MFC)和加入FeS2的试验组(Pyr-MFC)。阳极液为0.641 g/L的NaAc(即0.5 g/L COD)、0.607 1 g/L NaNO3(即0.1 g/L NO3--N)、0.02 g/L KH2PO4以及10 mL/L 微量元素浓缩液(表1),初始pH 为7.0 左右。在Pyr-MFC 的阳极室投加7 g FeS2粉末。阴极液采用铁氰化钾作为电子受体(10 g/L K3[Fe(CN)6]),其pH 用25 mmol/L 的磷酸盐缓冲溶液维持在7.0左右。

表1 微量元素溶液组成Table 1 Composition of trace element solution
1.3 试验设计
(1)加入FeS2对MFC 阳极反硝化脱氮与产电的影响
将FeS2加入到NO3--N 废水中混合,检测5 d 内NO3--N 浓度的变化,探究FeS2在Pyr-MFC 中是否存在化学脱氮效果。在此基础上,通过对比不加FeS2的空白对照组(C-MFC)和加7 g FeS2的试验组(Pyr-MFC),探究FeS2的加入对MFC 阳极反硝化脱氮与产电的影响,该试验在C/N 为5 下进行,120 h为1 个运行周期。
(2)不同C/N 对Pyr-MFC 阳极反硝化脱氮与产电的影响
建立4 组不同C/N 的Pyr-MFC 反应器,C/N分别为4、3、2、1,FeS2投加量均为7 g,72 h 为1 个运行周期,进水NO3--N 浓度为100 mg/L,初始pH 约为7.0,探究不同C/N 对MFC 阳极反硝化脱氮与产电的影响。
(3)运行结束后阳极表面形态及微生物群落变化
在反应器运行结束后,取C/N 为3 时的MFC 阳极室内使用前后的碳刷电极,采用扫描电子显微镜(SEM)对C-MFC、Pyr-MFC 反应器挂膜前后(空白碳刷和反应器稳定运行后的碳刷生物膜)的表面形态进行成像,观察碳刷表面微生物生长变化和FeS2附着效果。采用高通量基因测序技术,以接种污泥和C-MFC、Pyr-MFC 反应器稳定运行后的阳极碳刷表面微生物作为样品,对MFC 阳极室微生物群落变化进行分析。
(4)MFC 中物质转移试验
取试验前后硫铁矿进行XPS 表征,探究MFC中的硫铁矿元素变化。在4 组MFC 反应器中分别加入FeCl2、FeCl3、Na2S、NaS2O3,对比各反应器对NO3--N 的去除效果,在试验结束后取4 组反应器内污泥样品进行高通量基因测序,探究不同价态铁或硫在MFC 中的脱氮性能。
1.4 分析检测方法
1.4.1 水质分析方法
水质指标依据《水和废水监测分析方法》4 版[16]中的方法进行检测。其中pH 采用pH 计(WTW 7110)测定;COD 采用重铬酸钾法测定;TN 浓度采用过硫酸钾分光光度法测定;NH4+-N 浓度采用纳氏试剂分光光度法测定;NO3--N、NO2--N、SO42-浓度采用离子色谱法(ICS-900,Thermo,美国)测定;Fe2+和总铁浓度采用邻菲啰啉分光光度法测定。
COD、氮等的去除率通过反应结束时检测浓度与初始状态下浓度之比计算得到,数据显著性分析通过SPSS 20.0 软件进行,采用独立样本进行t检验。
1.4.2 物理表征方法
采用XRD 仪对FeS2材料的晶型进行表征分析;采用X 射线光电子能谱(XPS)对反应前后的FeS2进行Fe、S 元素精细谱分析。
1.4.3 电化学分析方法[17]
通过输出电压(U)、体积功率密度(W)、阴(阳)极电极电位(E)等电化学指标分析MFC 产电性能;采用循环伏安(CV)法测定阳极微生物电化学活性;采用电化学阻抗测试法(EIS)对MFC 阳极的阻抗行为和内阻大小进行分析。
U由安捷伦34972A 数据采集器每5 min 采集1 次,每个数据取6 次测量的平均值,以运行时间和U分别为横、纵坐标作MFC 电压曲线图。
电极电势趋势可以用来观察MFC 阴(阳)极的性能,将参比电极(饱和甘汞电极)与阴(阳)极用万用表连接则可得阴(阳)极电极电位。根据吉布斯函数和能斯特方程可知,当任意2 个电极组成电池时,该电池电动势等于其阴极电势与阳极电势之差。
体积功率密度是单位时间、单位体积MFC 所输出的能量,反映了MFC 的产电能力。计算公式如下:
式中:U为MFC 输出电压,V;R为外电路电阻,Ω;V为阳极室有效容积,m3。
利用华辰 CHI660 电化学工作站比较C-MFC和Pyr-MFC 阳极室微生物的氧化还原活性,绘制CV(电流-电压)曲线。采用三电极测量体系:阳极碳刷为工作电极,阴极碳刷为对电极,饱和甘汞电极为参比电极,电解液为MFC 阳极液,对电压最高时MFC 阳极室微生物进行CV 扫描。电势扫描范围为-0.85~0.80 V,扫描速度为10 mV/s。
采用华辰CHI660 电化学工作站进行EIS 的测定,比较C-MFC 和Pyr-MFC 阳极的阻抗行为和内阻大小,以阻抗实部Z′为横坐标、虚部-Z′′为纵坐标,绘制Nyquist 曲线。测试在MFC 运行状态下进行,测试前先将MFC 开路处理(外电路断开约10 min),待开路电压稳定后,将MFC 接入电化学工作站,采用三电极测量体系:阳极为工作电极,阴极为对电极,饱和甘汞电极为参比电极,进行电压最高时体系的EIS 测试。频率扫描范围为10-2~103Hz,正弦扰动幅度为10 mV。
1.4.4 微生物分析方法
电极微生物在扫描前需要经过固定、脱水、干燥、喷金等预处理,具体步骤如下:首先采用0.1 mol/L 磷酸盐缓冲液(PBS)清洗微生物样品3 次;再加入2.5%戊二醛固定12 h;然后用PBS 清洗3 次,每次浸泡10 min;接着用30%、50%、70%、80%、90%、100%梯度浓度的乙醇依次脱水,每次5~7 min;最后自然干燥后经喷金用扫描电镜观察。
2 结果与讨论
2.1 基于FeS2 构建的Pyr-MFC 脱氮产电性能
2.1.1 脱氮效果
在化学脱氮试验中,Pyr-MFC 中的NO3--N 浓度基本保持不变,NO3--N 和FeS2没有发生化学反应,这与已有研究结论[18-19]相符。C-MFC 和Pyr-MFC生物脱氮效果变化如图3 所示。由图3(a)可知,在前8 h,Pyr-MFC 和C-MFC 中的NO3--N 浓度均不断下降,Pyr-MFC 的NO3--N 降解速率为15.54 mg/(L·h),高于C-MFC〔12.02 mg/(L·h)〕,Pyr-MFC 和C-MFC 中的NO3--N 分别在第8 和12 小时被完全降解。与NO3--N 降解规律类似,Pyr-MFC 的COD 去除速率〔62.5 mg/(L·h)〕同样高于C-MFC〔42.12 mg/(L·h)〕,随着NO3--N 的完全降解,C-MFC 和Pyr-MFC 的COD降解速率迅速降至1.21 和1.24 mg/(L·h),降解速率更加平稳。
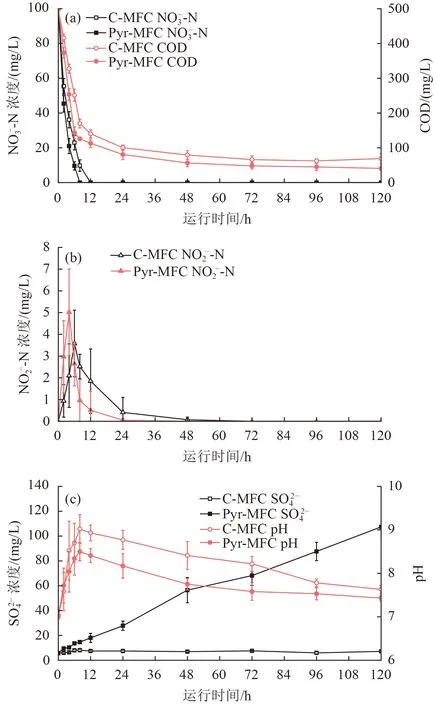
图3 不同MFC 脱氮效果对比Fig.3 Comparison of nitrogen removal effect of different MFCs
由图3(b)可知,C-MFC 和Pyr-MFC 中的NO2--N浓度最高分别达到3.58 和5.02 mg/L,在2 组MFC反应器中均未出现明显的累积。由图3(c)可知,2 组MFC 反应器内的pH 均呈先上升后下降的趋势,C-MFC 和Pyr-MFC 的平均pH 分别为8.06 和7.71,Pyr-MFC 中 的pH 较C-MFC 偏 低,可 能 是FeS2自养反硝化产生的酸度部分中和了异养反硝化产生的碱度[20]。C-MFC 中的硫酸盐浓度基本保持不变,而Pyr-MFC 中的硫酸盐浓度以1.28 mg/(L·h)的速率不断上升,在第8 小时NO3--N 完全降解后,硫酸盐的产生速率继续保持在0.83 mg/(L·h),在1 个周期(120 h)结束时,硫酸盐浓度最终达到107.38 mg/L。
2.1.2 产电效果
C-MFC 和Pyr-MFC 产电效果对比如图4 所示。由图4(a)可知,C-MFC 与Pyr-MFC 的初始电压分别为0.261 和0.630 V。C-MFC 反应器的电压在0~8 h 从0.261 V 左右逐渐降低,在8 h 降低到谷值0.202 V;8~12 h 电压重新升高,至12 h 达到峰值0.511 V;12~120 h 电 压 缓 慢 下 降 并 稳 定 在0.100 V 左右。在整个产电周期内,C-MFC 的最大电压达到0.511 V,相应的最大功率密度为1.30 W/m3。Pyr-MFC 反应器的电压在0~4.5 h 从0.630 V 左右逐渐降低,至4.5 h 降低到谷值0.536 V;4.5~10 h 电压重新升高,至10 h 达到峰值0.780 V;10~120 h 电压下降缓慢且相对稳定。在整个产电周期内,Pyr-MFC 的最大电压达到0.780 V,相应的最大功率密度为3.04 W/m3。说明FeS2的加入增强了Pyr-MFC 的产电性能。Ju 等[21]在单室MFC 中使用FeS2颗粒也提高了生物电输出,解释其原因在于硫和铁价态的转变为体系提供了电子,比如S2-变成SO42-、Fe2+和Fe3+相互转化。
MFC 电压大小取决于阴极电势与阳极电势的相对差值。如图4(b)所示,在产电周期内阴极电势基本稳定在0.300 V 左右,而阳极电势波动较大,表明MFC 的输出电能主要由阳极电势调控,阳极反应是产电的决定因素。采用CV 和EIS 对电压峰值时刻MFC 电化学性能进行分析,结果见图4(c)~图4(d)。Pyr-MFC 具有一对氧化还原峰,-0.016 V 出氧化峰对应电流-0.012 9 A,-0.369 V 出还原峰对应电流0.017 5 A。C-MFC 基本没有氧化还原峰。Pyr-MFC的闭合曲线面积(即电化学活性面积)大于C-MFC,说明Pyr-MFC 电化学催化活性更高,更有利于电子转移。通过EIS 测试发现,投加FeS2后溶液的内阻(Rs)和材料氧化还原反应电荷转移内阻(Rct)降低,说明Pyr-MFC 细菌之间电子转移速度更快,具有更好的导电性能。
2.2 C/N 对Pyr-MFC 运行性能的影响
反硝化过程中C/N 过高容易导致反应器出水COD 升高,而Pyr-MFC 可以在减少碳源的条件下进行自养反硝化反应,既能节省碳源的消耗,又能提高反硝化脱氮效果。由图5(a)可知,当C/N 为4、3 时,Pyr-MFC 的NO3--N 去除效果较好,去除率分别达到100%和97.8%;但是C/N 为2、1 时,Pyr-MFC 的NO3--N 去除率明显降低,分别为58.4%和49.7%,说明有机碳的存在有利于反硝化过程进行,但碳源不足会导致反硝化反应无法彻底进行。在不同C/N 条件下,Pyr-MFC 中的NO3--N 去除率均高于没有投加FeS2的C-MFC 反应器,表明FeS2的加入对MFC 反硝化脱氮有促进作用,同时也说明在缺乏足够碳源的情况下,FeS2的投加可以提高脱氮性能。以C/N=3 为 例,将72 h 的NO3--N 去 除 率 数 据 通 过SPSS 20.0 软件进行处理,独立样本t检验结果表明,Pyr-MFC 的NO3--N 去 除 率 显 著 高 于C-MFC(P<0.05)。研究表明,FeS2可以刺激异养反硝化细菌,同时能够进行FeS2驱动的自养反硝化,弥补碳源减少带来的不利影响[22]。由图5(b)可知,无论碳源是否充足,反硝化过程中的亚硝态氮变化趋势基本相同,即反硝化过程中均会出现亚硝态氮积累且随后逐渐消失的现象,在C/N 为3 时,亚硝酸盐的累积量较多,浓度最高达到11.29 mg/L,原因可能是硝酸盐还原速率相对较高,且电子供体相对较少,导致亚硝酸盐产生了积累。由图5(c)可知,当C/N 从4 减至1 时,即进水COD 呈梯度降低时,出水COD 均能维持在较低水平。由图5(d)可知,不同C/N 下,各Pyr-MFC 的硫酸盐浓度均不断增加,而各C-MFC 的硫酸盐浓度与初始相比基本没有变化。当C/N 为2、1 时,Pyr-MFC 中产生的硫酸盐浓度较高,分别达到98.51 和108.26 mg/L。硫酸盐浓度升高可能与硫的自养反硝化有关,当碳源不足时,微生物以硫及硫的化合物作为电子供体还原硝酸盐并产生硫酸盐,从而导致低C/N 时硫酸盐释放量增加[23]。
由图6 可知,C/N 对MFC 的产电能力影响较大。随着C/N 的降低,Pyr-MFC 的产电能力均大于C-MFC,但整体电压却大幅度降低。这说明FeS2可以提高MFC 产电性能;同时,碳源对MFC 电压的影响较大,在低C/N 情况下COD 越高,产电性能越好。由图6 可知,MFC 产电首先受到阳极反硝化脱氮影响呈下降趋势,到脱氮尾声电压迅速升高进行发电作用,随着碳源的消耗电压再逐渐降低,完成1 个周期脱氮产电。电子供体不足时,优先阳极反硝化脱氮,碳源较低不足以在产电阶段再次升高电压发电。
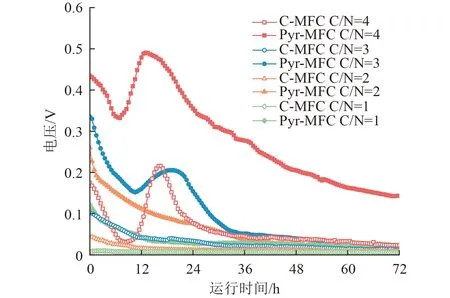
图6 C/N 对不同MFC 产电效果影响Fig.6 Effect of C/N ratio on the electricity production effect of different MFCs
2.3 Pyr-MFC 脱氮产电机理
2.3.1 生物膜形貌表征
图7 分别显示使用前、运行60 d 后C-MFC 和Pyr-MFC 阳极室电极表面的SEM,放大倍数均为10 000 倍。Pyr-MFC 生物膜表面分布着大量的缝隙,使其便于与废水充分接触,提高微生物的反应效率。且Pyr-MFC 生物膜中微生物群体以菌胶团形式存在,菌胶团表面有很多细菌分泌的黏性物质,使菌胶团之间连接更加紧密,也提升了抗冲击能力。

图7 阳极碳刷表面微生物SEMFig.7 SEM of microorganisms on the surface of anode carbon brush
2.3.2 微生物群落结构分析
对微生物在不同物种分类学水平上进行分析,研究反应器内微生物群落结构变化,推断出主要微生物的功能与作用。微生物门水平的相对丰度如图8(a)所示。Proteobacteria(变形菌门)相对丰度最高,在接种污泥、C-MFC 和Pyr-MFC 中的相对丰度分别为58.22%、68.09%、76.21%,是产电菌与反硝化菌的主要优势菌门。Proteobacteria 是革兰氏阴性菌,广泛存在于城市污水及活性污泥中,且大多数的异养和自养反硝化菌属于Proteobacteria[23-24],该菌门包含了许多固氮微生物,能够强化脱氮作用[25-26]。Bacteroidetes(拟杆菌门)为化能异养菌[27],相对丰度仅次于Proteobacteria,分别为25.31%、22.85%和10.65%。Pyr-MFC 中Bacteroidetes 的相对丰度低于C-MFC,表明Pyr-MFC 反应器中的自养反硝化水平不断提高。
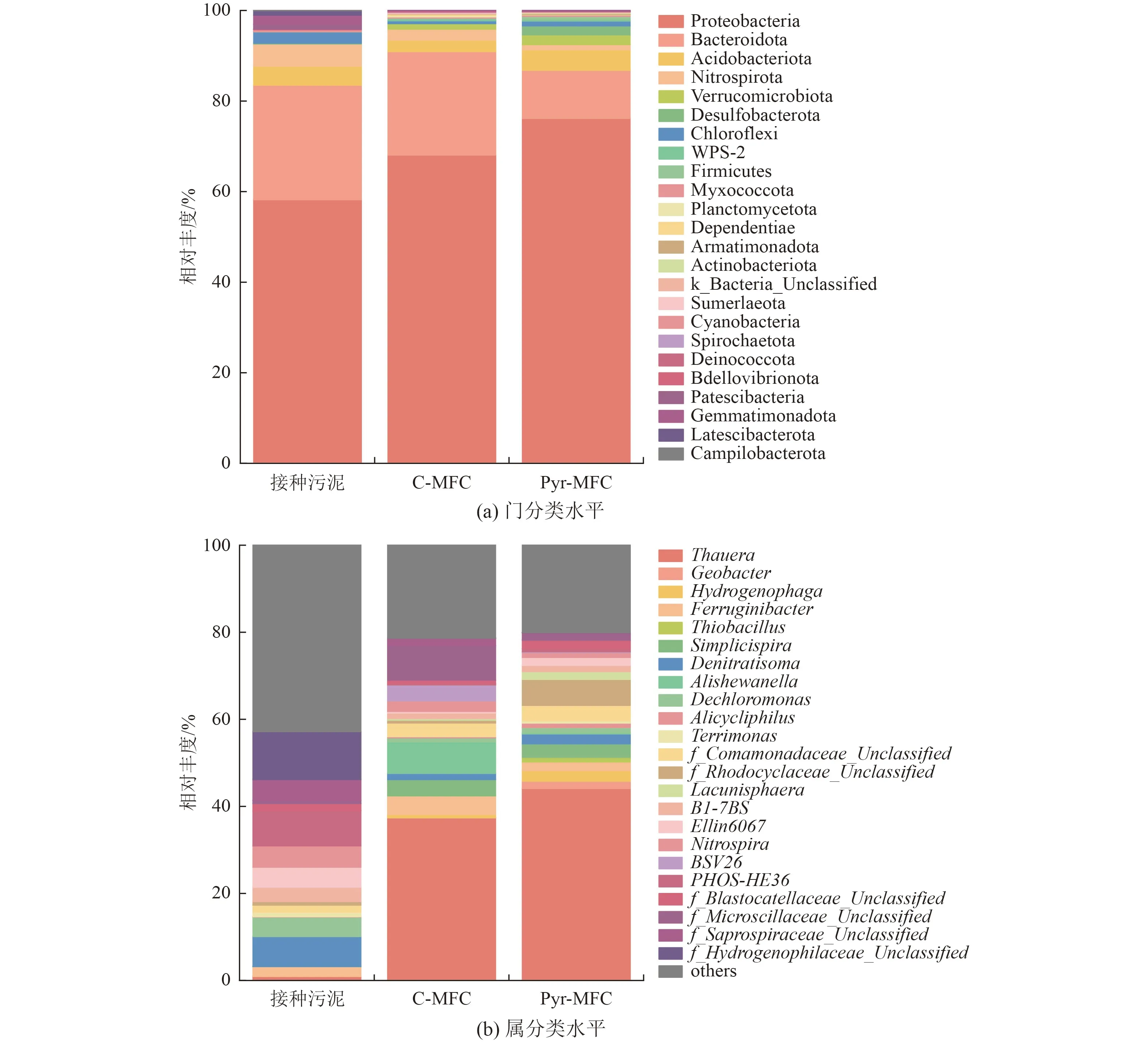
图8 微生物不同物种分类学水平的相对丰度Fig.8 Relative abundance of microorganisms at the taxonomic level of different species
研究表明,最常见的电化学活性细菌在门水平上一般属于Proteobacteria、Acidobacteria(酸杆菌门)、Firmicutes(厚壁菌门)、Actinobacteria(放线菌门)[28]。通过在MFC 系统中培养,该类微生物占比增加。此外,FeS2的投加使得这4 个菌门的相对丰度从C-MFC 中的68.09%、2.52%、0.03%、0.03%分别提高到Pyr-MFC 中的76.21%、4.52%、0.64%、0.19%。表明MFC 系统有利于产电菌的富集,且FeS2的投加进一步提高了产电能力。
微生物属水平的相对丰度如图8(b)所示。接种污泥、C-MFC、Pyr-MFC 反应器中占比最大的菌属为异养反硝化菌Thauera(陶厄氏菌属),其属于Proteobacteria,相对丰度分别为0.94%、37.38%和44.12%。Shen 等[29]的研究表明,Thauera是在以乙酸钠为反硝化碳源时相对丰度最高的菌属。自养反硝化菌是指能够将无机化合物(如硫化物、铁、分子氢、其他金属)的氧化与硝酸盐的还原耦合起来的菌属[30]。异养过程中产生的CO2作为自养反硝化菌的额外无机碳源[31]。Thiobacillus(硫杆菌属)是常见的自养反硝化菌,相对丰度分别为0.00%、0.03%和1.05%,在硫自养反硝化中起着关键作用,可以利用单质硫、硫化物及硫代硫酸盐等作为电子供体,还原硝酸盐和亚硝酸盐[32]。与C-MFC 相比,Pyr-MFC 中的异养与自养反硝化菌的相对丰度都得到了增长。Hydrogenophaga(噬氢菌属)是一种兼性噬氢自养菌,具有促进同步硝化反硝化系统脱氮性能[33]。接种 污 泥、C-MFC、Pyr-MFC 3 组 污 泥 样 品 中 的Hydrogenophaga相对丰度分别为0.04%、0.77%和2.43%,表明FeS2的投加可以促进该菌的富集生长,其原因可能是与投加的铁有关[33]。Denitratisoma是一种典型的可利用硝酸盐为电子受体的异养反硝化菌,具有去除氮和其他化合物的能力,接种污泥、C-MFC、 Pyr-MFC 中该菌的相对丰度分别为6.90%、1.43%和2.27%,表明低C/N 不利于该菌在C-MFC、Pyr-MFC 2 组反应器的生长。此外,Geobacter(地杆菌属)的相对丰度分别为0.00%、0.03%和1.70%。Geobacter是参与电子形成的产电微生物,是一种铁还原菌[34]。电化学活性细菌(EAB)可以通过电子的直接转移参与并加速反硝化过程。电流对异养反硝化菌有一定的刺激作用,能刺激异养反硝化菌的新陈代谢,提高其脱氮速率[35]。
FeS2的投加使得体系中与脱氮相关的菌属提高了约9.43%,表明FeS2能影响微生物群落的分布,从而可以促进硝酸盐的去除,同时产生生物电。
2.3.3 物质转移分析
FeS2的理论S/Fe 约为1.15,本试验中反应前FeS2的初始S/Fe 约为3.53,比例偏高,可能是部分铁在稀硝酸预处理过程中流失所致。反应后FeS2的S/Fe 降至2.02。图9 表明,反应后的FeS2颗粒表面硫含量降低,FeS2中Sn2-、S0等多价态硫含量出现变化,说明FeS2在物质转移过程中出现了多价态硫中间产物。反应后铁峰形复杂,可能有多种铁氧化物或铁硫化物存在。且711 eV 左右的峰较大(可能为三价铁的峰值)、708 eV 左右的峰较小(可能为二价铁的峰值),其原因可能是铁参与循环所致[33]。研究表明,铁元素影响着反硝化过程中与电子传递相关的酶的作用[36],许多异种金属还原细菌,如Geobacter和Shewanella oneidensis,使用Fe(Ⅲ)作为电子受体,而元素硫也介导了细菌铁还原过程中的电子传递[37-38]。
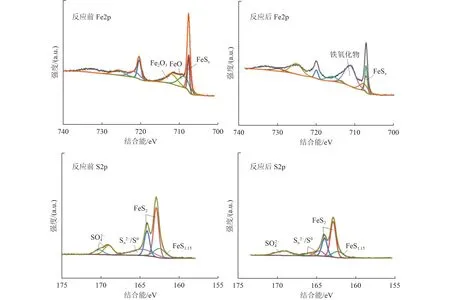
图9 FeS2 反应前后XPS 图Fig.9 XPS diagram before and after FeS2 reaction
由图9 可知,反应后的FeS2中Sn2-、S0等多价态硫含量出现变化,FeS2在物质转移过程中出现了多价态硫中间产物,最终转化为SO42-,证明FeS2中的元素S 参与了MFC 脱氮产电。且Thiobacillus的增长,进一步证明Pyr-MFC 体系中发生了FeS2驱动的硫自养反硝化。以FeS2为电子供体的自养反硝化方程如式(2)所示。其中,FeS2是双电子供体,FeS2中元素S 氧化为SO42-时产生14 个电子,而Fe2+氧化为Fe3+时产生1 个电子,产生大部分能量的是硫化物部分的氧化,而不是铁。因此,FeS2作为电子供体,一定程度上弥补了碳源不足的缺陷,通过自养反硝化提高低C/N 脱氮效果,且FeS2对反硝化微生物的刺激也提高了MFC 脱氮效果。
加入FeCl2、FeCl3、Na2S、NaS2O3的MFC 反应器对NO3--N 的去除率分别为77.0%、72.0%、93.2%和89.2%(数据图未展示)。如图10 所示,在4 组MFC 的污泥样品中,Thauera的总相对丰度最高,在FeCl2-MFC、FeCl3-MFC、Na2S-MFC和Na2S2O3-MFC中的占比分别为9.05%、1.10%、35.28%和9.63%。因此,相对于铁元素,硫元素在MFC 阳极反硝化脱氮时的贡献比铁元素更大。
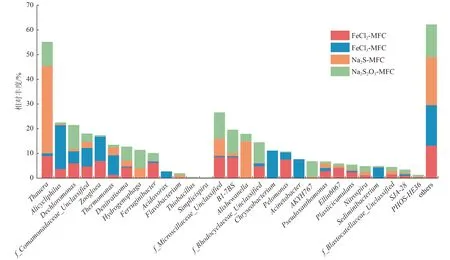
图10 不同价态铁或硫在MFC 中的微生物相对丰度Fig.10 Relative microbial abundance of different valence states of iron or sulfur in MFC
Pyr-MFC 反应机理如图11 所示。FeS2中的S 主要作为电子供体、Fe 主要作为电子穿梭体起作用。FeS2具有捕获更多电子、促进电子转移的能力,可以刺激反硝化微生物与产电微生物的生长繁殖,从而提高MFC 脱氮产电性能。
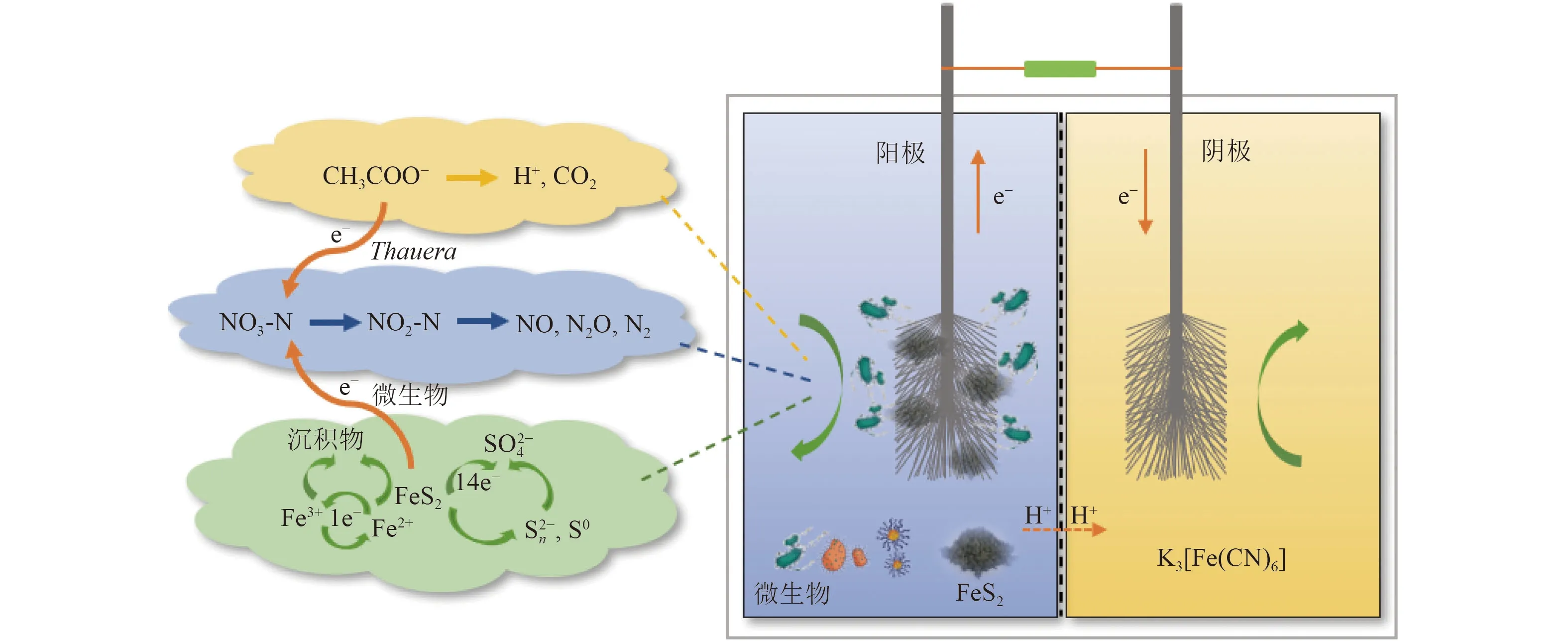
图11 Pyr-MFC 反应机理示意Fig.11 Schematic diagram of Pyr-MFC reaction mechanism
3 结论
(1)阳极室中加入FeS2构建Pyr-MFC 系统提高了体系反硝化脱氮产电效果。相对于没有加入FeS2的C-MFC,Pyr-MFC 具有更高的反硝化脱氮效率和功率密度。在C/N 为5,NO3--N 浓度为100 mg/L时,NO3--N 去除速率由C-MFC 中的12.02 mg/(L·h)提 高 到Pyr-MFC 的15.54 mg/(L·h),最 高 电 压 由0.511 V 提高到0.780 V。
(2)FeS2的加入抑制了MFC 对高C/N 的依赖性,低C/N 下脱氮效果依然突出。C/N 为4、3、2、1时,Pyr-MFC 中NO3--N 去除率分别为100%、97.8%、58.4%和49.7%,去除率均高于对照组反应器(99.5%、82.1%、45.9%和38.7%)。根据不同C/N 的产电规律可知,FeS2可以提高MFC 产电性能,但是不能替代碳源的产电贡献,在低C/N 范围COD 越高,产电性能越好。FeS2作为电子供体,一定程度上弥补了碳源不足,通过自养反硝化提高了低C/N 的脱氮效果。
(3)相比于C-MFC,Pyr-MFC 中碳刷电极生物负载量增加,细菌间的黏附力增大,反硝化菌和产电菌的丰度增加,微生物群落更加多样化,如Thauera、Thiobacillus和Geobacter的相对丰度分别由37.38%、0.03%、0.03%提高到44.12%、1.05%、1.70%,与脱氮相关的菌属相对丰度提高了约9.43%。FeS2的投加为微生物生长提供了附着空间,且刺激了多种微生物的繁殖,从而提高了反硝化性能和电回收率。
