羟基酪醇对肉仔鸡生长性能、抗氧化能力和肠道炎性因子的影响
2023-11-30文晓宾钟儒清
苏 丹,文晓宾,马 腾,钟儒清*,王 阳,陈 亮
(1.青岛农业大学动物科技学院,青岛 266000;2.中国农业科学院北京畜牧兽医研究所 畜禽营养与饲养 全国重点实验室,北京 100193)
羟基酪醇(Hydroxytyrosol, HT)是一种天然单组分酚类化合物,主要以脂类的形式存在于橄榄果实、橄榄叶以及橄榄油中[1]。HT具有较好的水溶性和脂溶性,在动物胃肠道中被吸收后,可迅速转移并广泛分布于体内各组织中,是目前发现的生物利用度最高的一种酚类[2]。HT具有显著的药理学作用[3],能有效抗炎、抗菌、抗肿瘤,有良好的抗氧化性,是天然的抗氧剂之一[1]。当前国内外对HT的研究主要集中在医药学领域和保健行业,在畜禽生产领域也将有重要应用潜力。特别是在后抗生素时代,开发绿色、天然、高效的饲料“替抗”添加剂已经成为畜禽行业重要的探索课题。前人研究发现,HT对二硫化碳(CS2)诱导的小鼠睾丸组织损伤具有保护作用,其机制主要是HT维持了抗氧化酶的活性,缓解了氧化损伤[4]。本团队前期研究也发现,饲喂100 mg·kg-1体重(BW)橄榄粗提物的小鼠可以通过改善结肠微生物群落提升机体的抗氧化能力[5]。进一步深入探讨揭示,羟基酪醇不仅显著提高了氧化应激小鼠小肠中Nrf2抗氧化通路相关基因的mRNA水平,还通过影响甘油磷酸以及戊糖和葡萄糖醛酸盐转化代谢通路,提高机体的抗氧化能力[6]。然而,目前国内外对HT的研究主要是以小鼠为研究对象,除了本团队在公猪精液品质提升上的研究等少数几个报道外[4],在畜禽养殖领域的研究还较少。而肉鸡产业是我国目前畜禽养殖中集约化养殖程度最高的产业,特别是饲料禁抗以后肉鸡养殖对绿色替抗饲料添加剂产品的需求更为迫切。因此,本试验旨在研究饲粮添加HT对肉鸡生长性能、抗氧化能力和肠道炎性因子等的影响,为在畜牧行业“禁抗、限抗”背景下开发一种以HT为核心成分的肉鸡新型天然绿色添加剂提供数据支撑。
1 材料与方法
1.1 试验设计
试验选取初始体重(BW)为(46.0±1.0)g的1日龄健康爱拔益加(AA)肉仔鸡126只,随机分为3个处理组,每个组6个重复,每个重复7只鸡。对照组(CON)饲喂玉米-豆粕型基础饲粮,其为参照《鸡饲养标准》(NY/T 33—2004)配制的粉状配合饲料,基础饲粮组成及营养水平见表1。抗生素组(ANT)饲粮是在基础饲粮中添加100 mg·kg-1的金霉素,另外的试验饲粮为在基础饲粮中添加500 mg·kg-1HT的饲粮,试验期为21 d。试验所用HT为杭州唯铂莱生物科技有限公司提供,纯度为99%。
肉鸡试验于中国农业科学院北京畜牧兽医研究所/动物营养学国家重点实验室昌平试验基地开展,采用三层立体笼养,所有笼子配置饮水器,试验期间自由采食和饮水。试验期间清洗、消毒、鸡只免疫、饲养规程等按动物营养国家重点实验室管理规定执行。试验前1~3 d鸡舍温度控制在33 ℃左右,之后每2 d降低1 ℃,直到鸡舍温度降到26 ℃左右。整个试验期间每天记录鸡只的数量,每周记录采食量,21 d试验结束时称重。
1.2 样品采集
在试验的第21天,从CON组、ANT组以及HT组中,每个重复里面随机挑选1只接近平均体重的肉鸡进行样品采集。从翼根静脉采血至采血管,分离血清,于-20 ℃冰箱保存。颈静脉放血致死,解剖后快速分离盲肠和空肠,将盲肠纵向切开,用无菌取样匙取出其中的内容物,放于液氮中保存。将空肠沿肠系膜剪开,轻轻除去食糜,用生理盐水冲洗干净,刮取中部黏膜组织,液氮速冻后置于-80 ℃中保存。
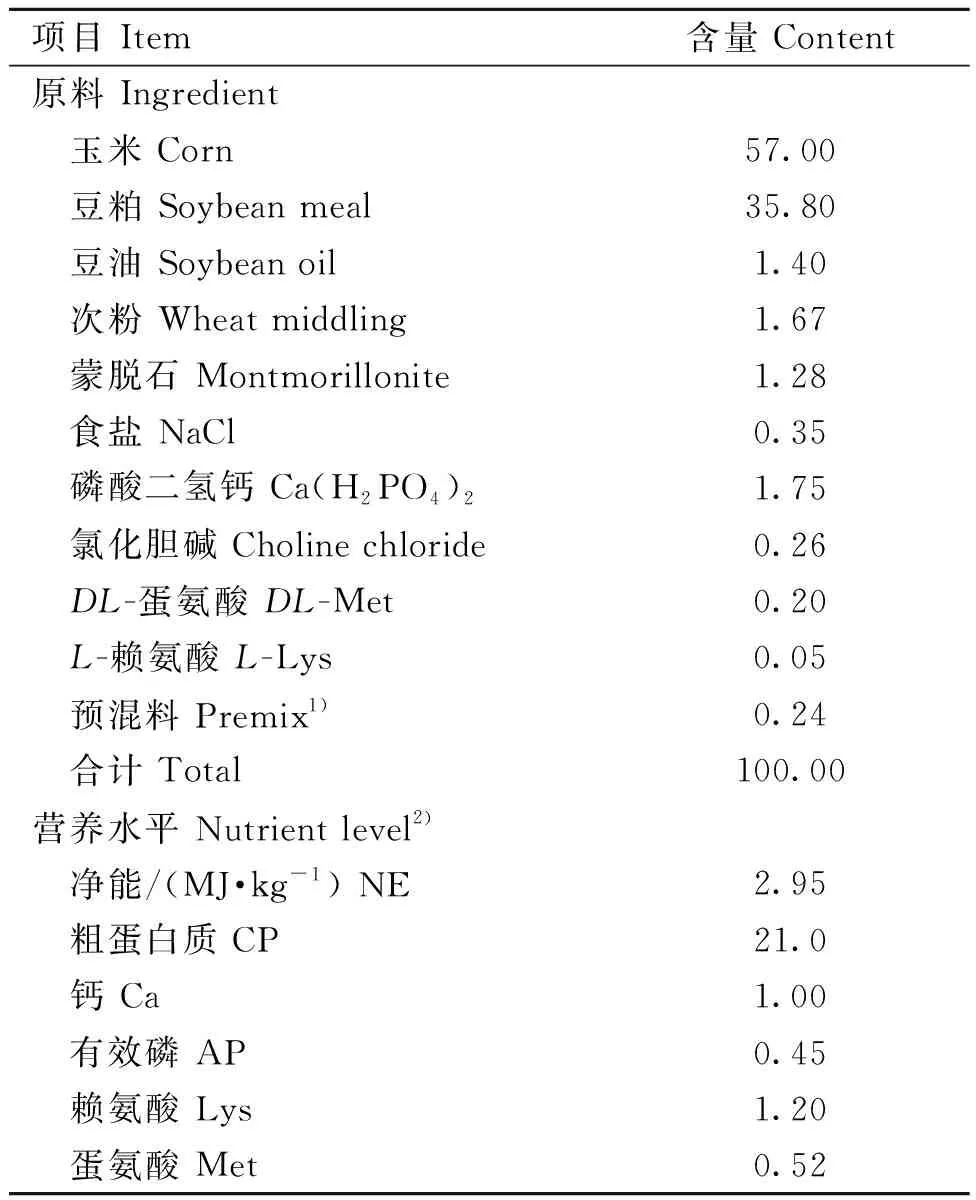
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets (air-dry basis) %
1.3 检测指标与方法
1.3.1 生长性能 试验第21天称取每只鸡的体重,试验期间以重复为单位记录采食量,根据肉鸡体重和采食量计算1~21 d的平均日增重(ADG)、平均日采食量(ADFI)和料肉比(F/G)等指标。
1.3.2 器官重量及器官指数 将肉鸡放血后进行屠宰解剖,采集肝、脾、法氏囊、肾,用滤纸擦去血渍,去除脂肪后称取器官重。器官指数按照如下公式计算:
器官指数(g·kg-1)= 器官重量(g)/活体重量(kg)。
1.3.3 血清抗氧化指标测定 将保存的血清进行抗氧化指标的测定,试剂盒购自南京建成生物工程研究所,所有操作均按照试剂盒说明书进行,采用酶标仪(Tecan Infinite 200 Pro,瑞士)测定血清中的总抗氧化能力(T-AOC,AO15-1-2)、丙二醛(MDA,A003-1-1)含量、总超氧化物歧化酶(T-SOD,A001-1-1)和过氧化氢酶(CAT,A007-1-1)的活性。
1.3.4 盲肠内容物短链脂肪酸(short chain fatty acid,SCFA)含量的测定 称取0.5 mg盲肠内容物于1 mL的生理盐水中,混匀后取0.8 mL的上清液,按照5∶1的比例加入25%的偏磷酸继续混合均匀,室温静置反应3~4 h后离心,45 μm微孔滤膜(尼龙系)过滤,加入上机瓶(600 μL以上),在色谱质谱联用仪(Agilent 5975C,美国)中主要检测乙酸(acetic acid)、丙酸(propionic acid)、异丁酸(isobutyric acid)、丁酸(butyric acid)、异戊酸(isovaleric acid)、戊酸(valeric acid)等,具体操作参考Tang等[7]的方法执行。
1.3.5 基因表达检测
1.3.5.1 肉鸡肠道黏膜总RNA的提取:将肠道黏膜从-80 ℃冰箱中取出,称取约10 mg组织,RNA提取按照Qiagen RNesay Kit试剂盒(QIAGEN,德国)的说明书在超净台内进行。取1 μL总RNA使用超微量蛋白核酸分析仪(BioDrop-μLite,英国)进行定量,确保RNA样品的检测数值A260/280=1.8~2.0即可。提取的总RNA通过1.5%琼脂糖凝胶电泳检测RNA质量,确定RNA条带清晰明亮且无拖尾现象后进行定量、反转录和定量操作。
1.3.5.2 反转录及定量:采用PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,日本),对1 μg的总RNA进行反转录,获得cDNA用于荧光定量PCR。荧光定量PCR采用TB Green Premix Ex TaqTM(Tli RNaseH Plus, TaKaRa,日本)试剂盒在7500 Real-time PCR System (ABI,美国)进行,荧光定量PCR操作均按照说明书进行。组织中各基因相对表达量以β-actin和GAPDH双管家基因为内参,基因表达量采用2-ΔΔct法进行计算。以上操作均在超净台中完成。
1.3.5.3 PCR引物的设计合成:所有引物均使用Primer-BLAST(NCBI的引物设计和特异性检验工具)在线设计并检验其特异性,由生工生物工程(上海)股份有限公司合成。Toll样受体4(TLR-4)、核转录因子-κB(NK-κB)、白介素-1β(IL-1β)、IL-6、IL-10、转化生长因子-β(TGF-β)、肿瘤坏死因子-α(TNF-α)以及内参基因(β-actin)所有引物均由模板梯度稀释后做标准曲线计算扩增效率,经测试所有引物扩增效率均在90%~100%。
1.4 统计分析
试验数据以JMP10.0软件(A Business Unit of SAS SAS Campus Drive Cary, NC 27513)进行数据分析。试验数据采用平均值及标准误(SEM)表示,采用单因素方差分析对试验数据进行差异显著性分析,采用Tukey法对不同处理的均值进行多重比较。结果以P<0.05为差异显著性判断标准,P<0.01表示差异极显著。
2 结 果
2.1 羟基酪醇对肉鸡生长性能的影响
从表2可知,在21 d试验结束时,HT组和ANT组肉鸡的BW分别为855.35和859.23 g,相较于CON组(824.86 g)分别提高了3.70%和4.17%,但差异未达到显著水平(P=0.285)。类似地,HT组和ANT组肉鸡的ADG比CON组分别提高了1.36和1.73 g,亦未达到显著水平。饲喂羟基酪醇肉鸡的ADFI为57.17 g,显著高于CON组和ANT组(P=0.007)。三组肉鸡的料重比数据具有差异趋势(P=0.069),分别为1.39(CON组)、1.34(ANT组)和1.48(HT组)。
2.2 羟基酪醇对肉鸡器官重量及器官指数的影响
如表3所示,从数值上看,相较于CON组和ANT组,HT组肉鸡肝重(22.48 g)、肝脏指数(28.5 g·kg-1)、肾脏重量(2.87 g)、肾脏指数(7.28 g·kg-1)以及法氏囊重量(1.75 g)最高,但差异未达到显著水平。HT组肉鸡的脾重(0.70 g)和
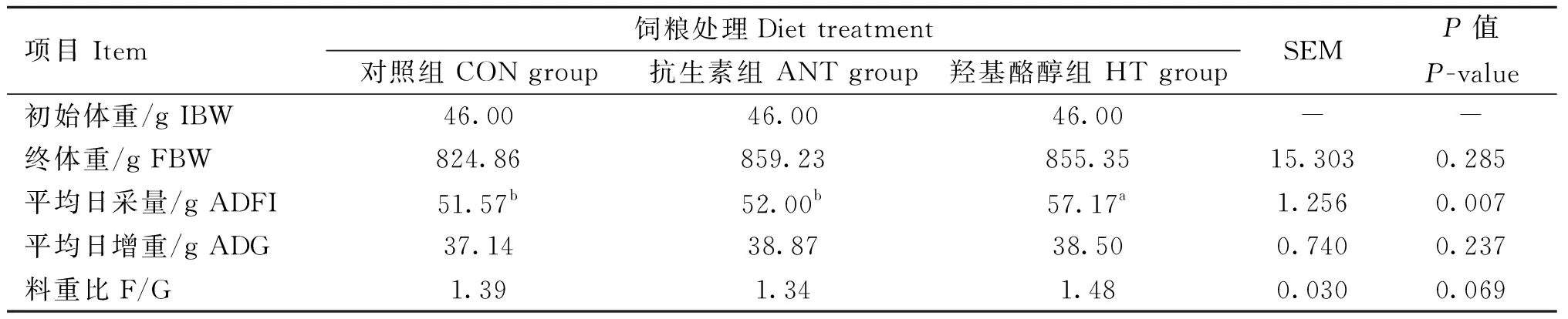
表2 羟基酪醇对肉鸡生长性能的影响Table 2 Effects of hydroxytyrosol on growth performance of broilers
脾脏指数(0.89 g·kg-1)在数值上低于另外两个组,但差异不显著。
2.3 羟基酪醇对肉鸡血清抗氧化指标的影响
由表4可知,与CON组相比,饲粮中添加HT和添加ANT均显著降低肉鸡血清中MDA含量(P<0.01)。添加HT的肉鸡血清中CAT值为0.23 U·mL-1,远高于CON组(0.03 U·mL-1)和ANT组(0.06 U·mL-1,P<0.01)。与CON组相比,饲粮中添加HT和ANT还有提高血清中T-SOD的趋势(P=0.068)。各组肉鸡血清的T-AOC值没有统计上的差异性。
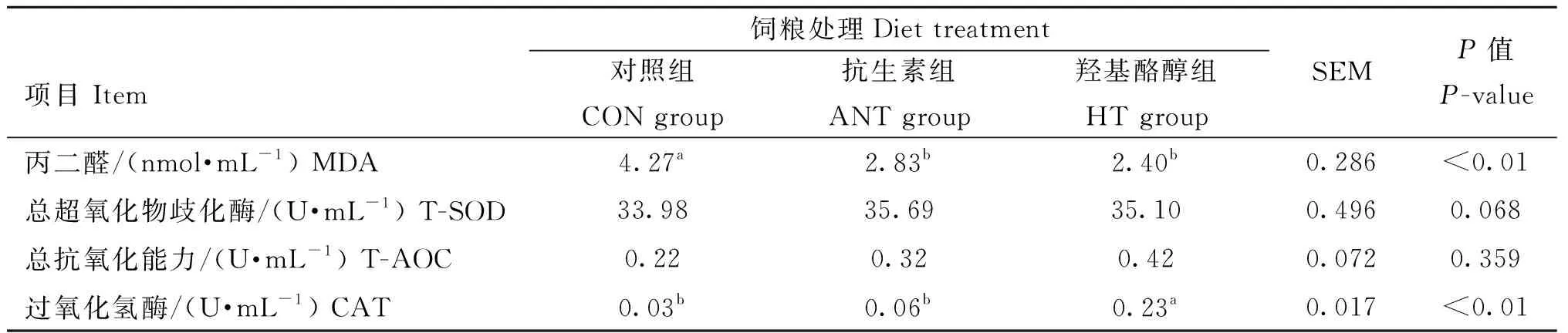
表4 羟基酪醇对肉鸡血清抗氧化能力的影响Table 4 Effect of hydroxytyrosol on serum antioxidant capacity of broilers
2.4 羟基酪醇对肉鸡空肠炎性因子的影响
由图1A可知,与CON组和ANT组相比,添加HT显著降低空肠黏膜TLR4/NF-κB信号通路中TLR-4的mRNA水平(P<0.05)。HT组肉鸡空肠黏膜NF-κB的mRNA表达量也低于ANT组(图1B,P<0.05),但是与CON组没有显著差异。与CON组和ANT组相比,添加HT均能不同程度地降低致炎性因子IL-1β、IL-6的mRNA表达量(图1C、1 D,P<0.05)。TNF-α的mRNA表达量在HT和ANT组间没有显著性差异,但是均显著低于CON组(图1F,P<0.05)。抑炎性因子TGF-β和IL-10的mRNA在HT组肉鸡空肠黏膜中的表达量也显著低于CON组和ANT组(图1E、1 G,P<0.05)。
2.5 羟基酪醇对肉鸡盲肠内容物挥发性脂肪酸的影响
由表5可知,三个处理组肉鸡盲肠内容物中的挥发性脂肪酸主要是乙酸、丙酸、丁酸,异丁酸、异戊酸和戊酸含量较低。以上不同挥发性脂肪酸含量在三个不同处理间差异并不显著。
3 讨 论
HT主要提取自橄榄果实、橄榄叶及橄榄相关加工品,我国亦有较为丰富的橄榄品种资源[8]。此外,使用合成生物学技术、化学合成法和光催化合成法是获得HT的重要途径[9]。大量文献报道,HT具有抗氧化、抗炎、预防癌症、降脂等多方面生物学功能[10],目前多应用于生物医药、食品保健等行业上。在养殖行业,对维护畜禽动物肠道健康、保护肝、促进骨骼发育等方面也具有巨大应用潜力[8]。畜禽养殖业,首先关注的就是对畜禽动物的生长性能及对饲料养分的消化吸收效率。Leskovec等[11]添加了10%的发酵橄榄叶于肉鸡饲料中,发现可以显著提升肉鸡对饲料中蛋白质的利用效率。在以海鲷为对象的研究中发现,饲料中添加橄榄残渣提取物,具有提高其生长性能的趋势[12]。Vazquez-Gomez等[13]在猪的研究中表明,母体补充HT可以改善子代产前和产后的生长性能。本试验发现,添加HT可以显著提高肉鸡采食量,但是肉鸡的终体重差异并不显著。可能是因为本试验周期较短,其促进生长的功能效果还没有完全体现出来[14]。大量文献报道,HT可以通过抑制机体炎性反应,减少细胞凋亡,增加抗氧化活性等途径发挥保护机体肝功能的作用[15-16]。本试验发现,500 mg kg-1HT处理组肉鸡的肝重量和肝脏指数在数值上均高于CON组和ANT组,这与HT调控肉鸡肝组织健康是否相关以及其具体作用途径还需要进一步验证探究。
若机体内自由基产生过多或者清除能力下降,机体氧化和抗氧化防御系统之间的动态平衡会被破坏,进而产生氧化应激。氧化应激会损伤机体DNA、蛋白质及组织结构,进而诱发多种疾病,甚至导致动物死亡[17]。MDA是氧化应激的主要标志物,其含量可以直接反映体内自由基的反应程度,也间接反映细胞的受损程度[18]。而SOD、CAT等则共同构成机体的抗氧化防御系统,能够一定程度上清除过量产生的氧自由基,发挥抗氧化作用[17,19]。研究表明,HT可直接清除机体内源性和外源性自由基和氧化物,又可通过调节Nrf2和JNK-p62/SQSTM1抗氧化系统间接抑制氧化应激[20],其抗氧化能力是茶多酚的15倍、辅酶Q的3倍[16,21]。本试验也发现,饲喂HT显著降低肉鸡血清中的MDA含量,提高了CAT的活性,对SOD活性也有提升的趋势,这与本团队前期以小鼠和公猪为模式动物的研究结果也相一致[4-6]。
TLR-4/NF-κB信号通路是介导免疫应答和机体炎症反应的经典通路。本试验发现饲喂HT能够不同程度地降低肉鸡肠道黏膜的TLR-4和NF-κB的mRNA水平,抑制下游炎性因子的产生,这与Wang等[22]的报道相一致。本试验中,500 mg·kg-1HT添加组肉鸡下游的致炎性因子IL-1β、IL-6、TNF-α等均不同程度的降低,也再次验证HT的抗炎的作用。IL-10和TGF-β是体内重要的抑炎细胞因子。有趣的是,本试验也同时发现,饲喂HT肉鸡肠道黏膜的IL-10和TGF-β表达量较CON和ANT组显著降低,这与Wang等[23]及Shan和Miao[24]的研究结果不完全一致。推测,这可能由于HT一定程度上影响了抑炎因子和促炎因子的动态平衡,未来可以通过肉鸡的肠道炎症模型试验或者细胞试验进一步深入研究。
本试验还分析了HT对肉鸡后肠SCFA的影响。SCFA是肠道微生物碳水化合物发酵的代谢产物,其含量与肠道菌群的数量和组成密切相关。前期本团队研究发现,肠道微生物在HT发挥机体抗氧化功能过程中存在重要的介导作用[4-6],但是本研究并没有发现饲喂HT对SCFA含量有显著性的影响。这可能是HT大多在前消化道被吸收,少部分进入后肠的HT通过改变关键菌的相对丰度发挥功能调节作用,而对微生物总量影响有限导致的[6]。后续还需要进一步开展微生物多样性和功能分析,以验证HT对肉鸡肠道微生物的调节作用。
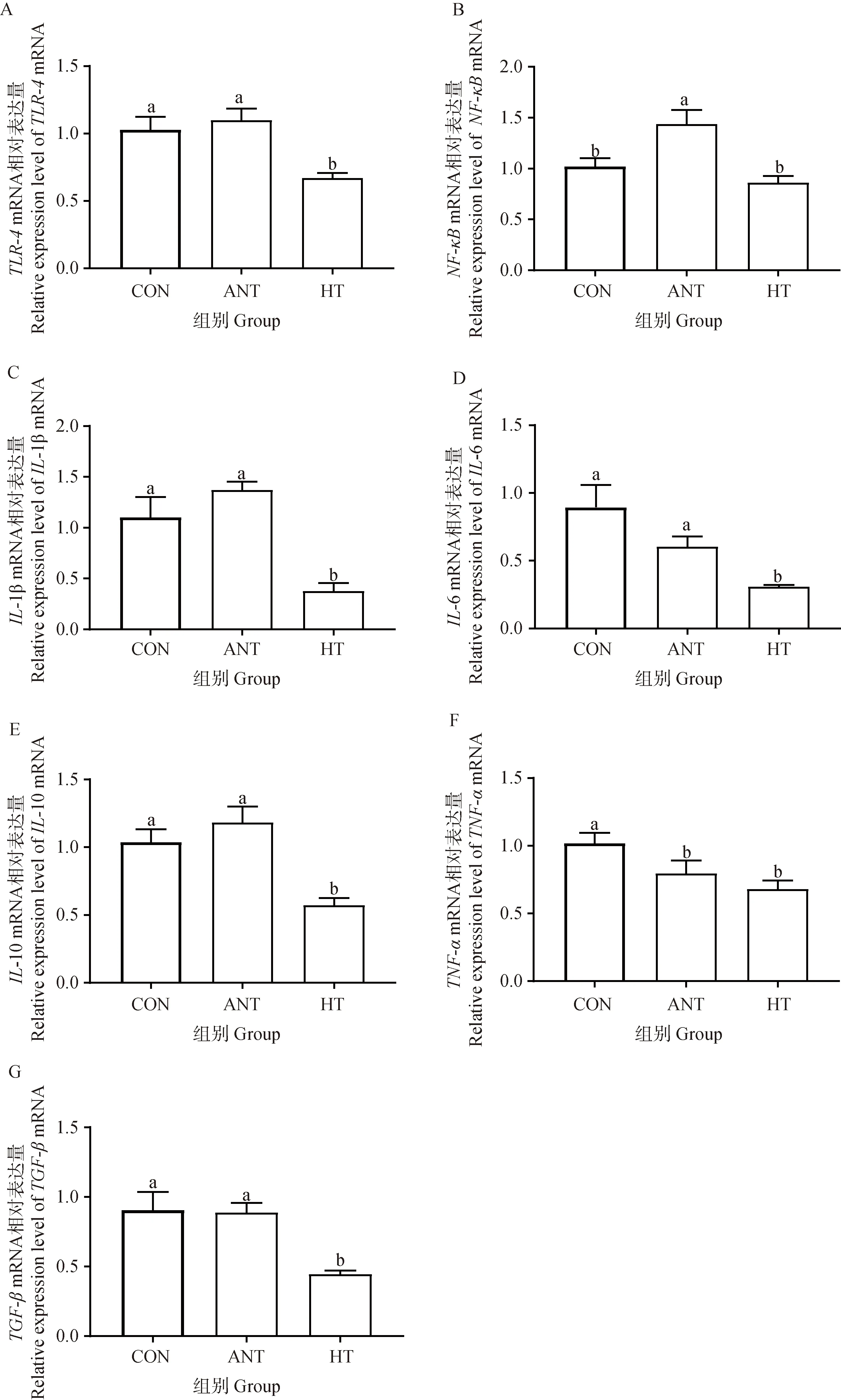
A.G. 分别为空肠TLR-4、NF-κB、IL-1β、IL-6、IL-10、TNF-α、TGF-β mRNA相对表达量。柱上不同小写字母表示差异显著(P<0.05) A-G. The relative expression levels of TLR-4, NF-κB, IL-1β, IL-6, IL-10, TNF-α, TGF-β mRNA, respectively. Bars with different lowercase letters mean significant different(P<0.05)图1 羟基酪醇对肉鸡空肠炎性因子相对表达量的影响Fig.1 Influence of hydroxytyrosol on the mRNA relative expression level of jejunal inflammatory factors of broilers
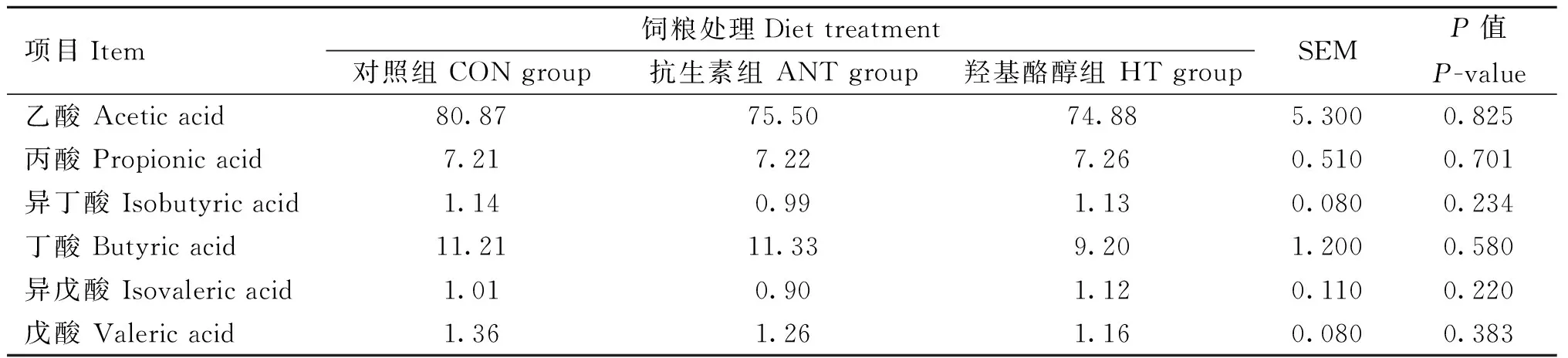
表5 饲料添加羟基酪醇对肉鸡盲肠内容物挥发性脂肪酸的影响Table 5 Effects of dietary hydroxytyrosol on volatile fatty acids in cecum content of broilers μmol·g-1
4 结 论
在本试验条件下,肉鸡饲粮中添加羟基酪醇可以提高机体抗氧化能力,降低炎性因子水平,并可能通过此改善肉鸡的生长性能,一定程度上实现抗生素替代。其具体作用机制及在畜禽养殖行业上的应用前景还需要进一步探讨评估。
