牛乳来源外泌体对巨噬细胞极化调控作用的研究
2023-11-30郭心雨王昊天张雪梅王小龙李和平杨彦宾
郭心雨,王昊天,张雪梅,王小龙,李和平,杨彦宾,钟 凯*
(1.河南农业大学动物医学院,农业农村部动物生物与营养重点实验室,郑州 450046; 2.河南省银丰生物工程技术有限公司,郑州 450000)
奶牛乳腺炎(bovine mastitis)是由多种细菌引起的乳房内感染,被列为奶牛的四大疾病之一,也是影响牛奶高产的最大问题之一[1]。目前关于奶牛乳腺炎已经有了大量的临床研究,但尚未取得很好的实际治疗效果。病原微生物大肠杆菌(Escherichiacoli,E.coli)及其脂多糖(lipopolysaccharide,LPS)刺激是诱发乳腺炎的主要原因之一[2]。乳腺炎患牛最直接的影响是引起乳汁中的体细胞增加,奶牛乳腺感染病原微生物时,乳腺的免疫防御机制被激活,大量的白细胞透过乳腺和毛细血管进入乳汁,另外,因微生物感染和损伤脱落的乳腺细胞也进入到乳汁中,引起了乳汁中体细胞数量急剧增加[3],因此乳腺炎检测中最常用的指标是牛乳中的体细胞数(somatic cell count, SCC)检测法[4]。根据美国乳房炎协会(National Mastitis Council,NMC)规定,SCC超过2.0×105·mL-1的奶牛即使没有其他临床症状,也被认为患有亚临床型乳房炎[5]。
机体发生各种炎症反应的根本环节是巨噬细胞的激活与损伤,奶牛乳腺炎微环境细胞中巨噬细胞起主要作用,巨噬细胞的极化参与其进展,同时又受其调控[6]。巨噬细胞在不同条件刺激下可极化为促炎M1型或抗炎M2型,M1型巨噬细胞能诱导Th1型免疫反应,促进机体释放一氧化氮(nitric oxide,NO)和分泌促炎因子以发挥杀伤作用,LPS、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)和干扰素-γ(interferon-γ,IFN-γ)能够诱导巨噬细胞向M1型分化,以高表达诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、白细胞介素-1β(interleukin-1β,IL-1β)及共刺激分子CD86等为特征,M2型巨噬细胞可以激活Th2型免疫反应,活化后以分泌白细胞介素-10(IL-10)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、精氨酸酶-2(arginase-2,Arg-2)和甘露糖受体(CD206)等为特征,可以促进纤维变性、组织重塑修复和肿瘤发生,具有免疫抑制作用,巨噬细胞极化的平衡对炎症的发生、发展和维持体内微环境稳态有着重要作用[7]。外泌体(exosomes, Exo)是细胞分泌的一种活性囊泡[8],在正常或病理条件下,可以携带多种脂质、蛋白质、mRNA和非编码RNA,介导细胞、组织与器官之间的信息交流。Exo中的mRNA和miRNA在受到病理生理刺激和疾病影响后会发生改变,进而把这种信息传递给受体细胞,引起受体细胞功能的改变[9]。通过Exo介导巨噬细胞极化影响炎症反应的研究也与日俱增,2017年,Lo Sicco等[10]的研究证明,脂肪组织来源的间充质干细胞释放具有强大的抗炎能力的Exo,促巨噬细胞M2极化;并且既往的研究发现,牛奶Exo的成分可因乳腺感染而发生改变[11],然而,奶牛乳腺炎牛乳来源的Exo影响巨噬细胞表型和功能的研究极少,因此本研究通过探究牛乳来源Exo对巨噬细胞表型转化的影响,旨在探讨牛乳来源Exo是否具有影响巨噬细胞极化的能力,为进一步研究奶牛乳腺炎感染免疫机制奠定基础。
1 材料与方法
1.1 试验动物与乳样采集
经河南农业大学动物使用与护理委员会批准,从河南兴豫源牧场以及河南农业大学科技园区牛场共选取10头泌乳前中期、年龄3~4岁、胎次2~3胎的荷斯坦奶牛用于本试验研究。其中4头为无奶牛乳腺炎临床症状的健康奶牛,6头为有乳房发红,肿胀或疼痛等乳腺炎临床症状的奶牛。采样前先用高锰酸钾溶液清洗奶牛乳房、乳头,然后用75%酒精对乳头进行消毒。每个乳区挤去头2~3把奶然后无菌操作进行采样,采集乳样400 mL·头-1,部分样品送至河南省奶牛生产性能测定中心及实验室进行奶牛生产性能测定和细菌学鉴定,剩余样品用于超速离心提取Exo。
1.2 细胞及主要试剂
本试验所用的小鼠巨噬细胞(Raw264.7)购自北京BNCC公司;大肠杆菌来源LPS、蛋白酶抑制剂(PMSF)、青-链霉素双抗混合液均购自上海碧云天生物有限公司;鼠抗人(CD63、TSG101、β-actin)一抗、辣根过氧化物酶标记的山羊抗鼠IgG二抗购自英国Abcam公司;胎牛血清(FBS)、0.25%胰酶-EDTA、无血清细胞冻存液、DMEM培养基、D-PBS购自美国Gibco公司;PVDF膜、Millipore Western blot化学发光HRP底物ECL发光液购自德国Millipore公司;引物均由上海生物工程有限公司合成。
1.3 牛乳样品细菌培养鉴定
每份样品到达实验室时立即取100 μL均匀涂布在麦康凯培养基、牛肉膏蛋白胨培养基、伊红美蓝培养基上,倒置在37 ℃,5% CO2培养箱中培养48 h,根据平板上菌落形态,挑取不同单菌落进行纯化培养,对纯化后培养基平板上的细菌挑取单菌落进行革兰染色、镜检。
另以1∶100的比例取适量牛乳样品用LB或BHI肉汤增菌培养。
1.4 DNA提取
用Easy Pure Genomic DNA Kit试剂盒(北京全式金生物技术有限公司)提取筛选到的菌株的基因组DNA,具体步骤如下:①向菌体沉淀中加入100 μL Lys,37 ℃水浴2 h;②水浴后向菌体沉淀中加入100 μL LB2和20 μL Proteinasek,震荡至菌体彻底悬浮,55 ℃孵育15 min;③加入500 μL BB2,立即涡旋5 s,室温孵育10 min;④将全部菌液加入离心柱中,12 000 r·min-1离心30 s,弃去废液;⑤加入500 μL CB2,12 000 r·min-1离心30 s,弃去废液;⑥重复⑤一次;⑦加入500 μL加入无水乙醇的WB2,12 000 r·min-1离心30 s,弃去废液;⑧重复⑦一次,开盖晾干无水乙醇;⑨将离心柱置于一干净的EP管中,在离心柱的中央加入200 μL EB,室温静置1 min,12 000 r·min-1离心1 min,洗脱DNA;⑩-20 ℃保存,做好标记。
1.5 PCR扩增
使用细菌16S rDNA序列的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′,正向引物)和1492R(5′-ACGGCTACCTTGTTACGACTT-3′,反向引物)以基因组DNA为模板,扩增菌株的16S rRNA基因片段,PCR反应体系20 μL:DNA 1 μL,Mix 10 μL,上、下游引物各1 μL,ddH2O 7 μL。PCR反应程序:95 ℃ 10 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 10 min,12 ℃ 1 min。扩增样品送华大基因科技有限公司测序验证。测序结果通过NCBI数据库的在线序列比对软件BLAST进行比对分析。
1.6 超速离心纯化提取Exo
取40 mL乳样置于50 mL无菌离心管中,300×g,4 ℃离心10 min,收集上层乳清;4 ℃下2 000×g离心10 min,收集上层乳样;加盐酸调节pH至4.6,4 ℃静置2 h,10 000×g,4 ℃离心30 min,收集上清;重复上一步骤两次;0.22 μm滤头过滤上清,110 000×g,4 ℃离心70 min,弃上清;加入少量PBS重悬,110 000×g,4 ℃离心70 min,弃去上清;用100 μL PBS重悬沉淀,-80 ℃保存备用。
1.7 Exo透射电镜(TEM)观察
使用100 μL 2%多聚甲醛重悬Exo,滴5 μL Exo悬液至铜网上,室温静止20 min;PBS漂洗3次;1%戊二醛固定5 min;ddH2O漂洗10次;4%醋酸双氧铀负染5 min,室温晾干后使用TECNAIG2上机观察。
1.8 Exo纳米颗粒跟踪分析(NTA)
300 μL PBS重悬Exo后加入10 mL PBS进行二次稀释,将样品缓慢打入样品池,避免产生气泡,推入主机按照标准操作规程操作仪器检测;选60 s录制时间,进行影像录制;视频分析完毕后,导出报告。
1.9 Exo荧光示踪
预先在24孔板中加入合适直径的细胞爬片,以3×104个细胞·孔-1密度将Raw264.7细胞接种在爬片上,每孔1 mL培养基。按照PKH67荧光标记试剂盒说明书进行荧光标记Exo:将50 μL Exo稀释在500 μL稀释液中,混匀标为管①;2 μL PKH67荧光染料中加入500 μL稀释液,混匀标为管②;将管①与管②混匀,37 ℃孵育5 min,加入1 mL含0.5% BSA的PBS终止标记反应;120 000×g,4 ℃,离心60 min,用50 μL PBS重新富集荧光标记好的Exo;将荧光标记后的Exo以80 μg·mL-1终浓度加入接种Raw264.7细胞的24孔板中,共培养3 h;用200 μL PBS冲洗3次,加入20 μL 4%多聚甲醛固定20 min;PBS冲洗3次,加200 μL DAPI染色细胞核1 h,用PBS冲洗2次;滴一滴抗荧光淬灭剂在载玻片上,将有Raw264.7细胞的一面爬片覆盖在载玻片上;使用电子荧光显微镜成像后,放4 ℃长期保存。
1.10 细胞分组
选取生长状态良好的Raw264.7细胞,培养至第三代,以1×105·孔-1密度接种于6孔板中,细胞密度达到80%时,换用去除掉Exo FBS的培养基继续培养,将细胞分对照(CT)组、LPS组、正常牛乳来源Exo(N-Exo)组、低体细胞数牛乳来源Exo(L-Exo)组、高体细胞数牛乳来源Exo(H-Exo)组:CT组不做任何处理为阴性对照;LPS组使用100 ng·mL-1大肠杆菌来源LPS处理Raw264.7细胞24 h,构建体外炎症模型做阳性对照;N-Exo、L-Exo、H-Exo组分别使用健康牛乳样本(Con)、低体细胞数乳腺炎牛乳样本(Low SCC);高体细胞数乳腺炎牛乳样本(High SCC)来源Exo以100 μg·mL-1浓度处理Raw264.7细胞24 h,每组6个重复。
1.11 实时荧光定量PCR(RT-PCR)检测
用Trizol试剂反复吹打各处理组Raw264.7细胞提取总RNA,随后用反转录试剂盒制备cDNA,根据NCBI GenBank中白介素(IL)-1β、肿瘤坏死因子(TNF)-α、IL-6、精氨酸酶(Arg)-1、生长转化因子(TGF)-β和IL-10核苷酸登录号查询到的序列,用Primer Premier 3.0软件设计实时荧光定量PCR引物,引物序列见表1。实时荧光定量PCR反应体系10 μL:cDNA 1.5 μL,SYBR Mix 5 μL,上、下游引物各0.4 μL,ddH2O 2.7 μL。PCR反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,4 ℃ 1 min,以GAPDH为内参基因,采用2-ΔΔCt法进行相对定量分析。
1.12 酶联免疫吸附法(ELISA)检测
收集各组细胞上清液,利用ELISA试剂盒检测各组TNF-α、IL-6、一氧化氮合酶(iNOS)、IL-1β、IL-10、TGF-β以及甘露糖受体(CD206)表达水平,具体操作参照制造商说明书进行,使用酶标仪检测样品在450 nm处的吸光值。
1.13 BCA法蛋白定量检测
将牛血清白蛋白(2 g·L-1)梯度稀释成0.125、0.25、0.5、1.0、2.0 g·L-1,制作标准曲线;将待测蛋白样本进行稀释,使其浓度处于标准曲线范围内;将试剂盒中的Solution A和Solution B按体积为50∶1混合,配制BCA工作液;分别将2 μL各稀释浓度的牛血清白蛋白标准溶液和待测样本依次加入至96孔板中;按照蛋白质溶液与工作液比例为1∶20,加入40 μL BCA工作液。每个样品设置3个复孔;将加好液体的孔板37℃孵育30 min;酶标仪于595 nm处测定吸光度,绘制标准曲线并计算Exo的蛋白含量。
1)数据分类。数据分类主要将档案实体数据按照数据类型进行分类,不同类型的数据需要通过不同的特征提取技术进行特征提取。在实际应用中,档案数据都是经过著录整理过的有序数据,一般已经归档的档案数据均包含数据类别信息。

表1 引物信息Table 1 Primer information
1.14 蛋白免疫印迹(WB)检测
用BCA蛋白检测试剂盒测定Exo浓度,加5×SDS上样缓冲液,99 ℃金属浴中加热10 min;上样进行10% SDS-PAGE;转膜后室温下用5% BSA封闭2 h,清洗后依次孵育一抗以及二抗,最后加入ECL试剂显影后观察结果。
1.15 统计学分析
2 结 果
2.1 牛乳体细胞数检测
牛奶记录系统(dairy herd improvement, DHI)检测结果显示,4份乳样SCC<2.0×105·mL-1,判定为健康牛乳样本组(Con,n=4);3份乳样SCC为2.0×105~2.0×106·mL-1,判定为低体细胞数乳腺炎牛乳样本组(Low SCC,n=3);3份乳样SCC>2.0×106·mL-1,判定为高体细胞数乳腺炎牛乳样本组(High SCC,n=3),如表2所示。
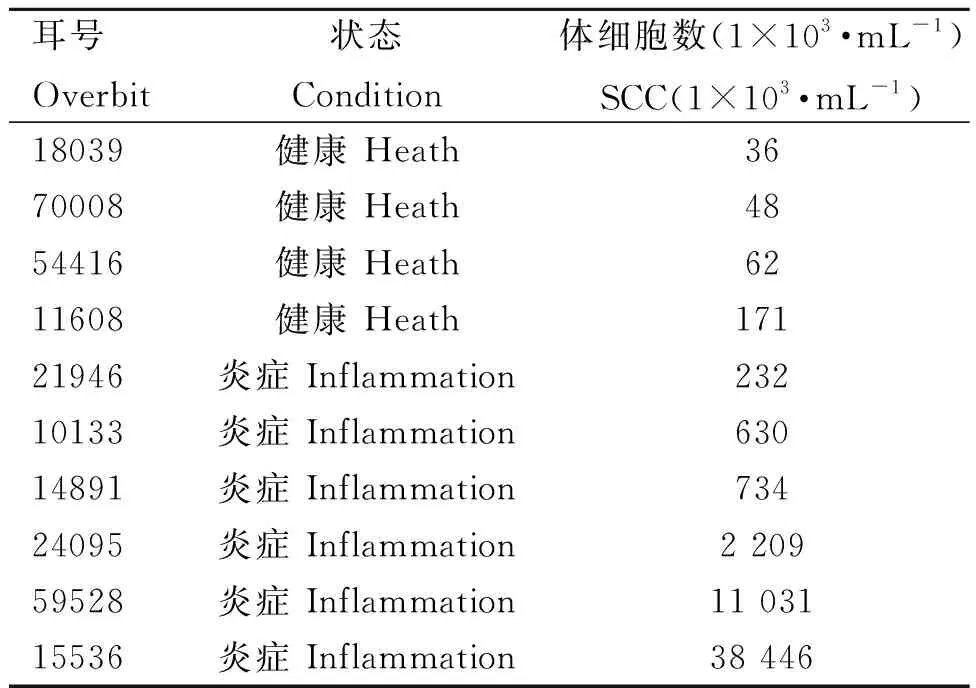
表2 乳样DHI检测结果Table 2 DHI test results of milk samples
2.2 奶牛乳腺炎感染细菌鉴定
2.2.1 细菌培养 在6份SCC>2.0×105·mL-1的牛乳样本中,有4份在培养基上长出菌落,将此4份样本标记为L21946、L10133、L14891、H24095。革兰染色后,在光镜下观察到细菌呈红色杆状,可初步判定为革兰阴性杆菌(图1)。
2.2.2 16S rDNA目的基因扩增 对提取的4个细菌样品进行16S rDNA序列的PCR扩增。从PCR的扩增结果可见,4个细菌样品16S rDNA序列的PCR扩增产物呈现清晰完整的条带,而且这些样品16S rDNA序列的PCR产物处于同一位置,大小约为1 500 bp(图2)。
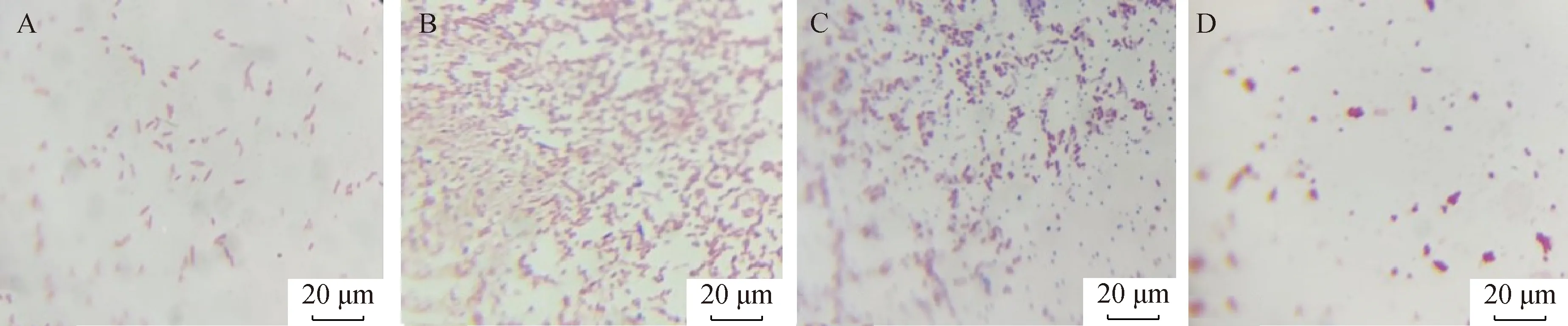
A~D. L21946、L10133、L14891、H24095样本革兰染色镜检结果 A-D. Microscopic examination after Gram staining of L21946, L10133, L14891 and H24095 samples图1 牛乳样本的细菌光镜照片(400×)Fig.1 Microscopic observation of the bacteria of the milk sample(400×)
2.2.3 16S rDNA序列测定 基于分子生物学技术,将分离株测序得到的16S rDNA基因序列提交NCBI GenBank数据库进行BLAST比对查找其同源序列,结果显示L21946和L10133两个细菌样本与大肠杆菌(E.coil)的相似性最高,基因序列具有99.8%和99.9%的相似性;L14891细菌样本与数据库上的绿脓杆菌(P.aeruginosa)16S rDNA基因序列具有100%的相似性;H24095细菌样本与数据库上的克雷伯肺炎杆菌(K.pneumoniae)的相似性最高,16S rDNA基因序列具有99.8%的相似性,由此确定L21946和L10133两个细菌样本的鉴定结果为E.coil;L14891细菌样本的鉴定结果为P.aeruginosa;H24095细菌样本的鉴定结果为K.pneumoniae,均为革兰阴性菌(表3)。
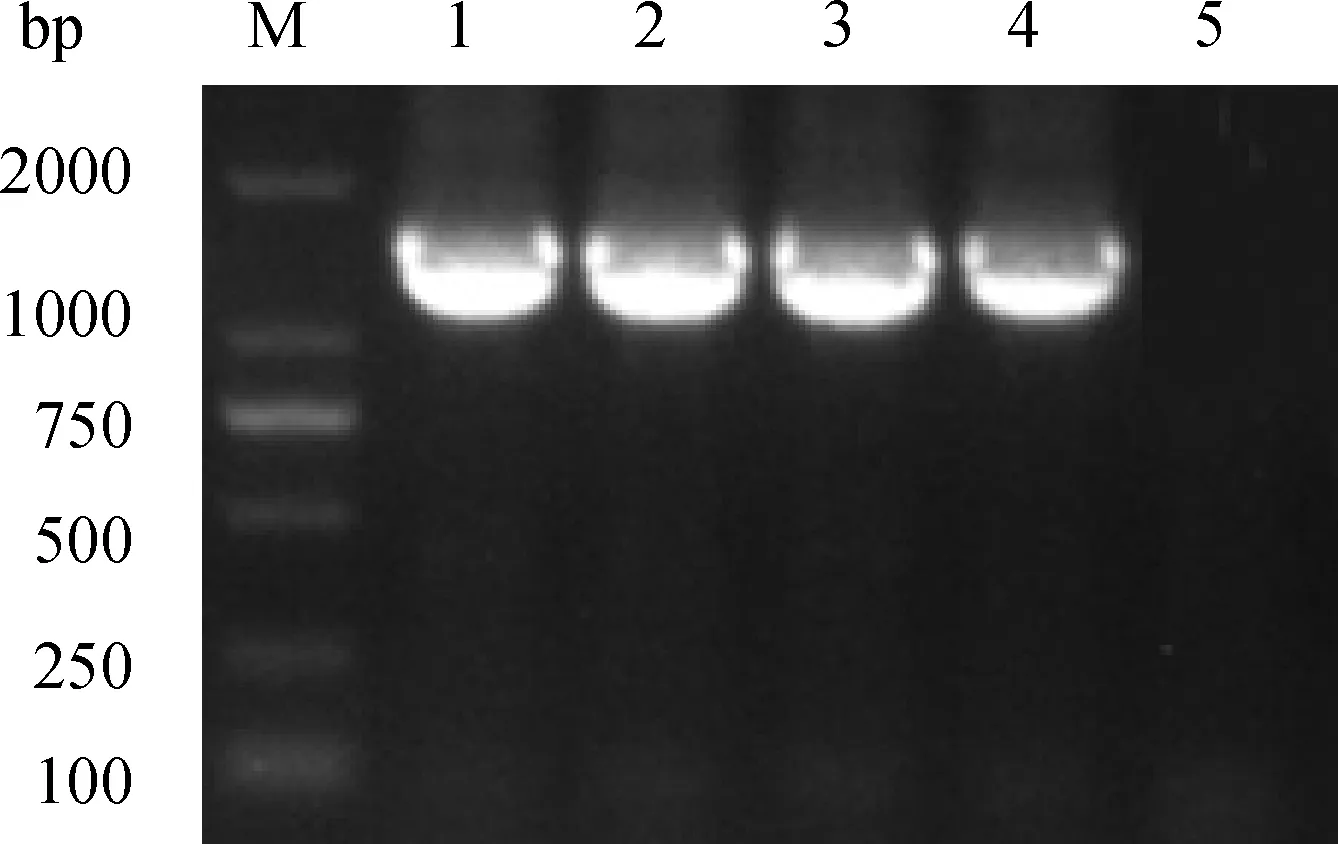
M. DL2000 DNA相对分子质量标准;1~5. L21946、L10133、L14891、H24095、阴性对照样品PCR扩增结果 M. DL2000 DNA marker; 1-5. PCR amplification result of sample L21946,L10133,L14891,H24095, and negative control图2 16S rDNA扩增结果Fig.2 PCR amplication of 16S rDNA
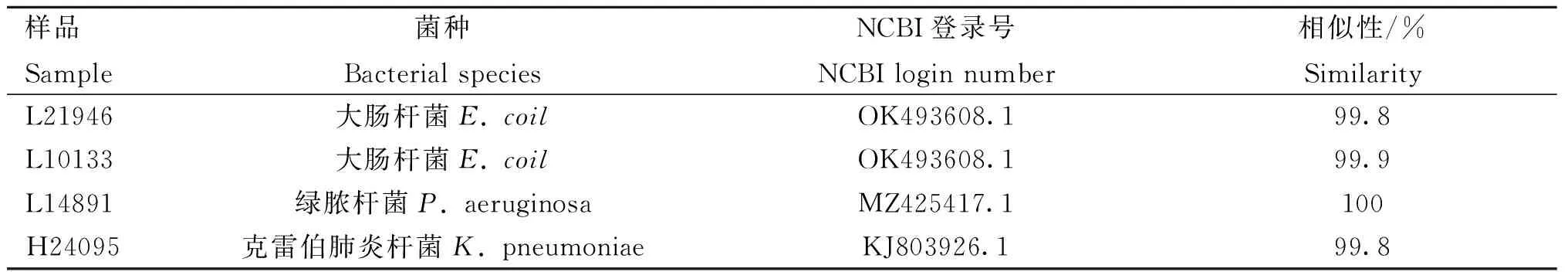
表3 细菌标本 16S rDNA序列测定的比对结果Table 3 The BLAST of 16S rDNA sequences of the bacterial specimens
2.3 牛乳来源Exo鉴定
2.3.1 透射电镜(TEM)观察 TEM观察结果显示,正常牛乳(Normal)、低体细胞数乳腺炎牛乳(Low SCC)和高体细胞数乳腺炎乳牛(High SCC)来源的Exo均呈圆形或椭圆形、具有双层膜结构,中间凹陷、边缘清晰、呈典型的“杯盘”状形态(图3)。
2.3.3 BCA检测 使用BCA试剂盒检测所有样本Exo蛋白浓度,结果如图5所示,健康、低以及高体细胞数牛乳来源Exo蛋白浓度无显著差异(P>0.05)。
2.3.4 Western blot检测 Western blot结果如图6所示,N-Exo、L-Exo和H-Exo均能特异性表达CD63和TSG101蛋白。

图3 牛乳来源Exo透射电镜鉴定结果Fig.3 Transmission electron microscopy identification results of bovine milk-derived exosomes
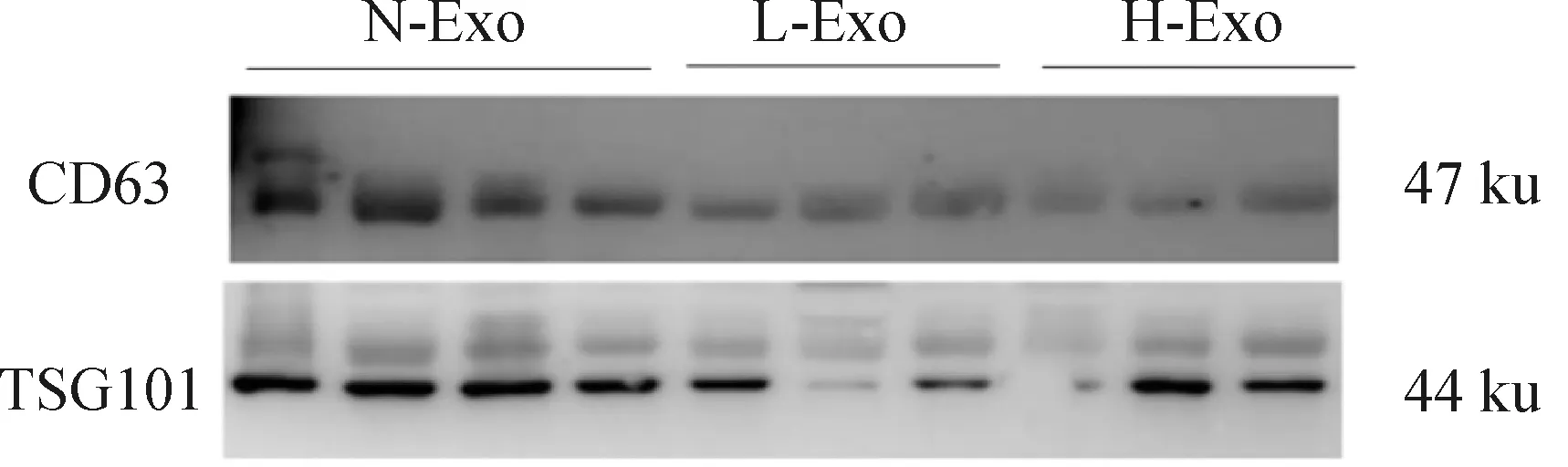
图6 牛乳Exo Western blot鉴定结果Fig.6 Western blot identification results of bovine milk-derived exosomes
2.4 Exo被巨噬细胞内化
荧光共聚焦显微镜拍摄图片显示(图7),N-Exo与Raw264.7细胞共培养,3 h时N-Exo还有少量未被Raw264.7细胞所内化,而6 h时N-Exo被Raw264.7细胞内化完全,细胞内化Exo呈时间依赖性,因此采用6 h时间节点进行后续研究,结果显示N-Exo、L-Exo和H-Exo均能被Raw264.7巨噬细胞内化,无显著差异(图8)。
2.5 Exo通过介导巨噬细胞极化影响奶牛乳腺炎症反应
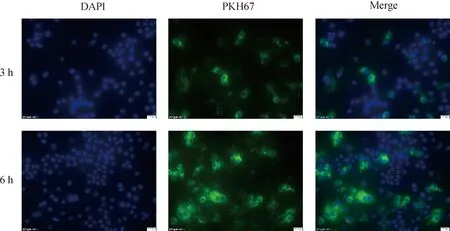
图7 共培养不同时间点N-Exo被巨噬细胞摄取效果(400×)Fig.7 Uptake effect of N-Exo by macrophages at different time points of co-culture (400×)
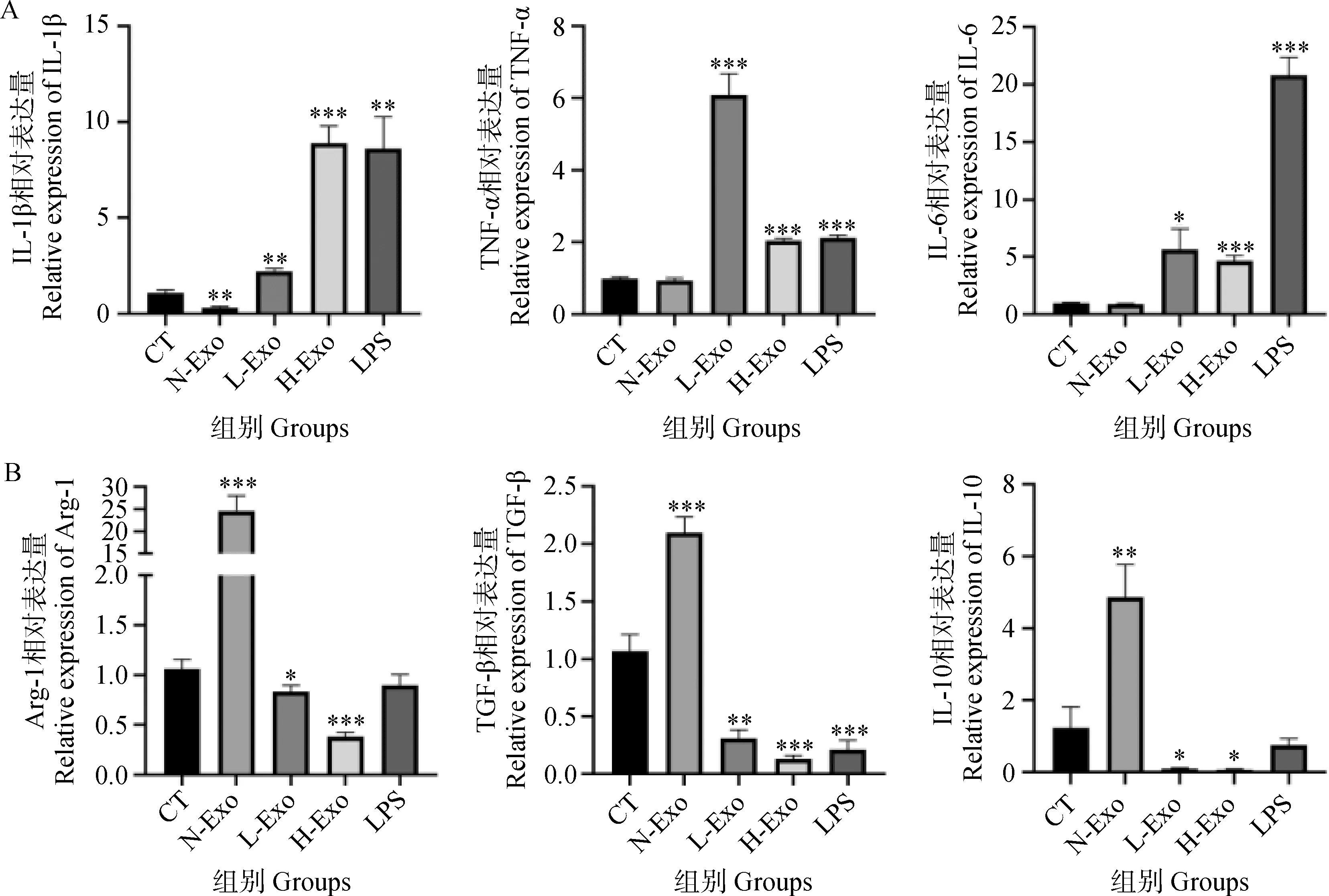
A. 炎性因子(IL-1β、TNF-α、IL-6) mRNA表达水平;B. 抗炎因子(Arg-1、TGF-β、IL-10) mRNA表达水平;*. P<0.05, **. P<0.01, ***. P<0.001A. mRNA expression levels of Inflammatory factors (IL-1β, TNF-α, IL-6); B. mRNA expression levels of Anti-inflammatory factors (Arg-1, TGF-β, IL-10); *. P<0.05, **. P<0.01, ***. P<0.001图9 牛乳Exo作用巨噬细胞后在基因水平对不同细胞因子表达的影响Fig.9 Effects of milk-derived exosomes on the expression of different cytokines at the gene level after acting on macrophages
2.5.1 牛乳来源Exo对巨噬细胞表达细胞因子的影响 RT-PCR检测牛乳来源Exo作用于巨噬细胞后相关细胞因子表达的结果见图9A、B。与CT组相比,L-Exo处理组使Raw264.7细胞促炎性细胞因子TNF-α的mRNA水平升高极显著(P<0.001),IL-1β高水平表达(P<0.01),IL-6 mRNA表达水平显著上升(P<0.05),而抗炎性细胞因子Arg-1和IL-10 mRNA表达显著降低(P<0.05),TGF-β表达水平极显著降低(P<0.01);H-Exo处理组使Raw264.7细胞促炎性细胞因子TNF-α、IL-1β和IL-6 mRNA表达均极显著升高(P<0.001),抗炎性细胞因子TGF-β和Arg-1的表达极显著降低(P<0.001),IL-10 mRNA水平也显著降低(P<0.05),而N-Exo处理组的TNF-α和IL-6 mRNA的表达水平未有明显改变,但IL-1β mRNA的表达水平明显下降(P<0.01),Arg-1和TGF-β mRNA的表达水平极显著升高(P<0.001),IL-10 mRNA高水平表达(P<0.01)。
2.5.2 牛乳来源Exo对巨噬细胞蛋白表达的影响 ELISA检测牛乳来源Exo作用于巨噬细胞后相关蛋白表达的结果见图10A、B。与CT组相比,L-Exo组使Raw264.7细胞的TNF-α和CD206蛋白表达水平升高极显著(P<0.001),IL-1β和IL-6蛋白表达显著升高(P<0.01),iNOS的蛋白水平也有所升高(P<0.05),且TGF-β的蛋白表达水平显著降低(P<0.05);H-Exo组使Raw264.7细胞的TNF-α和IL-6蛋白表达极显著升高(P<0.001),IL-1β、CD206和iNOS的蛋白高水平表达(P<0.01),IL-10和TGF-β的蛋白表达受到极显著抑制(P<0.001),而N-Exo组TNF-α和CD206蛋白表达受到极显著抑制(P<0.001)、IL-6的蛋白水平也显著降低(P<0.01),IL-1β、iNOS的表达水平呈明显下降趋势(P<0.05),TGF-β的蛋白表达极显著升高(P<0.01),IL-10表达有升高趋势(P<0.05)。但M2型表面标记蛋白CD206的表达水平检测结果与M1型各蛋白类似,此外,H-Exo处理组的各蛋白表达水平与LPS处理组无显著差异(P>0.05)。
3 讨 论
全球约三分之一的奶牛都受奶牛乳腺炎影响,该病已严重影响了全球畜牧产业以及乳制品行业的经济发展[12]。根据乳样中能否检出病原菌以及乳样是否有明显变化,该病可分为非特异性临床型乳腺炎、非特异性亚临床型乳腺炎、感染性临床型乳腺炎以及感染性亚临床型乳腺炎,而乳腺炎检测中最常用的指标是牛乳中的SCC检测法[4,13]。本研究于河南省两个奶牛养殖场无菌采集泌乳期、年龄、胎次均无显著差异的荷斯坦奶牛共10份牛乳样品,其中4份样品来源于表观健康奶牛,6份样品采集自已出现乳腺炎临床症状的奶牛,乳样送至河南省奶牛生产性能测定中心进行SCC的检测,根据其SCC水平将牛乳样品分为3组:正常乳样组(SCC<2.0×105·mL-1)(n=4),低体细胞数乳腺炎组(2.0×105
最近越来越多的研究表明,可以通过检测Exo内含物反映其细胞起源和疾病状态,或通过其细胞间信息与物质传递能力影响靶细胞生物功能,使Exo成为诊断和治疗疾病的潜在生物标志物[15]。牛乳来源的Exo可通过细胞间传递生物信息物质参与胎儿的生理和免疫反应[16]。因此本研究从不同牛乳样本中超速离心纯化得到的Exo并进行鉴定,电镜观察到其形态为圆形或椭圆形,中间凹陷,具有“杯盘”状和双层膜结构,直径均为30~150 nm,特异性表达Exo标志蛋白CD63和TSG101,均符合Exo典型特征,并且BCA结果显示正常、低和高体细胞数牛乳来源Exo浓度无显著性差异,证明本试验采用超速离心法成功分离纯化得到牛乳来源Exo,能够满足后续试验的需求,并且正常以及乳腺炎牛乳来源Exo的生物学特征无显著性差异。
巨噬细胞极化的平衡对炎症的发生、发展和维持体内微环境稳态有着重要作用[17]。部分研究表明,炎症微环境中Exo与巨噬细胞极化密切相关,通过表型可鉴定巨噬细胞的类型,研究巨噬细胞在不同生理和病理条件下所发挥的功能具有重要的意义[18]。Jiao等[19]研究发现中性粒细胞来源Exo诱导脓毒症相关急性肺损伤中Rawa264.7巨噬细胞M1极化并启动巨噬细胞焦磷酸作用来促进肺部炎症。刘文涛等[20]研究表明骨髓间充质干细胞的Exo可以调控Raw264.7巨噬细胞向M1型巨噬细胞极化,并且抑制M2型巨噬细胞活性。Hyvärinen等[21]的研究也证明巨噬细胞来源的Exo通过抑制IL-23和IL-22的产生来促进巨噬细胞抗炎表型M2极化。但关于奶牛乳腺炎来源的Exo对于免疫细胞的影响鲜有报道,因此本研究通过富集纯化奶牛乳腺炎以及正常牛乳来源的Exo与Raw264.7细胞共培养,探究其对Raw264.7细胞极化的影响,为排除培养基中Exo对试验结果的干扰,本试验所使用的细胞培养基和小牛血清均进行了去Exo处理。结果显示,共培养6 h时巨噬细胞对Exo的摄取量显著高于3 h,因此选取6 h为后续共培养时间节点;此外正常、低体细胞数牛乳以及高体细胞数牛乳来源Exo均能无差异地被巨噬细胞内化,乳腺炎牛乳来源Exo能促使巨噬细胞向M1型极化,高表达促炎性细胞因子;而正常牛乳来源的Exo能促使巨噬细胞向M2型极化,表达高水平的抗炎性细胞因子。Admyre等[22]发现人乳中的Exo也具有免疫调节作用,支持本研究结果。上述结果提示病原感染导致的乳腺炎会使牛乳中Exo对巨噬细胞极化方向产生影响,进而改变免疫微环境,但其中的发生机制仍需深入研究,应易恬等[23]的研究结果表明乳腺炎病原感染可引起宿主细胞所分泌的Exo成分发生改变;Reinhardt等[24]也证实乳腺感染可引起牛奶Exo蛋白组分发生改变;其他研究发现,从经LPS预处理的间充质干细胞中分离出的Exo可能通过转运miRNA let-7b从而对巨噬细胞极化和慢性炎症的消退具有良好的调节能力[25]。此外本实验室之前研究发现乳腺炎奶牛牛乳来源的Exo中miR-223与miR-146a与正常牛乳Exo相比有显著差异,因而,在本研究中观察到的乳腺炎牛乳Exo对巨噬细胞极化产生的影响可能是由于病原微生物感染导致Exo内容物变化而发挥作用,但对于炎症相关Exo介导巨噬细胞极化具体作用机制以及信号通路的研究甚少,后续还需进行深入探究。另需指出的是,目前牛源性的巨噬细胞分离纯化较为困难,没有商品化的细胞系,而小鼠巨噬细胞是研究细胞免疫和分子免疫学的重要对象,鼠源Raw264.7细胞是研究炎症最常见的体外模型之一,也是研究巨噬细胞极化的常用细胞系,因此本试验选取小鼠Raw264.7巨噬细胞作为研究对象。此外,通常认为CD206是M2型巨噬细胞的特异性蛋白,但Jaguin等[26]观察到CD206的表达在M1和M2巨噬细胞之间没有差异,并提出M2型巨噬细胞特异性表达的是CD200R膜糖蛋白,而并非CD206。作者的研究结果也证实了这一结论,ELISA结果显示,炎性Exo和LPS作用于Raw264.7细胞后,CD206的表达反而上调,而正常Exo作用Raw264.7细胞后,CD206的表达下降,与M1型巨噬细胞表达情况一致。此外,虽然牛乳Exo主要来自乳腺上皮细胞(MECs),但病原微生物也可产生Exo[27],因而,在本研究中观察到的乳腺炎牛乳Exo的生物学效应可能是宿主和病原微生物产生的Exo的共同效应。
综上所述,本研究证实了乳腺炎牛乳来源的Exo通过细胞内化作用与巨噬细胞进行信息交流与物质传递,使巨噬细胞极化为M1型,而健康状态下的牛乳来源Exo可以显著抑制巨噬细胞M1型蛋白的表达,促进巨噬细胞M2极化,参与机体免疫调节。通过调节巨噬细胞极化平衡,对增强抗病原微生物入侵或抑制有害炎症对机体产生进一步损伤有重要意义,也能为奶牛乳腺炎开发新的治疗方法提供新思路。但Exo中何种物质以及通过何种信号通路发挥作用,还需在此基础上结合体内试验进一步进行生物信息学及蛋白组学等方面的研究,但目前全球对于Exo应用于大动物模型中的研究很少,一方面Exo还未能实现大批量生产,另一方面对于Exo应用于治疗大动物疾病所用剂量还需进一步摸索,Exo作为大动物临床治疗手段还有很长的路要走。
4 结 论
乳腺炎牛乳来源Exo可介导巨噬细胞M1极化,正常牛乳来源Exo可介导巨噬细胞M2极化。
