金合欢素调节HIF-1α/VEGF信号通路对胆囊癌细胞恶性生物学行为的影响
2023-11-30严培虎郭金有李伟张瑞汉张百飞刘源张政于富强谢高山
严培虎 郭金有 李伟 张瑞汉 张百飞 刘源 张政 于富强 谢高山
胆囊癌是一种非常凶险的恶性肿瘤,原发于胆囊黏膜上皮,早期没有明显典型症状,容易误诊,且病情进展迅速,可很快发展到晚期,预后非常差,被誉为“癌中之王”,极大危害患者生命安全[1-3]。缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)在缺氧环境中表达升高,可通过提高血管内皮生长因子(vascular endothelial growth factor,VEGF)表达而促进肿瘤血管生成,进而促使结直肠癌、非小细胞肺癌等多种肿瘤体内生长和恶性进展[4,5],下调HIF-1α可降低基质金属肽酶9表达,进而抑制缺氧诱导的GBC-SD细胞上皮间充质转化、迁移和其异种移植模型中肿瘤生长[6],下调HIF-1α/VEGF可抑制缺氧诱导GBC-SD细胞迁移和体内生长[7],因此HIF-1α/VEGF是胆囊癌细胞恶性生物学行为的重要调控信号。金合欢素是一种广泛存在于金合欢树、刺槐、菊花等植物中的天然黄酮类化合物,具有免疫调节、抗炎抑菌、抗肿瘤等多重生物活性,可增加细胞内活性氧的产生,对结直肠癌发挥抗肿瘤和诱导凋亡的作用[8,9],并可作为雪菊总黄酮的活性成分之一,抑制结肠癌细胞增殖和迁移[10],因而推测金合欢素可能因其抗癌活性来治疗胆囊癌。本文基于HIF-1α/VEGF信号通路,分析探究金合欢素对胆囊癌细胞恶性生物学行为的调节作用,报道如下。
1 材料与方法
1.1 材料与试剂 HUVEC细胞(货号SNL-503)、人胆囊癌细胞GBC-SD(货号SNL-230)、RPMI-1640完全培养基(含10%血清与双抗,货号SNM-001E)购自武汉尚恩生物技术有限公司;金合欢素(HPLC≥98%,货号:IA1150)、ANNEXIN V-FITC/PI 凋亡检测试剂盒(货号CA1020)、人VEGF酶联免疫吸附测定(ELISA)试剂盒(货号SEKH-0052)、CCK-8试剂盒(货号CK04)、0.1%结晶紫染色液(货号G1063)、兔SP检测试剂盒(货号SP0021)购自北京索莱宝科技有限公司;Matrigel胶(货号354248)购自BD Biocoat公司;一步法实时荧光定量PCR检测试剂盒(货号QYR0604)购自北京启研生物科技有限公司;TRIzol试剂(货号15596026)购自赛默飞世尔科技(中国)有限公司;兔源抗人Anti-HIF-1α一抗(货号ab179483)、兔源抗人Anti-CD31一抗(货号ab76533)、HRP偶联驴抗兔二抗(货号ab205722)购自Abcam公司;兔源抗人Anti-VEGF一抗(货号AF1309)购自上海碧云天生物技术有限公司等。
1.2 仪器 酶联免疫分析仪(ST-MB96A)购自山东三体仪器有限公司;研究级生物显微镜(XSP-13CA)购自上海光学仪器一厂;流式细胞分析仪(NovoCyte Advanteon)购自安捷伦科技(中国)有限公司;实时荧光定量PCR仪(MA-6000)购自苏州雅睿生物技术有限公司;电泳系统(XCell SureLock Mini-Cell)、转印系统(XCell II Blot Module)购自赛默飞世尔(中国)科技有限公司;石蜡切片机(QPJ-1B)购自济南童鑫生物科技有限公司等。
1.3 方法
1.3.1 采用CCK-8法检测不同浓度金合欢素处理后GBC-SD细胞增殖率:冻存的GBC-SD细胞置于39.8℃温水浴中快速解冻,离心后加入适量RPMI-1640完全培养基培养至约80%融合后传代,接种在无菌96孔板培养,每孔约104个细胞,24 h后分别以终浓度0、10、25、50、100、150 μmol/L的金合欢素处理[11]。将不接种GBC-SD细胞的培养孔作为空白对照,0 μg/ml金合欢素处理的GBC-SD细胞作为对照,不同浓度金合欢素处理24 h后,根据CCK-8试剂盒的制造商说明测定吸光值,参考其说明书中指导计算增殖率,增殖率=(吸光值处理组-吸光值空白对照组)/(吸光值对照组-吸光值空白对照组)×100%。
1.3.2 细胞分组处理及采集标本:将GBC-SD细胞传代接种在24孔板中,每孔约1.5×105个细胞,分为对照组、金合欢素低、高剂量组、金合欢素高剂量+空载组、金合欢素高剂量+HIF-1α过表达组,培养24 h后分组处理:对照组不做处理,金合欢素低剂量组、金合欢素高剂量组细胞分别以终浓度50、100 μmol/L的金合欢素处理,金合欢素高剂量+空载组细胞以终浓度100 μmol/L的金合欢素处理的同时以脂质体转染空载质粒,金合欢素高剂量+HIF-1α过表达组以终浓度100 μmol/L的金合欢素处理的同时转染HIF-1α过表达质粒,24 h后收集细胞沉淀备用。
1.3.3 采用实时荧光定量PCR和免疫印迹法检测GBC-SD细胞HIF-1α、VEGF表达:实时荧光定量PCR:TRIzol试剂提取1.3.2中各组GBC-SD细胞的总RNA,测出其浓度后每组取适量总RNA、各基因引物与一步法实时荧光定量PCR检测试剂盒中预混液混合,参考试剂盒说明书中方法设定反应条件进行PCR扩增反应,获得各组基因Ct值后以2-ΔΔCt算法分析,同时采用GAPDH做HIF-1α、VEGF的内参,最终量化各组基因相对表达。免疫印迹法:采用蛋白提取试剂盒制备总蛋白。裂解产物经10% SDS-PAGE分离,并转移到硝酸纤维素膜上。用5%脱脂牛奶封闭膜,然后用HIF-1α、VEGF一抗和特异性二抗孵育。最后在ChemiDoc MP成像系统下捕获印迹并使用Image J软件进行分析。见表1。
1.3.4 采用CCK-8法和流式细胞术检测各组GBC-SD细胞增殖率、凋亡率:CCK-8法:将GBC-SD细胞接种在96孔板(1×104个/孔)中,24 h后根据1.3.2中的方法处理,24 h后按照1.3.1的方法检测并计算增殖率。流式细胞术:将GBC-SD细胞传代接种在24孔板中,每孔约1.5×105个细胞,培养24 h后按照1.3.2中步骤进行分组处理,24 h后采集各组GBC-SD细胞,采用ANNEXIN V-FITC/PI凋亡检测试剂盒对各组细胞(2×105个)进行处理,在流式细胞仪上检测各组GBC-SD细胞凋亡率。
1.3.5 采用Transwell侵袭实验和细胞划痕实验检测各组GBC-SD细胞侵袭数、迁移率:Transwell侵袭实验:将1.3.2中收集的各组细胞PBS洗涤、RPMI-1640基础培养基(不含胎牛血清)、计数后每组取约2×105个,接种在Transwell培养板上室中(Matrigel胶包被过夜),同时在Transwell培养板下室中加入适量RPMI-1640完全培养基(含10%胎牛血清),继续培养细胞24 h,洗涤、固定穿梭侵袭到下室的细胞后采用0.1%结晶紫染色液染色,洗涤后采用生物显微镜观察并摄制各组细胞图片,以Image J软件定量图片中各组侵袭细胞数量。细胞划痕实验:将GBC-SD细胞传代接种在24孔板中,每孔约1.5×105个细胞,培养24 h后按照1.3.2中步骤进行分组处理,24 h后使用枪头在每个培养孔中央划一条直线,洗去划痕中细胞后采用生物显微镜观察并摄制各组细胞图片,以Image J软件定量图片中各组划痕宽度H0h,继续培养细胞24 h再次测量各组划痕宽度H24h,计算各组细胞迁移率,公式为:迁移率=(H0h-H24h)/H0h×100%。
1.3.6 采用ELISA和小管形成实验分别检测GBC-SD细胞VEGF产生水平、HUVEC细胞成管长度:①ELISA:将GBC-SD细胞传代接种在24孔板中,每孔约1.5×105个细胞,培养24 h后按照1.3.2中步骤进行分组处理,24 h后收集培养基后离心得到其条件培养基,采用ELISA试剂盒测定其中VEGF水平,具体步骤根据制造商说明书中指导进行。②小管形成实验:将HUVEC细胞传代接种在经Matrigel胶提前包被过的24孔板中,每孔约1.5×105个细胞,培养24 h后加入上述收集的各组GBC-SD细胞条件培养基分组处理,继续培养24 h后采用生物显微镜观察并摄制各组细胞图片,以Image J软件定量图片中各组HUVEC的成管长度。
1.3.7 建立GBC-SD裸鼠移植瘤模型后检测各组裸鼠肿瘤组织微血管密度(CD31表达)及肿瘤体积:参考文献构建GBC-SD裸鼠移植瘤模型[12]:取1.3.2中收集的分组处理后的各组GBC-SD细胞,以PBS重悬、计数后制成密度为1×107个/ml的细胞悬液,于裸鼠右腋皮下注射上述各组细胞悬液200 μl,1周后观察到有皮下硬质结节出现表明裸鼠移植瘤模型构建成功,4周后颈椎脱臼处死各组裸鼠后剥离出肿瘤组织,测量其长径a和短径b,计算出各组肿瘤体积,公式为:肿瘤体积(mm3)=1/2×a×b2,然后对肿瘤组织进行固定、脱水、石蜡包埋、切片后,选出无褶皱的薄片脱蜡、水化、封闭后孵育兔源抗人Anti-CD31一抗,洗涤后采用兔SP检测试剂盒孵育二抗、DAB显色,按照其试剂盒说明指导进行免疫组化染色,洗涤、中性树脂封片后采用生物显微镜观察并摄制各组细胞图片,以Image J软件定量图片中各组细胞总数量和CD31阳性细胞数量,计算各组细胞CD31阳性细胞比例,公式为:CD31阳性细胞比例=CD31阳性细胞数量/细胞总数量×100%。
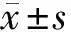
2 结果
2.1 金合欢素作用浓度确定 10、25、50、100、150 μmol/L的金合欢素可抑制GBC-SD细胞增殖,并随浓度的升高而抑制作用增强,本文择IC50值附近的50、100 μmol/L的金合欢素处理GBC-SD细胞进行后续实验。见图1。
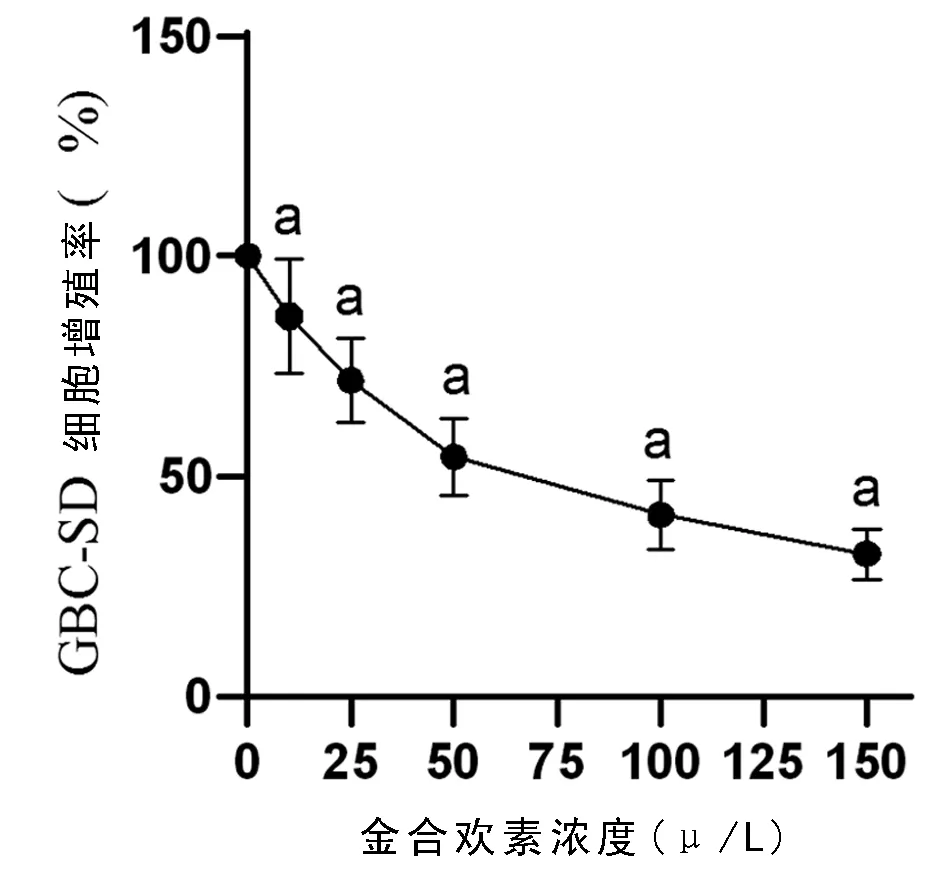
图1 不同浓度金合欢素对GBC-SD细胞增殖率的影响
2.2 金合欢素对GBC-SD细胞HIF-1α/VEGF通路蛋白表达的影响 与对照组相比,金合欢素低、高剂量组GBC-SD细胞HIF-1α、VEGF mRNA与蛋白表达均降低(P<0.05),金合欢素高剂量组GBC-SD细胞HIF-1α、VEGF mRNA与蛋白表达相比金合欢素低剂量组进一步降低(P<0.05)。与金合欢素高剂量组相比,金合欢素高剂量+HIF-1α过表达组GBC-SD细胞HIF-1α、VEGF mRNA与蛋白表达升高(P<0.05);金合欢素高剂量+空载组GBC-SD细胞HIF-1α、VEGF mRNA与蛋白表达无显著变化(P>0.05)。见图2,表2。

图2 免疫印迹检测GBC-SD细胞HIF-1α/VEGF通路蛋白表达;A 对照组;B 金合欢素低剂量组;C 金合欢素高剂量组;D 金合欢素高剂量+空载组;E 金合欢素高剂量+HIF-1α过表达组
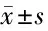
表2 5组GBC-SD细胞HIF-1α、VEGF蛋白相对表达
2.3 金合欢素对GBC-SD细胞增殖与凋亡的影响 与对照组相比,金合欢素低、高剂量组GBC-SD细胞增殖率均降低(P<0.05),凋亡率均升高(P<0.05);金合欢素高剂量组与金合欢素低剂量组相比,GBC-SD细胞增殖率降低(P<0.05),凋亡率升高(P<0.05)。与金合欢素高剂量组相比,金合欢素高剂量+HIF-1α过表达组GBC-SD细胞增殖率升高(P<0.05),凋亡率降低(P<0.05);金合欢素高剂量+空载组GBC-SD细胞增殖率、凋亡率无显著变化(P>0.05)。见图3,表3。
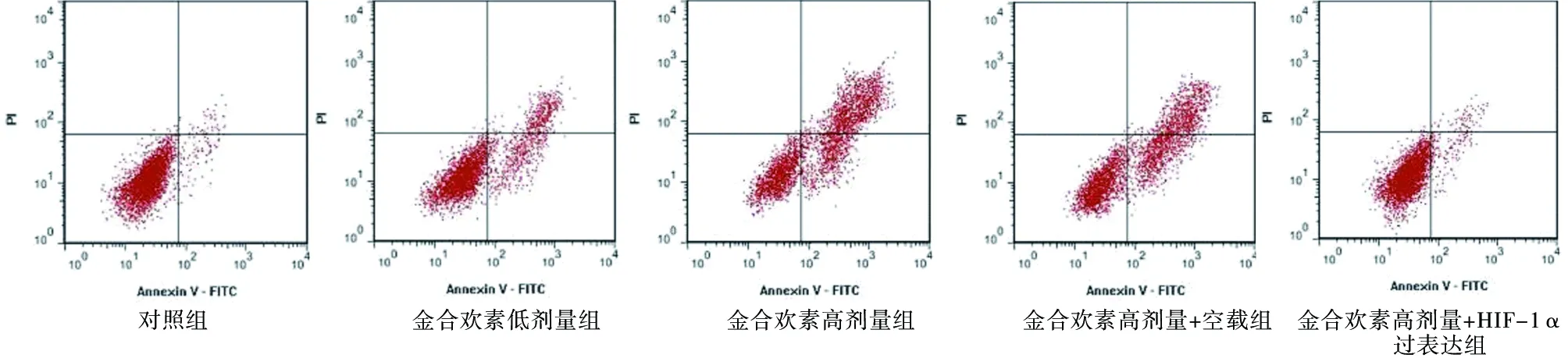
图3 流式细胞术检测5组GBC-SD细胞凋亡率(×200)
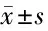
表3 5组GBC-SD细胞增殖率、凋亡率 n=6,%,
2.4 金合欢素对GBC-SD细胞侵袭与迁移的影响 与对照组相比,金合欢素低、高剂量组GBC-SD细胞侵袭数与迁移率下降(P<0.05);金合欢素高剂量组与金合欢素低剂量组相比,GBC-SD细胞侵袭数、迁移率下降(P<0.05)。与金合欢素高剂量组相比,金合欢素高剂量+HIF-1α过表达组GBC-SD细胞侵袭数与迁移率升高(P<0.05);金合欢素高剂量+空载组GBC-SD细胞侵袭数与迁移率无显著变化(P>0.05)。见图4、5,表4。

图4 Transwell侵袭实验检测各组GBC-SD细胞侵袭数(×200)

图5 细胞划痕实验检测5组GBC-SD细胞迁移率(×200)
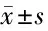
表4 5组GBC-SD细胞侵袭数与迁移率n=6,%,
2.5 金合欢素对GBC-SD细胞分泌VEGF及HUVEC细胞成管的影响 与对照组相比,金合欢素低、高剂量组GBC-SD细胞培养基中VEGF水平、HUVEC细胞成管长度均降低(P<0.05),金合欢素高剂量组GBC-SD细胞培养基中VEGF水平、HUVEC细胞成管长度相比金合欢素低剂量组进一步降低(P<0.05)。与金合欢素高剂量组相比,金合欢素高剂量+HIF-1α过表达组GBC-SD细胞培养基中VEGF水平、HUVEC细胞成管长度升高(P<0.05);金合欢素高剂量+空载组GBC-SD细胞培养基中VEGF水平HUVEC细胞成管长度无显著变化(P>0.05)。见图6,表5。

图6 5组HUVEC细胞成管情况(×200)
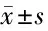
表5 5组HUVEC细胞成管长度 n=6,
2.6 金合欢素对GBC-SD移植瘤裸鼠微血管密度(CD31表达)及肿瘤体积的影响 与对照组相比,金合欢素低、高剂量组GBC-SD裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积均降低(P<0.05);金合欢素高剂量组相较于金合欢素低剂量组,GBC-SD裸鼠肿瘤组织CD31阳性细胞比例、肿瘤体积更低(P<0.05)。与金合欢素高剂量组相比,金合欢素高剂量+HIF-1α过表达组GBC-SD裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积升高(P<0.05);金合欢素高剂量+空载组GBC-SD裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积无显著变化(P>0.05)。见图7,表6。

图7 GBC-SD移植瘤裸鼠肿瘤组织CD31表达(免疫组化×200)
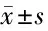
表6 5组GBC-SD移植瘤裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积 n=6,
3 讨论
目前胆囊癌的临床疗手段单一,对放化疗均不敏感,因而除了手术切除之外,还没有很好的辅助治疗手段,并且还易发生浸润转移,患者生存期很短,死亡率很高,急需开发新的更有效治疗方式[13,14]。
总黄酮是一大类天然产物,作为中药的有效成分,可抑制肿瘤细胞生长、增殖及侵袭转移,对肺癌、肝癌、乳腺癌等多种肿瘤均具有一定的防治作用[15],金合欢素作为一种广泛存在于各种药用植物中的天然黄酮类化合物,可以剂量和时间依赖的方式抑制肝癌细胞增殖、存活和血管生成[16],并可减少促炎细胞因子的产生,抑制间皮细胞诱发的卵巢癌恶性特征,降低卵巢癌细胞增殖和侵袭能力[17]。
本文以不同剂量金合欢素处理GBC-SD细胞,可降低细胞增殖率、侵袭数、迁移率、GBC-SD细胞培养基中VEGF水平、HUVEC细胞成管长度、裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积,升高其凋亡率,表明金合欢素可降低胆囊癌细胞增殖、侵袭及迁移力,减少VEGF产生分泌,抑制胆囊癌移植瘤裸鼠体内肿瘤生长和血管生成,显著抑制胆囊癌细胞恶性生物学行为,对胆囊癌发挥明显抗癌功效,揭示金合欢素在胆囊癌的临床治疗中具有很好的应用前景。
研究表明,HIF-1α可通过调控糖酵解介导胆囊癌或胆管癌、结直肠癌、胃癌等多种肿瘤的发生及恶性进展,缺氧诱导的HIF-1α的高表达与肿瘤患者较短的总生存期、淋巴结转移阳性、更深的侵袭显著相关[18],缺氧条件下HIF-1α的激活还可上调VEGF表达,促进肝癌细胞生长、迁移、侵袭血管生成、和其体内肿瘤生长[19],抑制HIF-1α/VEGFA表达可成功抑制肝癌体内肿瘤生长和血管生成[20]。
本文结果显示,以不同剂量金合欢素处理GBC-SD细胞,可降低细胞HIF-1α、VEGF mRNA与蛋白表达,表明HIF-1α/VEGF信号参与介导金合欢素对胆囊癌细胞恶性生物学行为的抑制过程。本文还发现,金合欢素和HIF-1α过表达质粒联合处理可提高GBC-SD细胞HIF-1α、VEGF mRNA与蛋白表达,并升高其增殖率、侵袭数、迁移率、GBC-SD细胞培养基中VEGF水平、HUVEC细胞成管长度、裸鼠肿瘤组织CD31阳性细胞比例及肿瘤体积,降低其凋亡率,表明过表达HIF-1α可减弱金合欢素对GBC-SD细胞增殖、侵袭及迁移的抑制作用,消除其对胆囊癌移植瘤裸鼠体内肿瘤生长和血管生成的减轻作用,最终逆转金合欢素对胆囊癌的抗癌功效,揭示金合欢素对胆囊癌细胞恶性生物学行为的抑制是通过下调HIF-1α实现的。
总之,本文结果证实了金合欢素可降低HIF-1α、VEGF蛋白表达,抑制胆囊癌细胞增殖、迁移和侵袭,诱导其凋亡,并减轻其体内肿瘤生长和血管生成,最终减弱其恶性生物学行为,下调HIF-1α/VEGF信号通路可能是其药理机制之一,本文为胆囊癌的临床治疗提供了金合欢素这一新的药物候选,有利于胆囊癌患者生存期的延长。
