不同生物量苦草对生活污水尾水的净化效果研究
2023-11-29殷金岩赵秀芳韦依伶徐曼
殷金岩赵秀芳韦依伶徐曼
(1.岭南生态文旅股份有限公司,广东 东莞 523007;2.广东省园林绿化生态营建与修复工程技术研究中心,广东 东莞 523001)
生活污水的尾水水质是制约尾水利用的关键[1]。当前我国污水处理厂尾水通常执行一级Ⅰ级A和Ⅰ级B标准,出水中仍含有少量的悬浮颗粒物、氮磷有机物、细菌和重金属等有毒物质,这些物质的含量远远高于地表水Ⅳ类水标准,排入水体会造成水环境容量减少和水体污染,需要深度处理后才能进行排放利用[2]。现有的尾水深度处理技术主要有膜分离、混凝沉淀、生物滤池和人工湿地[3],与其它技术相比较,以“绿色系统”为核心的人工湿地,不仅基建及运行费用低,而且污染物处理能力强、设备运行维护简单、景观营造效果好,可实现对氮磷等营养物的高效降解,是实现尾水水质提升的优选方案。植物是人工湿地的重要组成部分,本文以苦草(Vallisneria natans)为研究对象,开展不同生物量的苦草对生活污水的尾水净化效果,以期对工程实践提供理论基础。
1 材料与方法
1.1 实验材料
苦草(Vallisneria natans),水鳖科苦草属沉水植物,选择生长状态良好的植株,洗净后修剪至规格一致(10~15cm)待用;实验用水为生活污水尾水;实验装置为500L白色聚乙烯桶,规格为直径1m、高0.84m。
1.2 实验设计
实验共设A、B、C、D、E 5个处理组,见表1,每个处理组3个平行处理。各实验桶均铺设约10cm厚底泥,加水至距桶上沿约5cm处,待桶内水体条件稳定后,种植沉水植物。

表1 实验组别设计
1.3 实验指标及测定方法
2 结果与分析
本实验于2022年8月24日—10月9日进行,共计47d;实验过程中及时观察各实验桶内情况,去除水面杂物及滋生的水绵和螺类,减少对实验桶的影响;实验过程中降雨量少,整体气温较高。
2.1 不同处理组对水体浊度的影响
从图1可以看出,实验初期各处理组浊度成波动趋势,其原因可能是种植植物对水体的搅动作用以及植物对水体存在适应阶段所导致;实验中期开始,A、B、C、D 4个处理组浊度均逐渐稳定下降,且A、B 2组的下降速度要高于其他组别,C、D 2组呈交叉下降趋势,空白E组则从中期开始呈现明显的波动上升趋势;实验结束时,各处理组浊度分别为A组1.89、B组7.30、C组13.07、D组20.90、E组63.20,各处理组之间存在显著差异。说明高生物量的苦草对水体浊度的下降有更加明显的促进作用。
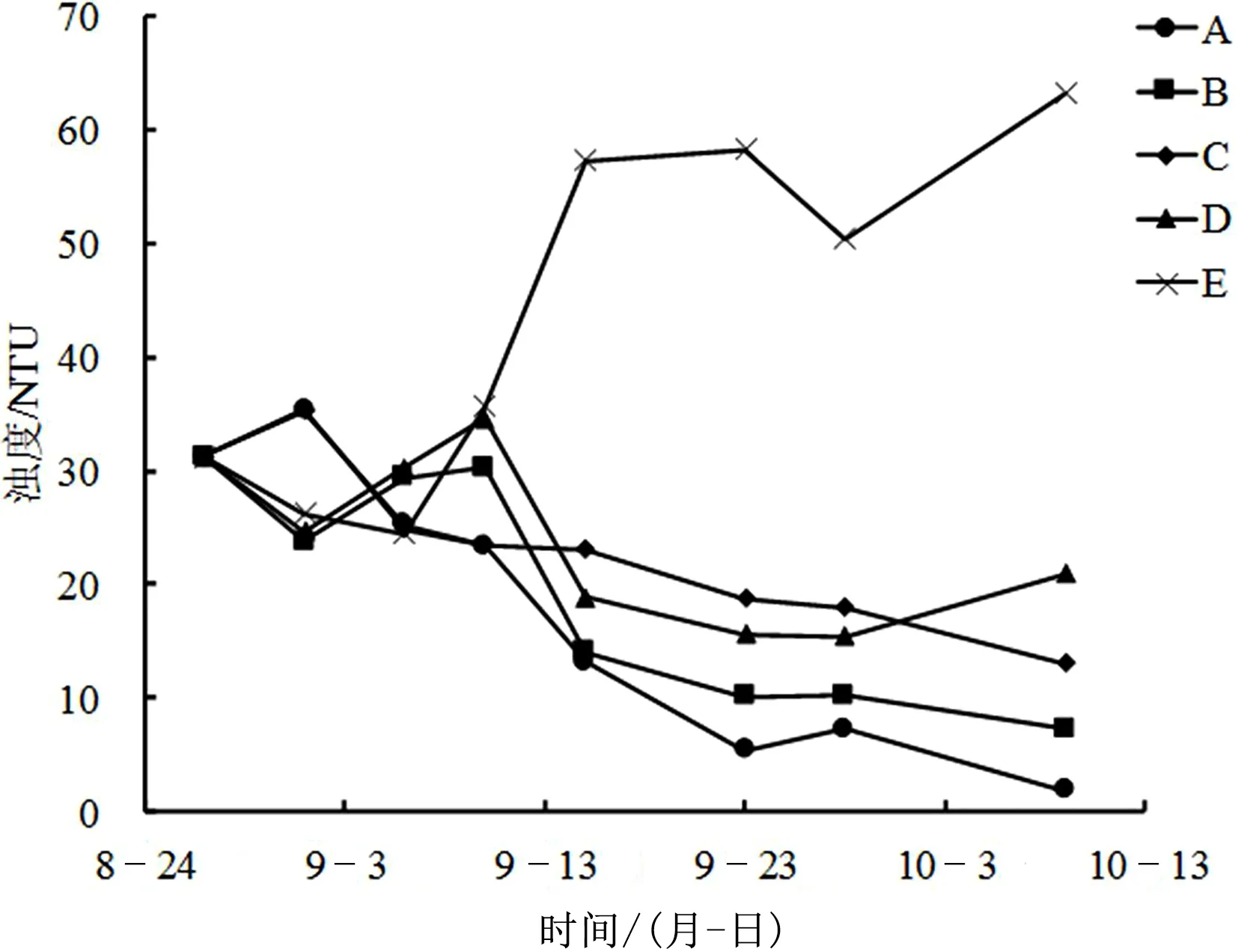
图1 不同处理组浊度变化
如图2所示,实验初期各组去除率也呈现波动趋势,实验中期开始,各有草处理组浊度去除率开始明显上升,空白E组则逐渐下降,且A组、B组浊度去除率始终高于其他2个组别;实验结束时,各处理组的浊度去除率分别为A组93.94%、B组76.61%、C组58.12%、D组33.03%、E组-102.51%,各处理组之间差异明显。同样说明高生物量的苦草能更快的降低水体的浊度。
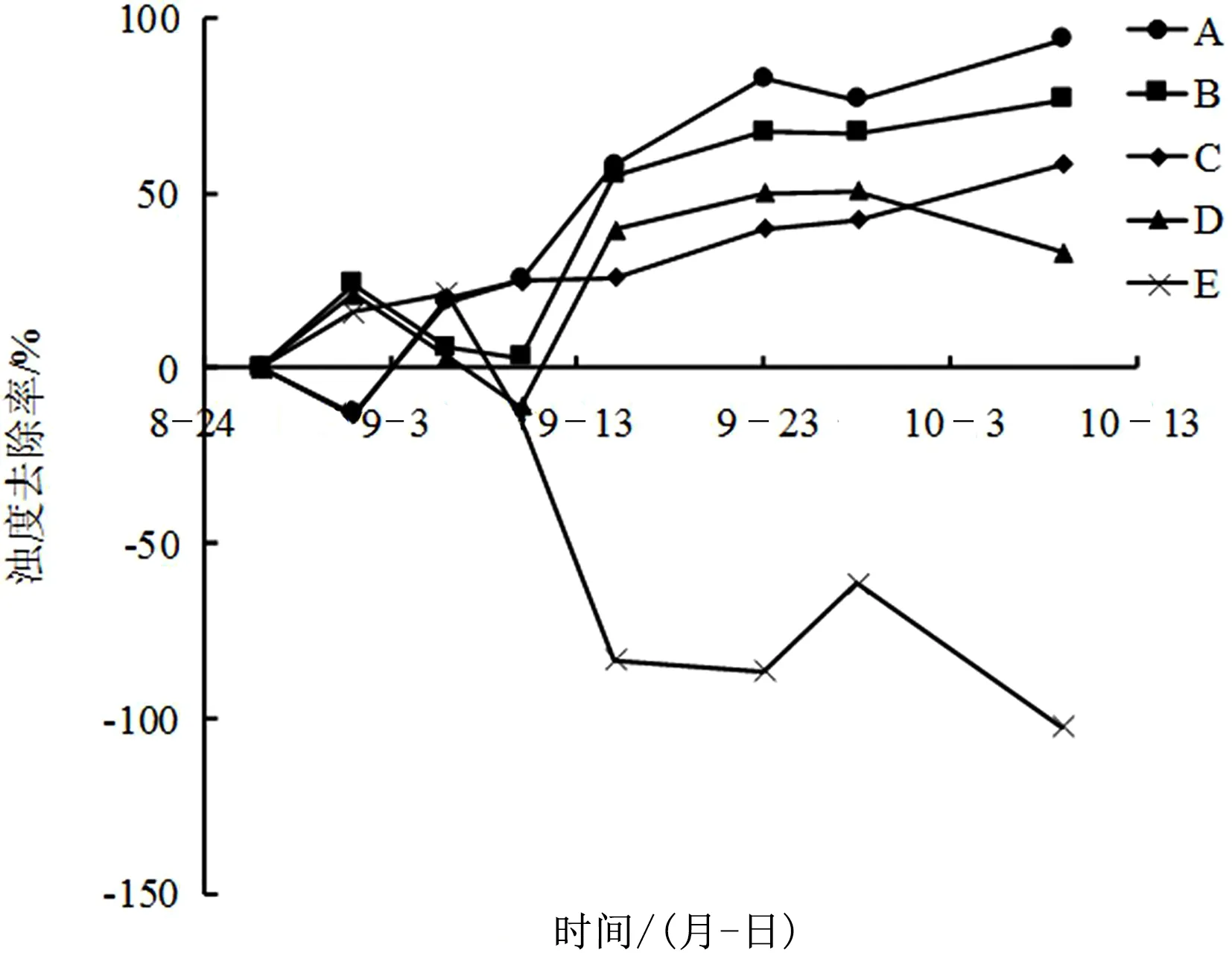
图2 不同处理组浊度去除率变化
2.2 不同处理组对水体TN浓度的影响
不同处理组对TN浓度的影响如图3所示,实验初期各处理组TN浓度均出现明显的下降,这可能是由于水体本身的沉降作用所致,但与TP类似,有草处理组TN浓度下降速度要高于空白E组,且A组下降速度最快;之后空白E组TN浓度开始逐渐上升,其他组别则出现不同程度的逐步下降,且除C组TN浓度波动较大外,其余组别均为高生物量处理组TN浓度低于低生物量处理组;实验结束时,各处理组TN浓度存在较显著差异,分别为A组0.2505mg·L-1、B组0.4841mg·L-1、C组0.7111mg·L-1、D组1.6387mg·L-1、E组6.4898mg·L-1。说明高生物量苦草对水体TN浓度有更好的去除作用,且去除效率更高。
在水质标准上,实验开始时,各处理组TN浓度均为劣Ⅴ类水标准,第5天时,A组、B组、C组下降到Ⅴ类水标准,第10天时,A组下降到Ⅳ类水标准,第19天时,A组下降到Ⅲ类水标准,B组、C组下降到Ⅳ类水标准,D组下降到Ⅴ类水标准,第43天时,A组、B组下降到Ⅱ类水标准,C组下降到Ⅲ类水标准,最终实验结束时,各处理组TN浓度水质标准分别为A组Ⅱ类水、B组Ⅱ类水、C组Ⅲ类水、D组Ⅴ类水、E组劣Ⅴ类水。也能够说明高生物量处理组能更快的降低水体的TN含量,提高水质。
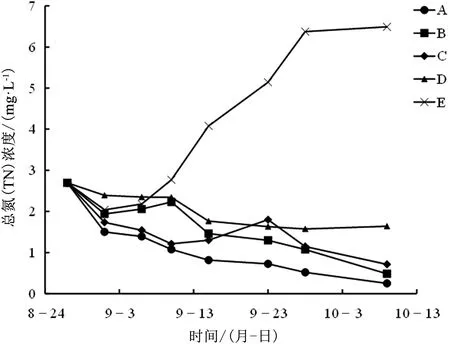
图3 不同处理组TN浓度变化
各处理组TN浓度去除率如图4所示,与TN浓度变化相反,实验开始时,各处理组TN去除率均出现明显的上升;之后空白E组出现显著且持续的下降,而有草的其余组别则出现不同程度的上升,且除C组外,高生物量组别TN去除率要高于低生物量组别;实验结束时,各处理组TN去除率有明显的差异,分别为A组90.70%、B组82.04%、C组73.62%、D组39.20%、E组-140.79%。
2.3 不同处理组对水体氨氮浓度的影响
不同处理组氨氮浓度变化如图5所示,实验开始时,各处理组氨氮初始浓度均较低,属于地表Ⅱ类水标准,外界环境变化对水体的影响作用导致实验数据在实验中期呈波动趋势,至实验中后期,空白E组氨氮浓度显著上升,其他处理组稳定下降,且植物生物量高的组别氨氮浓度要低于植物生物量低的组别,说明高生物量对氨氮浓度有更明显的去除作用;实验结束时,A组氨氮浓度为0.0912mg·L-1,达到地表Ⅰ类水标准,B组浓度为0.1621mg·L-1,C组浓度为0.1571mg·L-1,D组浓度为0.2128mg·L-1,3组均达到地表Ⅱ类水标准,E组浓度为0.6975mg·L-1,上升至地表Ⅲ类水标准。说明高生物量苦草对水体氨氮浓度有更好的去除效果,且去除效率更高。

图4 不同处理组TN去除率变化
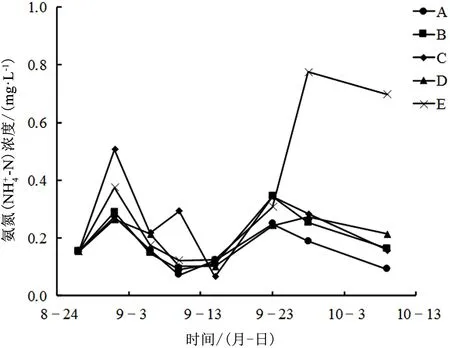
图5 不同处理组氨氮浓度变化
各处理组氨氮去除率如图6所示,实验结束时,除A组外其他各处理组氨氮去除率均为负值,且植物生物量大的处理组去除率均高于植物生物量小的处理组,各组别去除率分别为A组40.33%,B组-6.08%,C组-2.76%,D组-39.23%,E组-356.35%,说明高植物生物量对本实验水体氨氮的升高有更强的抑制作用。
2.4 不同处理组对水体TP浓度的影响
不同处理组对TP浓度的影响如图7所示,实验初期各处理组TP浓度均出现一个明显的下降,这可能是由于水体本身的沉降作用导致,但有草处理组下降速度要高于空白E组;之后空白E组TP浓度开始逐渐升高,其余各处理组TP浓度开始出现不同程度的下降,且除C组外,高生物量处理组下降速度要快于低生物量处理组;实验结束时,各处理组TP浓度有明显的差异,分别为A组0.0128mg·L-1、B组0.0385mg·L-1、C组0.0428mg·L-1、D组0.1540mg·L-1、E组0.3251mg·L-1。说明高的苦草植物生物量对水体TP含量有更好的去除作用,且去除效率更高。
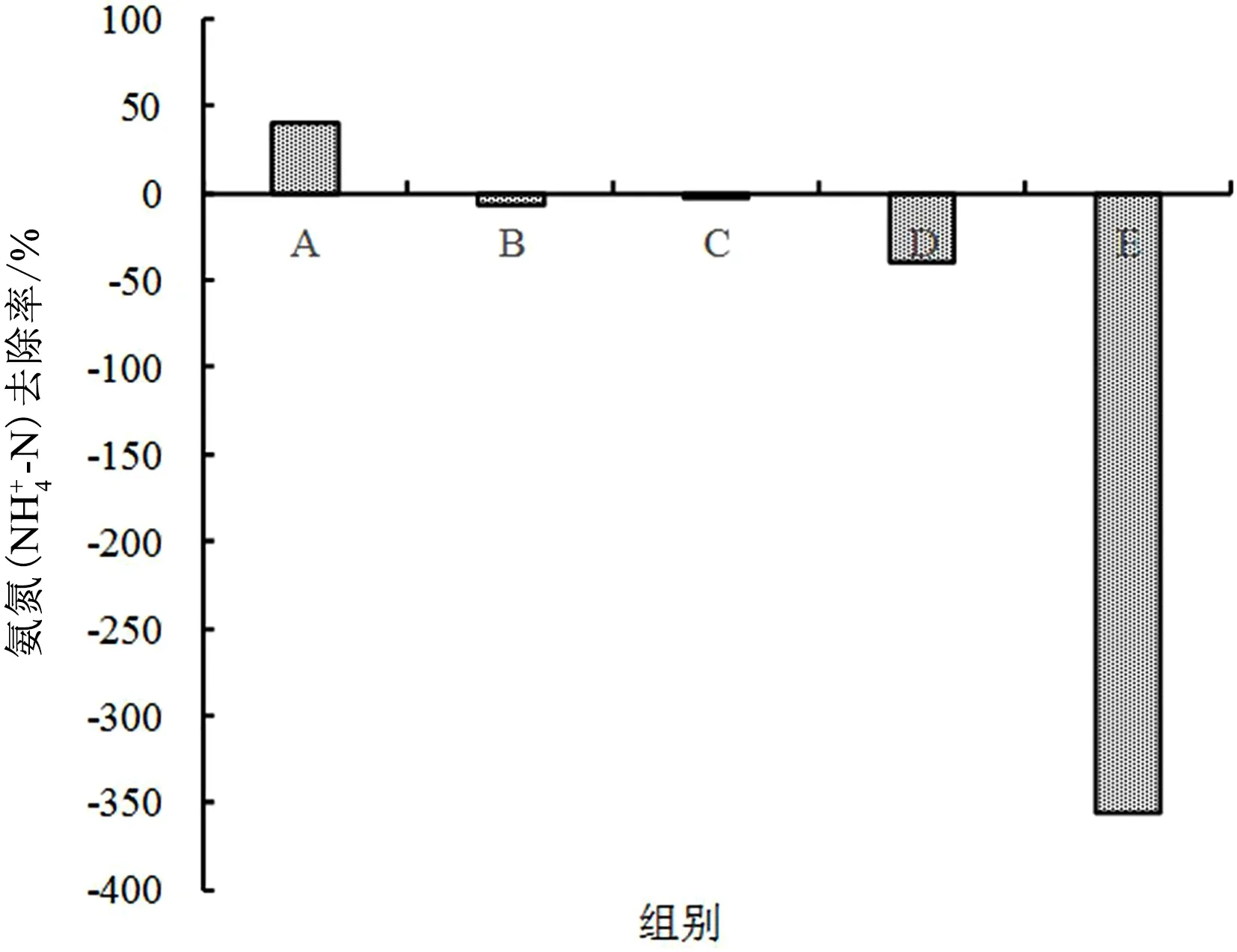
图6 不同处理组氨氮去除率变化
在水质标准上,实验开始时,各组别TP浓度均为Ⅴ类水标准,第5天时,A组、B组、C组、D组均下降到Ⅲ类水,E组下降到Ⅳ类水标准,第10天时,A组下降到Ⅱ类水标准,第19天时,B组、C组下降到Ⅱ类水标准,第43天时,A组下降到Ⅰ类水标准,实验结束时,各处理组TP浓度水质类别分别为A组Ⅰ类水、B组Ⅱ类水、C组Ⅱ类水、D组Ⅲ类水、E组Ⅴ类水。也能够说明高生物量处理组能更快的降低水体的TP含量,提高水质。
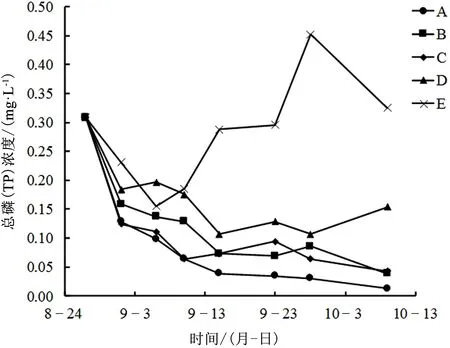
图7 不同处理组TP浓度变化
各处理组TP去除率变化如图8所示,与TP浓度变化相反,实验开始时各处理组TP去除率先出现一个明显的上升;之后空白E组开始逐渐下降,其余组别TP去除率出现不同程度的上升,其中A组TP去除率始终高于其他组别,E组去除率始终最低;至实验结束时,各处理组TP去除率存在明显的差异,分别为A组95.84%、B组87.51%、C组86.12%、D组50.04%、E组-5.47%。
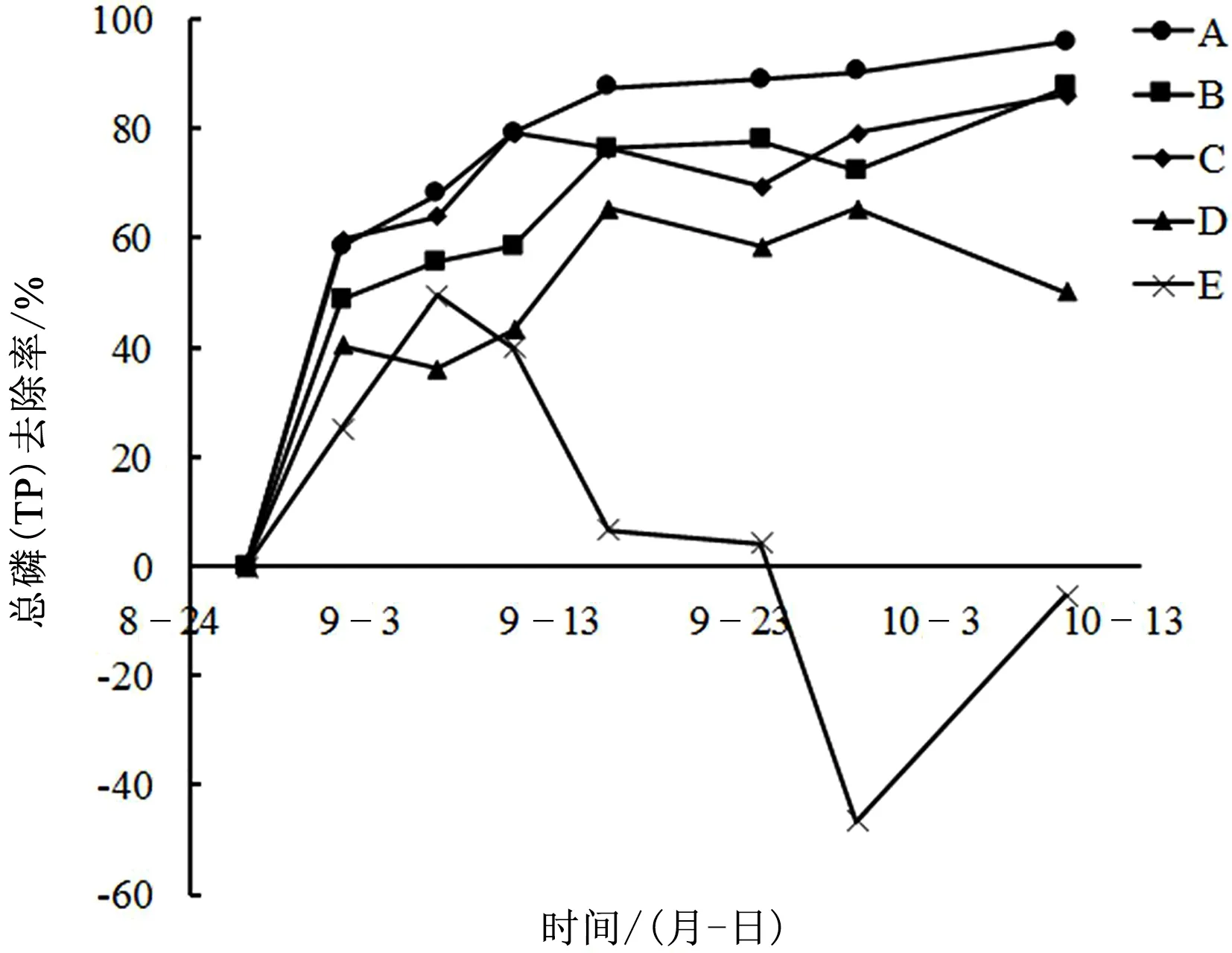
图8 不同处理组TP去除率变化
2.5 不同处理组对水体叶绿素a浓度的影响
不同处理组叶绿素a浓度变化如图9所示,实验初期,由于水体沉降作用,各个组别浓度均出现一定下降,但有草处理组下降速度均高于空白E组;之后空白E组叶绿素a浓度逐渐上升,其他各处理组均出现不同程度的下降,除C组外,其余3组均为高生物量组别下降速度快于低生物量组别;实验结束时,各处理组叶绿素a浓度分别为A组1.3303μg·L-1、B组16.15633μg·L-1、C组4.85033μg·L-1、D组43.44233μg·L-1、E组277.65943μg·L-1。说明高生物量苦草对水体的叶绿素a浓度有更好的去除作用,且去除效率更高。
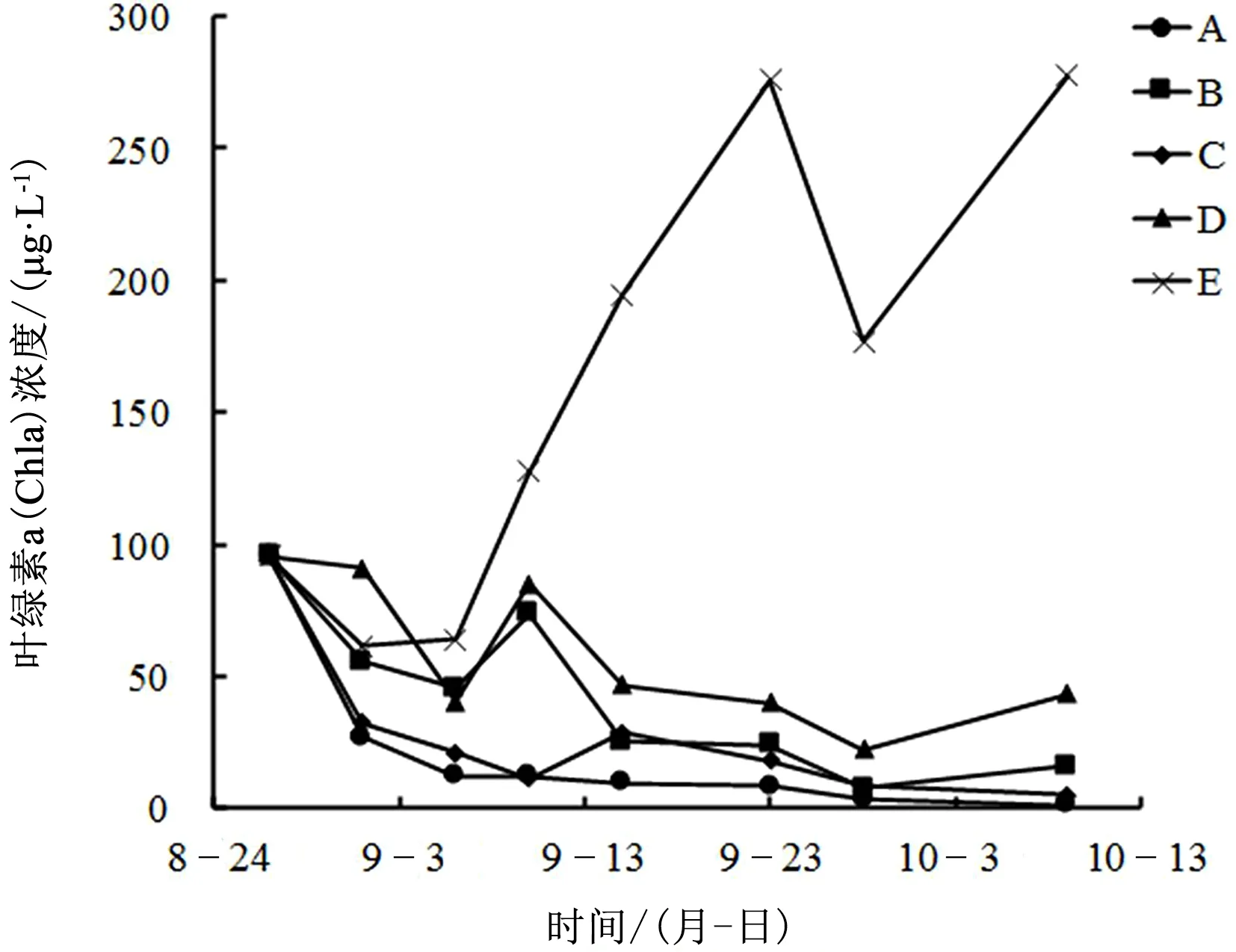
图9 不同处理组叶绿素a浓度变化
各处理组叶绿素a去除率如图10所示,实验结束时,除空白E组外,其余各处理组对叶绿素a均有明显去除效果,其中A组去除率最高,为98.61%,B组、C组去除率分别为83.12%和94.93%,D组去除率最低,为54.61%,而空白E组去除率为-190.13%。也能够说明越高的苦草生物量能够更好的去除水体中的叶绿素a含量。

图10 不同处理组叶绿素a去除率
3 讨论
本实验中,有苦草的处理组与空白组相比,均能够有效去除水体中的氮磷营养盐、悬浮颗粒及浮游藻类含量。其中,A组为种植苦草300g的组别,与其他组别相比,其去除水体污染物的能力和去除速度均最高;D组的去除能力和去除速度在有草处理组中最差;C组则有与B组数据交叉的现象出现,这可能由于:实验过程中观察到C组桶壁与其他组别相比有明显的附着现象,可能是因为过多的螺类生长,从而导致实验数据异常;C组桶内生长有过多的水绵,也起到了一定去除水体污染物的作用;C组植物生物量与B组相差不大,也可能导致实验数据出现交叉。
苦草作为水体生态修复中常用沉水植物物种,对水体的氮磷营养盐、悬浮颗粒含量及浮游藻类含量有很好的去除作用[4]。本研究结果显示,随着苦草植物生物量的增大,其去除效果变好,去除速度也更快。这可能是因为随着苦草数量的增加其群落的稳定性更强。因此在水生生态系统中,一定规模沉水植物的存在能够使整个水体的水质保持良好的水平,较好的缓解外界污染物所产生的影响。
