腰椎后路融合内固定术后切口深部感染病原菌及局部抗菌药物治疗研究
2023-11-28韩志红温存宁熊尚文谢东妍邯郸市第一医院脊柱骨肿瘤科河北邯郸05600邯郸市第一医院急诊科河北邯郸05600邯郸市第一医院神经介入外科河北邯郸05600邯郸市第一医院东区综合外科河北邯郸05600
韩志红,温存宁,庞 硕,熊尚文,谢东妍 (. 邯郸市第一医院脊柱骨肿瘤科,河北 邯郸 05600;. 邯郸市第一医院急诊科,河北 邯郸 05600;. 邯郸市第一医院神经介入外科,河北 邯郸 05600;. 邯郸市第一医院东区综合外科,河北 邯郸 05600)
腰椎后路融合内固定术疗效确切,广泛应用于脊柱损伤及退行性病变的治疗[1]。但由于脊柱手术创伤面积大,且患者多为免疫力低下的老年人群,术后存在感染的风险,可能引发脓毒症及神经损伤[2-3]。因此,探讨患者术后切口深部感染病原菌分布及耐药特征,对改善患者预后具有重要意义。清创联合持续灌注引流是治疗脊柱手术后感染的重要方法之一,目前临床上多以生理盐水作为灌注液[4]。有研究提出,在灌注液中加入抗菌药物抗菌消炎,可缩短治疗时间,提高治疗效果[5];但也有研究认为,局部使用抗菌药物可能导致耐药,不利于控制术后感染[6]。因此,灌注液中是否添加抗菌药物目前尚存在争议。本研究以60 例行腰椎后路融合内固定术后并发早期感染的患者作为研究对象,分析其感染部位分泌物的病原菌分布特征及耐药性,并探讨清创联合持续灌注引流治疗术后感染的临床疗效,旨在为临床提供参考。
1 资料与方法
1.1 临床资料
前瞻性选取2020 年5 月至2022 年5 月于我院行腰椎后路融合内固定术后并发早期感染的60 例患者为研究对象,其中男33 例,女27 例,年龄(60.15±4.76)岁,随机分为对照组和观察组,每组30例。纳入标准:①行腰椎后路融合内固定术;②符合术后感染的诊断标准[7];③切口分泌物细菌培养阳性。排除标准:①合并恶性肿瘤;②合并免疫功能障碍或严重骨质疏松;③术前合并急性或慢性感染疾病;④术前存在脊柱结核。本研究经我院医学伦理委员会批准(YL20200082),患者均签署知情同意书。
1.2 方法
观察组患者全身麻醉,清创后保留内固定。于切口两端留置1根灌注管,将管路用丝线固定并缝合伤口,灌注瓶内注入混合抗菌药物(根据药敏结果选择合适的抗菌药物)的生理盐水,并接灌注管和引流袋。术后以125 mL/h的滴速灌注创口,待体温正常、引流液细菌培养结果阴性,且相关炎症指标降至正常水平时停止灌注。对照组患者采用相同方法进行处理,灌注液用等量生理盐水,以3 L/d的引流速度持续灌注引流24 h。
1.3 观察指标
采用Oswestry 功能障碍指数(Oswestry disability index, ODI)和视觉模拟量表(visual analogue scale,VAS)评估患者术前及出院时的生活质量及腰痛情况。于术前、术后1 d、术后3 d、术后7 d及出院时测量患者体温,并采集患者空腹静脉血,检测白细胞计数(white blood cell count,WBC)、C 反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)及红细胞沉降率(erythrocyte sedimentation rate,ESR),并记录患者治疗后恢复情况。
1.4 病原菌及耐药性检查
灌注前取样,然后通过全自动病原微生物鉴定系统(VITEK 2 Compact,法国生物梅里埃公司)对感染分泌物的主要病原菌进行分析及药敏试验。
1.5 统计学分析
采用SPSS 23.0 统计软件分析数据,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 患者术后早期切口深部感染病原菌分布
60例样本中检出病原菌90株,其中革兰氏阳性菌30 株(33.33%),以金黄色葡萄球菌(20.00%)为主要致病菌;革兰氏阴性菌56株(62.22%),以铜绿假单胞菌(28.89%)为主要致病菌;真菌4株(4.44%),见表1。
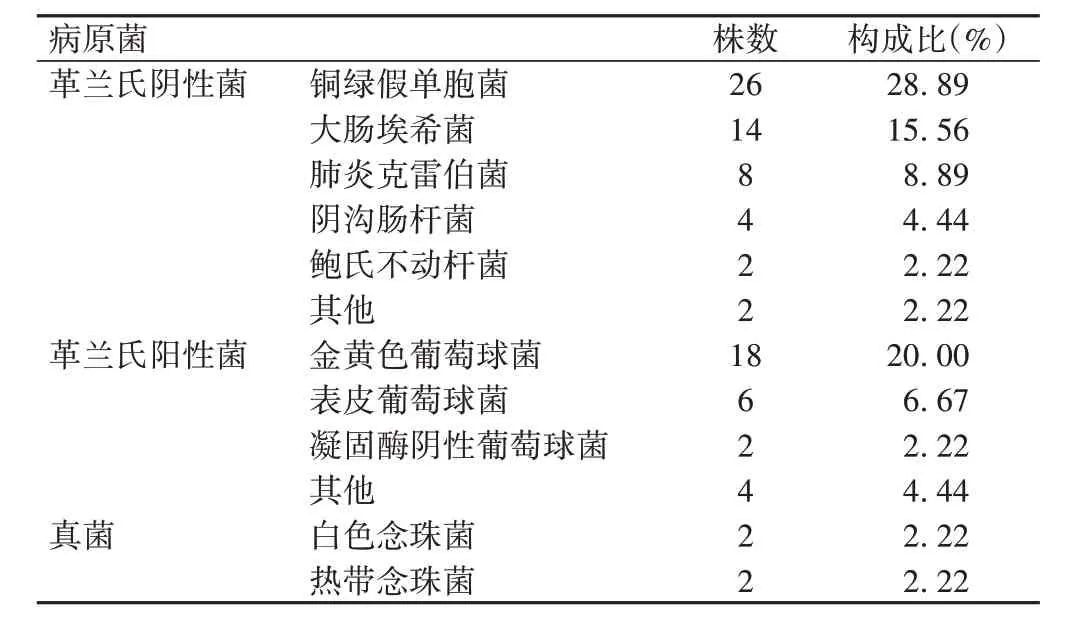
表1 患者术后早期切口深部感染病原菌分布
2.2 病原菌耐药性分析
革兰氏阴性菌中,铜绿假单胞菌对庆大霉素、环丙沙星及氨苄西林耐药性较高,大肠埃希菌对头孢唑林耐药性较高,肺炎克雷伯菌对庆大霉素耐药性较高。革兰氏阳性菌中,金黄色葡萄球菌对氨苄西林和青霉素耐药性较高;表皮葡萄球菌对万古霉素耐药性较高;凝固酶阴性葡萄球菌对氨苄西林、红霉素耐药性较高,见表2、3。

表2 抗革兰氏阴性菌药物耐药性分析[株(%)]
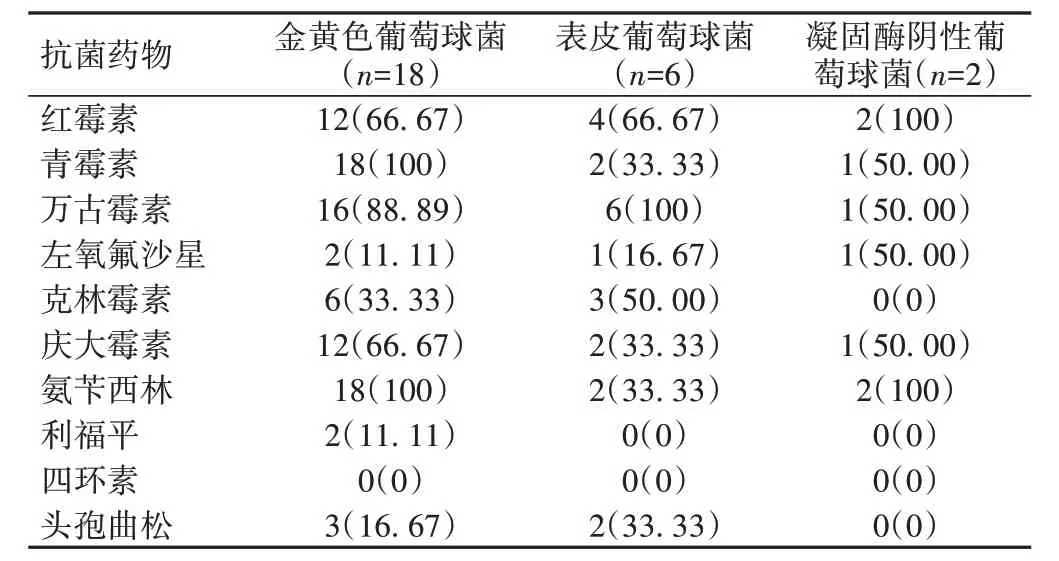
表3 抗革兰氏阳性菌药物耐药性分析[株(%)]
2.3 2组患者VAS评分及ODI
2 组患者出院时VAS 评分及ODI 均较术前明显降低(P<0.05),但2 组患者术前及出院时的VAS 评分及ODI比较,差异无统计学意义(P>0.05),见表4。
表4 2组患者手术前后VAS评分及ODI(±s,n=30)

表4 2组患者手术前后VAS评分及ODI(±s,n=30)
*:与术前比较,P<0.05
组别对照组观察组VAS评分(分)术前6.68±1.60 6.28±1.55 0.653 0.516出院时33.19±7.28*33.59±9.53*0.744 0.463 t P出院时2.75±0.98*2.81±1.24*0.274 0.785 ODI(%)术前75.12±8.00 72.79±9.84 1.273 0.213
2.4 2组患者感染相关指标
2组患者治疗后体温及WBC、CRP、PCT、ESR水平均较术前明显降低(P<0.05),且观察组患者术后1 d、3 d、7 d及出院时ESR,术后3 d、7 d及出院时CRP,术后7 d及出院时PCT改善情况优于对照组(P<0.05),见表5。
表5 2组患者感染相关指标(±s,n=30)
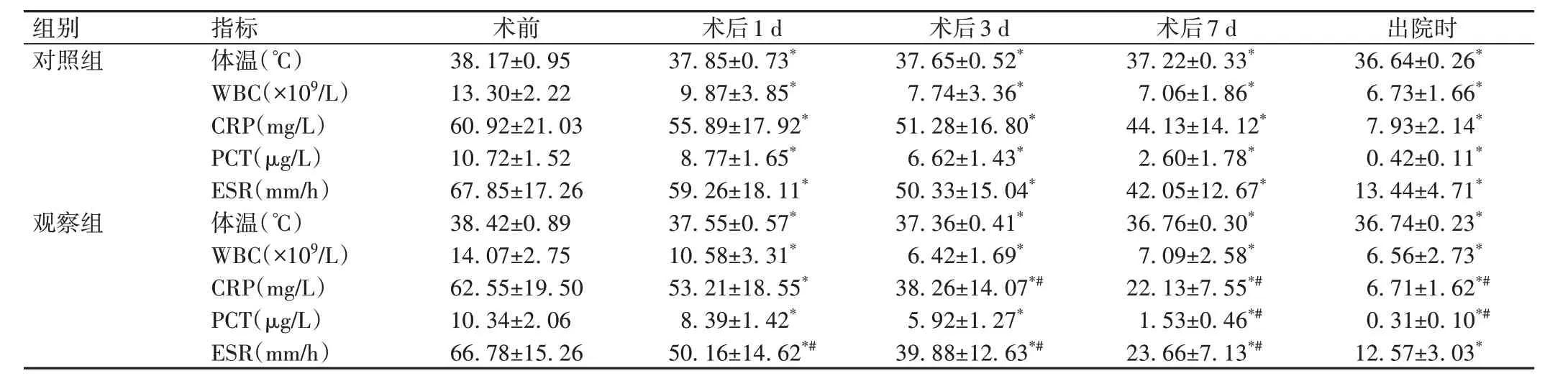
表5 2组患者感染相关指标(±s,n=30)
*:与术前比较,P<0.05;#:与对照组比较,P<0.05
组别对照组观察组指标体温(℃)WBC(×109/L)CRP(mg/L)PCT(µg/L)ESR(mm/h)体温(℃)WBC(×109/L)CRP(mg/L)PCT(µg/L)ESR(mm/h)术前38.17±0.95 13.30±2.22 60.92±21.03 10.72±1.52 67.85±17.26 38.42±0.89 14.07±2.75 62.55±19.50 10.34±2.06 66.78±15.26出院时36.64±0.26*6.73±1.66*7.93±2.14*0.42±0.11*13.44±4.71*36.74±0.23*6.56±2.73*6.71±1.62*#0.31±0.10*#12.57±3.03*术后1 d 37.85±0.73*9.87±3.85*55.89±17.92*8.77±1.65*59.26±18.11*37.55±0.57*10.58±3.31*53.21±18.55*8.39±1.42*50.16±14.62*#术后3 d 37.65±0.52*7.74±3.36*51.28±16.80*6.62±1.43*50.33±15.04*37.36±0.41*6.42±1.69*38.26±14.07*#5.92±1.27*39.88±12.63*#术后7 d 37.22±0.33*7.06±1.86*44.13±14.12*2.60±1.78*42.05±12.67*36.76±0.30*7.09±2.58*22.13±7.55*#1.53±0.46*#23.66±7.13*#
2.5 2组患者术后恢复情况
与对照组比较,观察组患者灌注引流时间、引流管放置时间、静脉使用抗菌药物时间及住院时间均明显缩短(P<0.05),但2 组患者切口愈合时间无显著差异(P>0.05),见表6。
表6 2组患者术后恢复情况(±s,n=30,d)

表6 2组患者术后恢复情况(±s,n=30,d)
组别对照组观察组t P灌注引流时间19.07±9.91 14.29±3.52 11.596<0.001引流管放置时间21.33±10.42 16.08±3.44 12.920<0.001静脉使用抗菌药物时间25.78±10.31 19.33±4.06 13.008<0.001切口愈合时间16.74±3.43 15.74±3.75 1.752 0.082住院时间30.79±10.26 23.61±4.13 15.026<0.001
3 讨论
术后早期感染发生率为0.11%~4.00%,引起术后早期感染的因素较多,其中手术创口处局部抵抗力较低、术中或术后发生细菌血源性传播及伤口污染是主要因素[8]。针对早期感染患者,一般认为通过应用抗菌药物、给予白蛋白支持治疗等非手术手段即可实现有效治疗,但椎间盘血供较少,抗菌药物到达感染部位的药物浓度难以确定,且椎间隙上下为椎体,周围伴有韧带封闭,导致炎症难以控制,从而影响非手术治疗效果[9-10]。近年来的研究认为,尽早清除病变的椎间盘组织,并合理选用抗菌药物,可避免炎症向椎管内蔓延,有效缩短恢复时间[11]。
本研究结果显示,患者术后感染以铜绿假单胞菌为主。有研究表明,铜绿假单胞菌、大肠埃希菌在术后感染中较为常见[12-13]。因此,在临床治疗过程中,应关注病原菌种类,合理选用抗菌药物。本研究的耐药性分析结果显示,革兰氏阴性菌中,铜绿假单胞菌对庆大霉素、环丙沙星及氨苄西林耐药性较高,大肠埃希菌对头孢唑林耐药性较高,肺炎克雷伯菌对庆大霉素耐药性较高;革兰氏阳性菌中,金黄色葡萄球菌对氨苄西林和青霉素耐药性较高,表皮葡萄球菌对万古霉素耐药性较高,凝固酶阴性葡萄球菌对氨苄西林、红霉素耐药性较高(均达到100%),与朱新峰等[14]的研究结果一致。说明在临床用药时,应合理使用抗菌药物进行针对性治疗,尽量减少药物用量,避免因耐药影响治疗效果。早期切口深部感染诊断存在一定困难,因为腰部肌肉和皮下组织较厚,早期伤口红肿不明显,通过分析感染常见病原菌并使用敏感抗菌药物,有利于控制感染。
临床上治疗感染主要使用抗菌药物,对于创口疼痛加剧、持续性红肿及深部感染患者,需进行清创、引流处理[15]。本研究中,对照组和观察组患者治疗后VAS 评分及ODI 均较术前明显降低,且观察组患者引流管放置时间、灌注引流时间、静脉使用抗菌药物时间及住院时间均明显短于对照组,在体温及WBC、CRP、PCT、ESR 水平方面,观察组患者改善情况优于对照组。提示在生理盐水中加入抗菌药物可缩短引流管拔除时间,及早控制术后深部感染,有利于内置物保留,促进患者术后恢复。结合既往临床研究结果,我们总结了清创联合抗菌药物局部持续灌注引流治疗的特点:①有效维持局部药物浓度,避免了药物半衰期的影响,使炎症指标水平明显降低[16];②有内固定置入的患者,细菌定植在置入物表面形成多糖-蛋白膜,使得抗菌药物难以进入,有利于保留内固定[17-18];③缩短静脉使用抗菌药物时间,降低细菌耐药率[19]。
综上所述,腰椎后路融合内固定术后早期切口深部感染多以金黄色葡萄球菌及铜绿假单胞菌为主,清创联合抗菌药物局部持续灌注引流治疗感染疗效可靠。但由于腰椎后路融合内固定术后感染患者较少,且病例收集时间较短,本研究结果尚需扩大样本量进行多中心研究,以得出更加可靠的结论。
