HPLC法测定地顶孢霉培养物中腺苷的含量*
2023-11-28郑雪媚蒋顺进刘宗新
郑雪媚,蒋顺进,林 昊,刘宗新
(1 广东容大生物股份有限公司,广东 清远 511500;2 清远一生自然生物研究院有限公司,广东 清远 511500)
地顶孢霉培养物是从野生虫草中分离得到的地顶孢霉菌株,通过人工发酵的方式生产出的一种新型绿色的饲料添加剂,富含腺苷、虫草素、虫草多糖、虫草酸、甾醇等多种活性成分,被誉为动物可以食用的“冬虫夏草”[1-2]。腺苷是一种嘌呤核苷,对动物的心肌具有保护作用,其含量被用作虫草类产品的质控指标,因此建立完善准确的质量检测方法是很有必要的[3]。本研究利用高效液相色谱法测定地顶孢霉培养物中腺苷的含量,旨在为地顶孢霉培养物中腺苷含量的测定及虫草类产品质量监控提供技术支撑。
参照虫草制品中虫草素和腺苷的测定高效液相色谱法[4],根据腺苷的结构特点,建立测定地顶孢霉培养物中腺苷含量的HPLC法。该方法具有定量检测准确度高、线性范围广、重现性好、分析时间短、样品处理简单等特点,为地顶孢霉培养物的质量控制提供可靠的依据。
1 实 验
1.1 仪器和材料
G7111AAgilent液相色谱仪;CTO-20AC柱温箱;UPR-5T超纯水仪;KQ-500DE超声波清洗器;METTLER MS105DU天平;腺苷标准品(来源:中国食品药品检定研究院(含量99.4%));地顶孢霉培养物(来源:广东容大生物股份有限公司提供),水为超纯水(来源:广东容大生物股份有限公司提供),乙腈(来源:科鲁德化工股份有限公司)。
1.2 色谱条件
流动相:乙腈-水(5∶95)为流动相;
色谱柱:菲罗门 C185 μm,4.6 mm×250 mm;
检测波长:260 nm;
流速:1.0 mL/min;
柱温:35 ℃;
进样量:10 μL。
1.3 溶液的配制
1.3.1 对照品溶液的制备
精密称取20 mg腺苷对照品,置200 mL容量瓶,加超纯水至刻度,摇匀,精密移取上述溶液5 mL,置于100 mL容量瓶,加超纯水至刻度,摇匀,过滤,即得。
1.3.2 供试品溶液的制备
精密称取1 g地顶孢霉培养样品,置100 mL容量瓶,加适量超纯水,超声30 min后定容至刻度,摇匀,过滤,即得。
1.4 阴性干扰测定
以相同的处方比例,按照地顶孢霉培养物的制备工艺,制得地顶孢霉培养物的阴性制剂。取地顶孢霉培养物的阴性颗粒适量,按1.3.2项下制成地顶孢霉培养物阴性溶液。进样测试,结果阴性溶液无干扰。证明本方法用于腺苷的含量测定具有专属性。

图1 腺苷对照品Fig.1 Adenosine reference

图2 地顶孢霉培养物阴性样品Fig.2 Acremonium terricola culture negative sample

图3 地顶孢霉培养物样品Fig.3 Sample of acremonium terricola culture
1.5 标准曲线的制备

表1 腺苷对照品溶液浓度及峰面积Table 1 Adenosine reference solution concentration and peak area
精密称取腺苷对照品100.4 mg,置1 000 mL容量瓶中,加纯化水至刻度使溶解,摇匀,作为对照品贮备液;分别移取对照品贮备液0.5、1、2、5、20、100 mL置100 mL容量瓶中,加纯化水至刻度,摇匀,作为对照品溶液。对以上6种对照品溶液进样测定。记录色谱图,测定结果见表1。

图4 腺苷的线性关系图Fig.4 Linear plot of adenosine
以腺苷浓度为横坐标,峰面积为纵坐标,绘制标准曲线,见图4。结果表明,在0.499 0~99.797 6 μg/mL范围内,腺苷浓度与峰面积呈良好的线性关系,其回归方程为y=26.144x-1.811 9,R2=1。
1.6 精密度试验
精密称取腺苷对照品20.11 mg,按1.3.1项下制成每1 mL含4.997 3 μg腺苷对照品溶液。连续进样6次,记录色谱图。结果见表2。
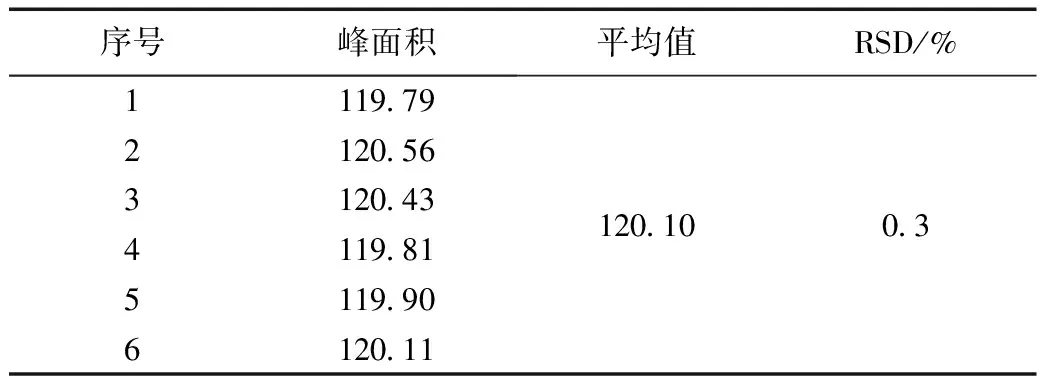
表2 腺苷精密度试验Table 2 Adenosine precision test
结果表明,腺苷峰面积RSD为0.3%,证明本方法的精密度良好。
1.7 重复性试验
1.7.1 对照品溶液的制备
精密称定腺苷对照品20.43 mg,按1.3.1项下制成每1 mL含5.076 9 μg腺苷对照品溶液。
1.7.2 供试品溶液的制备
精密称定地顶孢霉培养,按1.3.2项下制备供试品溶液,平行处理6份,进样测定。结果见表3。

表3 腺苷含量测定重复性试验Table 3 Repeatability test for determination of adenosine content
结果表明,腺苷含量RSD为0.2%,证明本测试方法重复性良好。
1.8 回收率试验
1.8.1 对照品母液的制备
精密称取腺苷对照品20.17 mg,置200 mL棕色容量瓶中,加纯化水至刻度使溶解,作为腺苷对照品母液。
1.8.2 对照品溶液的制备
取对照品母液5 mL,置100 mL容量瓶中,加纯化水至刻度,摇匀,过滤,即得。
精密称取已知含量的同一批地顶孢霉培养样品约0.5 g(共9份)置于100 mL容量瓶中,分别加入上述对照品母液1.5 mL、2.5 mL、3.5 mL,加适量超纯水,超声30 min后定容至刻度,过滤,进样测定。进样测定,记录色谱图,结果见表4。

表4 腺苷回收率试验数据Table 4 Adenosine recovery test data
结果显示,腺苷回收率的平均值为98.70%,RSD值为0.8%,表明本方法回收率较好。
1.9 腺苷测定方法的耐用性研究
本试验考察色谱柱温度、流速、波长、不同品牌色谱柱及流动相比例对地顶孢霉培养物中腺苷含量测定的影响。
1.9.1 不同的色谱柱温度
对照品溶液的制备:精密称定腺苷对照品20.18 mg,按1.3.1项下制成每1 mL含5.014 7 μg腺苷对照品溶液。
供试品溶液的制备:取地顶孢霉培养物,按1.3.2项下制备地顶孢霉培养物供试品溶液。
在其它色谱条件不变的情况下,色谱柱温度分别设定为30、35、40 ℃,对同一样品进行含量测定,记录峰面积,计算腺苷含量,结果见表5。
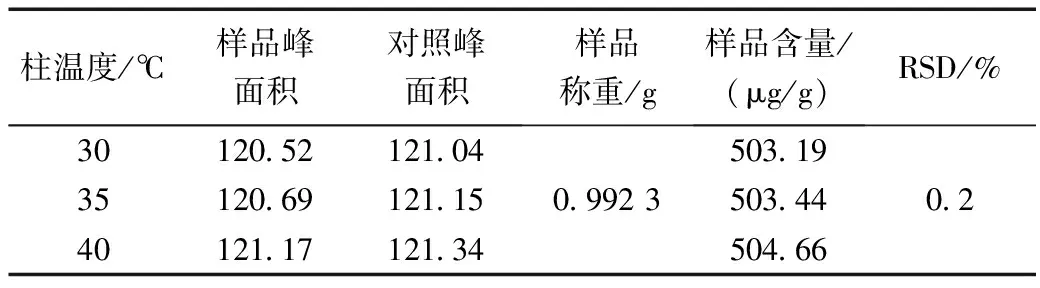
表5 不同色谱柱温度对腺苷含量测定的影响Table 5 Effects of different chromatographic column temperatures on the determination of adenosine content
结果表明,色谱柱温度的微小变化对腺苷含量测定无明显影响。
1.9.2 不同的流速
(1)对照品溶液的制备
精密称定腺苷对照品20.20 mg,按1.3.1项下制成每1 mL含5.019 7 μg腺苷对照品溶液。
(2)供试品溶液的制备
取地顶孢霉培养物,按1.3.2项下制备地顶孢霉培养物供试品溶液。
在其它色谱条件不变的情况下,流动相流速分别设定为0.8、1.0、1.2 mL/min,对同一样品进行含量测定,记录峰面积,计算腺苷含量,结果见表6。
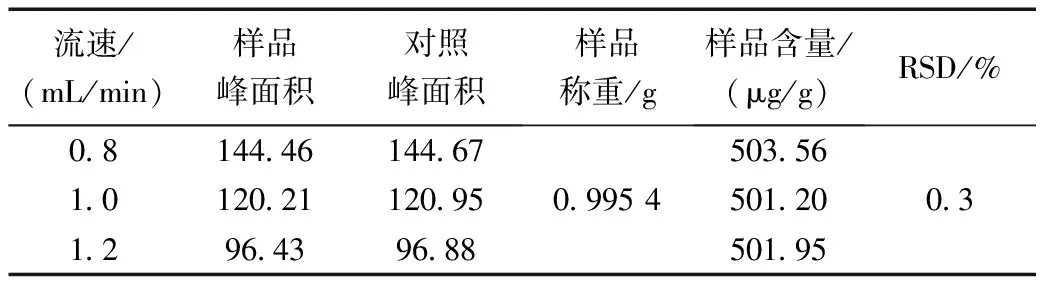
表6 不同流动相速度对腺苷含量测定的影响Table 6 Effect of the velocity of different mobile phases on the determination of adenosine content
结果表明,流动相速度的微小变化对腺苷含量测定无明显影响。
1.9.3 不同的色谱柱
(1)对照品溶液的制备
精密称定腺苷对照品20.41 mg,按1.3.1项下制成每1 mL含5.071 9 μg腺苷对照品溶液。
(2)供试品溶液的制备:
取地顶孢霉培养物,按1.3.2项下制备地顶孢霉培养物供试品溶液。
在其它色谱条件不变的情况下,使用不同的色谱柱,对同一样品进行含量测定,记录峰面积,计算腺苷含量,结果见表7。

表7 不同品牌色谱柱对腺苷含量测定的影响Table 7 Effect of different brands of chromatographic columns on the determination of adenosine content
结果证实,不同品牌色谱柱对腺苷的含量测定无明显影响。
1.9.4 不同的测定波长
(1)对照品溶液的制备
精密称定腺苷对照品20.25 mg,按1.3.1项下制成每1 mL含5.032 1 μg腺苷对照品溶液。
(2)供试品溶液的制备:
取地顶孢霉培养物,按1.3.2项下制备地顶孢霉培养物供试品溶液。
在其它色谱条件不变的情况下,测定波长分别设定为257、258、259、260、261、262、263 nm,对同一样品进行含量测定,记录峰面积,计算腺苷含量,结果见表8。
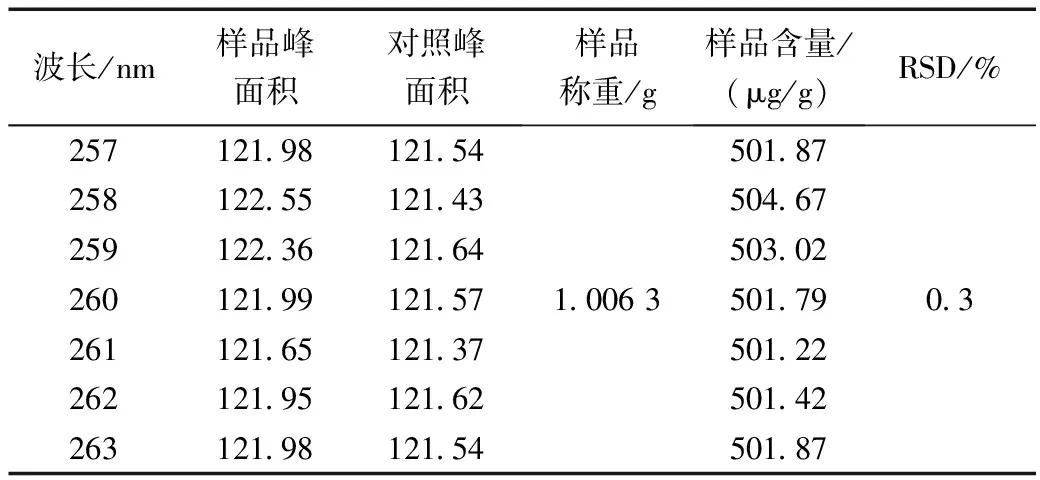
表8 不同测定波长对腺苷含量测定的影响Table 8 Effect of different determination wavelengths on the determination of adenosine content
结果表明,测定波长的微小变化对腺苷含量测定无明显影响。
1.9.5 不同的流动相比例
(1)对照品溶液的制备
精密称定腺苷对照品20.63 mg,按1.3.1项下制成每1 mL含5.126 6 μg腺苷对照品溶液。
(2)供试品溶液的制备

表9 不同流动相比例对腺苷含量测定的影响Table 9 Effect of the proportions of different mobile phases on the determination of adenosine content
取地顶孢霉培养物,按1.3.2项下制备地顶孢霉培养物供试品溶液。
在其他色谱条件不变的情况下,流动相乙腈-水比例分别设定为2.5∶97.5、5∶95、7.5∶92.5,对同一样品进行含量测定,记录峰面积,计算腺苷含量,结果见表9。
结果表明,流动相比例的微小变化对腺苷含量测定无明显影响。
小结:采用本方法能准确测定地顶孢霉培养物中的腺苷的含量,方法的耐用性较好。
2 结 论
徐娟娟等[5]建立了测定地顶孢霉培养物中腺苷含量的高效液相色谱法,该方法对地顶孢霉培养物中腺苷含量检测方法的波长、线性、精密度、回收率等进行了研究,在此基础上,本方法增加了专属性、耐用性(色谱柱温度、流速、波长、不同品牌色谱柱及流动相比例对地顶孢霉培养物中腺苷含量测定的影响)等的研究。刘书余等[6]建立了同时测定地顶孢霉培养物中腺苷、虫草素和麦角甾醇含量的高效液相色谱法,但该方法采用梯度洗脱,分析时间较长。本研究建立了HPLC法测地顶孢霉培养物中腺苷的含量,测定色谱条件为:以十八烷基硅烷键合硅胶为填充剂;流动相为乙腈-水(5∶95);检测波长为260 nm。本方法定量检测准确度高、线性范围广、重现性好、分析时间短、样品处理简单,为地顶孢霉培养物质量控制提供了依据。
