甜瓜自交系BPC-4双单倍体的创制、鉴定及基因组变化
2023-11-27毕研胜郑莉娜张璐王瑜晖钱春桃
毕研胜,郑莉娜,张璐,王瑜晖,钱春桃
(南京农业大学园艺学院/作物遗传与种质创新利用全国重点实验室,江苏 南京 210095)
甜瓜(CucumismeloL.)是葫芦科(Cucurbitaceae)黄瓜属(Cucumis)一年生蔓性草本植物,其果实营养丰富,是一种色、香、味俱佳的重要世界性水果[1]。由于甜瓜的遗传基础较为狭窄,抗病虫害和抗逆性较差,严重限制了甜瓜产量和品质的提高。杂种优势是提高产量、改进品质、增强抗性的重要途径[2],在甜瓜上已经利用杂种优势培育出了优良的品种[3-4]。杂种优势育种的关键是获得双亲纯系,常见的纯化方法是自交,传统育种需要自交8代以上才可获得较纯合的自交系。对于自交4代的甜瓜材料,其纯合率理论上为93.75%,还需自交4~5代才可进一步纯合;按照一年种植两季计算,需要2年以上才能纯合,这就减缓了育种进程。而将育种材料培育成双单倍体只需2代[5],因此双单倍体可以大大缩短育种材料纯合进程,可以明显提高育种效率。
作物通常无法直接获取双单倍体,需要先获得单倍体,再通过染色体加倍获得双单倍体[6]。目前获得单倍体的方法主要是自然突变和人工诱导。自然突变是指植物发育异常导致孤雄或孤雌生殖的发生,进而产生单倍体,这一方法突变概率很低且具有随机性[7]。人工诱导主要有体外诱导和体内诱导2种方法。体外诱导可分为雄配子体诱导(花药培养或小孢子培养)和雌配子体诱导(未受精子房或胚珠离体培养)。体内诱导分为辐射花粉诱导、诱导系诱导、CRISPR/Cas9基因编辑诱导和远缘杂交诱导[8]。雄配子诱导途径中,通过花药培养获得甜瓜单倍体比较困难,Dryanovska 等[9]曾尝试甜瓜花药的培养,结果以失败告终。小孢子培养获得甜瓜单倍体还未见有成功报道。雌配子诱导途径中,未受精子房和未受精胚珠离体培养可以获得甜瓜单倍体[10-11],但存在成苗率差,技术不成熟等问题。辐射花粉获得甜瓜单倍体也已有成功报道[12-13],但是存在需要昂贵辐射设备、基因型依赖性高等限制。而诱导系和CRISPR/Cas9基因编辑诱导单倍体的方法目前还未在甜瓜上获得成功。上述方法获得甜瓜单倍体已属不易,要想获得甜瓜双单倍体还需要经过染色体加倍[14],更增加了育种的难度。
小麦与玉米、栽培大麦与球茎大麦远缘杂交可以利用父本染色体的消除产生单倍体[15-16],然后经过染色体自然加倍形成双单倍体[17-18]。利用重测序技术可以对基因组变化进行检测[19],如玉米上利用重测序对自交系及自交后代SNP位点的纯合度进行检测,分析了纯合度和性状一致性的关系,在分子水平上为自交系建立保种圃提供了依据[20]。孙博文等[21]和黄耀等[22]利用甜瓜和野生种非洲角(C.africanus)、西印度瓜(C.anguria)远缘杂交诱导获得了双单倍体,并且创制的甜瓜双单倍体叶片、节间长等多个性状变小,整体表现为矮化。但是,甜瓜与同属近缘种黄瓜之间的种间杂交是否也能诱导染色体消除获得甜瓜双单倍体,以及获得的甜瓜双单倍体在性状和基因组水平上的变化特征,这些研究都未见报道。因此,本文在成功地利用甜瓜与黄瓜远缘杂交诱导出甜瓜自交系BPC-4(S4)的双单倍体基础上,系统比较分析其植物特性特征,并利用SSR标记分析双单倍体的基因位点纯合性,同时进一步分析全基因组SNP位点纯合性变化情况,为探明甜瓜与黄瓜远缘杂交获得甜瓜双单倍化的机制提供理论基础。
1 材料与方法
1.1 试验材料
用于远缘杂交的母本材料甜瓜品种‘白皮脆’由新疆农业科学院提供,经过4代自交得到自交系,将其编号为BPC-4(2n=2x=24)。远缘杂交的父本材料为甜瓜属8种不同基因型材料自交系(表1)。

表1 父本材料基因型信息Table 1 Genotype information of paternal material
以上材料种子由南京农业大学葫芦科作物遗传与种质创新实验室提供,其中,新种自交16代材料为本实验室自主培育材料[23]。试验材料于2020年秋季种植在南京农业大学白马基地。其中母本材料种植50株,父本材料各种植10株。
1.2 方法
1.2.1 远缘杂交诱导远缘杂交试验参考钱春桃等[24]的方法。授粉后立刻在雌花果梗处喷施25 mg·L-1氯吡脲溶液(又称坐果灵),4~5 h后用10 mg·L-1TDZ(噻苯隆)喷施子房,24 h后再次对子房喷施10 mg·L-1的TDZ。
1.2.2 杂交后代自交留种2021年春季对F1自交留种,获得的F2于2021年秋季再次自交得到F3,F3于2022年春季种植在南京农业大学白马基地。
1.2.3 远缘杂交后代的双单倍体特性鉴定1)染色体数目观察 由于F1较少,以F2的幼嫩根尖为材料进行制片观察。制片方法参考胡静轩等[25]的方法。染色体制片采用酶解去壁低渗火焰法,经4′,6-二脒基-2苯基吲哚(DAPI)荧光染料染色后,使用蔡司荧光显微镜(Image Z2)在100×油镜下观察并照相。
2)基因位点的SSR鉴定分析 利用SSR标记的共显性特征对杂交后代基因位点进行鉴定分析。选用葫芦科作物基因组数据库的852对SSR引物,与黄瓜参考基因组Cucumber(Chinese Long)genome v2和甜瓜参考基因组(DHL92)v3.6.1进行BLAST比对,得到235对SSR引物,进一步筛选得到分布在12条染色体上的27对父母本具有多态性的标记(表2)。筛选后的引物由南京擎科生物有限公司合成。利用CTAB法提取待测F2、F3和父母本叶片样品的DNA,扩增反应体系总体积20 μL:1 μL模板DNA(50~100 ng·μL-1),2×Taq Master Mix 10 μL,上、下游引物各1 μL(10 μmol·L-1),ddH2O 7 μL。PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,28个循环;72 ℃ 8 min,最后4 ℃保存。产物(50~100 ng·μL-1)经聚丙烯酰胺凝胶电泳检测。
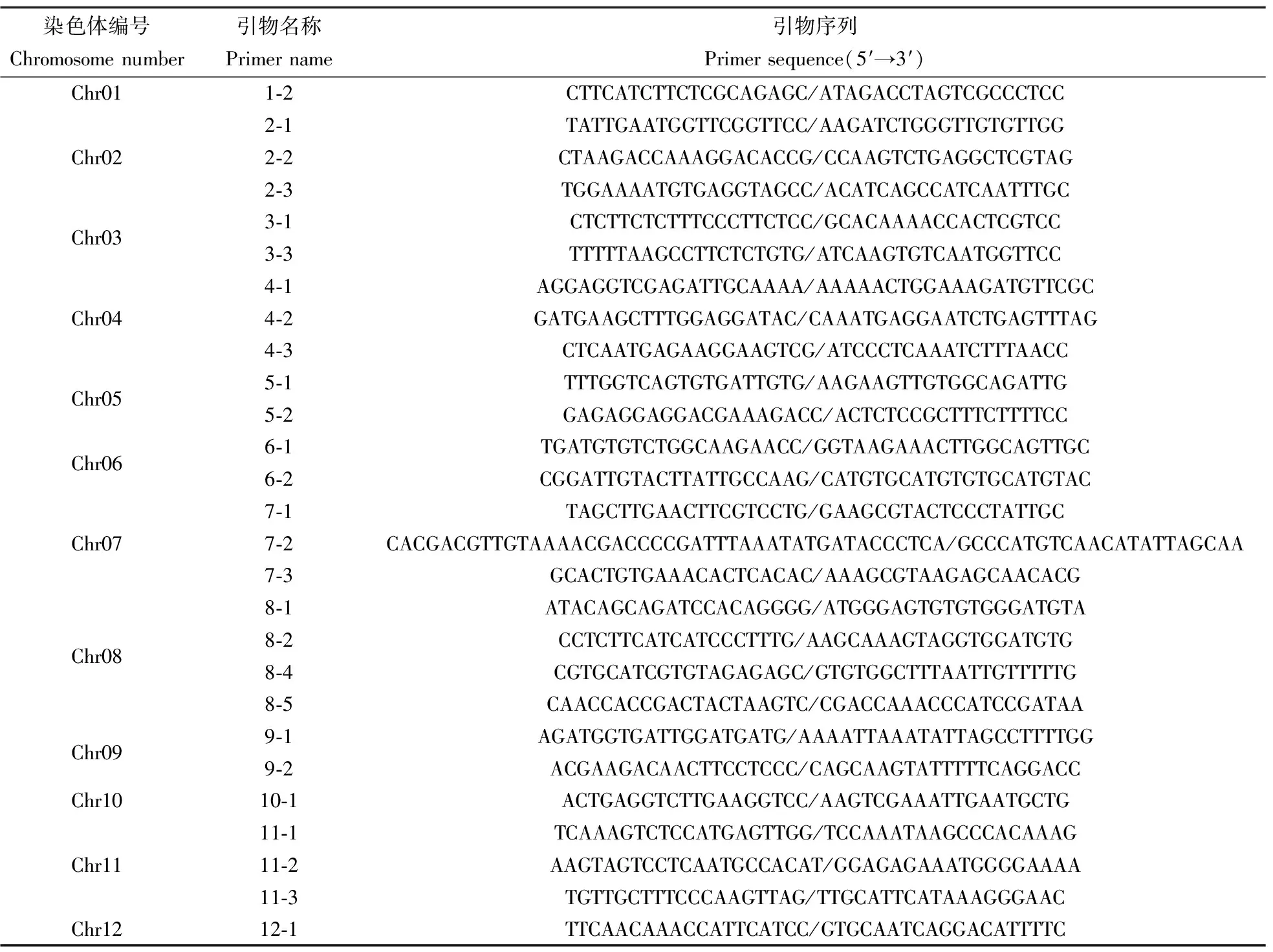
表2 多态性SSR引物名称及对应序列Table 2 Polymorphic SSR primer names and corresponding sequences
3)植物学性状的统计分析 通过观察发现F2与F3性状无明显变化,因此选用F2与BPC-4进行植物学性状的比较。植物学性状统计参照贾媛媛等[26]的方法,在盛花期测量植株13、14、15节位的叶长、叶宽、茎粗、节间长、叶柄长、叶柄与主蔓的夹角;每株分别取3朵当天开放的雄花测量花瓣长;测量植株总节间数;待果实成熟时随机取3个果实测量横纵径、单果重,并计算果形指数。利用手持糖度计测定可溶性糖含量。
1.2.4 双单倍体育性评价远缘杂交后代F1、F2、F3经过鉴定为双单倍体,将其依次命名为DH0、DH1、DH2。为了评价双单倍体的育性,统计BPC-4和DH0、DH1、DH2自交的种子数、结籽率等。结籽率=饱满种子数/种子数×100%。
1.2.5 重测序数据统计与分析重测序分2次进行,第1次测定BPC-4和DH1,第2次测定DH1和DH2,分2次采集植株幼嫩叶片样品后送交深圳华大基因股份有限公司进行测定,采用的重测序方法为第二代测序技术的纳米球测序技术。具体重测序方法如下:采用CTAB法提取叶片基因组DNA,用Covaris仪超声波随机打断成特定大小的片段;打断后的样品用Agencourt AMPure XP-Medium kit进行片段选择,使得样品条带集中在200~300 bp;末端修复、加“A”、接头连接;采用BGISEQ-500/MGISEQ-2000 上机测序。对仪器测序得到的序列(raw reads)进行过滤,将过滤后的序列(clean reads)使用BWA比对软件与甜瓜参考基因组(DHL92)v3.6.1进行比对,对比对结果进行排序、质量过滤和标记duplicate后进行后续变异类型的检测。使用GATK软件的HaplotypeCaller功能来检测样品相对于参考基因组之间的SNP位点。使用变异位点注释软件Annovar将变异位点在基因组上的位置区域注释。
参照陆珊珊等[21]的方法计算SNP位点纯化率,相同的碱基对记作纯合基因型(Hom),不同的碱基对记作杂合基因型(Het)。将两者SNP位点进行比较,过滤相同的SNP位点基因型,统计2种变化类型数量:A,杂合基因型变为纯合基因型;B,纯合基因型变为杂合基因型。计算SNP位点纯化率并统计SNP纯化位点在染色体上的分布。SNP纯化位点数=A-B。SNP位点纯化率计算公式:SNP位点纯化率=SNP纯化位点数/SNP位点数×100%。
1.3 数据处理
以上数据均使用Excel 2016软件计算均值与标准差,并进行单因素方差分析。
2 结果与分析
2.1 不同父本基因型对远缘杂交诱导的影响
将BPC-4人工去雄后,与8种父本进行远缘杂交。前期研究表明甜瓜远缘授粉后不进行处理的子房会发生败育[26],因此本研究在远缘杂交授粉后喷施了坐果灵。由表3可见:喷施坐果灵后8种杂交组合都可以收到自交果,坐果率为67.67%~84.00%。但是只有杂交组合BPC-4×YPJ-6的杂交果收获3粒相对饱满种子(F1),其他基因型作为父本的杂交组合均没有饱满种子,表明甜瓜远缘杂交有严重的杂交不亲和的现象,且和父本基因型有关;杂交组合BPC-4×YPJ-6不亲和现象可能较弱,因此杂交成功。
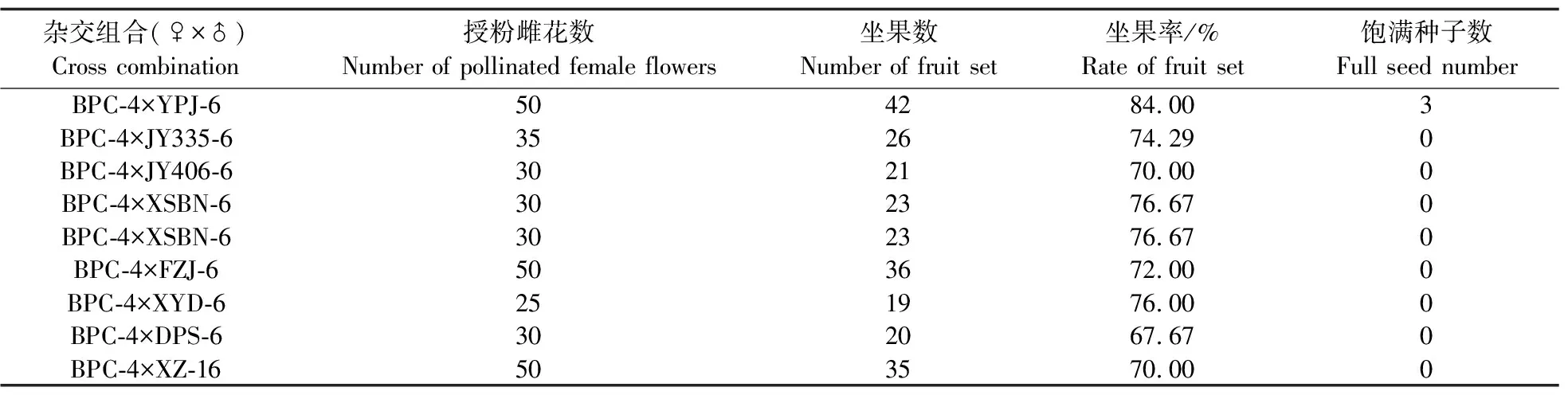
表3 8种远缘杂交组合的诱导结果Table 3 Induction results of 8 distant cross combinations
2.2 远缘杂交后代的双单倍体特性鉴定
将获得的3粒F1种子于2021年春季进行播种,其中有1粒种子发芽,自交收获50粒种子(F2);2021年秋季F2自交获得F3。将F3种子于2022年春季进行播种,用于进一步的染色体数目观察、SSR鉴定、植物学性状统计、育性评价和重测序分析。
2.2.1 染色体数目观察前人利用远缘杂交组合C.maximta×C.moschata曾获得了南瓜的单倍体[27]。本研究利用甜瓜和黄瓜进行远缘杂交,为确定获得后代是否也为单倍体,需要进行染色体计数鉴定。由于F1材料较少,选用F2的根尖进行观察,结果(图1)显示染色体数为24条,与甜瓜二倍体的染色体数目一致,可以证明本次远缘杂交诱导获得的材料为二倍体(2n=2x=24)。

图1 F2根尖细胞有丝分裂中期染色体(2n=2x=24)Fig.1 Mitotic metaphase chromosome of F2 root tip cell(2n=2x=24)
2.2.2 基因位点的SSR鉴定分析利用27对引物(表2)对F2进行扩增,结果(表4)显示,有22对标记检测到了母本的特异性条带,并且母本的特异性条带在F2的单株之间是一致的,这表明F2在这些位点上是纯合的。3-1、4-1、4-2、8-1和8-4这5对标记检测到少量可能来自父本的特异性条带(图2),但是这些条带在F2单株之间的位置是一致的,说明这5对标记上的位点可能为异质性纯合位点。为进一步检测这5对异质性纯合位点的真实性,对F2和F3再次进行扩增,发现F3中扩增出的条带位置与F2一致并未发生分离,在F2、F3中未再次扩增出可能来自父本的特异性条带(图3)。对这5对标记所在基因组区间进行F2重测序的碱基突变信息分析,结果未发现插入或缺失的碱基突变现象(表5),因此5对引物在F2中检测到的疑似异质性纯合位点是同质性纯合。

图2 SSR引物在亲本及F2中的扩增结果Fig.2 Amplification results of SSR primers in the parent and F2M:标准品;♀:母本BPC-4;♂:父本YPJ-6;1~10:F2单株。M:Marker;♀:Maternal parent BPC-4;♂:Paternal parent YPJ-6;1-10:F2 single plant.

图3 SSR引物在BCP-4、YPJ-6及F2、F3中的扩增结果Fig.3 Amplification results of SSR primers in BCP-4,YPJ-6 and F2 and F3M:标准品;♀:母本BPC-4;♂:父本YPJ-6;A和B:F2单株;1~8:F3单株。M:Marker;♀:Maternal parent BPC-4;♂:Paternal parent YPJ-6;A and B:F2 single plant;1-8:F3 single plant.
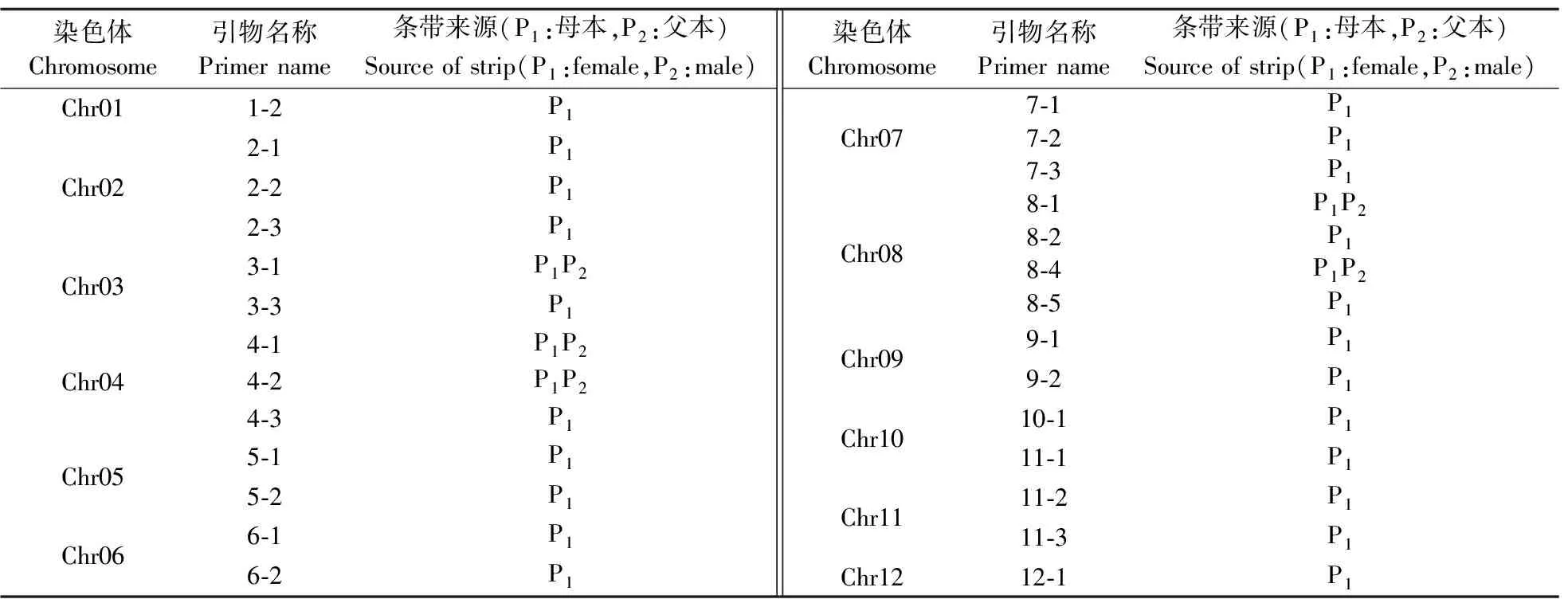
表4 SSR多态性标记带型分析Table 4 Analysis of SSR polymorphism marker banding

表5 F2基因组中5对SSR标记的序列变异统计Table 5 Statistics of sequence variation profiles for 5 pairs of SSR markers in the F2 genome
2.2.3 植物学性状的统计分析本研究中,与BPC-4 相比,F2植株整体表现为紧凑和矮化,叶长、叶宽、茎粗、节间长、叶柄长、雄花长、节间数、叶柄与主茎夹角和果实大小均小于BPC-4,且差异显著。叶片与果皮的颜色都更深(图4)。由表6和表7可见:除果形指数外,F2的其他性状指标均显著小于 BPC-4(P<0.05),但其可溶性糖含量极显著高于BPC-4(P<0.01)。表明相比于 BPC-4,双单倍体个体之间的性状变异程度较小更加整齐,符合双单倍体纯合稳定的特性,再次证明远缘杂交的后代为双单倍体。因此,将F1、F2、F3命名为DH0、DH1、DH2。

图4 双单倍体(DH)与BPC-4植物学性状比较Fig.4 Comparison of botanical characters between dihaploid(DH)and BPC-4 A. BPC-4与DH叶柄与主蔓夹角比较(以红色虚线代表叶柄和主蔓,白色曲线表示夹角);B. BPC-4与DH花期的叶片比较;C. BPC-4与DH盛花期的雄花比较;D. BPC-4与DH成熟期的果实。A. Comparison of the angle between petiole and main vine in BPC-4 and DH(red dashed line represents petiole and main vine,white curve indicates the angle);B. Comparison of leaves between BPC-4 and DH at flowering stage;C. Comparison of male flowers between BPC-4 and DH at bloom stage;D. BPC-4 and DH fruits at maturity stage.
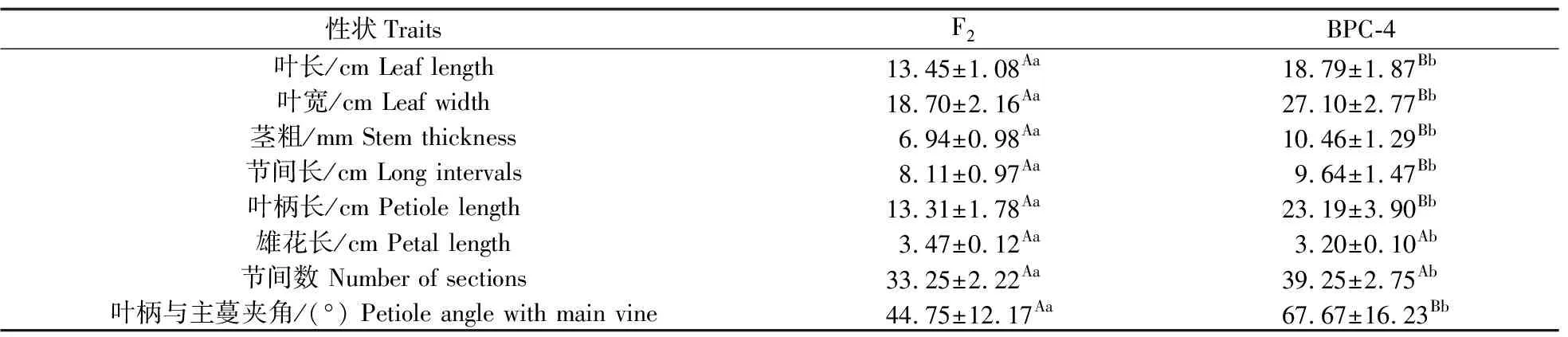
表6 F2与BPC-4部分植物学性状比较Table 6 Comparison of some botanical characters between F2 and BPC-4

表7 F2与BPC-4果实性状比较Table 7 Comparison of some fruit characters between F2 and BPC-4
2.3 双单倍体育性评价
由表8可见:DH0饱满种子数、结籽率分别为50、23.81%,与BPC-4相比有显著差异。DH1、DH2自交后的饱满种子数分别恢复到278、297,结籽率恢复到75.34%、78.78%,表明双单倍体经过自交育性恢复可以通过种子进行扩繁保存。

表8 DH0、DH1、DH2和BPC-4的种子数和结籽率比较Table 8 Comparison of seed number and seed setting rate of DH0,DH1,DH2 and BPC-4
2.4 BPC-4与双单倍体的重测序
2.4.1 重测序数据重测序共产生了13.19 G原始测序数据,经过SOAPnuke软件对数据进行接头过滤、低质量过滤和去N过滤后,最终得到12.83 G高质量的可用数据。BPC-4和DH1这2个样本原始数据的reads数分别为45 373 388和42 526 730,原始数据的碱基数分别为6 806 008 200 和6 379 009 500 bp。过滤后数据的reads数分别为44 411 746和41 145 684,过滤后数据的碱基数分别为6 661 761 900 和6 171 852 600 bp。可利用数据占送测样品原始数据的97.88%和96.75%。质量值大于Q20的碱基分别占96.28%和95.86%,质量值大于Q30的碱基分别占89.92%和88.81%。GC含量分别为37.50%和37.16%。综上,样本数据量充足,GC分布正常,测序质量合格,可用于进一步的分析。
2.4.2 数据比对使用BWA比对软件,将 clean reads 比对到参考基因组上,然后使用Qualimap软件对比对结果进行统计。BPC-4和双单倍体样本的比对率分别为96.00%和97.96%,平均测序深度分别为17.35X和16.42X。综上,比对结果正常,可用于后续相关分析。
2.4.3 BPC-4与双单倍体的SNP位点分析经过SNP注释分析,双单倍体共注释到 2 132 915个 SNP,BPC-4 共注释到 2 123 670 个 SNP。其中双单倍体有111 026个SNP位于基因上游,333 104个SNP位于编码区。BPC-4中有111 114个SNP位于基因上游,334 681个SNP位于编码区。基因上游和编码区的变异都可以直接或间接影响基因表达,进而影响基因功能和表型变化。
过滤相同的位点后,由BPC-4的杂合位点变为双单倍体的纯合位点数为68 972个,由BPC-4的纯合位点变为双单倍体的杂合位点数为63 480个,SNP纯化位点数为5 492个,SNP位点纯化率为0.26%,这证明BPC-4在经历4代自交后基因组的确仍存在杂合位点,可以进一步纯化,也证明经过远缘杂交诱导所获得的双单倍体相比与BPC-4更加纯合。纯化位点在12条染色体上均有分布,其中1号染色体数量最多,6号染色体分布最少(图5)。
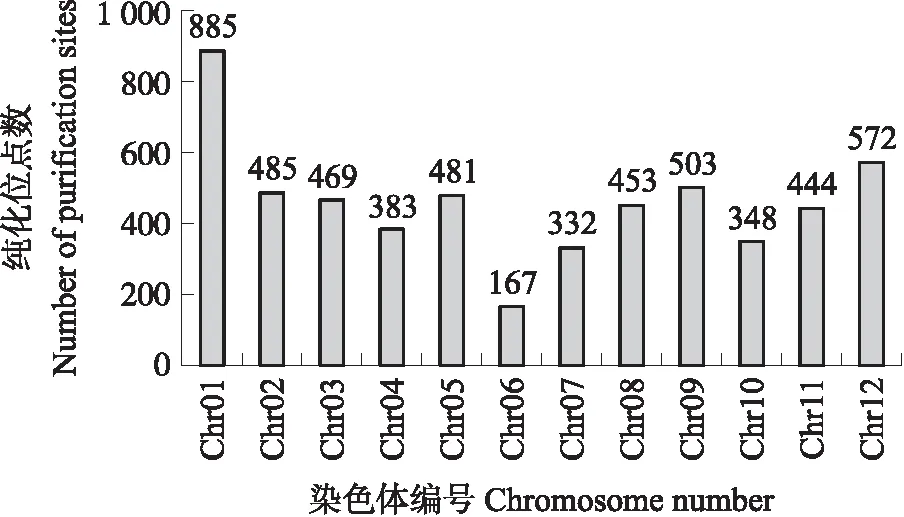
图5 双单倍体SNP纯化位点在染色体上的分布Fig.5 Distribution of purification sites of double haploid SNP on chromosomes
2.5 双单倍体自交后代的重测序
2.5.1 重测序数据DH1和DH2这2个样本原始数据的reads数分别为39 680 000和38 720 000,原始数据的碱基数分别为5 952 000 000和5 808 000 000 bp。过滤后数据的reads数为38 955 026和38 190 110,过滤后的数据的碱基数分别为5 843 253 900和5 728 516 500 bp。可利用数据占送测样品原始数据的98.17%和98.63%。质量值大于Q20的碱基分别占97.41%和97.00%,质量值大于Q30的碱基分别占93.05%和92.06%。GC含量分别为38.39%和37.54%。综上,样本数据量充足,GC分布正常,测序质量合格,可用于进一步分析。
2.5.2 数据比对使用BWA比对软件,将 clean reads 比对到参考基因组上,然后使用Qualimap软件对比对结果进行统计。DH1和DH2样本的比对率分别为97.81%和97.99%。平均测序深度分别为13.260 5X和13.087 9X。综上,比对结果正常,可用于后续相关分析。
2.5.3 双单倍体自交后代的基因组稳定性经过SNP 注释分析,DH1共注释到2 147 266个SNP,DH2共注释到 2 166 719个SNP。将DH1、DH2相同的SNP位点过滤,结果显示由DH1的杂合位点变为DH2的纯合位点数为104 920,由DH1的纯合位点变为DH2的杂合位点数为105 936,与纯合位点变为杂合位点的差值为1 016,占比仅为0.05%,远小于孟德尔遗传学理论上S4纯合度(93.75%)与S5纯合度(96.88%)的差值(3.13%),因此表明在自交到DH2时基因组水平上已经比较稳定。
3 讨论
本研究通过远缘杂交诱导的方法获得甜瓜BPC-4的双单倍体,其表型发生了显著变化,与孙博文等[21]在培育的甜瓜双单倍体中观察到的现象一致。通常认为一种材料在经历4代自交后性状应当比较稳定,我们对BPC-4(S4)进行自交,获得的S5、S6也未观察到性状分离情况(数据未列出)。可能是因为植物学性状大多是多基因控制的复杂性状,通过传统自交的方法很难进一步纯化。本研究获得的双单倍体纯系性状出现明显变化,表明自交系的性状经过双单倍体化可以进一步纯化。因此,有必要将甜瓜自交系(S4)创制为双单倍体。
马红梅等[28]利用籼稻蜡质基因5′上游区与GUS基因编码区构建融合基因,并采用基因枪法导入未成熟种子幼胚和糊粉层细胞中,结果证明基因上游区域可以调节基因编码区的表达。在本研究的双单倍体中注释到位于基因上游和编码区的SNP位点变化,并观察到自交系(S4)变化为双单倍体时出现的多个性状变化,这可能与马红梅等[28]的研究类似。此外,BPC-4在经双单倍体化后基因组进一步纯化,且这种纯化在12条染色体上都有分布,而且甜瓜1号染色体上的位点纯化最多。研究表明,甜瓜1号染色体与黄瓜7号染色体几乎完全一样,具有很高的同源性[29],因此,推测它们之间在种间杂交时发生同源重组的频率可能较高,这可能是甜瓜1号染色体上纯化位点分布最多的原因。
由于遗传的差异,不同基因型之间种间杂交的亲和性不同,筛选杂交亲和性高的配组应当是可能的[30]。本研究设置了8个不同的远缘杂交组合,以寻找亲和性较好的亲本组合。在喷施坐果灵后虽然都可以收到杂交果实,但只有甜瓜和栽培黄瓜的1个杂交组合成功获得3粒饱满的种子。这可能与该杂交组合的杂交亲和性较好有关。此外在8个杂交组合中有7个父本材料为二倍体,而新种(Cucumis×hytivusChen &Kirkbride,2n=38)是本实验室创制的人工异源四倍体,其作为父本与栽培甜瓜杂交也未能获得种子,这可能与不同倍性间的杂交更困难有关。因此,虽然新种作为桥梁种可以将原始亲本野生种(酸黄瓜C.hystrix,2n=2x=24)的一些优良基因导入到栽培黄瓜(C.sativus,2n=2x=14)中[31],但是本研究因远缘杂交未收到种子,从而未能实现新种作为桥梁种转导酸黄瓜的有用基因至栽培甜瓜中。
在禾本科植物中远缘杂交常用来获得作物的单倍体,而这种远缘杂交的方法之所以可以产生单倍体是因为经过杂交产生的核型不稳定,从而导致父本的染色体被全部消除,因此利用远缘杂交有望获得母本来源的单倍体[32]。利用SSR分子标记可以检测远缘杂交后代的基因位点纯合性,也可以检测父本遗传物质是否导入[33]。本研究利用双亲具有多态性的SSR引物检测远缘杂交后代F2,发现在F2中都只检测到母本的特异性条带,并未发现父本的特异性条带。因此,我们推测本研究所获得的双单倍体也是在远缘杂交后发生了父本外源染色体整体消除的结果。
远缘杂交获得的DH0经过自交仅有1个果实收到了少量种子(DH1),这表明最初的双单倍体育性很低。谢冰等[34]培育的双单倍体也发现育性降低的现象,并且认为这种现象可能与胚状体发育过程中发生变异有关。此外陈英等[35]发现籼粳杂交获得的DH中,部分DH结实率虽然很低,但随着世代的增进可以恢复。本研究中,DH1、DH2自交后的种子数、结籽率也得以恢复,这与陈英等[35]的研究结果类似。因此,本研究获得的育性恢复的双单倍体可以直接自交留种,这就为双单倍体在甜瓜育种实践和理论研究创造了有利条件。
前期我们利用甜瓜野生种与栽培甜瓜进行远缘杂交培育出了甜瓜双单倍体,所利用的野生种包括西印度瓜[21]和非洲角[22]。本研究首次以栽培黄瓜与甜瓜远缘杂交培育出甜瓜双单倍体,这就拓宽了甜瓜远缘杂交诱导双单倍体途径。同时,相比野生种父本携带较多的野生不利性状,如非洲角的苦味等,栽培黄瓜作父本则可以避免一些不利性状的导入。在小麦×玉米远缘杂交获得的DH群体上,一些玉米特异DNA可以被检测到[36],并观察到染色体桥、微核等染色体异常现象[37-38]。由于本研究通过远缘杂交最终只获得了1个DH0,利用SSR标记未发现父本的遗传物质。而禾本科远缘杂交后代可以检测到父本的遗传物质,可能是因为选取的杂交组合数量多,获得了较多的杂交后代单倍体(双单倍体)。因此,如果扩大甜瓜与黄瓜的远缘杂交诱导双单倍体试验规模,或许就可以确定有无外源遗传物质导入到栽培甜瓜双单倍体中。
