乳房炎对奶牛乳成分、氧化应激水平、炎性因子含量昼夜节律性变化的影响
2023-11-27金梦冬刘祖培张海森靳亚平陈华涛
金梦冬,张 靖,王 博,刘 田,2,刘祖培,张海森,2*,靳亚平,2,陈华涛,2*
(1.西北农林科技大学 动物医学学院,陕西 杨凌 712100;2.农业农村部动物生物技术重点实验室,陕西 杨凌 712100)
生物钟系统是哺乳动物固有的内在调控机制,参与调控机体大量行为活动和生理功能的昼夜节律性变化[1],对生物体的生存与其对环境的适应具有重要意义。在自然条件下,动物体通过接收外界光线明暗变化的周期性信号调节自身生理功能以维持生存。在实际生产中,研究发现奶牛乳汁中乳蛋白含量具有明显的季节性变化,且在12月份达到峰值[2]。有数据表明,泌乳奶牛体内醛固酮、孕酮、钠、钾具有明显的昼夜节律性变化,而皮质醇受时间的影响较小[3]。泌乳奶牛血浆中的生长激素和泌乳素具有昼夜节律性变化[4]。检测妊娠与非妊娠两组奶牛血清的葡萄糖、尿素、肌酐、总胆固醇、总脂质等指标,结果显示葡萄糖和尿素具有明显的昼夜节律性变化,同时发现饲养管理、环境等因素可对奶牛激素水平及其相关生理功能的节律性变化产生显著影响[5]。NIKKHAH等[6]通过给不同胎次泌乳奶牛在9:00和21:00供应精饲料和粗饲料,分析产奶量、24 h采食量以及血液代谢产物的变化,结果表明:饲喂时间的变化会改变奶牛的采食量,但对经产奶牛的产奶量几乎没有影响;在21:00饲喂精饲料可提高经产奶牛的乳脂率,但不影响初产奶牛的乳脂率,并且在9:00饲喂时结果正好相反。上述数据表明饲喂时间的改变对泌乳奶牛的乳脂率有影响;胎次可能是改变奶牛乳脂率的重要因素。QUIST等[7]发现泌乳奶牛产奶量、乳蛋白率、SCC等也表现昼夜节律性变化。敲除奶牛乳腺上皮细胞中的生物钟核心基因PER2后抑制了SREBF1和PPARG的表达,细胞凋亡相关通路Caspase-8基因mRNA表达量显著上升,从而下调乳腺上皮细胞中脂肪酸的合成和甘油三酯的生成以及脂滴的分泌等[8]。降低小鼠乳腺上皮细胞中的生物钟核心基因CLOCK的表达水平,显著降低脂肪酸合成酶编码基因FASN的表达,对乳脂合成有明显的抑制作用[9],而奶牛的CLOCK蛋白与小鼠高度相似,两者CDS区的相似性为90.3%[10]。哺乳动物在长期的压力或者疾病状态下,昼夜节律会发生紊乱,当奶牛患乳房炎时,奶牛生理活动的节律性也会受到严重影响[11]。
乳房炎是奶牛养殖场中最常见且频发的疾病,同时也是影响奶牛泌乳性能的重要因素。奶牛乳房炎的发生会降低奶牛泌乳性能,缩短奶牛利用期限,提高奶牛淘汰率,是影响奶牛养殖场经济效益的重要因素,不利于我国奶牛产业、乳品行业的快速发展。本研究通过检测健康组和乳房炎组奶牛不同时间点血液和乳汁样品的氧化应激水平、炎性因子含量与生物钟基因表达的差异性,从时间生物学角度探究奶牛乳房炎发生时的昼夜变化特征,以期为乳房炎的防治提供参考借鉴。
1 材料与方法
1.1 试验样品来源与采集试验样品采集于关中地区某一规模化奶牛场,选取处于泌乳期的健康状态(n=10)和患乳房炎(n=5)的3~4胎次(5~6岁)荷斯坦奶牛。按照挤奶时间(0:00、8:00与20:00)采集奶牛的血液和乳汁样品。本研究采集样本所用的临床型乳房炎奶牛根据牛场生产标准和实验室检查综合判定:先通过牛舍现场诊断奶牛乳房出现红肿热痛、乳汁变性等临床乳房炎症状,同时对乳汁样本通过氢氧化钠凝乳法和乳体细胞计数(somatic cell counts,SCC)结果(SCC >100万个/mL)作出实验室诊断(注:一般认为,SCC在50万个/mL以内为正常,而超过50万个/mL为隐性乳房炎,超过100万个/mL为临床型乳房炎)。
1.2 试验试剂β-N-乙酰氨基葡萄糖苷酶(NAG)测试盒、丙二醛(MDA)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、过氧化氢酶(CAT)测试盒、过氧化氢(H2O2)测试盒、超氧化物岐化酶(SOD)测试盒、总抗氧化能力(T-AOC)测试盒、总胆固醇(T-CHO)测试盒购自南京建成生物工程研究所;葡萄糖测定试剂盒购自上海荣盛生物药业有限公司;磷酸缓冲盐溶液(PBS)购自北京索莱宝科技有限公司;TRIzol、反转录试剂盒购自宝日医生物技术(北京)有限公司;ChamQ SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;红细胞裂解液购自生工生物工程(上海)股份有限公司。
1.3 主要仪器设备普通离心机购自赛默飞世尔科技(中国)有限公司;低温离心机购自德国艾本德股份公司;全波长酶标仪、荧光定量RCR仪、普通PCR仪购自美国伯乐(BIO-RAD)公司。
1.4 奶牛乳成分测定统计采样当天健康组和乳房炎组奶牛的日产奶量,按照0:00、8:00与20:00 共3个挤奶时间点,在每次挤奶中期分别收集健康组和乳房炎组每头奶牛的乳汁样品50 mL,密封后立即送往陕西省奶牛生产性能测定管理站进行乳成分检测。
1.5 奶牛血浆中葡萄糖和总胆固醇含量测定根据操作说明书,分别将各试剂依次加入管中,混匀,37℃放置10 min,测D505 nm值。计算公式:血浆中葡萄糖含量(mmol/L)=样本管D505 nm/校准管D505 nm× 校准液浓度。根据操作说明书分别将各试剂依次加入管中,混匀,37℃放置10 min,测D505 nm值。计算公式:血浆中胆固醇含量(mmol/L)=(D样本-D空白)/(D标准-D空白)×C标准。
1.6 奶牛血浆中氧化应激水平测定分别于0:00、8:00与20:00采集健康组和乳房炎组每头奶牛的血液样品,收集于肝素钠抗凝管中,室温放置2 h后于2 000 r/min离心5 min,收集上层血浆,并于-80℃保存。
1.6.1奶牛血浆中β-N-乙酰氨基葡萄糖苷酶测定 根据操作说明书分别将各试剂依次加入管中,混匀,测各孔D400 nm值。计算公式:血浆中β-N-乙酰氨基葡萄糖苷酶(β-N-acetylglucosaminidase,NAG)活力(U/L)=(测定D400 nm- 对照D400 nm)/(标准D400 nm-空白D400 nm)×C标准(0.6 mmol/L)× 1 000÷反应时间(15 min)。
1.6.2奶牛血浆中丙二醛含量测定 根据操作说明书分别将各试剂依次加入管中,混匀,95℃水浴40 min,流水冷却至室温,3 500 r/min离心10 min,取上清250 μL,测量各孔D532 nm值。计算公式:血浆中丙二醛(malondialdehyde,MDA)含量(μmol/L)=(测定D532 nm-对照D532 nm)/(标准D532 nm-空白D532 nm)×C标准(10 nmol/mL)× 样本测试前稀释倍数。
1.6.3奶牛血浆中谷胱甘肽过氧化物酶活力测定 酶促反应:根据操作说明书,分别将各试剂依次加入管中,混匀,3 500 r/min离心10 min,取上清1 mL。显色反应:根据操作说明书,分别将各试剂依次加入管中,混匀,室温静置15 min后,测量D412 nm值。计算公式:血浆中谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力 =(非酶管D412 nm-酶管D412 nm)/(标准管D412 nm-空白管D412 nm)×C标准(20 μmol/L) × 样本稀释前倍数 × 稀释倍数。
1.6.4奶牛血浆中过氧化氢酶测定 根据操作说明书,分别将各试剂加入管中,混匀,测量各管D405 nm值。ΔD=对照D405 nm-测定D405 nm。计算公式:血浆过氧化氢酶(catalase,CAT)活力(U/mL)=ΔD×271÷V样÷t×n。注:271为斜率的倒数,是常数;V样是指取样量,0.1 mL;t指反应时间,即60 s;n是指样本测试前的稀释倍数。
1.6.5奶牛血浆中过氧化氢含量测定 根据操作说明书分别将各试剂加入管中,混匀,测量各孔D405 nm值。计算公式:过氧化氢(hydrogen peroxide,H2O2)含量(mmol/L)=(测定D405 nm-空白D405 nm)/(标准D405 nm-空白D405 nm)× 163。
1.6.6奶牛血浆中超氧化物歧化酶测定 根据操作说明书分别将各试剂加入管中,混匀,37℃孵育20 min,测量D450 nm值。计算公式:超氧化物歧化酶(superoxide dismutase,SOD)抑制率(%)=[(对照D450 nm-对照空白D450 nm)-(测定D450 nm-测定空白D450 nm)]/(对照D450 nm-对照空白D450 nm)×100%;SOD活力(U/mL)=SOD抑制率 ÷ 50%×反应体系稀释倍数(0.24 mL/0.02 mL)×样本测试前稀释倍数。
1.6.7奶牛血浆中总抗氧化水平测定 根据操作说明书分别将各试剂依次加入管中,室温6 min。反应结束后尽快测量各孔D405 nm值并计算总抗氧化能力(total antioxidant capacity,T-AOC),标准曲线中Trolox的浓度分别为0.1,0.2,0.4,0.8,1.0 mmol/L。
1.7 奶牛乳汁样品氧化应激水平测定方法同1.6。
1.8 实时荧光定量PCR检测奶牛血液炎性相关因子与生物钟基因mRNA在健康组与乳房炎组的表达变化将EDTA-K2的抗凝管标记编号,采集0:00、8:00与20:00共3个时间点健康组与乳房炎组奶牛的血液样品后及时低温冷冻保存;吸取250~300 μL采集血液样品至离心管中,加入6倍体积的红细胞裂解液,上下颠倒混匀,室温裂解5 min;4 000 r/min离心3 min后弃去上清,即获得白细胞沉淀,沉淀为白色或淡红色(注:如果红细胞裂解不完全,重复此步骤);向获得的沉淀中加入2倍体积的1 × PBS溶液洗涤1~2次,4 000 r/min 离心3 min后弃去上清;加入1 mL TRIzol溶液至离心后的样品中,反复吹打混匀,室温静置5 min;4℃、12 000 r/min离心 5 min,将上清转移到新的管中;加入0.2 mL 氯仿,摇晃混匀,室温静置5 min,4℃、1 2000 r/min 离心15 min,将水样层加入新的管中;向水样层加入等体积异丙醇,颠倒混匀,室温静置10 min,4℃、12 000 r/min离心10 min,去上清;加入1 mL 75%乙醇,涡旋振荡后4℃、7 500 r/min离心5 min,除去上清后重复此步骤;去除上清,7 500 r/min离心30 s,除去液体。离心管底部沉淀即为提取的全血RNA样品,待沉淀半透明后加入适量的DNase/RNase-Free水,测定总RNA浓度后根据反转录试剂盒使用说明书进行后续试验或置于-80℃备用。引物信息见表 1。
1.9 实时荧光定量PCR检测奶牛乳汁炎性相关因子、生物钟基因及酪蛋白基因mRNA在健康组与乳房炎组的表达变化收集0:00、8:00与20:00共3个时间点健康组和乳房炎组每头奶牛的乳汁样品各100 mL左右,密封并做好标记后置于低温状态保存备用;将采集的牛乳于低温离心机1 000 r/min离心10 min,除去浓稠的上层乳脂,保留下层浑浊液体(约 10 mL),加入等体积1 × PBS进行清洗,低温离心机1 000 r/min离心10 min,弃上层液体并保留下层少量浑浊液体,此步骤可重复多次,直至管内液体澄清,弃上清;将上述得到的沉淀转移至新的离心管中,12 000 r/min离心10 min后弃去上清;后续步骤同1.8。
1.10 数据的统计与分析本试验利用Excel 2016、GraphPad Prism 8.0等软件对数据进行整理和统计学分析。所有处理的数据均以“平均值 ±标准误”表示,并利用t检验或Two-way ANOVA进行差异统计学分析。P<0.05被认为具有显著性差异。组间比较:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1;时间点比较:#表示P<0.05,##表示P<0.01,###表示P<0.001,####表示P<0.000 1。
2 结果
2.1 健康组和乳房炎组奶牛日产奶量与乳成分的差异如图1A、G所示,4%氢氧化钠凝乳法检测健康组和乳房炎组的乳汁样品,结果显示健康组乳汁无明显变化,乳房炎组乳汁呈现透明状,并有凝乳块形成;DHI检测结果显示健康组与乳房炎组奶牛乳汁的SCC具有显著性差异(P<0.000 1),并且乳房炎组奶牛乳汁的SCC显著高于100万个/mL。上述数据表明本研究采集的样品准确无误。如图1B~H所示,健康组和乳房炎组奶牛日产奶量平均值分别为39.142和34.840 kg,乳房炎组奶牛的日产奶量显著低于健康组(P<0.05)。DHI检测结果显示健康组与乳房炎组奶牛乳汁的乳脂率、乳蛋白率、乳糖率、总固体、SCC及尿素氮含量有显著性差异(P<0.001);相较于健康组,乳房炎组奶牛的乳脂率、乳糖率、总固体与尿素氮比率在3个时间点均降低;乳房炎组的乳蛋白率和SCC相较于健康组在3个时间点均升高,SCC差异显著(P<0.01);乳房炎组的乳糖率在8:00显著低于20:00(P<0.05),健康组的尿素氮在8:00显著低于20:00(P<0.05)。在3个时间点,健康组的乳脂率和总固体差异不显著,但呈现先下降后上升的变化趋势;乳房炎组的乳脂率、总固体和尿素氮在3个时间点差异不显著,均呈现先下降后上升的变化趋势。上述结果表明,乳房炎可导致奶牛日产奶量与乳品质下降;同时,检测结果提示奶牛乳成分含量具有昼夜差异。
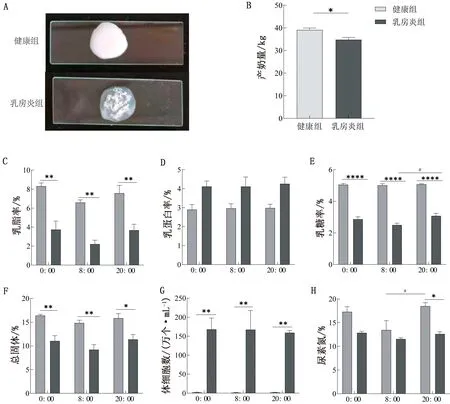
A.氢氧化钠凝乳实验;B.日产奶量;C.乳脂率;D.乳蛋白率;E.乳糖率;F.总固体;G.体细胞数;H.尿素氮。*表示P<0.05,**表示P<0.01,***表示P< 0.001,****表示P<0.000 1;#表示P<0.05,##表示 P<0.01,###表示 P<0.001,####表示 P<0.000 1;*代表组间比较,#代表时间比较。下同

表1 实时荧光定量PCR引物信息
2.2 乳房炎对奶牛血浆葡萄糖和胆固醇含量的影响通过酶联免疫吸附测定(ELISA)试剂盒检测3个时间点健康组和乳房炎组奶牛血浆样品中的葡萄糖和总胆固醇含量,如图2所示,乳房炎组的葡萄糖含量在3个时间点均显著高于健康组(P<0.000 1),同时健康组葡萄糖含量呈现下降的趋势,而乳房炎组呈现先下降再上升的变化趋势。乳房炎组奶牛血浆中总胆固醇含量显著低于健康组(P<0.000 1),健康组与乳房炎组奶牛血浆的胆固醇含量均呈现先上升再下降的趋势,并且在8:00时含量最高。
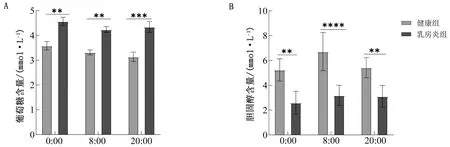
A.葡萄糖含量;B.胆固醇含量
2.3 健康组和乳房炎组奶牛血浆氧化应激水平的变化通过ELISA试剂盒检测奶牛血浆中氧化应激相关因子(β-N-乙酰氨基葡萄糖苷酶活力、丙二醛含量、谷胱甘肽过氧化物酶活力、过氧化氢酶活力、过氧化氢含量、超氧化物歧化酶活力和总抗氧化能力)的变化,结果如图3所示。与健康组相比,乳房炎组奶牛的β-N-乙酰氨基葡萄糖苷酶活力和过氧化氢含量升高且差异显著(P<0.000 1),乳房炎组血浆中的β-N-乙酰氨基葡萄糖苷酶活力在0:00和8:00相较于健康组差异显著(P<0.05),过氧化氢含量在0:00和20:00差异显著(P<0.05)。健康组奶牛血浆中的丙二醛含量在3 个时间点均不具有显著性差异,乳房炎组的丙二醛含量在0:00和8:00以及8:00和20:00差异显著(P<0.01)。过氧化氢酶活力在2组中差异显著(P<0.01);在0:00与20:00,乳房炎组的过氧化氢酶活力均显著升高于健康组(P<0.05,P<0.000 1),乳房炎组奶牛在3 个时间点均差异显著(P<0.05)。
3个时间点谷胱甘肽过氧化物酶活力的变化与过氧化氢酶活力的变化趋势相似。总抗氧化能力在健康组和乳房炎组的3个时间点均呈现下降趋势,且组间差异显著(P<0.05)。乳房炎组血浆中的超氧化物歧化酶活力在3个时间点具有高于健康组的趋势,但是差异不显著。上述结果表明,健康组和乳房炎组奶牛血浆的氧化应激水平具有昼夜差异,乳房炎组奶牛的氧化与抗氧化水平失衡,总抗氧化能力下降。
2.4 健康组和乳房炎组奶牛乳汁中氧化应激水平的变化采用ELISA试剂盒检测奶牛乳汁的β-N-乙酰氨基葡萄糖苷酶活力、丙二醛含量和过氧化氢酶活力,结果如图4所示。在3个时间点,乳房炎组的β-N-乙酰氨基葡萄糖苷酶活力显著高于健康组(P<0.000 1),且差异显著。丙二醛含量与β-N-乙酰氨基葡萄糖苷酶活力的变化趋势完全相反,健康组奶牛乳汁中的丙二醛含量显著高于乳房炎组(P<0.01)。健康组奶牛乳汁中的丙二醛含量在3个时间点呈现先下降再上升的昼夜变化(P<0.001),乳房炎组的丙二醛含量在3个时间点无显著性差异。
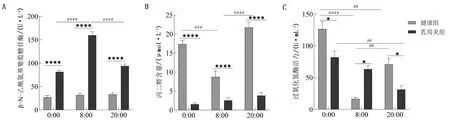
A.β-N-乙酰氨基葡萄糖苷酶活力;B.丙二醛含量;C.过氧化氢酶活力
健康组奶牛乳汁中的过氧化氢酶活力在3个时间点呈现先下降再上升的昼夜变化(P<0.01),而乳房炎组在3个时间点呈现持续下降的变化;相较于健康组,乳房炎组奶牛乳汁中的过氧化氢酶活力在0:00和20:00均降低,且差异显著(P<0.05),而在8:00的变化与之相反且差异显著(P<0.05)。上述结果表明,健康组和乳房炎组奶牛乳汁中的氧化应激水平具有昼夜差异,且乳房炎组奶牛的丙二醛含量和过氧化氢酶活力均降低,提示其抗氧化能力下降。
2.5 奶牛血液中炎性相关因子与生物钟基因mRNA在健康组与乳房炎组的表达变化通过实时荧光定量PCR检测健康组和乳房炎组奶牛血液中的炎性因子和生物钟基因mRNA的表达变化,结果如图5所示。

A.炎性相关因子mRNA的表达;B.生物钟基因mRNA的表达
乳房炎组中炎性相关因子IL-8、IL-1β与IL-6 mRNA的表达量均高于健康组,其中IL-8与IL-β基因的表达组间差异显著(P<0.05),抗炎因子IL-10 mRNA的表达变化与之相反,在乳房炎组中的表达量显著下降(P<0.000 1)。健康组和乳房炎组奶牛血液中生物钟基因NR1D1与CRY1 mRNA的表达变化组间差异显著(P<0.05)。健康组奶牛血液中的生物钟基因NR1D1、CRY1、PER2、RORα、DBP在3个时间点均呈现先下降再上升的趋势,且具有昼夜差异;乳房炎组中血液生物钟基因CRY1、RORα、BMAL1、DBP的表达变化依然遵循先下降再上升的变化趋势,但NR1D1的表达水平与健康组完全相反,PER2的表达持续下降,在20:00时达到最低。上述结果表明,奶牛血液中的炎性相关因子和生物钟基因的表达具有差异,并提示奶牛血液中生物钟基因的表达和乳房炎的发生发展具有潜在联系。
2.6 奶牛乳汁中炎性相关因子、生物钟基因与酪蛋白基因mRNA在健康组与乳房炎组的表达变化如图6所示。奶牛乳汁中的炎性因子存在昼夜变化,与健康组相比,乳房炎组中促炎因子CCL5、IL-1β、IL-8、IL-6、TNF-α的表达均显著升高(P<0.01),抗炎因子IL-10显著降低(P<0.000 1)。生物钟基因NR1D1、BMAL1、DBP显著低于健康组(P<0.000 1),酪蛋白相关基因CSN1S1、CSN2、CSN3均显著低于健康组(P<0.001)。在0:00、8:00与20:00时健康组中酪蛋白基因CSN1S1、CSN2、CSN3在0:00处于最低,之后逐渐升高,在20:00达到最高。上述结果表明,奶牛乳汁中的炎性相关因子及生物钟基因表达具有昼夜差异,提示乳汁中生物钟基因的表达与乳房炎的发生发展存在潜在联系。
3 讨论
乳房炎发病率高、且易反复发作,可严重损害奶牛养殖场的经济效益。目前全球2.2亿头奶牛中约有1/3患乳房炎[12],我国奶牛乳房炎发病率高达60%~70%,每年损失约30亿元人民币[13]。乳房炎引起的奶牛泌乳性能下降是造成养殖业经济损失的主要因素[14]。因此,探究奶牛乳房炎的发生发展规律,并制定合理的防治措施,是确保奶牛养殖业健康发展的前提条件。
目前,奶牛泌乳性能、氧化应激水平以及生物钟基因的表达变化与奶牛乳房炎的发生发展过程是否具有一定联系,尚不清楚。本研究通过测定健康组和乳房炎组奶牛一天的3个时间点(0:00、8:00与20:00)乳汁和血液样品的不同指标并进行分析。不同时间点乳成分检测结果显示,在健康组中,尿素氮在8:00和20:00差异显著(P<0.05),乳脂率和总固体含量具有昼夜差异,且在8:00含量最低。这些结果提示奶牛乳成分具有昼夜节律性变化,这为实际生产中根据对不同乳成分的需求制定合理的挤奶时间提供了前期理论基础。同时,试验结果显示乳房炎组的乳脂率显著低于健康组,造成这个结果的原因可能是临床型乳房炎奶牛的乳腺组织受损,抑制乳腺上皮细胞的乳脂合成,进而导致乳脂率降低。
血液中的葡萄糖是机体各组织器官正常代谢活动的能量来源。反刍动物血液中的葡萄糖主要来自于两个方面:一是由瘤胃发酵产生的丙酸异生;二是由饲料蛋白质产生的糖异生[15]。本研究结果表明,乳房炎组奶牛血液中的葡萄糖含量显著高于健康组,可能是由于乳房炎造成的奶牛瘤胃代谢紊乱,葡萄糖与糖原转化受阻。胆固醇是维持细胞结构所必需的基本分子,对各种正常的生物功能至关重要,胆固醇的升高与很多疾病的发生密切相关,包括肝硬化、黏液性水肿、肾病综合征、胆总管阻塞、乳房炎等[16]。本研究中发现乳房炎组胆固醇的含量显著低于健康组,这可能反映在能量负平衡条件下乳房炎奶牛机体对能量的消耗增加[17],或由于机体生理功能出现障碍,胆固醇合成减少,从而导致脂蛋白含量降低[18]。另外,通过比对不同时间点血液中葡萄糖与胆固醇含量的变化,我们发现健康组奶牛血液一天中胆固醇的变化幅度较大,且这种变化幅度伴随乳房炎的发生而减弱。可能是由于乳房炎组奶牛机体处于应激状态并且代谢途径受阻,导致患乳房炎奶牛对日粮中脂类物质的吸收和转化受阻,进而致使胆固醇合成量减少且变化幅度减弱。
氧化应激是指由于机体内的活性氧自由基ROS(reactive oxygen species)和活性氮自由基RNS(reactive nitrogen species)失衡[19],生成大量的氧化中间产物,使机体处于能量负平衡状态。哺乳动物体内发生氧化应激后,机体的生理状况和代谢水平发生急剧改变,导致动物机体对疾病的抵御能力下降产生多种慢性疾病。奶牛发生氧化应激可影响奶牛的生长发育和生产性能。氧化应激对乳房炎症有重要的调控作用。奶牛在泌乳初期由于活性氧生成增加导致氧化和抗氧化作用失衡,致使机体免疫应答能力下降,奶牛乳腺组织更易被病菌侵袭并诱发乳房炎[20]。在隐性乳房炎中,血液中抗氧化水平显著降低,但红细胞中脂质过氧化物水平升高[21]。超氧化物岐化酶(SOD)、血浆过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)是哺乳动物体内的抗氧化酶,参与调控机体的氧化和抗氧化平衡。SOD通过歧化超氧阴离子形成的H2O2解除超氧阴离子对细胞的损伤作用[22]。发生氧化应激时,自由基攻击膜脂蛋白和多不饱和脂肪酸时可产生155种含氧化合物,其中包括丙二醛(MDA)和共轭二烯在内的醛类化合物[23]。一般通过同时检测MDA和SOD来反映出细胞的氧化损伤程度。NAG溶菌酶是检测乳腺上皮细胞的完整性的标志之一[24]。本研究结果显示乳房炎组奶牛乳汁中的NAG含量显著高于健康组,且在3个时间点差异显著,表明NAG的含量可能受到生物钟的调控。乳房炎组的CAT与GSH-Px含量在3个时间点差异显著,SOD无统计学差异,但其变化趋势与CAT、GSH-Px一致,表明机体内抗氧化酶的变化与生物钟密切相关。在本研究中,乳房炎组的总抗氧化能力降低,表明乳房炎组奶牛消除氧自由基的能力下降,体内的氧化与抗氧化作用处于失衡状态,且过氧化反应增强,这会导致机体逐渐发展为亚健康状态,进而导致日产奶量降低影响经济效益。
近年来,关于哺乳动物生物钟的研究越来越多。有研究指出奶牛乳腺的分泌活动受到生物钟的调控[25],奶牛妊娠晚期暴露于慢性光-暗相移环境下可能导致奶牛的产奶量下降[26]。胡良宇[2]的研究表明敲低PER2基因可以明显促进分娩后小鼠的乳腺腺泡生长发育,并且提高酪蛋白CSN1S1、CSN2和CSN3表达量。另外,有研究指出生物钟蛋白BMAL1、CRY、REV-ERB可影响炎症细胞因子与趋化因子的表达,从而调控机体的免疫功能[27]。在白细胞亚群中,包括先天性和适应性免疫细胞,如单核细胞、自然杀伤细胞(NK)、中性粒细胞、嗜酸粒细胞等,都发现了生物钟的节律性振荡[28]。生物钟核心基因NR1D1缺失会影响神经元的正常生理功能,导致小鼠海马区的促炎因子增加[29]。本研究检测了不同时间点健康组和乳房炎组奶牛血液和乳汁中炎性相关因子、生物钟基因以及酪蛋白基因的表达变化,结果表明,在血液中,乳房炎组的促炎因子IL-1β、IL-8、IL-6较健康组升高;CCL5、IL-1β、IL-8、IL-6、抗肿瘤因子(TNF-α)在健康组和乳房炎组中的含量改变且呈现昼夜差异,生物钟基因NR1D1的表达在健康组和乳房炎组中具有显著性差异,且在0:00显著降低。在乳汁中,乳房炎组的CCL5、IL-1β、IL-8、IL-6、TNF-α mRNA表达水平显著高于健康组,且具有昼夜差异;CSN1S1、CSN2、CSN3的mRNA表达水平均显著低于健康组,且随时间变化不断上升,在20:00达到最高;NR1D1、BMAL1、DBP显著低于健康组;在健康组中,生物钟基因NR1D1、DBP的mRNA的表达水平与酪蛋白基因CSN1S1、CSN2、CSN3呈现相反趋势。这些结果表明,由于奶牛乳房发生的炎症激活了机体的免疫系统,从而导致乳房炎组奶牛血液和乳汁中炎性相关因子发生改变,而奶牛乳汁中的体细胞主要为白细胞,白细胞炎性因子含量的变化可能引起生物钟基因表达量发生改变[27]。上述结果提示,生物钟可能参与炎症反应的发生发展且与酪蛋白基因的表达变化密切相关,进一步提示生物钟基因(NR1D1、BMAL1、DBP)的表达变化与奶牛乳房炎的发生发展具有潜在联系,乳体细胞中生物钟基因的表达变化或可作为奶牛乳房炎诊断的潜在指标。
