ISG15基因敲除增加小鼠对脑心肌炎病毒(EMCV)的易感性
2023-11-27何文峰李隆熙董靓靓杨国庆常洪涛刘慧敏
何文峰,李 琛,李隆熙,董靓靓,杨国庆,常洪涛,刘慧敏*
(1.河南农业大学 生命科学学院,河南 郑州 450002;2.河南农业大学 动物医学学院,河南 郑州 450002)
脑心肌炎病毒(encephalomyocarditis virus,EMCV)可引起动物的脑炎和心肌炎。该病毒属于微RNA病毒科心病毒属[1-2]。EMCV感染小鼠在1周内出现后肢瘫痪和心肌炎,随后死亡,表明小鼠在EMCV感染过程中,其中枢神经系统受到了损害[3]。EMCV在世界不同地区的许多野生和家养动物中被检测到[4-5],它可能是一种潜在的人畜共患病病毒,可以通过摄入被污染的食物、水和患病的尸体传播[6-7],导致心肌炎、糖尿病以及生殖和神经障碍。猪感染EMCV后常呈现急性的局灶性心肌炎并猝死,临床表现为厌食、麻木、麻痹、瘫痪或呼吸困难,妊娠母猪感染后出现流产、死胎或木乃伊胎,仔猪断奶前患病死亡率可以达到100%[8-10]。
干扰素刺激基因15(interferon-stimulated gene 15,ISG15)是干扰素(interferon,IFN)诱导的具有抗病毒活性的类泛素蛋白,是ISGs中被诱导最强烈、最迅速的ISGs之一,在宿主固有免疫和获得性免疫应答中发挥重要作用[11]。ISG15作为一种关键的ISGs,在对抗多种病毒入侵过程中发挥着重要作用。近年来,对ISG15抗病毒复制的作用有越来越多的研究[12-13]。然而,ISG15在EMCV复制、发病机制和宿主反应中的作用尚不清楚。
本实验室前期研究发现ISG15能明显抑制PRV复制,但是ISG15缺失对RNA病毒易感性的影响尚未见有报道,因此,本试验应用CRISPR/Cas9基因编辑技术,构建ISG15基因敲除的小鼠,通过分析EMCV感染后小鼠存活率、病毒滴度、炎性因子表达等,探究敲除ISG15基因对EMCV复制的影响,以期为进一步研究ISG15抑制EMCV复制的分子机制提供新思路。
1 材料与方法
1.1 试验材料乳仓鼠肾细胞(BHK-21)、EMCV由实验室保存;SPF级ISG15-/-C57BL/6N小鼠,7周龄,体质量20~22 g,SPF级野生型C57BL/6N小鼠,7周龄,体质量20~22 g,实验动物购自赛业生物科技有限公司;RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser、TB Green®Premix Ex TaqTMⅡ购自宝日医生物技术有限公司;Lipofectamine 3000购自赛默飞世尔科技公司;ELISA试剂盒购自酶免实业有限公司;细胞冻存液购自赛文创新科技有限公司;无水乙醇、二甲苯、中性树胶购自国药集团化学试剂有限公司;HE染色套盒购自赛维尔生物科技有限公司。
1.2 引物设计与合成通过NCBI数据库查找各目的基因mRNA序列,应用Primer-Blast设计RT-qPCR引物(表1)。

表1 引物序列
1.3 过表达ISG15对EMCV复制的影响BHK-21细胞转染ISG15质粒与空载对照,按照lipofectamine3000说明书操作,12 h后感染EMCV,分别在0,12,24,36 h时提取RNA和上清,将RNA反转录后利用荧光定量PCR检测VP1的转录水平。反应体系10 μL:TB Green®Premix Ex TaqTMⅡ 5 μL,上、下游引物(0.2 μmol/L)各0.4 μL,cDNA 1 μL,ddH2O 3.2 μL。反应条件:95℃预变性30 min;95℃变性5 s,60℃退火和延伸34 s,共40个循环。并选取β-actin作为内参基因;上清反复冻融3次后离心,用实验室前期建立的病毒噬斑法检测病毒滴度[14]。
1.4 EMCV感染小鼠后存活率、体质量变化及临床症状将小鼠分为ISG15-/-小鼠组(n=10)和野生型小鼠组(n=10),腹腔注射100 μL感染剂量为1×105TCID50的EMCV,每天记录2组小鼠的体质量、死亡情况和临床症状。
1.5 EMCV感染小鼠后病毒滴度的变化2组小鼠(n=6)腹腔注射EMCV,在感染后第4天取脑组织和心脏组织检测病毒滴度。将小鼠的组织剪碎,加入PBS研磨成匀浆状,冻融3次,离心取上清液后,通过病毒噬斑法检测组织中的病毒滴度。
1.6 EMCV感染小鼠后炎性因子的变化2组小鼠腹腔注射EMCV,在感染后第4天采血,并取脑组织和心脏组织。脑组织和心脏组织提取RNA,按1.3方法荧光定量PCR检测IL-1β、IL-6和TNF-α的转录水平;血液离心后取上清,ELISA试剂盒检测IL-1β、L-6和TNF-α的表达,具体步骤参照说明书。
1.7 HE染色分析脑组织与心脏组织的病理学变化感染后4 d,将2组小鼠给予安乐死,取脑组织和心脏组织,4%多聚甲醛固定48 h,脱水后石蜡包埋,并用苏木精-伊红染液中染色,中性树胶封片,显微镜镜检,图像采集分析。
1.8 统计学分析所有数据采用GraphPad Prism数据分析统计软件进行分析作图,结果中小鼠体质量变化曲线值、病毒滴度、炎症因子浓度以及转录水平以均值±标准误表示。P<0.05时认为差异有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果
2.1 过表达ISG15对EMCV复制的影响为了探究ISG15对EMCV复制的影响,本试验通过转染ISG15真核表达质粒,12 h后感染EMCV(MOI=1),24 h后提取RNA与上清。荧光定量PCR结果如图1A所示,病毒基因VP1转录水平随着EMCV的复制逐渐升高,在不同时间段过表达ISG15后病毒基因VP1转录水平均显著下降(P<0.05),病毒噬斑也出现了类似的结果(图1B)。结果表明,ISG15基因可以抑制EMCV的复制。

A.荧光定量PCR检测过表达ISG15后VP1的转录水平;B.病毒噬斑检测过表达ISG15后EMCV的病毒滴度;C.EMCV感染24 h病毒噬斑结果图(1.表示细胞对照;2~6.表示病毒4倍梯度稀释);D.EMCV感染过表达ISG15后病毒噬斑结果图(1.表示细胞对照;2~6.表示病毒4倍梯度稀释)
2.2 EMCV感染小鼠后存活率、体质量变化及临床症状为了进一步探究ISG15在体内对EMCV复制的影响,EMCV感染ISG15敲除(ISG15-/-)小鼠和野生型(WT)小鼠,检测感染后7 d内野生型小鼠和ISG15-/-小鼠的生存率和体质量变化,并记录小鼠发病情况。如图2A所示,感染EMCV之前ISG15-/-小鼠和野生型小鼠状态均正常,而ISG15-/-小鼠在EMCV感染后3 d出现精神不振,离群、动作缓慢、后肢瘫痪等症状(图2C),第4天开始出现死亡,第6天病死率为100%;而野生型小鼠在感染后第4天才出现精神萎靡、被毛杂乱、动作迟缓等症状(图2C),第5天开始出现死亡,到第7天的病死率为75%。随着症状加重,ISG15-/-小鼠在第3天以后体质量明显下降,并且持续下降,而野生型小鼠在第5天后又逐渐恢复体质量(图2B)。这些结果说明ISG15-/-小鼠对EMCV更易感。

A.生存率;B.体质量变化;C.临床症状
2.3 ISG15基因敲除小鼠对脑组织和心脏组织病毒滴度的影响野生型小鼠和ISG15-/-小鼠感染后4 d取脑和心脏组织检测其病毒滴度。ISG15-/-小鼠脑组织的病毒滴度显著高于野生型小鼠(P<0.05)(图3A),ISG15-/-小鼠心脏的病毒滴度也显著高于野生型小鼠(P<0.05)(图3B)。

A.病毒噬斑检测脑组织病毒滴度;B.病毒噬斑检测心脏组织病毒滴度
2.4 ISG15基因敲除小鼠对炎性因子转录水平的影响一般病毒感染会引起细胞因子风暴,也是机体抗感染的一种表现。我们进一步通过荧光定量PCR检测野生型小鼠和ISG15-/-小鼠脑中IL-1β、IL-6和TNF-α的转录水平。结果显示,小鼠脑组织和心脏组织的IL-1β、IL-6和TNF-α转录水平均显著高于野生型小鼠(图4A~F)。
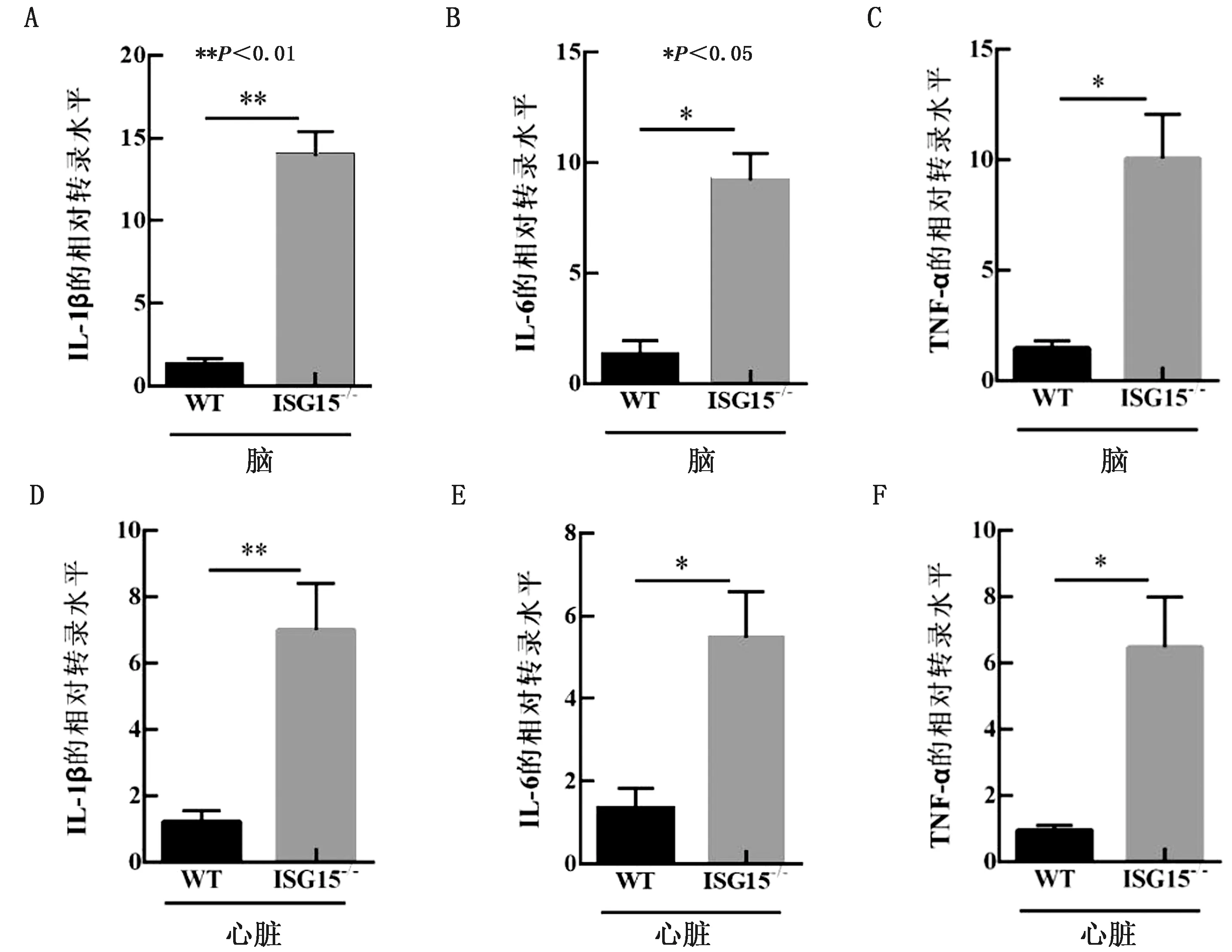
A~C.荧光定量PCR检测脑组织中IL-1β、IL-6和TNF-α的转录水平;D~F.荧光定量PCR检测心脏中IL-1β、IL-6和TNF-α的转录水平
2.5 ISG15基因敲除小鼠对炎性因子蛋白表达的影响ELISA检测野生型小鼠和ISG15-/-小鼠血清中IL-1β、IL-6和TNF-α蛋白水平,结果显示,ISG15-/-小鼠的IL-1β、IL-6和TNF-α蛋白表达水平均显著高于野生型小鼠(图5A~C)。这进一步表明ISG15-/-小鼠比野生型小鼠出现更严重的炎症反应,说明ISG15敲除促进EMCV感染的致病性。
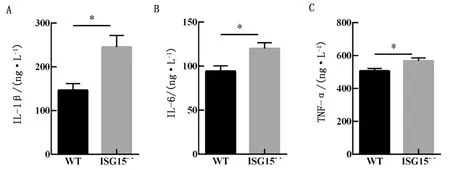
A~C.ELISA检测血清中IL-1β、IL-6和TNF-α的蛋白水平
2.6 HE染色分析脑与心脏组织病理变化脑心肌炎病毒感染引起的脑炎和心肌炎是导致动物死亡的关键因素[10]。为了检测野生型小鼠和ISG15-/-小鼠的脑炎与心肌炎程度,在感染后4 d对脑组织和心脏进行了组织病理学分析。如图6A~D所示,ISG15-/-小鼠与野生型小鼠相比,心肌细胞出现大面积细胞坏死,组织结构异常,脑组织中神经细胞变性坏死,有大量炎性细胞浸润,并严重充血。剖检发现ISG15-/-小鼠与野生型小鼠相比,脑和心脏都严重充血(图6I~L)。
3 讨论
EMCV是一种潜在的人畜共患病病原体,该病毒广泛分布于世界各国,给全球的养猪业造成巨大的经济损失[15-17],探索有效预防和治疗脑心肌炎的方法显得尤为重要。大量研究表明ISG15具有抗病毒功能,但其作用因宿主和病毒种类而不同[18-19]。ISG15调控EMCV复制的机制还未见报道,在大多数研究中,啮齿动物常被作为动物模型进行EMCV相关研究[20]。因此,本试验通过体内、体外试验探究ISG15对EMCV复制的作用。
本试验前期将ISG15重组质粒转染至Vero细胞后感染EMCV,结果发现ISG15过表达后病毒基因VP1转录水平和病毒滴度均显著低于对照组,说明体外过表达ISG15可抑制EMCV的复制。NAI等[21]研究发现过表达ISG15可以抑制日本脑炎病毒(Japanese encephalitis virus,JEV)的复制。在人类细胞中敲低ISG15表达后促进A型流感病毒(influenza virus,IAV)的复制,表明ISG15可直接拮抗病毒复制[22]。LI等[23]研究表明ISG15可以抑制CSFV复制。这些结果与本试验得出ISG15抑制EMCV复制的结果一致。
为了进一步研究ISG15在体内是否影响EMCV的复制,本试验通过ISG15-/-小鼠和野生型小鼠感染EMCV的相关研究,发现与野生型小鼠相比,ISG15-/-小鼠更容易感染EMCV,表现为死亡率升高,体质量下降更明显。通过病毒噬斑检测脑组织和心脏的病毒滴度,结果表明ISG15-/-小鼠的脑组织和心脏组织的病毒滴度显著高于野生型小鼠,说明敲除ISG15基因在体内促进EMCV的复制。ISG15敲除小鼠的早期研究表明,感染了IAV的ISG15敲除小鼠的死亡率有所增加[24]。PERNG等[13]研究发现在B型流感病毒(influenza B virus,IBV)感染期间,野生型小鼠的病毒载量在整个感染过程中保持非常低的水平。同样,ISG15基因敲除小鼠感染EMCV后体质量显著下降,病毒载量显著高于野生型小鼠。综上所述,这些结果表明ISG15在体外和体内均抑制EMCV的复制。
本试验检测了感染EMCV小鼠血清中炎性因子IL-1β、IL-6、TNF-α的转录水平和蛋白表达,发现ISG15-/-小鼠体内与炎症相关的3种细胞因子IL-1β、IL-6和TNF-α转录与表达均显著高于野生型小鼠,这个结果与脑炎和心肌炎的病症相吻合。观察感染EMCV小鼠脑组织与心脏组织病理学切片发现,与WT小鼠相比,ISG15-/-小鼠表现出更严重的心肌炎和脑炎的症状,主要为心肌细胞出现大面积坏死、弥漫性炎症和脑组织的神经细胞变性坏死及充血现象。有研究表明脑损伤主要是血管周围单核细胞浸润,心肌损伤主要表现为心肌坏死和细胞浸润[10],与本试验结果一致。这些组织病理学变化为观察野生型小鼠感染EMCV后出现的严重神经症状,包括后肢瘫痪、精神沉郁、动作缓慢等提供了形态学数据[25]。结果表明,ISG15敲除提高了EMCV的感染力以及复制。
通过RT-qPCR和病毒噬斑的方法初步发现在体外ISG15显著抑制EMCV的复制。进一步通过病毒噬斑、RT-qPCR、ELISA、HE染色等方法发现腹腔注射EMCV后,ISG15敲除小鼠组织的病毒滴度、死亡率、炎性因子转录与表达均高于野生型小鼠,说明在体内ISG15也具有抑制EMCV复制的作用。本试验为ISG15在体外和体内均抑制EMCV复制提供了证据,为EMCV感染提供了新的宿主细胞免疫治疗靶点。
