黄芩素-冰片抗脑缺血后内皮功能障碍的作用及机制
2023-11-27贺一凡张行行唐长杰崖壮举周子烨韩朝军刘继平史永恒
贺一凡,张行行, 2,唐长杰,陈 旭,崖壮举,周子烨,王 斌,韩朝军,刘继平,史永恒*
黄芩素-冰片抗脑缺血后内皮功能障碍的作用及机制
贺一凡1,张行行1, 2,唐长杰1,陈 旭1,崖壮举1,周子烨1,王 斌1,韩朝军1,刘继平1,史永恒1*
1. 陕西中医药大学药学院,陕西 咸阳 712046 2. 商洛市中医医院,陕西 商洛 726000
探究黄芩素、冰片及配伍对脑基底血管张力的影响和抗脑缺血后脑基底血管内皮功能障碍的作用及机制。采用离体血管环实验分别考察累积浓度的黄芩素、冰片及不同比例配伍对静息状态和内皮素-1(endothelin-1,ET-1)、血栓素A2类似物(U46619)、5-羟色胺(5-hydroxytryptamine,5-HT)预收缩的脑基底血管环张力的影响。利用线栓法构建局灶性脑缺血模型,给予不同比例的黄芩素-冰片,进行神经功能评分;采用红四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染色观察脑梗死体积;荧光染色法观察缺血侧皮层CD34表达;检测缺血侧皮层一氧化氮(nitric oxide,NO)水平;苏木素-伊红(HE)染色观察脑基底动脉血管内皮完整性;Western blotting检测脑基底动脉内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达;ELISA法检测血清中炎性因子水平。黄芩素、冰片和各比例配伍组对基础状态血管环张力无明显影响,但能明显舒张由ET-1、U46619、5-HT预收缩的脑基底血管环(<0.05、0.01),且随着浓度增大,黄芩素-冰片(1∶3)对ET-1、U46619预收血管环的舒张作用具有明显的优势。大脑中动脉局灶性梗死(middle cerebral artery occlusion,MCAO)术后大鼠神经功能评分显著升高(<0.01),药物干预24 h后,神经功能评分不同程度降低(<0.01);与假手术组比较,模型组大鼠脑梗死率显著升高(<0.01),脑基底动脉内皮损伤严重、断裂,eNOS表达显著降低(<0.05),iNOS表达显著升高(<0.01),缺血侧皮层中CD34表达升高(<0.01),NO水平显著降低(<0.01),血清中白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平明显升高(<0.01),转化生长因子-β(transforming growth factor-β,TGF-β)水平明显降低(<0.01);而黄芩素-冰片能不同程度明显降低大鼠脑梗死率(<0.01),改善脑基底动脉内皮状态,升高动脉中eNOS表达、缺血侧皮层中NO、CD34表达和血清中TGF-β表达(<0.05、0.01),下调脑基底动脉中iNOS表达和血清中IL-1β、IL-6、TNF-α水平(<0.05、0.01)。黄芩素、冰片及配伍可抑制由ET-1、U46619和5-HT诱发的血管收缩,且黄芩素-冰片(1∶3)的舒张作用优于其余各组,其可抑制过度炎性反应,上调缺血后微血管eNOS表达,下调iNOS表达,促进NO合成和分泌,发挥抗缺血区微血管内皮功能障碍和促进恢复,改善微循环,减轻神经损伤的作用。
脑缺血;黄芩素;冰片;内皮功能障碍;血管环
脑卒中是一个危害性极大的综合性神经疾病,主要是由于血管栓塞形成或血管性疾病引发的大脑局部血流减少或缺失[1],现代社会脑缺血的发病率逐年激增,虽然近几年发达地区脑卒中的发病率首次出现了下降,但我国脑卒中患者的发病率仍然在上升,并有年轻化趋势,我国脑卒中现患人数高居世界首位,给社会造成了非常沉重的负担[2]。因此,如何科学、有效地防治脑缺血的发生发展已经是医学研究的迫切需要。
正常生理情况下,内皮细胞可合成释放多种血管活性物质,维持血管各项生理功能[3]。脑缺血发生后,氧糖供应与消耗紊乱,脑组织产生梗死,而梗死灶边缘产生多种复杂效应,激活脑内免疫细胞,释放大量炎性介质、活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS),引发持续的炎症反应和氧化应激,加重能量供应障碍,损伤内皮细胞,引起内皮细胞体积缩小、胞间间隙变大,引发血管活性物质紊乱,引发微血管挛缩和血栓形成进一步加重缺血性损伤[4]。研究发现,缺血早期梗死边缘任有恢复的可能,因此如何在缺血早期针对内皮功能障碍进行干预,改善血管状态,改善微循环成为预防和治疗脑缺血的一个新的靶点和突破[5]。
中药在治疗此类复杂疾病时表现出独特优势,多数中药在不同时间段对脑缺血都表现出了良好的治疗作用[6]。近年来多项研究发现黄芩素、冰片具有舒张血管、保护血管内皮和改善内皮功能障碍的作用,但对二者配伍使用的研究较少,因此,本研究拟通过离体肌张力描记技术和建立脑缺血模型大鼠,探讨黄芩素-冰片不同比例配伍对脑基底血管的舒张作用及改善脑缺血后内皮功能障碍的作用及机制。
1 材料
1.1 动物
SPF级雄性SD大鼠100只,体质量(220±20)g,购自成都达硕实验动物有限公司,动物许可证编号SCXK(川)2020-030。饲养于陕西中医药大学中药药理实验动物房内,温度23~25 ℃,相对湿度45%~55%,自由摄食与饮水,昼夜各半,适应性饲养1周。实验过程中对动物的处置符合《实验动物福利伦理审查指南》(GB/T 35892-2018)《关于善待实验动物的指导性意见》和陕西中医药大学伦理委员会规定和相关管理条例,动物实验符合3R原则,本实验通过动物实验伦理审查(伦理批号SUCMDL20220301001)。
1.2 药品与试剂
黄芩素(质量分数≥95%,批号S25956)、冰片(质量分数≥98%,批号S47379)、红四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC,质量分数≥98%,批号L28J12S139144)均购自上海源叶生物科技有限公司;戊巴比妥钠(批号061222)购自北京化学试剂公司;PBS溶液(批号BB0830)、4%组织固定液(货号BB0808)均购自陕西中晖赫彩生物医药科技有限公司;线栓(批号MSRC40B200PK50)购自瑞沃德生命科技有限公司;血栓素A2类似物(U46619,质量分数≥98%,批号GC132051)购自美国GLPBIO公司;5-羟色胺(5-hydroxytryptamine,5-HT,批号SLCF8396)、内皮素-1(endothelin-1,ET-1,批号088M4849V)均购自美国Sigma公司;氯化钠(批号202012C8)、磷酸二氢钠(批号20220302)、无水氯化钙(批号20210506)、碳酸氢钠(批号20220102)均购自天力化学试剂有限公司;氯化镁(批号20190103)、葡萄糖(批号20190504)均购自大茂化学试剂厂;内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)一抗(批号ab215717)购自英国Abcam公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)一抗(批号BS-0162R)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(批号BS-2188R)均购自北京博奥森生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号YC0403)购自美国MP公司;BCA蛋白定量试剂盒(批号P0028)、一氧化氮(nitric oxide,NO)试剂盒(批号S0021)、苏木素-伊红(HE)染色试剂盒(批号C0105)均购自碧云天生物技术研究所;鼠抗兔IgG二抗(批号20207076s)购自美国CST公司;白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(批号0047R2)、IL-6 ELISA试剂盒(批号0190R2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号0194R2)、转化生长因子-β(transforming growth factor-β,TGF-β)ELISA试剂盒(批号0181R1)均购自江苏酶免实业有限公司;TRIzol试剂(批号262305)购自美国Thermo Fisher Scientific公司。
1.3 仪器
Exicycler 96荧光定量PCR仪(韩国Bioneer公司);DMT 630M型离体微血管张力测定系统(丹麦DMT公司);肌张力描记记录系统(澳大利亚ADI公司);电泳仪、转膜仪及化学发光系统(美国Bio-Rad公司);NW10LVF型超纯水系统(Heal Force公司);L420型离心机(北京六一生物科技有限公司);DP73型显微镜拍照系统(日本Olympus公司);800TS型酶标仪(美国Bio-Tek公司);DH36001B型电热恒温培养箱(天津泰斯特仪器有限公司);H-2050R型冷冻超速离心机(湖南湘仪集团);Alpha 7R III型全画幅微单™数码相机(日本索尼公司);KZ-II型高速组织研磨仪(武汉赛维尔生物科技有限公司)。
2 方法
2.1 肌张力描记测定血管张力
SD大鼠经1%戊巴比妥钠(50 mg/kg)麻醉后,腹主动脉采血处死,断颈小心取出全脑(连同小脑及延脑),浸于预冷的Na+-PSS溶液(NaCl 119 mmol/L、NaHCO315 mmol/L、KCl 4.6 mmol/L、MgCl21.2 mmol/L、NaH2PO41.2 mmol/L、CaCl21.5 mmol/L和葡萄糖5.5 mmol/L)中,显微镜下分离脑基底动脉,剥离周围组织,切成2~3 mm血管环,穿入2根40 μm的金属丝(注意穿过血管环时避免损伤血管内皮),然后迅速移至预先加热37 ℃,通入95% O2、5% CO2混合气体的浴槽中,将2根金属丝分别与可调节预张力的张力微调装置和张力换能器,固定好的动脉环平衡20 min后,分3次施加1 mN预张力,每次间隔10 min;更换5 mL 60 mmol/L K+-PSS溶液检验动脉环收缩活性,重复2次,当2次刺激的收缩幅度小于10%时可用于正式实验[7]。在基础状态下以及ET-1、U46619、5-HT预收缩血管环后,分别加入累积浓度为1×10−6~1×10−3mol/L的黄芩素、冰片、黄芩素-冰片(1∶1)、黄芩素-冰片(1∶3)和黄芩素-冰片(3∶1)进行血管张力的测定。
2.2 大脑中动脉局灶性梗死(middle cerebral artery occlusion,MCAO)模型考察黄芩素、冰片抗脑缺血后血管内皮障碍的作用及机制
2.2.1 动物分组、造模及给药 将70只大鼠按随机数字表法分为假手术组、模型组和黄芩素-冰片高、中、低剂量(200、100、50 mg/kg,分别相当于成人临床剂量的8、4、2倍)[8-11]组。大鼠适应性饲养1周后,各给药组ig相应药物,假手术组和模型组ig等体积生理盐水,1次/d,连续7 d。末次给药结束后,禁食12 h,1%戊巴比妥钠(50 mg/kg)麻醉大鼠,模型组和各给药组采用改良Longa线栓法建立右侧MCAO模型:大鼠仰卧位固定于鼠板,颈部消毒备皮,正中切口1.5 cm,钝性分离皮下筋膜,分离颈动脉,夹闭颈总动脉,由颈外动脉插入线栓,至线栓18 mm标记进入颈内动脉与颈总动脉分叉处,术中和术后保温。假手术组大鼠除不插线栓外,其他与模型组大鼠操作一致。分别于造模后2、24 h进行神经功能评分,取材,进行相关指标的测定[12]。
2.2.2 神经功能评分 所有大鼠均在造模2、24 h后参考改良的Zea-Longa 8级7分神经功能缺损评分法对各组大鼠进行评分[13]。
2.2.3 TTC染色计算脑梗死面积 取大鼠脑组织用于TTC染色:断头取出脑组织,用预冷的生理盐水清洗干净,吸水纸吸干表面水分,去除嗅球、小脑、脑干,−20 ℃冷冻20 min,待其冻硬后,于冠状位用手术刀等分切为4片2~3 mm厚的切片,置于12孔板中,每孔1片,加入37 ℃、2% TTC染液,每孔加1片22 mm圆形盖玻片封顶,锡纸密封,于37 ℃孵育箱内孵育20 min,期间摇晃1~2次,使染色均匀。孵育结束后,吸出染液,加PBS清洗2次,4%多聚甲醛固定48 h后,将切片置于相同蓝色背景上,使用高清微距相机拍照,Image J软件计算梗死部分体积及全脑体积,计算脑梗死率。
脑梗死率=梗死部分体积/全脑体积
2.2.4 HE染色脑基底动脉观察血管内皮状态 取出大鼠脑基底动脉,用预冷的生理盐水清洗干净,吸水纸吸干表面多余水分,4%多聚甲醛固定72 h后,经脱水、包埋、切片、脱蜡、染色、制片,光镜下不同倍数观察心肌组织病理学状态,选取固定位置拍照。
2.2.5 荧光染色法检测缺血侧皮层CD34表达 切片脱蜡至水,于EDTA抗原修复缓冲液中进行抗原修复,冷却后,PBS洗涤3次,每次5 min,用组化笔圈住组织,放入3%过氧化氢溶液,室温下避光孵育25 min,洗涤甩干,滴加牛血清白蛋白,5%山羊血清封闭30 min。加入一抗4 ℃孵育过夜,洗涤,在圈内滴加与一抗相应种属的HRP标记的二抗覆盖组织,室温下孵育50 min,洗涤,滴加CY3-TSA,室温避光孵育10 min,TBST洗涤3次,每次5 min。切片置于EDTA抗原修复缓冲液中加热处理,在圈内滴加DAPI染液,室温避光孵育10 min,洗涤,在圈内加入自发荧光淬灭剂5 min,流水冲洗10 min,用DAPI抗荧光淬灭封片剂封片。荧光显微镜下观察并采集图像。
2.2.6 检测缺血侧脑组织NO水平 准确称取缺血侧脑组织,加入9倍体积的0.9%生理盐水,冰水浴条件下,机械匀浆,制备成10%的匀浆液,3000 r/min离心10 min,取上清液,按试剂盒操作步骤测定缺血侧脑组织NO水平。
2.2.7 ELISA检测血清中IL-1β、IL-6、TNF-α和TGF-β水平 血液样本常温静置30 min,3000 r/min离心15 min,分装血清,−80 ℃冻存,按照试剂盒说明书测定血清中L-1β、IL-6、TNF-α和TGF-β水平。
2.2.8 Western blotting检测脑基底动脉eNOS和iNOS蛋白表达 分别取缺血侧皮层、脑基底动脉组织,加入RIPA裂解液提取蛋白并测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入抗体(1∶1000),4 ℃孵育过夜;洗涤后加入二抗(1∶5000)孵育,洗涤后加入ECL超敏发光液显影,采用成像仪摄像、测量,利用Image Pro Plus 5.0软件分析条带灰度值。
2.3 统计学分析

3 结果
3.1 黄芩素-冰片对血管环的舒张作用
3.1.1 黄芩素、冰片对基础状态的血管环张力的作用 血管环施加1 mN预张力,平衡后,分别累积浓度加入DMSO、黄芩素、冰片、黄芩素-冰片(1∶1)、黄芩素-冰片(1∶3)和黄芩素-冰片(3∶1),监测血管张力变化并计算血管舒张率,结果见图1-A,浓度为1×10−6~1×10−3mol/L时,黄芩素、冰片及不同比例配伍应用均对基础状态的脑基底血管环张力无明显。提示各药物组对正常状态血管张力无明显影响。
3.1.2 不同比例黄芩素-冰片对ET-1预收缩的血管环张力的影响 平衡后,使用1×10−6mol/L ET-1预收缩血管环,累积浓度加入对应药物,监测血管张力变化并计算血管舒张率,结果见图1-B,冰片、黄芩素及各比例配伍在浓度为1×10−4~1×10−3mol/L时表现出了显著的舒张血管作用(<0.01),随着药物浓度的增加,黄芩素-冰片(1∶3)的舒张作用明显大于其他药物组。提示各药物组能显著舒张由ET-1预收缩的脑基底血管环,且高浓度的黄芩素-冰片(1∶3)的舒张作用强于其他药物组。
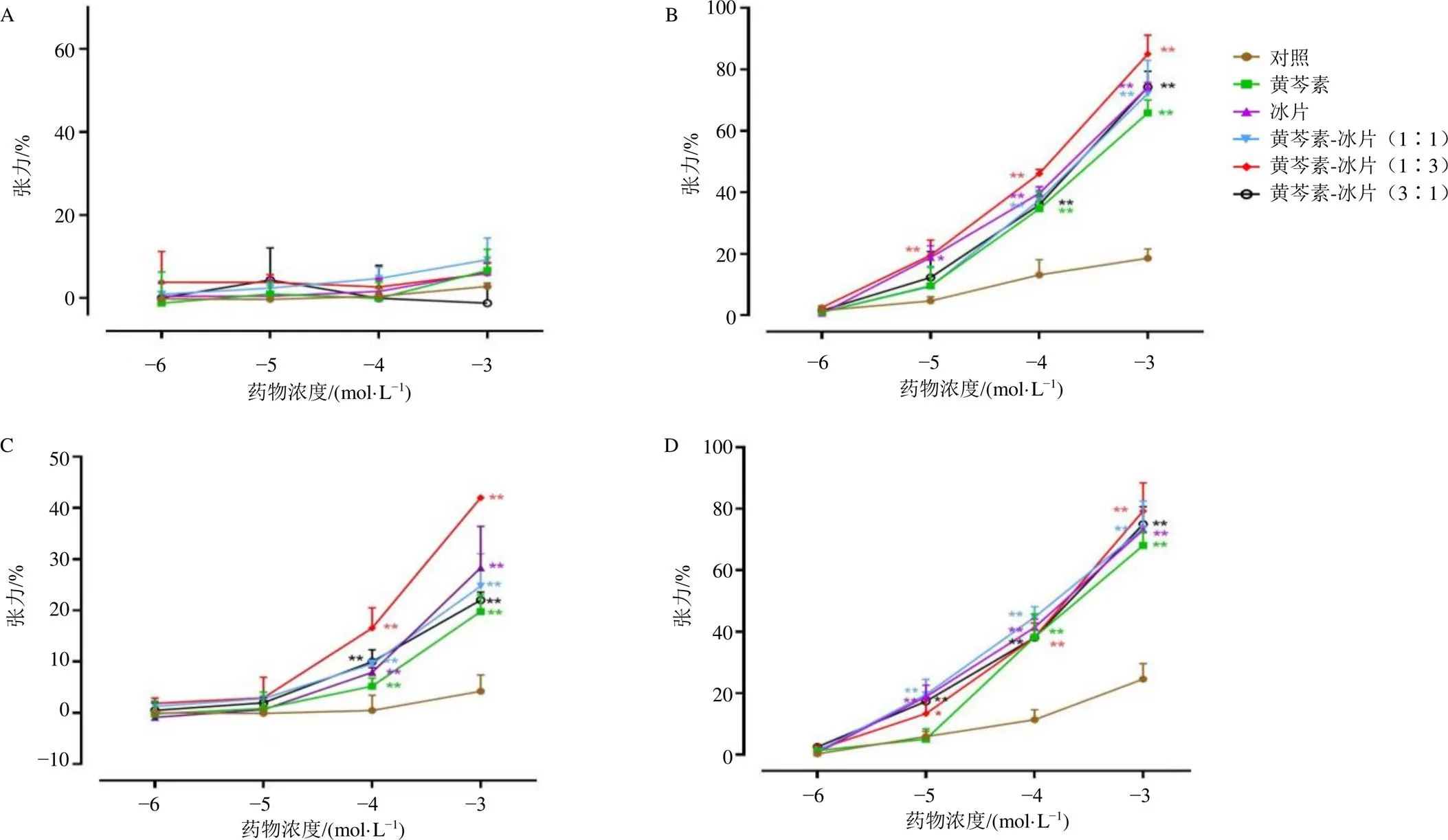
A-对基础状态血管环张力的影响 B-对ET-1预收缩的血管环张力的影响 C-对U46619预收缩的血管环张力的影响 D-对5-HT预收缩的血管环张力的影响 与对照组比较:*P<0.05 **P<0.01
3.1.3 不同比例黄芩素-冰片对U46619预收缩的血管环张力的影响 平衡后,使用1×10−6mol/L U46619预收缩血管环,累加浓度加入对应药物,监测血管张力变化并计算血管舒张率,结果见图1-C,所有药物组均在1×10−4~1×10−3mol/L时表现出了显著的舒张血管作用(<0.01),且与浓度呈正相关,随着药物浓度的增加,黄芩素-冰片(1∶3)对血管环的舒张作用明显大于其他药物组。提示各药物组能显著舒张由U46619预收缩的脑基底血管环,且浓度增大时,黄芩素-冰片(1∶3)对的舒张作用强于其他药物组。
3.1.4 不同比例黄芩素-冰片对5-HT预收缩的血管环张力的影响 平衡后,使用1×10−6mol/L 5-HT预收缩血管环,累加浓度加入对应药物,监测血管张力变化并计算血管舒张率,结果见图1-D,随着药物浓度的增加,各药物组均表现出了显著的舒张作用(<0.01),且各药物组之间无明显差异。提示各给药组均能显著舒张由5-HT预收缩的脑基底血管环,且各药物组无显著差异。
基础状态的血管内皮细胞通过调控缩血管物质ET-1、血管紧张素II(angiotensin II,AngII)、血栓素A2(thromboxane A2,TXA2)、ROS和血管舒张因子NO和前列环素(prostacyclin,PGI2)和内皮衍生超级化因子(endothelium‐derived hyperpolarizing factors,EDHFs)等血管活性物质参与血管张力的调节,正常生理状态下,二者维持表达平衡,但在脑缺血发生后,缺血区缺氧缺糖诱导一系列反应直接刺激内皮细胞损伤,导致缩血管物质分泌增加,而舒血管物质降低,诱发内皮功能障碍,进一步使血管收缩,减少缺血区血流量,加重脑损伤[14]。上述研究结果显示,黄芩素、冰片和各比例配伍组对基础状态血管环张力无明显影响,能明显舒张由ET-1、U46619、5-HT预收缩的脑基底血管环,且随着浓度增大,黄芩素-冰片(1∶3)对ET-1、U46619预收血管环的舒张作用具有明显的优势。因此,选择黄芩素-冰片(1∶3)继续后续研究,构建MCAO模型大鼠,初步在体探究黄芩素-冰片(1∶3)抗脑缺血后内皮功能障碍的作用及机制。
3.2 黄芩素-冰片对MCAO大鼠神经功能评分的影响
术后2 h,所有大鼠都表现出了不同程度的右侧脑缺血症状,即表现为活动减少,提尾后前肢无法完全伸直,左侧前肢收回置于胸壁,向左侧转圈或倾倒,神经功能评分稳定且各组之间无明显差异,提示模型构建成功。造模过程中各组均有造模失败(造模过程中出现的死亡以及造模结束后神经功能评分低于1分),共20只。造模成功率71.4%。如图2所示,药物干预24 h后,与模型组比较,黄芩素-冰片中、高剂量组神经功能评分显著降低神经功能评分(<0.01),低剂量组对MCAO大鼠神经功能评分无明显影响。提示中、高剂量的黄芩素-冰片能一定程度改善神经功能。
3.3 黄芩素-冰片对MCAO大鼠脑梗死率的影响
TTC染液可将正常脑组织染成红色,将梗死区域染成白色。如图3所示,与假手术组比较,模型组梗死体积显著增加(<0.01);与模型组比较,黄芩素-冰片低、中、高剂量组大鼠脑梗死率显著降低(<0.01)。提示黄芩素-冰片能降低脑梗死率,改善脑损伤。
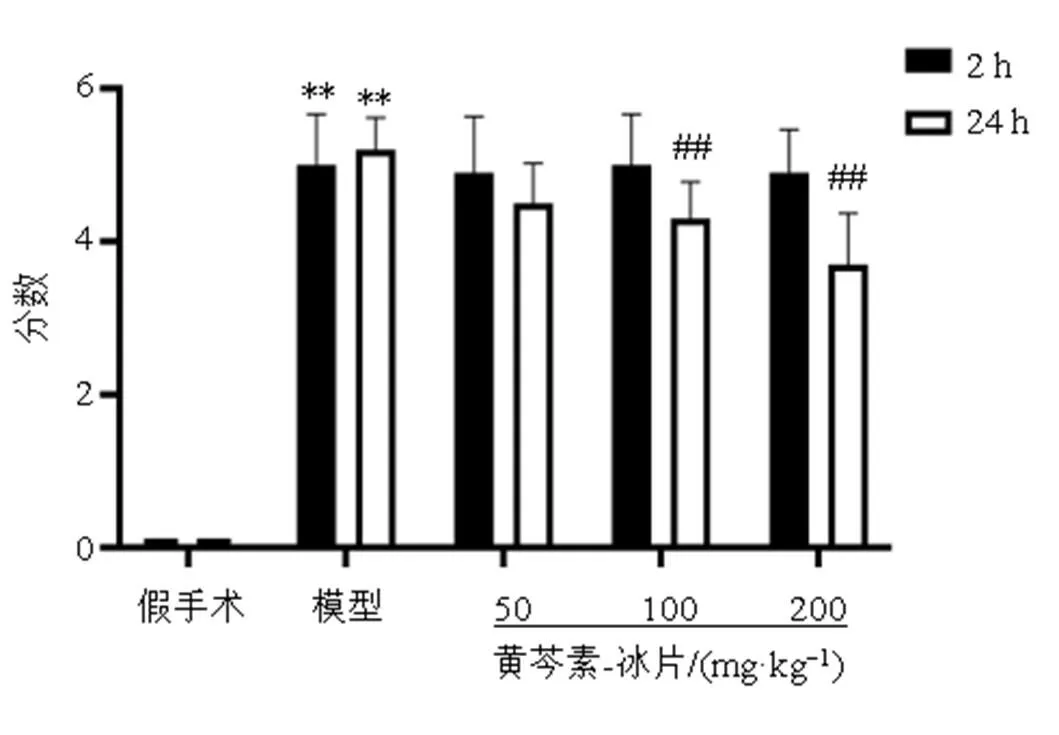
与同时间假手术组比较:**P<0.01;与同时间模型组比较:##P<0.01
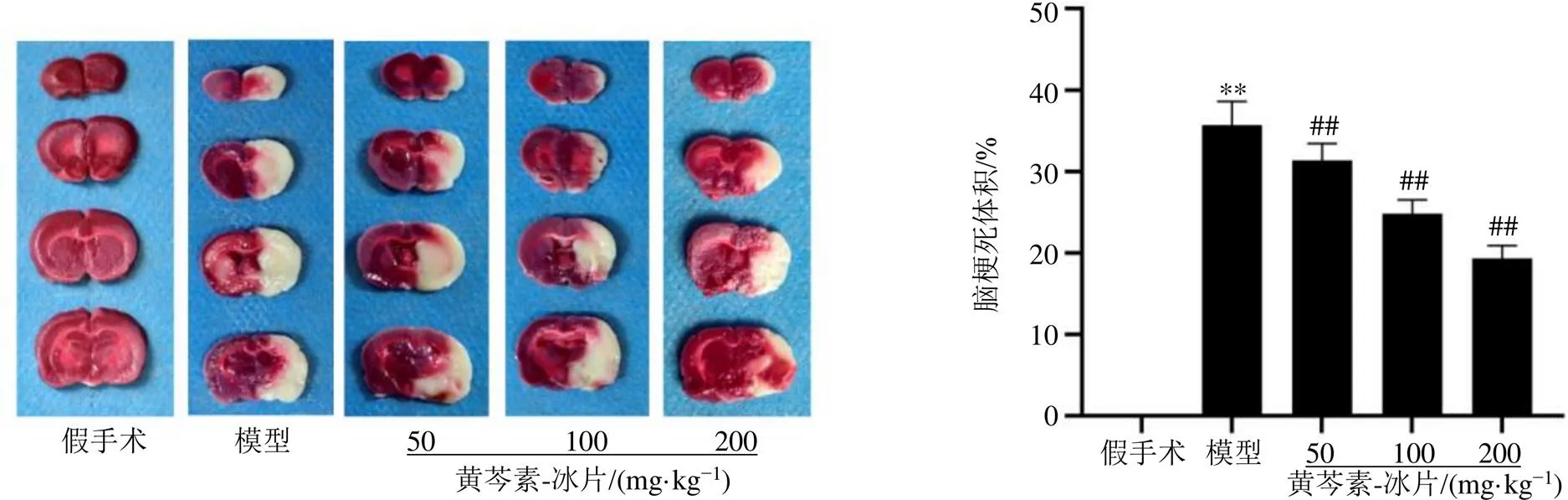
与假手术组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同
3.4 黄芩素-冰片对MCAO大鼠缺血侧皮层CD34表达的影响
CD34是内皮细胞损伤后修复的重要物质之一,也是内皮细胞首选标志物,血管新生发生与CD34表达呈正相关。利用荧光染色标记缺血侧皮层CD34表达,考察黄芩素-冰片对缺血侧皮层血管修复和新生的影响。如图4所示,与假手术组比较,模型组大鼠缺血侧皮层中CD34表达显著增加(<0.01);与模型组比较,黄芩素-冰片中、高剂量组大鼠缺血侧皮层中CD34表达显著增加(<0.01),低剂量对CD34表达无明显影响。表明黄芩素-冰片可促进MCAO模型大鼠缺血区微血管新生和恢复。
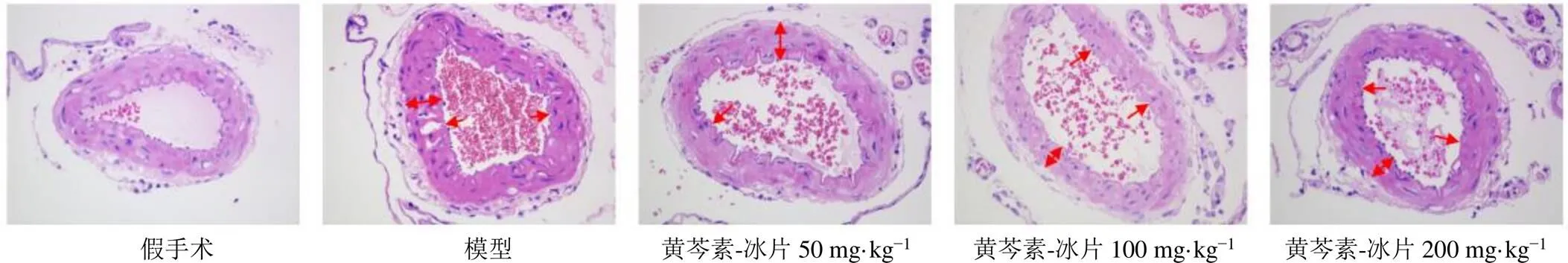
3.5 黄芩素-冰片对MCAO大鼠脑基底动脉内皮完整性的影响
如图5所示,假手术组大鼠脑基底血管内皮细胞连续、完整,无明显病理损伤;模型组大鼠脑基底动脉内皮完整性严重受损、出现缺失,内皮皱缩,黄芩素-冰片低、中、高剂量组大鼠内皮损伤程度和完整性得到不同程度恢复。提示黄芩素-冰片对脑缺血后血管内皮具有保护作用。
3.6 黄芩素-冰片对MCAO大鼠脑基底动脉eNOS和iNOS蛋白表达的影响
如图6所示,与假手术组比较,模型组大鼠脑基底动脉eNOS蛋白表达水平明显降低(<0.05),iNOS蛋白表达水平显著升高(<0.01);与模型组比较,黄芩素-冰片低、中、高剂量组大鼠脑基底动脉eNOS蛋白表达水平显著升高(<0.01),iNOS蛋白表达水平显著降低(<0.05、0.01),提示黄芩素-冰片能上调缺血后脑基底动脉eNOS表达、下调iNOS表达,调控eNOS/iNOS平衡,发挥抗内皮功能障碍作用。
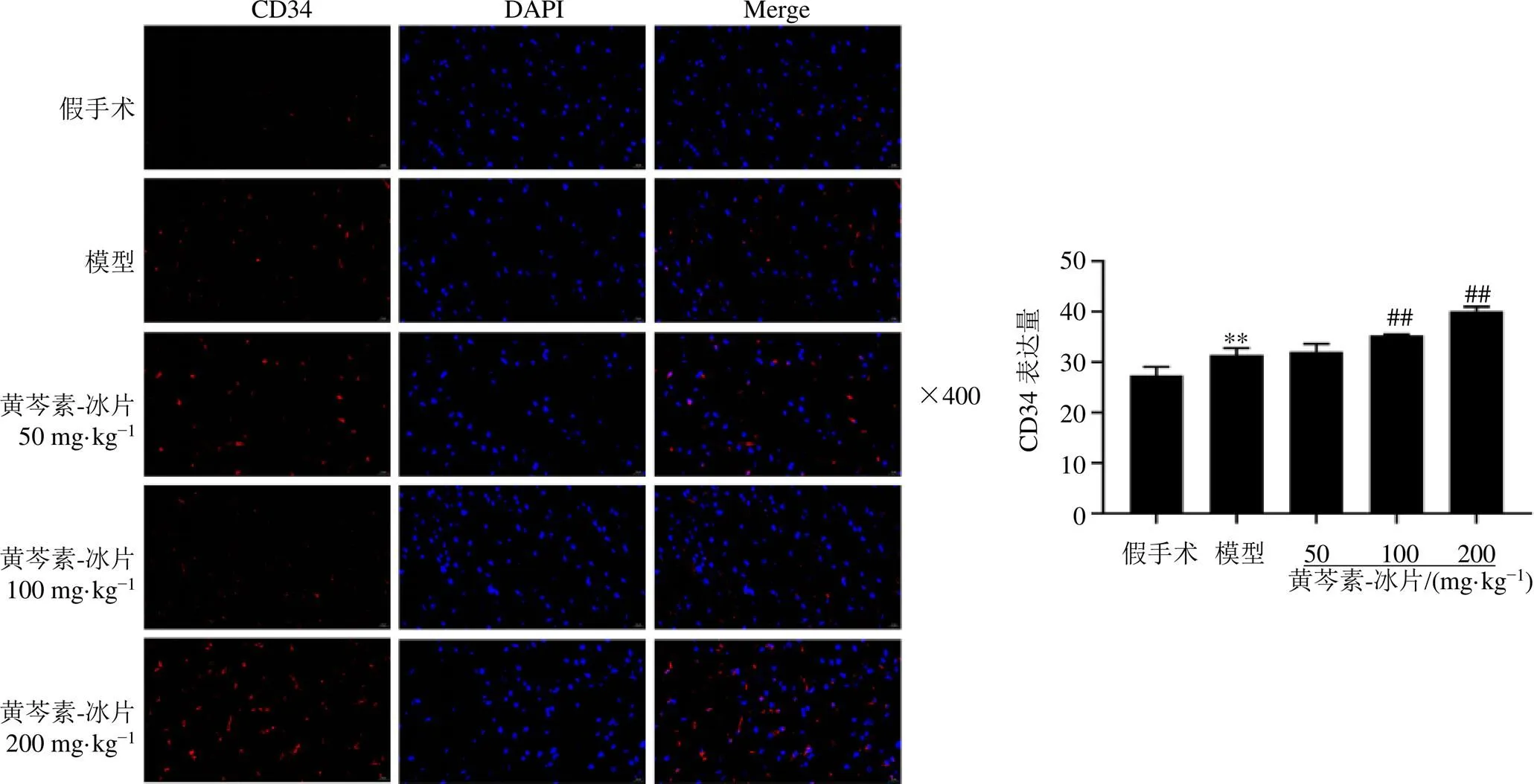
图4 黄芩素-冰片对MCAO大鼠缺血侧皮层CD34表达的影响(, n = 3)
箭头所示为血管内皮细胞
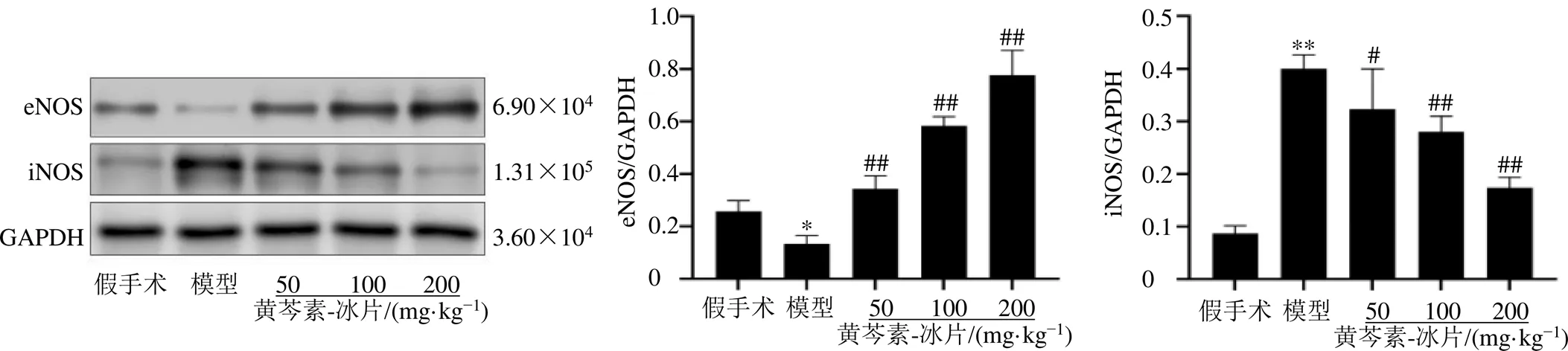
图6 黄芩素-冰片对MCAO大鼠脑基底动脉eNOS和iNOS蛋白表达的影响(, n = 3)
3.7 黄芩素-冰片对MCAO大鼠缺血侧皮层NO水平的影响
NO是主要的扩血管物质,组织中NO水平能在一定程度上反映血管内皮功能状态。如图7所示,与假手术组比较,模型组大鼠缺血侧皮层中NO水平显著降低(<0.01);与模型组比较,黄芩素-冰片中、高剂量组大鼠缺血侧皮层中NO水平显著升高(<0.01),低剂量组大鼠缺血侧皮层中NO水平无明显变化。提示黄芩素-冰片能上调缺血侧脑皮层中NO水平,改善血管功能,参与血管舒张。
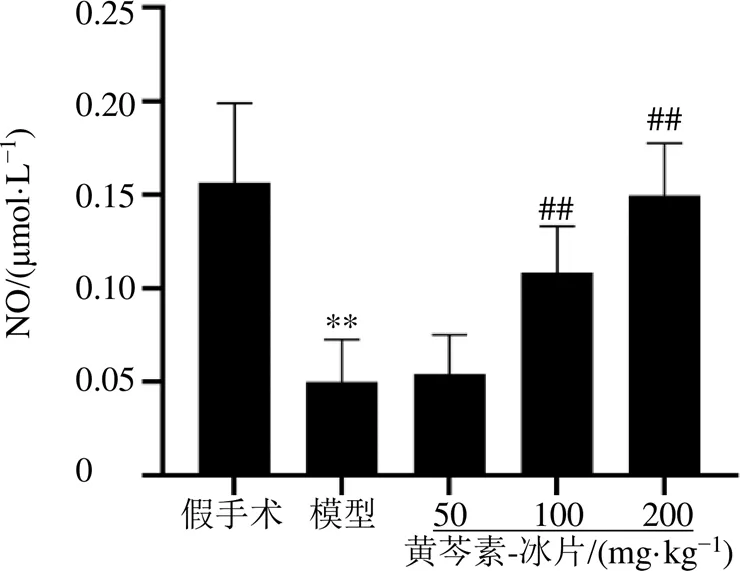
图7 黄芩素-冰片对MCAO大鼠缺血侧皮层NO水平的影响(, n = 3)
3.8 黄芩素-冰片对MCAO大鼠血清中炎性因子水平的影响
如图8所示,与假手术组比较,模型组大鼠血清中IL-1β、IL-6和TNF-α水平显著升高(<0.01),TGF-β水平降低(<0.01);与模型组比较,各给药组大鼠血清中IL-1β、IL-6和TNF-α水平明显降低(<0.05、0.01),TGF-β水平明显升高(<0.05、0.01)。提示黄芩素-冰片能抑制MCAO大鼠体内炎症反应。
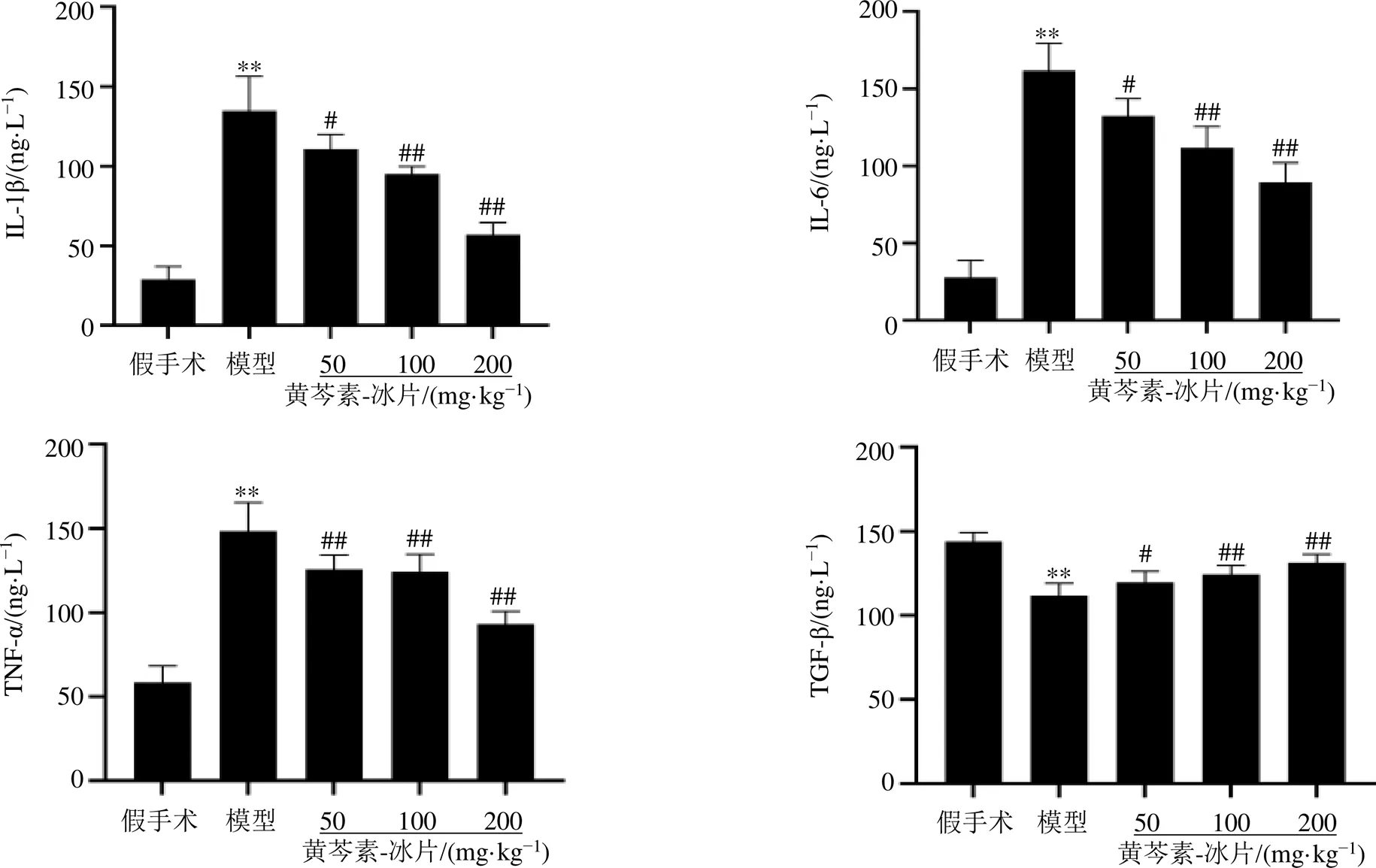
图8 黄芩素-冰片对MCAO大鼠血清中炎性因子水平的影响(, n = 6)
4 讨论
心脑血管疾病具有发病隐匿、病因复杂等特点,常造成多个器官的结构或功能损害[15]。据统计,脑缺血是世界上致死和致残的第3大原因,缺血性卒中在所有新发卒中中所占比例最大[16]。相关研究表明,脑缺血病机涉及氧化应激、炎症、凋亡等多种复杂机制[17]。脑缺血发生后,缺血中心区的星胶质细胞和小胶质细胞被激活后会释放出大量的ROS和RNS,ROS和RNS在机体组织或细胞内的大量蓄积会打破黄嘌呤氧化酶、还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)等促氧化酶和超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、过氧化氢酶等抗氧化酶的平衡,造成氧化/氮化应激反应[18],加剧炎症反应,损伤内皮,内皮细胞凋亡,造成血管内皮功能障碍[19]。本研究利用线栓法构建MCAO模型大鼠,术后大鼠神经功能评分显著升高,且各组间无明显差异,提示模型构建成果且稳定;TTC染色结果也能看出,模型组大鼠脑梗死率显著升高,而黄芩素-冰片干预后能明显降低大鼠脑梗死率,表明黄芩素-冰片具有改善脑缺血后神经功能损伤和降低脑梗死率的作用。
血管内皮细胞是连续覆盖在血管内壁表皮的单层扁平状细胞,紧贴血管壁生长,维持血管管腔光滑以减轻由血液流动产生的剪切应力,其可作为一个调节体液、营养物质和代谢物交换的关键介质的内分泌器官[20],在调节血管收缩或舒张、血管张力、血管重塑、控制血栓形成、细胞黏附、平滑肌细胞增殖和血管炎症方面具有重要意义[21]。生理情况下,内皮细胞可释放NO、PGI2等舒血管物质和ET-1、AngⅡ、TXA2等缩血管物质,这些血管活性物质的浓度在局部保持一定的比例,使血管的舒张与收缩功能保持动态平衡,进一步调节血管张力和血管平滑肌功能状态[22]。已有研究表明,黄芩素可部分内皮依赖性地舒张去甲肾上腺素收缩的离体大鼠胸主动脉环,内皮依赖性舒张作用可能与前列环素途径相关,非内皮依赖途径可能与三磷酸腺苷(adenosine triphosphate,ATP)敏感性钾通道和钙离子通道相关[23]。黄芩素低浓度下表现出收缩大鼠肠系膜动脉环及抑制乙酰胆碱舒张血管的作用[24]。冰片可通过血管平滑肌细胞的电压依赖性钙通道、受体操纵性钙通道及其介导的外钙内流和内钙释放等途径参与血管舒张[25],此外,冰片具有比较强的NO生物活性,其可以通过硝酸盐(NO3−)还原到亚硝酸盐(NO2−),再从NO2−还原到NO的补充途径(NO3−→NO2−→NO)产生NO,从而发挥对心血管的良好保护与治疗作用[26]。本研究发现黄芩素、冰片及其不同比例配伍对基础状态的脑基底血管环张力无明显影响,但能明显舒张由ET-1、U46619和5-HT预收缩的脑基底血管环,且在高剂量时,黄芩素-冰片(1∶3)对ET-1、U46619预收血管环的舒张作用具有明显的优势。ET-1是目前发现的最强的缩血管物质,对维持基础血管张力与心血管系统稳态起重要作用[27]。内皮细胞在受到刺激时,促进ET-1合成和释放,主要在基因转录水平进行调控[28],受NO、PGI2、心房利钠肽及肝素等负调控[29]。U46619是一种强效的TXA2受体激动剂,通过结合细胞膜上TXA2受体产生强烈的收缩血管作用[30]。结果表明黄芩素、冰片及配伍可抑制由ET-1、U46619和5-HT诱发的血管收缩,且黄芩素-冰片(1∶3)的舒张作用优于其余各组,但具体舒张机制尚未明确。
NO是一种具有内皮功能的多效性功能的分子,由内皮细胞中的-精氨酸在钙-钙调蛋白依赖性的一氧化氮合酶(nitric oxide synthase,NOS)催化下合成释放[31]。而NOS有3种亚型,即在正常状态下表达的神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和eNOS以及在损伤后诱导表达的iNOS[32]。其中来源于iNOS和nNOS的NO具有神经毒性作用,来源于eNOS的NO具有神经保护作用[33]。eNOS和iNOS是催化NO生成的关键酶,其通过在分子水平上调控NO的合成进而参与机体内多种生理活动[34]。而体内iNOS与eNOS之间表达水平的平衡可能是维持血管正常生理功能所必需[35]。目前已知的NOS催化-精氨酸所需要的辅助因子包括氧、NADPH和四氢生物蝶呤(tetrahydrobiopterin,BH4)[36],NO合成后,由内皮细胞透膜分布到血管平滑肌细胞,激活鸟苷酸环化酶,将鸟苷三磷酸转化为环磷酸鸟苷,最终导致Ca2+超极化,细胞松弛、血管舒张[37]。脑缺血发生后的短期内,脑组织的氧糖供应迅速减少,致剪切应力的变化和ROS的产生[38],ROS的蓄积一方面直接刺激内皮细胞,降低了内皮细胞对NO的生物利用率,并诱导其分泌功能紊乱或从平滑肌脱落、结构破坏[39]。另一方面会引起BH4水平不足,导致eNOS脱偶联,影响对NO的调控,eNOS会和O2−发生反应(O2−由NADPH产生)生成过氧亚硝基(ONOO−),而不是NO,最终发展为内皮细胞功能障碍[40]。因此,NO介导的血管舒张功能受损是促成血管功能障碍的一个重要因素,NO浓度的变化可作为判断脑梗死预后的重要指标[41]。本研究中,模型组大鼠脑基底动脉内皮损伤严重、断裂,eNOS表达显著降低、iNOS表达显著升高,缺血侧皮层中NO水平显著降低、CD34表达升高,血清中IL-1β、IL-6、TNF-α水平均明显升高,TGF-β水平降低;而黄芩素-冰片能不同程度改善脑基底动脉内皮状态,升高动脉中eNOS、缺血侧皮层中CD34、NO和血清中TGF-β表达,下调脑基底动脉中iNOS表达和血清中IL-1β、IL-6、TNF-α水平,维持eNOS/iNOS的动态平衡,发挥抑制炎症、保护血管内皮作用。
本研究尚存在不足之处:①只考察了对黄芩素、冰片及其配伍对离体预收缩血管环的舒张作用,并未对具体舒张机制进行探讨,也未对MCAO模型大鼠脑基底的舒缩功能进行检测。②黄芩素、冰片及配伍组只在高浓度时才展现出较好的舒张血管作用,但在考察其对基础状态的血管环张力的影响时,虽未体现出明显的舒张作用,但在高浓度时也表现出了有舒张的血管的趋势,在此,没有明确该作用是由于药物在高浓度时对血管环的毒性所引起的,还是由于药物本身的舒张作用引发的。③大鼠脑基底动脉由于极细,在穿钢丝时,极易损伤血管环内皮,影响药物对血管张力的作用。④只初步对黄芩素-冰片在体药效进行了评价,而未深入探究具体机制。
综上,本研究通过离体肌张力描记技术考察了黄芩素、冰片及其配伍对基础状态和ET-1、U46619和5-HT预收缩脑基底血管环的舒张作用筛选出最佳比例——黄芩素-冰片(1∶3),通过体内动物学实验考察了其最佳比例对MCAO模型大鼠的神经功能评分、脑梗死体积、缺血侧皮层中CD34和NO表达、血清中炎症因子水平、脑基底血管内皮状态、eNOS和iNOS表达的影响,推测黄芩素-冰片可抑制过度炎性反应,上调缺血后微血管eNOS表达,下调iNOS表达,促进NO合成和分泌,提高机体对NO的利用率,发挥抗缺血区微血管内皮功能障碍和促进恢复,改善微循环,减轻神经损伤的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhao Y F, Zhang X J, Chen X Y,. Neuronal injuries in cerebral infarction and ischemic stroke: From mechanisms to treatment (Review) [J]., 2021, 49(2): 15.
[2] 王陇德, 彭斌, 张鸿祺, 等.《中国脑卒中防治报告2020》概要 [J]. 中国脑血管病杂志, 2022, 19(2): 136-144.
[3] 邹洁, 张德德, 陶毅, 等. 葛根素减轻KKAy小鼠血管内皮细胞炎性反应 [J]. 基础医学与临床, 2023, 43(3): 433-437.
[4] 初云惠, 周罗绮, 庞晓伟, 等. 脑缺血后血管内皮细胞对小胶质细胞的调节作用及机制 [J]. 神经损伤与功能重建, 2023, 18(8): 470-473.
[5] Licht C, Schleder S, Isenberg C. Cerebral ischemia due to-induced vasculitis by pseudo-occlusion of the basilar artery [J]., 2021, 92(10): 1064-1066.
[6] 陈祥宇, 阳晶晶, 梅志刚, 等. 中医药靶向调节线粒体动力学及相关蛋白SUMO化修饰防治脑缺血/再灌注损伤的研究进展 [J]. 中草药, 2022, 53(16): 5205-5214.
[7] 王川, 王钰莹, 王婷, 等. 基于SIRT1-ERK1/2通路研究白藜芦醇对环孢菌素A诱导高血压的作用及机制 [J]. 中草药, 2022, 53(9): 2723-2730.
[8] 周娟平. 黄芩素通过线粒体途径对大鼠脑缺血再灌注损伤的保护作用研究 [D]. 兰州: 兰州大学, 2021.
[9] 杨文文. “良关系”丹参—冰片药对抗脑缺血作用 [D]. 西安: 西北大学, 2022.
[10] 郑敏敏, 柳洁, 赵清. 药用植物黄芩的生物学研究进展及展望 [J]. 生物技术通报, 2023, 39(2): 10-23.
[11] 沈晓庆, 王晶, 李婷君. 汉黄芩素对胶原诱导性关节炎大鼠的治疗作用及对NLRP3炎症小体的影响 [J]. 中医药导报, 2021, 27(8): 26-30.
[12] 赵麓, 张行行, 孙欠欠, 等. 基于NLRP3炎症小体研究黄芩苷联合栀子苷防治缺血性脑卒中及并发心肌损伤的作用机制 [J]. 中草药, 2023, 54(6): 1833-1841.
[13] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[14] Krüger-Genge A, Blocki A, Franke R P,. Vascular endothelial cell biology: An update [J]., 2019, 20(18): 4411.
[15] Libby P, Buring J E, Badimon L,. Atherosclerosis [J]., 2019, 5(1): 56.
[16] GBD Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the Global Burden of Disease Study 2019 [J]., 2021, 20(10): 795-820.
[17] 王哲义, 孙怿泽, 邓欣祺, 等. 丹参酮类脂溶性成分及其干预缺血性脑卒中机制的研究进展 [J]. 中草药, 2022, 53(4): 1181-1190.
[18] Takeda H, Yamaguchi T, Yano H,. Microglial metabolic disturbances and neuroinflammation in cerebral infarction [J]., 2021, 145(1): 130-139.
[19] Lapi D, Colantuoni A. Remodeling of cerebral microcirculation after ischemia-reperfusion [J]., 2015, 52(1): 22-31.
[20] 祝娜. 基于血管新生的天麻素与薯蓣皂苷元配伍抗大鼠脑微血管内皮细胞缺氧损伤作用研究 [D]. 北京: 中央民族大学, 2022.
[21] 刘祎. 基于“瘀毒互结”理论探讨脑缺血再灌注损伤神经细胞自噬及活血化瘀解毒方干预机理 [D]. 长沙: 湖南中医药大学, 2022.
[22] Evans C E, Iruela-Arispe M L, Zhao Y Y. Mechanisms of endothelial regeneration and vascular repair and their application to regenerative medicine [J]., 2021, 191(1): 52-65.
[23] 周恒源, 卞筱泓, 许激扬, 等. 黄芩素对大鼠离体胸主动脉的舒张作用及其机制 [J]. 中国实验方剂学杂志, 2013, 19(11): 167-171.
[24] Chen Z Y, Su Y L, Lau C W,. Endothelium-dependent contraction and direct relaxation induced by baicalein in rat mesenteric artery [J]., 1999, 374(1): 41-47.
[25] 岳思, 李铮, 郑卫红. 冰片舒张血管作用及其机制研究 [J]. 中药药理与临床, 2021, 37(5): 59-63.
[26] 苏坤莲, 凡永杰, 刘原, 等. 冰片对心脑血管系统药理作用及其机制的研究进展 [J]. 辽宁中医杂志, 2018, 45(9): 2001-2003.
[27] Houde M, Desbiens L, D'Orléans-Juste P. Endothelin-1: Biosynthesis, signaling and vasoreactivity [J]., 2016, 77: 143-175.
[28] Rapoport R M, Merkus D. Endothelin-1 regulation of exercise-induced changes in flow: Dynamic regulation of vascular tone [J]., 2017, 8: 517.
[29] Cao L, Huang C, Wang N,. ET-1/NO: A controversial target for myocardial ischemia-reperfusion injury [J]., 2014, 127(2): 140.
[30] Jiang R S, Zhang L, Yang H,. Signalling pathway of U46619-induced vascular smooth muscle contraction in mouse coronary artery [J]., 2021, 48(7): 996-1006.
[31] Kashiwagi S, Morita A, Yokomizo S,. Photobiomodulation and nitric oxide signaling [J]., 2023, 130: 58-68.
[32] Lapointe J, Roy M, St-Pierre I,. Hormonal and spatial regulation of nitric oxide synthases (NOS) (neuronal NOS, inducible NOS, and endothelial NOS) in the oviducts [J]., 2006, 147(12): 5600-5610.
[33] 王颖婷, 嘎珍, 张林泉, 等. 内皮型一氧化氮合酶在心血管疾病中的调节作用研究进展 [J]. 医学理论与实践, 2023, 36(6): 926-928.
[34] Luo S X, Lei H, Qin H H,. Molecular mechanisms of endothelial NO synthase uncoupling [J]., 2014, 20(22): 3548-3553.
[35] 冼海涛, 姚华国, 张媛莉. 他汀类药物对脓毒症一氧化氮合酶的影响 [J]. 中国热带医学, 2008, 8(3): 487-489.
[36] 黄语悠, 房亚兰, 刘克建, 等. 一氧化氮及其衍生物在缺血性脑血管病中的作用 [J]. 首都医科大学学报, 2017, 38(1): 67-71.
[37] Zhu J Q, Song W S, Hu Z,. Traditional Chinese medicine’s intervention in endothelial nitric oxide synthase activation and nitric oxide synthesis in cardiovascular system [J]., 2015, doi: 10.1007/s11655-015-1964-1.
[38] Liu D Q, Wang H L, Zhang Y G,. Protective effects of chlorogenic acid on cerebral ischemia/reperfusion injury rats by regulating oxidative stress-related Nrf2 pathway [J]., 2020, 14: 51-60.
[39] Chen W Y, Li D L. Reactive oxygen species (ROS)-responsive nanomedicine for solving ischemia-reperfusion injury [J]., 2020, 8: 732.
[40] Li H G, Förstermann U. Uncoupling of endothelial NO synthase in atherosclerosis and vascular disease [J]., 2013, 13(2): 161-167.
[41] Costa E D, Rezende B A, Cortes S F,. Neuronal nitric oxide synthase in vascular physiology and diseases [J]., 2016, 7: 206.
Effect and mechanism of baicalein-borneol on endothelial dysfunction after cerebral ischemia
HE Yi-fan1, ZHANG Hang-hang1, 2, TANG Chang-jie1, CHEN Xu1, YA Zhuang-ju1, ZHOU Zi-ye1, WANG Bin1, HAN Chao-jun1, LIU Ji-ping1, SHI Yong-heng1
1. School of Pharmacy, Shaanxi University of Chinese Medicine, Xianyang 712046, China 2. Shangluo Traditional Chinese Medicine Hospital, Shangluo 726000, China
To explore the effect and mechanism of baicalein, borneol and their combination on tension of cerebral basal vessels and their anti-endothelial dysfunction after cerebral ischemia.vascular ring experiments was used to investigate the effects of cumulative concentrations of baicalein, borneol and different proportions of compatibility on tension of cerebral basal vascular ring pre-contracted by endothelin-1 (ET-1), thromboxane A2analog (U46619) and 5-hydroxytryptamine (5-HT) in resting state. A model of focal cerebral ischemia was constructed by thread occlusion method, different proportions of baicalein-borneol was given, neurological function score was performed; 2,3,5-Triphenyl tetrazolium chloride (TTC) staining was used to observe the volume of cerebral infarction; Fluorescence staining was used to observe the expression of CD34 in ischemic cortex; Level of nitric oxide (NO) in ischemic cortex was detected; Hematoxylin-eosin (HE) staining was used to observe the endothelial integrity of cerebral basal artery; Western blotting was used to detect the expressions of endothelial nitric oxide synthase (eNOS) and inducible nitric oxide synthase (iNOS) in basal artery of the brain; ELISA method was used to detect the levels of inflammatory factors in serum.The combination of baicalein, borneol and various proportions had no significant effect on basal vascular ring tension, but could significantly relax the brain basal vascular ring pre-contracted by ET-1, U46619 and 5-HT (< 0.05, 0.01). As the concentration increased, baicalein-borneol (1∶3) had a significant advantage in the relaxation effect of ET-1, U46619 pre-contracted vascular rings. After middle cerebral artery occlusion (MCAO) surgery, the neurological function score of rats was significantly increased (< 0.01). After 24 h of drug intervention, the neurological function score was decreased to varying degrees (< 0.01); Compared with sham group, cerebral infarction rate of rats in model group was significantly increased (< 0.01), endothelial damage and rupture of cerebral basal artery were severe, eNOS expression was significantly decreased (< 0.05), iNOS expression was significantly increased (< 0.01), CD34 expression in ischemic cortex was increased (< 0.01), NO level was significantly reduced (< 0.01), levels of interleukin-1β (IL-1β), IL-6 and tumor necrosis factor-α (TNF-α) in serum were significantly increased (< 0.01), transforming growth factor-β (TGF-β) level was significantly decreased (< 0.01); Baicalein-borneol could significantly reduce the cerebral infarction rate to varying degrees (< 0.01), improve the endothelial status of basal artery, increase the expressions of eNOS in arteries, NO and CD34 in ischemic cortex and TGF-β in serum (< 0.05, 0.01), down-regulate iNOS expression in basal artery of brain and IL-1β, IL-6, TNF- α in serum (< 0.05, 0.01).Baicalein, borneol and their combination can inhibit vasoconstriction induced by ET-1, U46619 and 5-HT, and the relaxation effect of baicalein-borneol (1∶3) is superior to other groups. It can inhibit excessive inflammatory response, upregulate the expression of eNOS in microvessels after ischemia, down-regulate the expression of iNOS, promote NO synthesis and secretion, and play a role in combating microvascular endothelial dysfunction and promoting recovery in ischemic areas, improving microcirculation and reducing nerve damage.
cerebral ischemia; baicalein; borneol; endothelial dysfunction; vascular ring
R285.5
A
0253 - 2670(2023)22 - 7455 - 11
10.7501/j.issn.0253-2670.2023.22.022
2023-08-06
陕西省教育厅专项科研计划项目(21JK0608);陕西省中医药管理局中医药科研项目(2021-ZZ-JC023)
贺一凡(1999—),女,硕士研究生,研究方向为心脑血管药理学。
通信作者:史永恒,副教授,博士。E-mail: yhshi@sntcm.edu.cn
[责任编辑 李亚楠]
