基于UPLC-Q-TOF-MS代谢组学技术研究淫羊藿-川芎对骨关节炎大鼠的调控作用
2023-11-27吴恩慧章建华李清林
吴恩慧,章建华,张 琳,李清林,王 玲,尹 华*
• 药理与临床•
基于UPLC-Q-TOF-MS代谢组学技术研究淫羊藿-川芎对骨关节炎大鼠的调控作用
吴恩慧1,章建华2,张 琳1,李清林1,王 玲1,尹 华1*
1. 浙江中医药大学药学院中药标准化研究实验室,浙江 杭州 311402 2. 浙江中医药大学附属第一医院骨伤科,浙江 杭州 310006
基于超高效液相色谱-四极杆-飞行时间质谱联用仪(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)代谢组学技术探究骨关节炎大鼠的血浆代谢特征及淫羊藿-川芎配伍对骨关节炎大鼠代谢的调控作用。SD大鼠随机分成正常组、假手术组、模型组、病理经时评价组、淫羊藿组、川芎组、淫羊藿-川芎组(40 g/kg)、阳性药物组(盐酸氨基葡萄糖0.12 g/kg+塞来昔布1.00 g/kg)。模型组、病理经时评价组和各给药组采用交叉韧带-半月板损伤术建立骨关节炎模型,造模第6周各给药组给予相应药物干预,正常组、模型组给予等体积蒸馏水。采集0、2、4、6、8、10、12、14周大鼠血浆,通过病理组织学及血浆中基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)检测结果评价药效,UPLC-Q-TOF-MS技术分析大鼠血浆代谢轮廓,并结合多元统计分析,检测各组大鼠血浆代谢相关生物标志物的变化。造模4周后MMP-13水平明显升高(<0.01),给药8周后显著下降(<0.01)。基于代谢组学发现给药组大鼠血浆中2种潜在生物标志物发生明显变化,分别为溶血磷脂酰胆碱(16∶0)、磷脂酰胆碱(18∶0/ 20∶4),主要涉及磷脂代谢通路。淫羊藿、川芎单用和两者配伍均可回调差异代谢物治疗骨关节炎大鼠,且配伍效果优于单用。
淫羊藿-川芎;代谢组学;骨关节炎;药对配伍;溶血磷脂酰胆碱(16∶0);磷脂酰胆碱(18∶0/20∶4);绿原酸;阿魏酸;淫羊藿苷;藁本内酯
骨关节炎(osteoarthritis,OA)是一种以关节软骨的退行性病变和继发性骨质增生为主要病变的慢性关节疾病,以关节疼痛、滑膜炎症和活动受限为主要表现[1]。目前化学药治疗以缓解疼痛、抗炎或改善功能状态为主,但不良反应明显,不宜长期应用,因此尚缺乏切实有效的治疗手段和药物[2]。中医临床多以“补肾活血”为治疗准则[3],常以出自《太平圣惠方》的补肾活血药对淫羊藿-川芎配伍使用。淫羊藿补肾壮阳而治肾虚之根本,入肝肾祛风湿强筋骨;川芎活血祛瘀、祛风止痛治疗血瘀气滞[4-5]。
OA疾病发展过程及其治疗与代谢密切相关,代谢组学的研究可用于发现疾病的发病机制及探究药对干预下的调控机制[6-8]。研究表明,在OA发展过程中,软骨细胞代谢发生改变,基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)参与软骨的降解,滑膜细胞和软骨细胞局部合成的促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)造成关节软骨持续损伤[9-11]。药理研究表明,淫羊藿可调节软骨细胞代谢,促进软骨基质合成和细胞增殖[12-13]。川芎的有效成分可抑制炎症因子IL-1β、TNF-α、MMP-13的表达[14-15]。
淫羊藿-川芎对OA的作用机制尚不清楚,因此本研究基于超高效液相色谱-四极杆-飞行时间质谱联用仪(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)的代谢组学方法考察淫羊藿-川芎配伍及其单药治疗OA的内源性代谢产物变化及代谢轮廓,明确其发挥药效的代谢调控通路。
1 材料
1.1 动物
清洁级SD大鼠66只,体质量(190±10)g,雌雄各半,购自上海斯莱克实验动物有限公司,生产许可证号SCXK(沪)2013-0018,使用许可证号SCXK(浙)2013-0184。温度和相对湿度分别维持在(22±1)℃和(60±10)%。动物实验经浙江中医药大学伦理委员会批准(批准号ZSLL-2018-009)。
1.2 药材
淫羊藿(批号141117)和川芎(批号140527)均购自华东医药股份有限公司,经浙江中医药大学药学院张汝松教授分别鉴定为小檗科植物淫羊藿Maxim.的干燥叶、伞形科植物川芎Hort.的干燥根茎。
1.3 药品与试剂
塞来昔布胶囊(批号R55865)购自美国辉瑞制药有限公司;盐酸氨基葡萄糖胶囊(批号1504174)购自海南澳美华制药有限公司;MMP-13 ELISA试剂盒(批号20151201A)购自杭州乐峰生物科技有限公司;色谱纯甲醇和乙腈购自德国Merck公司;分析级乙酸(批号200903006)购自杭州化学试剂有限公司;水为超纯水;青霉素(批号F4056202)购自华北制药股份有限公司。
1.4 仪器
Waters Acquity UPLC、Waters Q-TOF-Premier(美国Waters公司);DMI3000B型显微镜(德国Leica公司);Power Wave 340型酶标仪(美国Bio-Tek公司);WH-866型涡旋震荡器(华利达公司);SENCOR系列旋转蒸发仪(上海申生科技有限公司);5804R型高速冷冻离心机、移液枪(德国Eppendorf公司)。
2 方法
2.1 给药溶液的制备
2.1.1 淫羊藿溶液的制备与分析 根据课题组前期研究确定最佳提取工艺进行药液制备[16],取淫羊藿饮片5000 g,置于多功能提取罐中,加12倍量50%乙醇,室温浸泡1 h,加热回流提取1 h,提取2次,合并药液,滤过,浓缩成2 g生药/mL的药液,置4 ℃冰箱保存备用。浓缩的药液稀释4倍,进样检测分析[17]。
2.1.2 川芎溶液的制备与分析 取川芎饮片5000 g,按“2.1.1”项下方法制备与分析。
2.1.3 淫羊藿-川芎溶液的制备与分析 取淫羊藿饮片和川芎饮片各2500 g,按“2.1.1”项下方法制备与分析。
2.2 动物分组、造模、给药及取材
66只大鼠适应性饲养1周后,按体质量随机分为正常组(=8)、假手术组(=8)、模型组(=8)、病理经时评价组(=10)、淫羊藿组(=8)、川芎组(=8)、淫羊藿-川芎组(=8)、阳性药物组(=8)。除正常组和假手术组外,其余各组均采用交叉韧带-半月板损伤术造模。假手术组切开关节囊,打开关节腔,不切断前交叉韧带和损伤半月板。术后所有手术大鼠im青霉素[40 000 U/(只·d)]。
造模6周后,各组ig相应药物,1次/d,连续8周。淫羊藿组、川芎组、淫羊藿-川芎组分别ig相应给药溶液(2 g生药/mL),阳性药物组ig盐酸氨基葡萄糖(0.006 g/mL)和塞来昔布(0.05 g/mL),正常组和模型组ig等体积蒸馏水(20 mL/kg)。
病理经时评价组于第0、2、4、6、8周随机取2只大鼠,颈椎脱臼处死,其余各组大鼠于第14周处死。取关节软骨,福尔马林溶液中固定,EDTA脱钙、脱水、石蜡固定包埋,切片,用于苏木素-伊红(hematoxylin-eosin staining,HE)和番红O-固绿(safranin O/fast green staining,SO)染色。
2.3 样品的采集与制备
于第0、2、4、6、8周,采集假手术组血液样本,于第6、8、10、12、14周采集各给药组血液样本,于第0、2、4、6、8、10、12、14周正常组、模型组血液样本置于抗凝管中,摇匀,4 ℃、3000 r/min离心10 min,分离得到血浆,置−80 ℃冰箱保存备用,后续用于UPLC-Q-TOF-MS分析和ELISA检测。
取血浆样品,解冻至室温,移取200 µL血浆样品,加入600 µL乙腈。涡旋1 min,4 ℃、12 000 r/min离心10 min,取上清液上机检测。吸取各样品上清液50 μL混合成质控样品。
2.4 色谱和质谱条件
2.4.1 色谱条件 Waters AcquityTMC18色谱柱(100 mm×2.1 mm,1.7 µm),流动相为含0.1%醋酸的水溶液(A)-含0.1%醋酸的甲醇溶液(B),梯度洗脱:0~0.5 min,3% B;0.5~8 min,3%~80% B;8~16 min,80%~98% B;16~21 min,98% B;21~21.5 min,98%~100% B;21.5~24 min,100% B;24~25 min,100%~3% B;25~30 min,3% B。体积流量为300 µL/min;柱温为35 ℃;进样体积为5 µL;自动进样器温度为4 ℃。
2.4.2 质谱条件 采用电喷雾离子源(ESI),正离子扫描模式,毛细管电压为3.0 kV,锥孔电压为40 V,碰撞电压为10~60 V,离子源温度为120 ℃,脱溶剂气温为350 ℃,脱溶剂气体积流量为450 L/h,碰撞气体为氩气。扫描范围/50~1000,扫描时间0.3 s,扫描间隔0.02 s。
TOF离子飞行方式采用“V”模式。使用0.5 ng/µL的亮氨酸-脑啡肽溶液进行相对分子质量测定校正。
2.5 数据处理与统计学分析
2.5.1 代谢组学数据处理 将原始数据导入MassLynx v4.1 and MarkerLynx 4.1软件,经过峰识别、峰对齐和归一化等处理后,得到由保留时间、质荷比和峰面积组成的数据矩阵,导入SIMCA-P 12.0进行无监督的主成分分析(principal component analysis,PCA)和有监督的正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。根据S-plot图中的变量投影重要性(variable importance in projection,VIP)>1和独立样本检验的<0.05,筛选差异代谢物作为潜在生物标志物。根据选取物质精确的质荷比,检索HMDB(http://www.hmdb.ca/)和METLIN(http://metlin.scripps.edu)对代谢物进行匹配鉴定。将鉴定所得潜在生物标志物导入京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(http://www.kegg.ip),明确相关代谢途径,并分析其调控作用。
3 结果
3.1 淫羊藿、川芎及药对的主要成分含量测定
淫羊藿有效成分绿原酸、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷I,其质量分数分别为0.618 0、1.480、1.968、2.283、4.494、0.840 0 mg/g。川芎有效成分绿原酸、藁本内酯,其质量分数分别为0.502 2、11.39 mg/g。淫羊藿-川芎中绿原酸、阿魏酸、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷I、藁本内酯质量分数分别为1.318、0.502 6、1.562、2.104、1.988、5.869、0.858 9、9.216 mg/g。
3.2 病理结果
3.2.1 OA模型大鼠关节软骨组织病理学经时评价 如图1所示,正常组及假手术组关节面光滑平整,颜色红润鲜艳,SO着色均匀,软骨细胞排列整齐,四层结构及潮线清晰可见。造模第2周模型组大鼠关节软骨较正常组无明显变化,仅在软骨层表面有较小、浅的裂隙;第4周关节软骨层变薄,表面粗糙,局部软骨出现片状脱落,部分软骨基质不着色;第6周关节软骨层严重破坏,各层软骨细胞簇集生长,排列紊乱;第8周病变加剧,可见软骨细胞坏死,潮线更加不规则或完全消失,甚至可见软骨下骨暴露。提示第6周OA模型建立成功。
3.2.2 淫羊藿-川芎对OA大鼠膝关节组织病理学的影响 如图2所示,正常组关节面光滑平整,颜色红润,软骨细胞排列整齐,四层结构及潮线清晰可见,SO着色均匀,颜色鲜艳。模型组关节软骨层明显变薄,软骨部分脱落,软骨细胞簇集,排列紊乱,潮线多不完整或完全消失,SO着色重度减弱,可见坏死崩解细胞,甚至可见软骨下骨质外露。各给药组软骨细胞排列有序,软骨细胞聚集生长现象逐渐消失,软骨层逐渐恢复。淫羊藿-川芎组和阳性药物组关节软骨层光滑,无明显软骨细胞聚集,SO着色均匀,但阳性药物组软骨细胞内可见大量脂肪滴。淫羊藿组软骨层表面有轻微裂缝,未见明显软骨脱落,软骨细胞排列较为整齐,但存在细胞聚集;川芎组软骨层薄且脱落明显,淫羊藿组和川芎组均存在失染现象,但淫羊藿组较川芎组软骨层厚,软骨细胞簇集程度较弱。说明淫羊藿、川芎及其配伍、阳性药物均对OA有治疗作用。淫羊藿-川芎配伍治疗效果与阳性药物相似,较单用更佳。
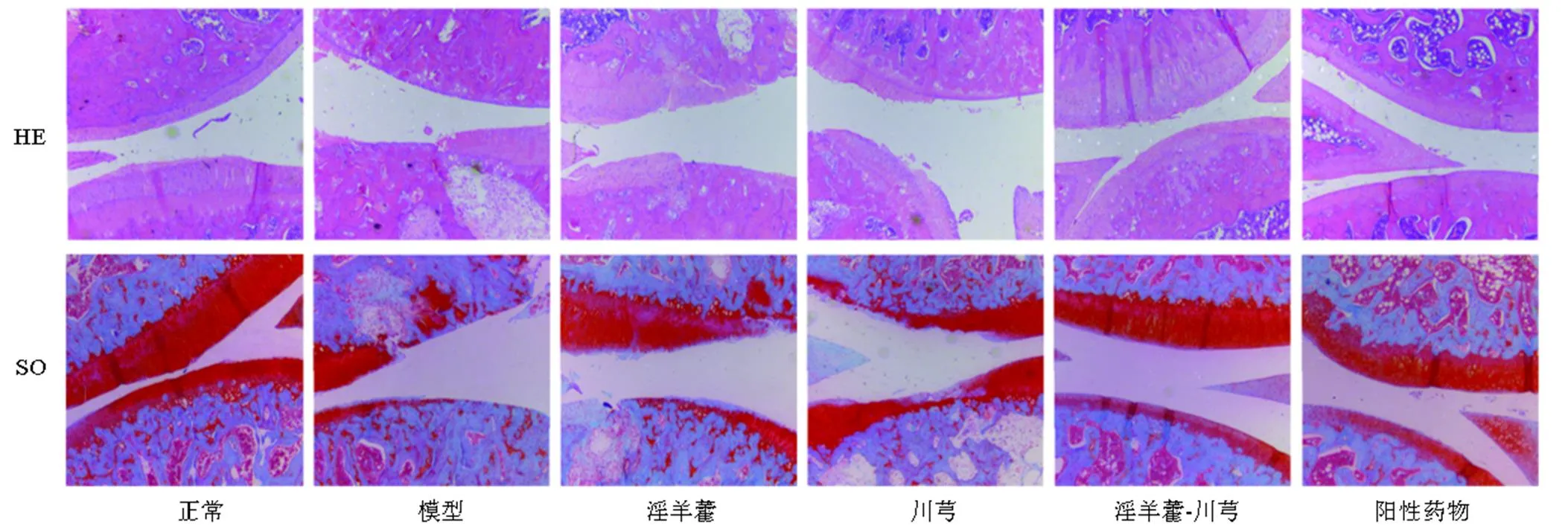
图2 给药8周(14周)大鼠膝关节病理形态(×25)
3.3 MMP-13结果
3.3.1 OA模型大鼠血浆中MMP-13水平经时评价 如表1所示,与正常组比较,假手术组MMP-13水平无明显差异,模型组造模2周后MMP-13水平显著升高(<0.05、0.01)。
3.3.2 单药及配伍对OA大鼠血浆中MMP-13水平的影响 各给药组于第12、14周的MMP-13水平较同时期模型组有显著性差异(<0.01)。淫羊藿-川芎组和阳性药物组血浆中MMP-13水平显著低于淫羊藿组和川芎组(<0.05、0.01)。说明阳性药物组、淫羊藿、川芎与淫羊藿-川芎均有治疗OA的作用,且配伍使用效果较好。
3.4 代谢组学分析
3.4.1 OA大鼠模型代谢组学分析 各组大鼠0~8周血浆代谢动态反映了OA的发展,如图3所示,第0、2周,3组血浆样本代谢无明显变化,第4、6、8周,3组样本均呈现分离趋势,假手术组的趋势更接近模型组。正常组大鼠未进行任何手术,6周的代谢变化只反映了大鼠正常衰老的情况;而假手术组模仿OA模型组大鼠实施了手术,体现了创伤对机体内源性成分的影响,其代谢变化由大鼠正常衰老和手术创伤共同作用产生。因此,在进行OA代谢组学研究时,以假手术组作为空白对照组更为合理。
表1 各组大鼠各时段血浆中MMP-13水平变化(, n = 6)
与正常组比较:*<0.05**<0.01;与假手术组比较:△△<0.01;与模型组比较:▲<0.05▲▲<0.01;与阳性药物(盐酸氨基葡萄糖+塞来昔布)组比较:#<0.05##<0.01;与淫羊藿-川芎组比较:^<0.05^^<0.01;与淫羊藿组比较:†<0.05††<0.01;与川芎组比较:◆<0.05◆◆<0.01
*< 0.05**< 0.01normal group;△△< 0.01sham group;▲< 0.05▲▲< 0.01model group;#< 0.05##<0.01positive drug (glucosamine hydrochloride + celebrex) group;^< 0.05^^< 0.01-group;†< 0.05††< 0.01group;◆< 0.05◆◆< 0.01group
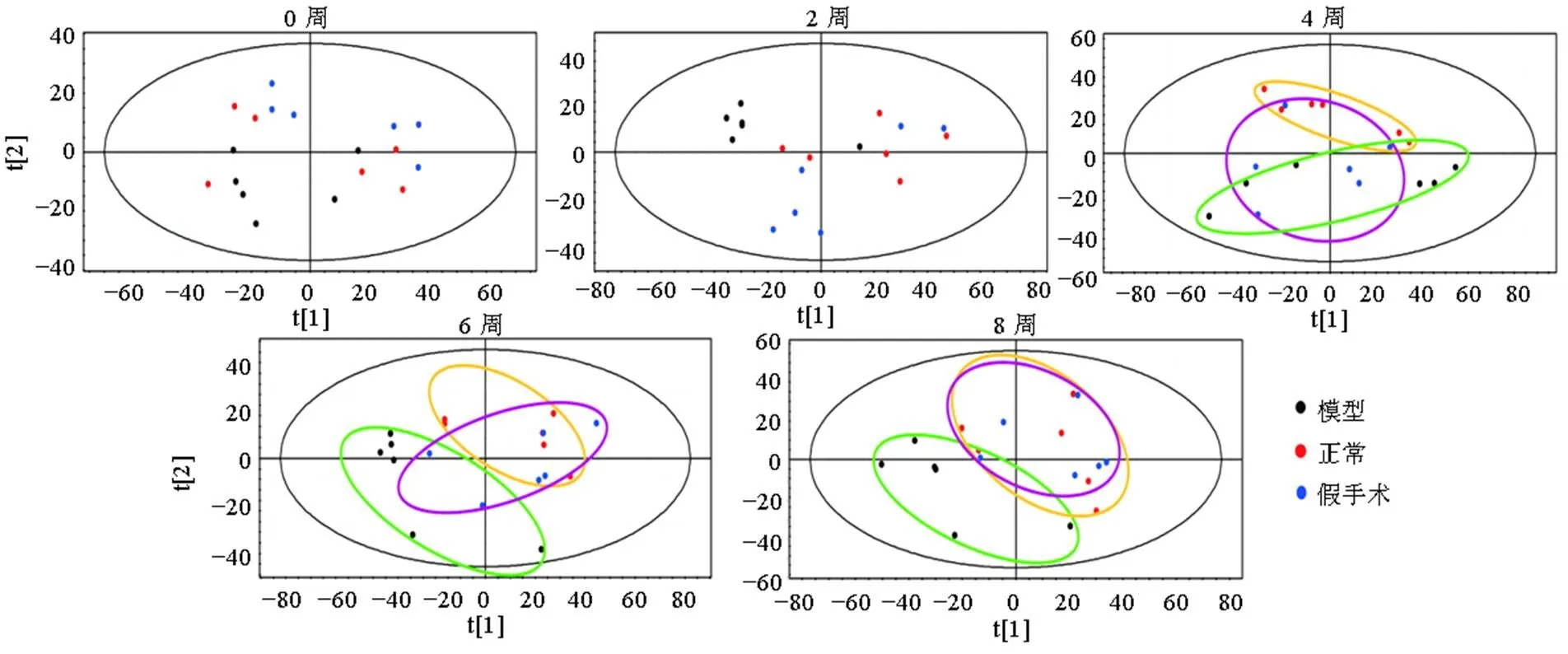
图3 各组大鼠0~8周血浆代谢PCA得分图
如图4所示,正常组呈现一定的代谢变化趋势,可能是大鼠正常衰老的生理变化。假手术组较正常大鼠0~2周分离趋势较明显,4~8周变化趋于缓和,可能与手术创伤及机体自身修复有关。模型组造模前后样本分离明显,随着时间的推移,第4~8周呈现有规律的分离,OA大鼠内源性代谢产物较正常组有明显变化。第4~6周变化最明显,第6~8周趋于稳定,说明第6周OA模型建立成功。
为了使组间差异最大化,消除组内变异对分类的负面影响,建立模型组和假手术组的OPLS-DA模型(图5),模型组和假手术组能明显分开,两者在代谢产物方面具有明显差异。在200次迭代中应用排列检验,说明没有过拟合。
A-正常组 B-假手术组 C-模型组
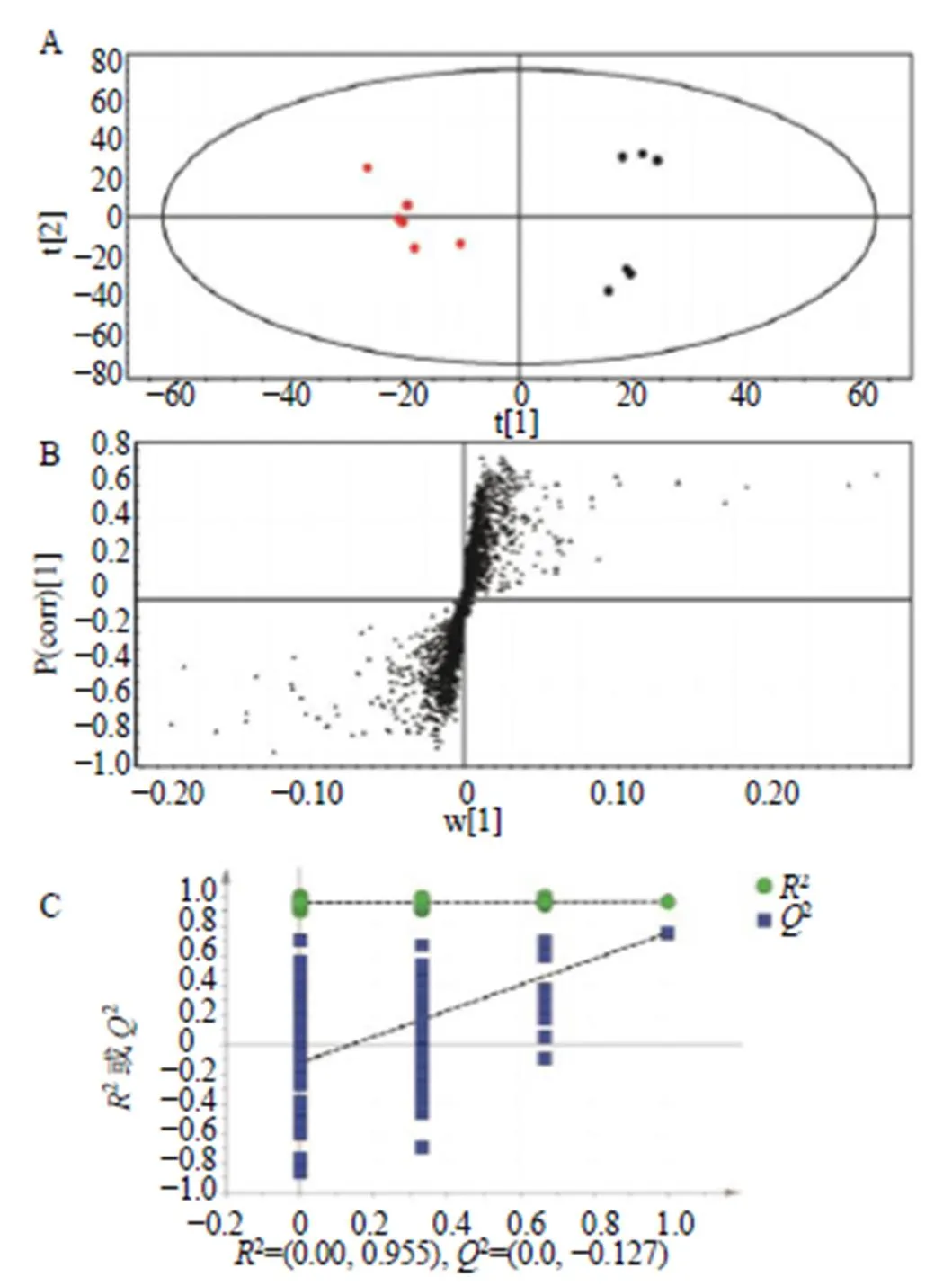
A-OPLS-DA得分图 B-S-plot图 C-模型验证图
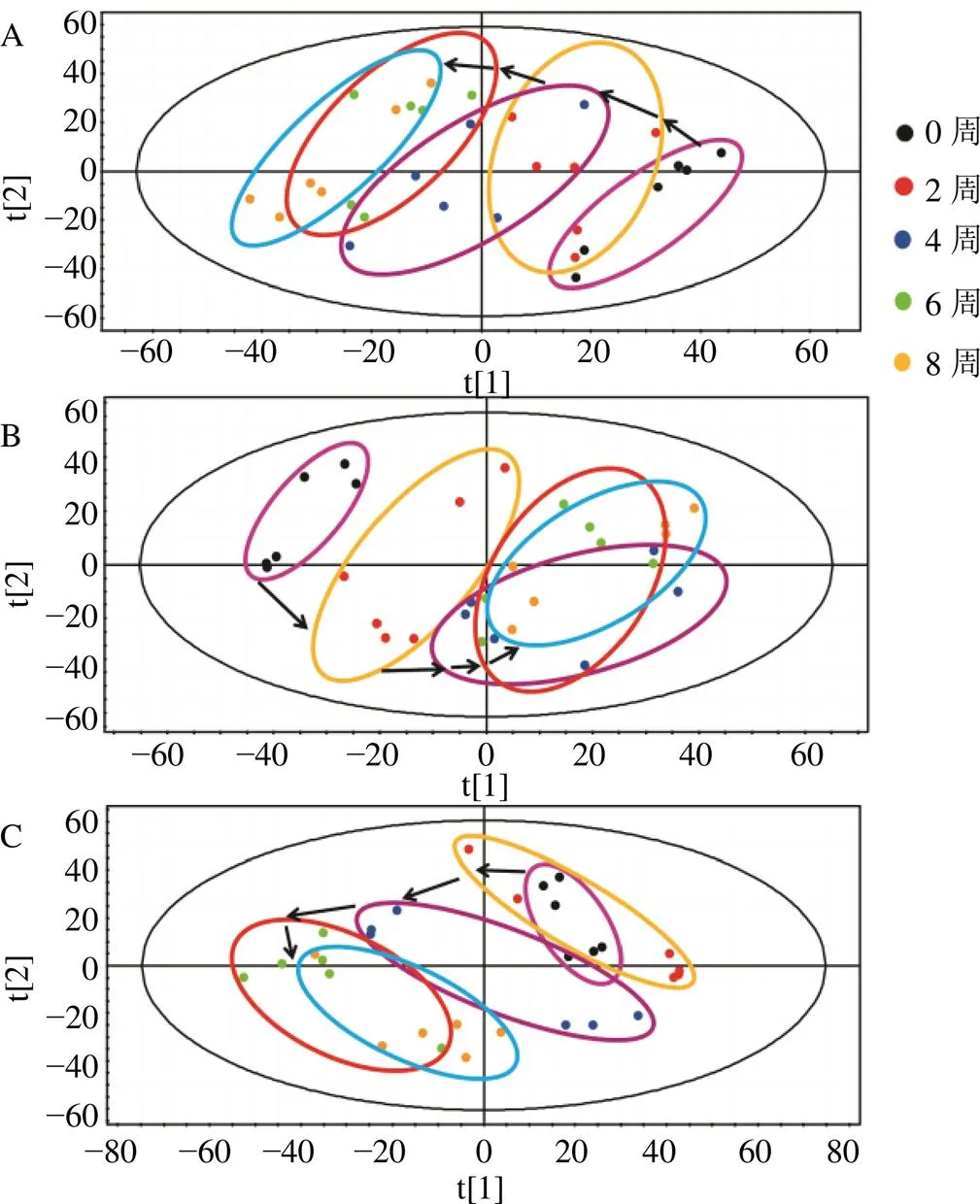
3.4.2 给药组大鼠代谢组学分析 如图6-A~H所示,各给药组于第10~14周与模型组达到分离,并逐渐向正常组靠拢,在第14周趋势最为明显。说明各给药组均可调控其向正常状态转变,其中淫羊藿-川芎组和阳性药物组调控作用明显优于单药。各给药组OPLS-DA图(图6-I、J)显示,淫羊藿-川芎和阳性药物组疗效优于淫羊藿和川芎单药,进行了模型验证,显示2截距小于0,未过拟合,模型可靠,初步阐明“补肾活血”法治疗OA的科学性。
3.5 血浆潜在生物标志物的筛选
结合OPLS-DA模型的VIP值及<0.05筛选出OA模型中69种差异表达代谢物。通过建立第8周和第14周各给药组样本的S-plot图,从淫羊藿组、川芎组、淫羊藿-川芎组和阳性药物组中筛选出16种差异表达代谢物,鉴定出2个潜在的生物标志物(表1和图7)。Lyso PC(16∶0)水平下调,该生物标志物仅受淫羊藿-川芎的调控,提示淫羊藿与川芎联合用药可能增强对OA代谢物的调控。
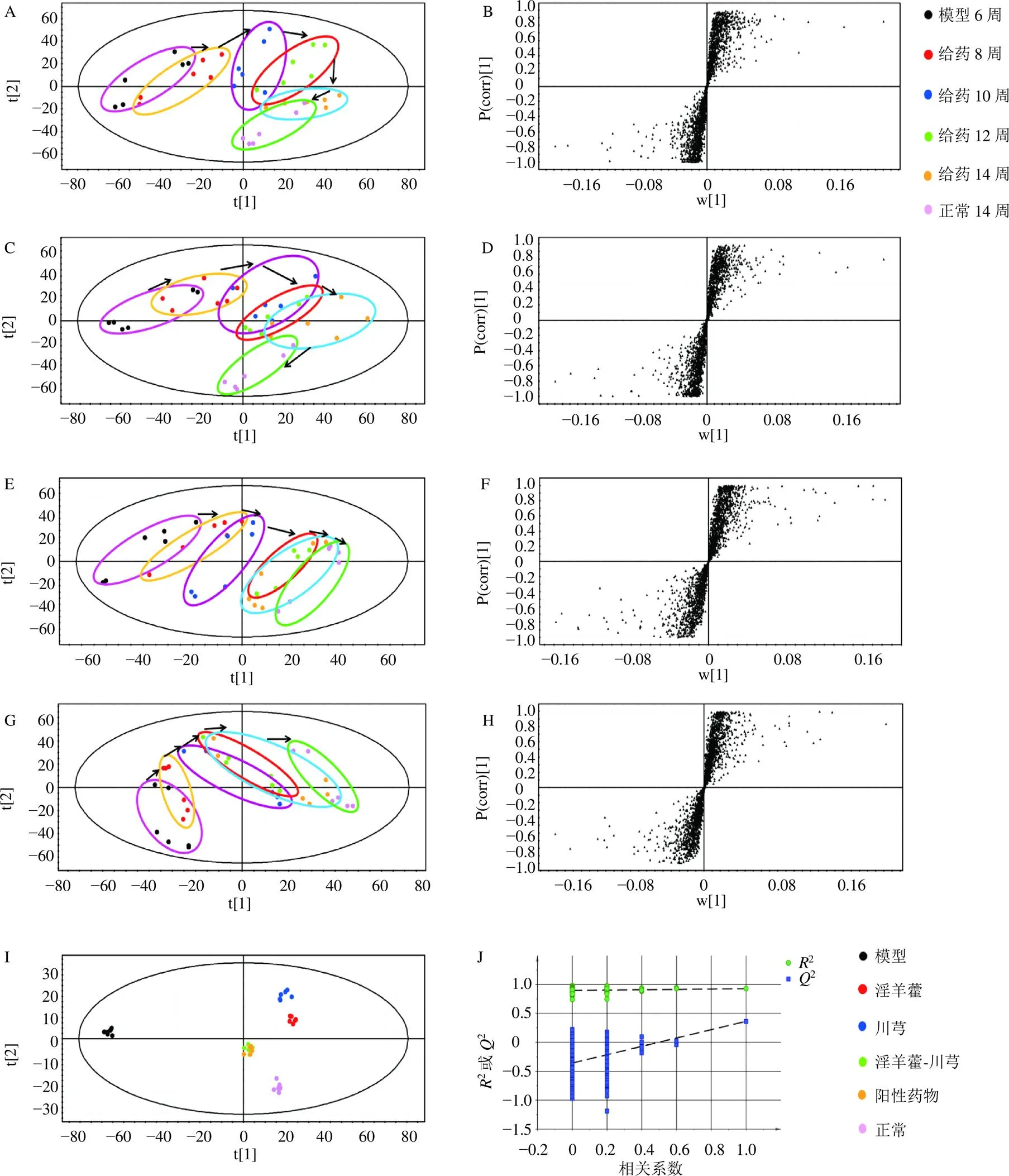
A、B-正常、模型和淫羊藿组的PLS-DA得分图及其S-plot图 C、D-正常、模型和川芎组的PLS-DA得分图及其S-plot图 E、F-正常、模型和淫羊藿-川芎组的PLS-DA得分图及其S-plot图 G、H-正常、模型和阳性药物组的PLS-DA得分图及其S-plot图 I、J-给药8周血浆代谢物OPLS-DA得分图及其模型验证图
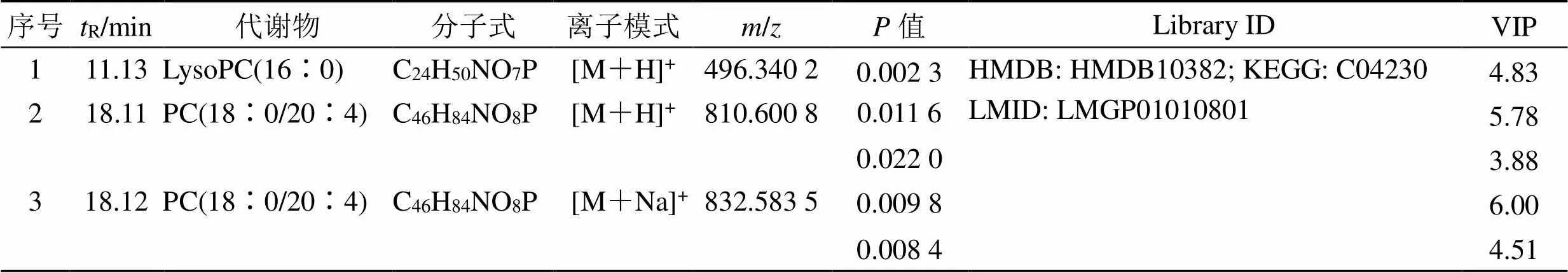
表1 差异代谢物含量变化情况
LysoPC-溶血磷脂酰胆碱 PC-磷脂酰胆碱
LysoPC-lysophosphatidyl choline PC-phosphatidyl choline
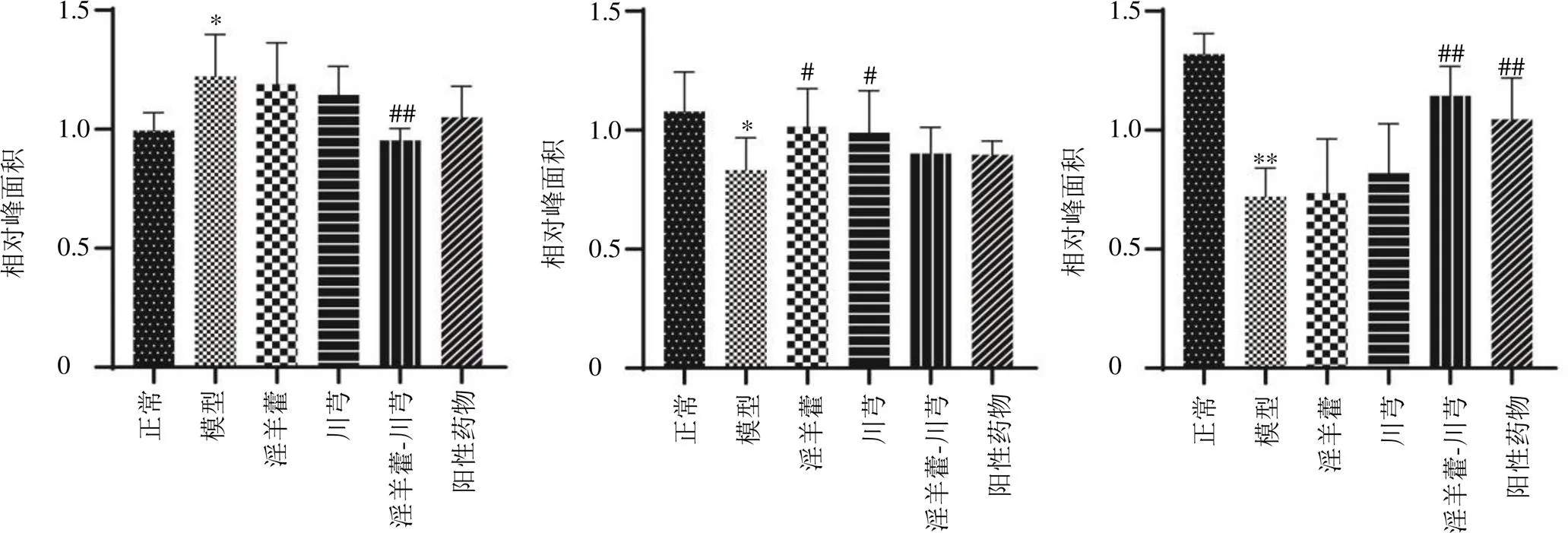
与正常组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.6 血浆的代谢通路分析
潜在的生物标志物属于甘油磷脂,如LysoPC、PC,与磷脂代谢通路相关,代谢途径可能为OA的发病机制及淫羊藿-川芎对OA大鼠作用机制提供依据。
4 讨论
本研究采用UPLC-Q-TOF-MS技术经时评价OA造模过程中血浆内源性代谢物和MMP-13水平的动态变化,直观揭示了OA大鼠模型在代谢层面的发病轨迹,有助于为OA的早期诊断提供依据。研究了淫羊藿-川芎配伍对OA大鼠代谢的调控作用,给药后各组代谢轮廓变化及回调,其结果与组织病理学和MMP-13评价的药效作用一致,证明了其配伍治疗OA的合理性。初步获得2个生物标志物,分别为LysoPC(16∶0)和PC(18∶0/20∶4),与磷脂代谢通路相关。
课题组前期考察淫羊藿-川芎不同配比(1∶1、1∶2、2∶1)对OA大鼠的药效作用,病理组织学(HE、SO染色),MMP-13、IL-1β检测结果表明淫羊藿、川芎以1:1配伍使对OA大鼠的药效作用最佳。故选择淫羊藿-川芎(1∶1)研究其配伍机制。
经时评价OA造模过程中,第6周OA模型建立,第8周OA病变进一步加重。一般药物干预主要对早期和中期OA有效。为体现OA早期诊断、早期治疗的理念,本研究选择造模后6周进行药物干预研究。随着造模时间的延长,模型组大鼠血浆中MMP-13表达水平逐步升高,提示可将MMP-13的表达水平作为评价OA模型建立的一个评价指标。给药后,各给药组血浆中MMP-13水平随给药时间的延长而逐步降低,提示MMP-13水平可用于疗效评价。
本研究初步获得2个生物标志物,分别为LysoPC(16:0)和PC(18∶0/20∶4),LysoPCs和PCs是脂质双分子层的组成部分,可以调节跨膜信号传导[18]。OA与磷脂的结构和浓度的变化密切相关。PCs的缺乏,特别是含有长链脂肪酸的不饱和PCs,可能会增加摩擦并导致关节软骨损伤[19]。PCs可通过磷脂酶A2(PLA2)水解生成LysoPCs,而OA软骨细胞中PLA2的高表达可促进IL-1β、TNF等炎性因子的表达[20-21]。Zhang等[22]研究发现,LysoPCs与PCs的比率可用于预测OA,与正常人相比,OA患者血浆中LysoPCs水平较高,PCs水平较低。氧化应激反应也可导致OA,当活性氧存在时,可以促使PCs转化为LysoPCs[23]。OA软骨细胞、滑膜成纤维细胞和脂肪细胞均可产生造成机械、生化刺激的活性氧和一氧化氮。中性粒细胞可以通过释放蛋白水解酶混合物以结合活性氧,导致软骨组织破坏[24-26]。
本研究从代谢组学层面初步揭示淫羊藿-川芎对OA大鼠的作用机制,证明其配伍合理性,动态监测OA进展和淫羊藿-川芎治疗情况的结果,为探索中医药治疗OA代谢组学的潜在疗效和机制提供了更有效的途径。
利益冲突 所有作者均声明不存在利益冲突
[1] Katz J N, Arant K R, Loeser R F. Diagnosis and treatment of hip and knee osteoarthritis: A review [J]., 2021, 325(6): 568-578.
[2] Kolasinski S L, Neogi T, Hochberg M C,. 2019 American college of rheumatology/arthritis foundation guideline for the management of osteoarthritis of the hand, hip, and knee [J]., 2020, 72(2): 149-162.
[3] Chen G C, Ye X L, Guan Y X,. Effects of Bushen Huoxue method for knee osteoarthritis: A protocol for systematic review and meta-analysis [J]., 2020, 99(24): e20659.
[4] Xiang C, Liao Y L, Chen Z Y,. Network pharmacology and molecular docking to elucidate the potential mechanism ofagainst osteoarthritis [J]., 2022, 13: 854215.
[5] 李远栋, 王世坤, 杨东元, 等. 淫羊藿苷防治膝骨性关节炎作用机制的研究进展[J]. 中草药, 2023, 54(8): 2652-2658.
[6] 王杰, 隗鑫, 陈威, 等. 代谢组学技术在中药复方配伍规律研究中的应用 [J]. 中草药, 2022, 53(5): 1528-1539.
[7] Mobasheri A, Rayman M P, Gualillo O,. The role of metabolism in the pathogenesis of osteoarthritis [J]., 2017, 13(5): 302-311.
[8] de Sousa E B, Junior dos Santos G C, Duarte M E L,. Metabolomics as a promising tool for early osteoarthritis diagnosis [J]., 2017, 50(11): e6485.
[9] Zheng L L, Zhang Z J, Sheng P Y,. The role of metabolism in chondrocyte dysfunction and the progression of osteoarthritis [J]., 2021, 66: 101249.
[10] Hu Q C, Ecker M. Overview of MMP-13 as a promising target for the treatment of osteoarthritis [J]., 2021, 22(4): 1742.
[11] Moon M H, Jeong J K, Lee Y J,. SIRT1, a class III histone deacetylase, regulates TNF-α-induced inflammation in human chondrocytes [J]., 2013, 21(3): 470-480.
[12] Pan L H, Zhang Y H, Chen N,. Icariin regulates cellular functions and gene expression of osteoarthritis patient-derived human fibroblast-like synoviocytes [J]., 2017, 18(12): 2656.
[13] Ziadlou R, Barbero A, Martin I,. Anti-inflammatory and chondroprotective effects of vanillic acid and epimedin C in human osteoarthritic chondrocytes [J]., 2020, 10(6): 932.
[14] Shao M L, Lv D W, Zhou K,. Senkyunolide A inhibits the progression of osteoarthritis by inhibiting the NLRP3 signalling pathway [J]., 2022, 60(1): 535-542.
[15] Chen M P, Yang S H, Chou C H,. The chondroprotective effects of ferulic acid on hydrogen peroxide-stimulated chondrocytes: Inhibition of hydrogen peroxide-induced pro-inflammatory cytokines and metalloproteinase gene expression at the mRNA level [J]., 2010, 59(8): 587-595.
[16] 任红, 汪轩, 张琳, 等. 正交试验法优选淫羊藿-川芎药对的配伍提取工艺 [J]. 中国中药杂志, 2015, 40(9): 1727-1731.
[17] 陈文钧, 骆媱, 章建华, 等. 淫羊藿-川芎药对中8个成分的定量分析方法研究 [J]. 中药材, 2020, 43(12): 2983-2987.
[18] Gibellini F, Smith T K. The Kennedy pathway: De novo synthesis of phosphatidylethanolamine and phosphatidylcholine [J]., 2010, 62(6): 414-428.
[19] Kosinska M K, Ludwig T E, Liebisch G,. Articular joint lubricants during osteoarthritis and rheumatoid arthritis display altered levels and molecular species [J]., 2015, 10(5): e0125192.
[20] Law S H, Chan M L, Marathe G K,. An updated review of lysophosphatidylcholine metabolism in human diseases [J]., 2019, 20(5): 1149.
[21] Leistad L, Feuerherm A J, Faxvaag A,. Multiple phospholipase A2 enzymes participate in the inflammatory process in osteoarthritic cartilage [J]., 2011, 40(4): 308-316.
[22] Zhang W D, Sun G, Aitken D,. Lysophosphatidylcholines to phosphatidylcholines ratio predicts advanced knee osteoarthritis [J]., 2016, 55(9): 1566-1574.
[23] Wallner S, Schmitz G. Plasmalogens the neglected regulatory and scavenging lipid species [J]., 2011, 164(6): 573-589.
[24] Bolduc J A, Collins J A, Loeser R F. Reactive oxygen species, aging and articular cartilage homeostasis [J]., 2019, 132: 73-82.
[25] Glennon-Alty L, Hackett A P, Chapman E A,. Neutrophils and redox stress in the pathogenesis of autoimmune disease [J]., 2018, 125: 25-35.
[26] Grange L, Nguyen M V, Lardy B,. NAD(P)H oxidase activity of Nox4 in chondrocytes is both inducible and involved in collagenase expression [J]., 2006, 8: 1485-1496.
Effects ofRhizoma on osteoarthritic rats based on UPLC-Q-TOF-MS metabonomics
WU En-hui1, ZHANG Jian-hua2, ZHANG Lin1, LI Qing-lin1, WANG Ling1, YIN Hua1
1. Research Laboratory for Standardization of Chinese Medicines Research Laboratory, School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 311402, China 2. Department of Osteopathy and Traumatology, the First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310006, China
To investigate the plasma metabolic profile of rats with osteoarthritis (OA) and regulatory effects of Yinyanghuo ()-Chuanxiong () on metabolism of osteoarthritic rats based on ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF-MS) metabonomics technology.SD rats were randomly divided into normal group, sham group, model group, pathological evaluation group during the process of OA modeling,group,group,-group (40 g/kg), and positive drug group (glucosamine hydrochloride 0.12 g/kg + celebrex 1.00 g/kg). Osteoarthritis model was established by cruciate ligament-meniscus injury surgery in model group, pathological time evaluation group and administration groups, and corresponding drug interventions were given to each drug administration group at 6th week of modelling. Equal amount of distilled water was given to the normal and model groups. Plasma was collected from rats at 0, 2, 4, 6, 8, 10, 12 and 14 weeks. The drug efficacy was evaluated by pathological histology and the results of matrix metalloproteinase-13 (MMP-13) assay. The plasma metabolic profiles of rats were analyzed by UPLC-Q-TOF-MS technology, and changes in plasma metabolism-related biomarkers were detected by combining with multivariate statistical analyses in each group.The level of MMP-13 was increased after four weeks of modelling (< 0.01) and decreased significantly after eight weeks of drug administration (< 0.01). Based on metabonomics, two potential biomarkers were found to be significantly changed in the plasma of rats in administration group, namely lysophosphatidylcholine (16∶0) and phosphatidylcholine (18∶0/20∶4), which were mainly involved in phospholipid metabolic pathway.andalone and the combination can reverse the differential metabolites for the treatment of osteoarthritis in rats, and the combination is more effective than the single use.
-; metabonomics; osteoarthritis; drug pair compatibility;lysophosphatidylcholine (16∶0); phosphatidylcholine (18∶0/ 20∶4); chlorogenic acid; ferulic acid; icariin; ligustilide
R285.5
A
0253 - 2670(2023)22 - 7445 - 10
10.7501/j.issn.0253-2670.2023.22.021
2023-07-31
国家自然科学基金面上项目(81874340);浙江省科技厅公益性技术应用研究计划项目(2014C33216)
吴恩慧(1999—),女,硕士研究生,研究方向为中药分析及新药研发。Tel: 17326083487 E-mail: weh_grace@163.com
通信作者:尹 华,教授,从事中药分析及新药研发研究。Tel: (0571)61768172 E-mail: maryyinhua@163.com
[责任编辑 李亚楠]
