人参皂苷Rg3抗肿瘤纳米给药系统研究进展
2023-11-27刘晓瑞张坤峰王向涛
刘晓瑞,张坤峰,李 鑫,王向涛*
人参皂苷Rg3抗肿瘤纳米给药系统研究进展
刘晓瑞1, 2,张坤峰2,李 鑫1*,王向涛1, 2*
1. 哈尔滨商业大学药学院,黑龙江 哈尔滨 150076 2. 中国医学科学院北京协和医学院药用植物研究所,北京 100193
人参皂苷Rg3(ginsenoside Rg3,Rg3)是人参中主要的活性成分之一,具有广泛的药理活性,尤其在抗肿瘤研究方面备受关注。然而,Rg3在水中溶解度差和生物利用度低等问题极大地限制了Rg3的临床应用。纳米给药系统在改善Rg3水溶性差、延缓Rg3体内代谢等方面取得了一定的进展,并已开发出具有不同诊疗功能的Rg3纳米药物,显著提高了Rg3的抗癌效果。通过对近年来Rg3纳米药物及其在抗肿瘤方面的研究进行综述,为Rg3的进一步研究提供参考。
人参皂苷Rg3;抗肿瘤;纳米给药系统;生物利用度;纳米医学
癌症是人类死亡的主要原因之一[1]。研究发现,仅2020年全球就有近1000万人因癌症去世[2]。放射治疗、手术和化疗是治疗癌症的主要方法,然而化疗药物在杀伤肿瘤细胞的同时,因其非选择性也会杀伤正常细胞,容易导致严重的不良反应;同时,长期使用会产生耐药性,降低化疗药物的疗效[3]。天然产物,包括中草药的单体成分或提取物,用于肿瘤治疗时具有疗效好、毒性低等优点,相比于化疗药物,因其多成分、多靶点效应,在治疗疾病方面具有独特优势[4-5]。
人参为五加科植物人参C. A. Mey.的干燥根和根茎。具有大补元气、复脉固脱、补脾益肺、生津止渴、安神益智等功效。几千年来,人参被认为是医学中最有价值的药用植物之一,被誉为“百补之王”。人参含有多种化学成分,其中皂苷被认为是人参发挥功效的主要活性成分。人参皂苷Rg3(ginsenoside Rg3,Rg3)是从人参茎叶或根中分离出来的一种四环三萜皂苷[6]。大量研究表明,Rg3具有抗肿瘤[7]、抗氧化[8]、抗炎[9]、降血糖[10]、抗抑郁[11]、神经保护[12]等多种药理活性。其中Rg3抗肿瘤作用近年来备受关注[3,13-14],对乳腺癌[15]、结肠癌[16]、胆囊癌[17]、胃癌[18]、肺癌[19]、肝癌[20]、卵巢癌[21]等均有一定的疗效,不仅可以预防肿瘤的转移和复发,还能促进肿瘤细胞凋亡、抑制肿瘤细胞增殖分化、减少肿瘤血管生成[7]。以Rg3为主要成分的参一胶囊是国内首批上市的肿瘤新生血管抑制剂,可作为常规癌症治疗的辅助药物,并与化疗药物协同提高疗效或减少不良反应[3,22-23]。Rg3与常用化疗药物紫杉醇[24]、多西他赛[25]、顺铂[26]、5-氟尿嘧啶[27]、索拉非尼[28]等联合使用可显著提高治疗效果并降低毒性。然而,Rg3水溶性差,易被胃酸分解和肠道菌群代谢,导致口服生物利用度极低,限制了其临床疗效的发挥[29-30]。Qian等[31]通过研究Rg3在大鼠体内药动学中发现,大鼠iv Rg35 mg/mL,其半衰期为18.5 min,ig 100 mg/kg后在血液中未检测到Rg3,排泄物中仅能检测到0.97%~1.15%的原型药物。受试者单次Rg33.2 mg/kg后检测到最大血药浓度(max)仅为(16±6)ng/mL[32];Rg3在大鼠体内的绝对生物利用度仅为2.63%[33]。
纳米给药系统是指将目标药物包封于药用载体中,形成粒径为10~1000 nm的药物递送系统,其中包括脂质体、胶束、乳剂、聚合物纳米粒、纳米晶等[34-35]。纳米给药系统不仅可以提高药物在肠道环境的稳定性,还能改善药物的溶解性和对脂质膜的渗透性,从而提高口服生物利用度。iv的纳米药物,还可由于高通透性和高滞留(enhanced permeability and retention,EPR)效应,而在肿瘤或炎症组织中聚集,提高对肿瘤和炎症的治疗效果[34,36]。本文对Rg3不同类型的纳米药物及其抗肿瘤作用进行综述,并总结了近10年有关负载Rg3纳米给药系统抗肿瘤作用的研究进展。
1 Rg3脂质体
脂质体最早由Bangham等[37]发现并命名,于20世纪70年代由Gregoriadis等[38]最先开发为药物载体。脂质体是由磷脂双层组成的球形囊泡,具有与生物膜相似的脂质双分子层结构(图1),根据层数分为单层或多层,单层囊泡可细分为小单层和大单层囊泡[39-40]。脂质体具有良好的生物相容性,可装载亲水性和亲脂性药物,主动靶向修饰增强药物对肿瘤组织的递送效率,增强肿瘤细胞对药物的摄取,从而提高抗肿瘤效果[41-43]。目前,脂质体是医疗应用最为广泛的纳米载体之一[44-45]。
郑淇予[46]采用乙醇注入法制备了Rg3脂质体,脂药比为15∶1,其粒径、ζ电位、多分散系数(polymer dispersibility index,PDI)值分别为93.95 nm、−2.42 mV和0.138,Rg3包封效率为94.57%。体外细胞实验证实Rg3通过降低细胞周期蛋白水平,从而诱导G1期细胞周期停滞。当给药浓度高于20 μmol/L时,Rg3脂质体相比单体对人肝癌Bel-7402细胞和HCCLM3细胞表现出更明显的癌细胞抑制作用。
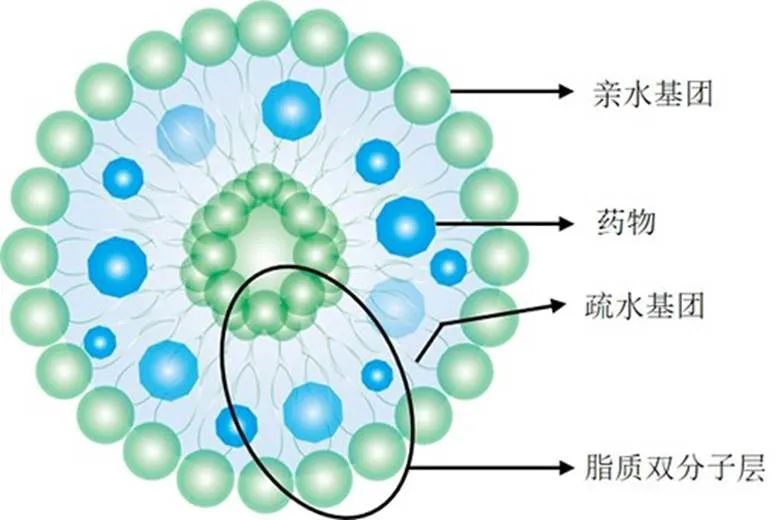
图1 脂质体结构
Wang等[47]采用pH梯度法制备了熊果酸(ursolic acid,UA)和Rg3共载脂质体(UA+Rg3-LIP),平均粒径(181.6±4.1)nm,ζ电位为(−33.3±1.4)mV,其中Rg3的包封率为71.68%,24 h内在体外释放接近100%,相比游离的Rg3(10 h内释放100%)具备更好的缓释效果。噻唑蓝(methyl thiazolyl tetrazolium,MTT)比色法和流式细胞术结果表明,UA+Rg3-LIP可高效抑制人肝癌HepG2细胞的生长和增殖,显著诱导HepG2细胞凋亡,同时提高G0/G1期细胞比例,降低S期细胞比例,并表现出一定的剂量相关性。
Zhu等[48]采用薄膜水化法,以Rg3-EPC-PTX(6∶20∶3)的质量比制备了共载紫杉醇(paclitaxel,PTX)和Rg3脂质体(Rg3-PTX-LIP),粒径(88.70±0.99)nm,包封率和载药量分别为97.35%和20.15%。Rg3- PTX-LIP易被过表达葡萄糖转运蛋白-1(glucose transporter-1,GLUT-1)的人乳腺癌MCF-7/T细胞高效摄取,较游离药物显示出更好的细胞毒性,半数抑制浓度(median inhibition concentration,IC50)值降低近4倍。另外,Rg3-PTX-LIP还可以靶向乳腺癌肿瘤组织,逆转癌症耐药,与游离的药物和普通脂质体相比表现出更显著的抗肿瘤效果,抑瘤率高达90.3%。Rg3-PTX-LIP还可在一定程度上重塑肿瘤微环境,抑制肿瘤新生血管的生成及相关纤维细胞的表达。
Miao等[49]构建了以叶酸(folic acid,FA)为靶向配体的聚(2-乙基-噁唑啉)-胆固醇碳酸甲酯(FA- PEOz-CHMC),以其为靶向材料通过薄膜分散法制备了FA-PEOZ-CHMC修饰的Rg3脂质体(FA- PEOZ-CHMC-Rg3-LIP),平均粒径、PDI和ζ电位分别为100 nm、0.16和−30 mV,包封率为90.07%。体外抗肿瘤实验采用乳腺癌4T1细胞,FA-PEOZ- CHMC-Rg3-LIP组的IC50值为37.74 μg/mL,显著低于Rg3-LIP(53.26 μg/mL)和Rg3溶液(73.46 μg/mL)。体内抗肿瘤实验中,FA-PEOZ-CHMC-Rg3-LIP和Rg3-LIP组的肿瘤体积显著小于对照组,其中FA- PEOZ-CHMC-Rg3-LIP组的肿瘤体积更小,同时改善了三阴性乳腺癌(triple-negative breast cancer,TNBC)小鼠肿瘤纤维化程度。
Xia等[50]采用薄膜水合法制备了一种负载多西紫杉醇(docetaxel,DTX)的多功能Rg3脂质体(Rg3-LIP/DTX),平均粒径为(80.3±3.7)nm,载药量和包封率分别为6.5%和91%。其中Rg3既可作为膜材料替代胆固醇以保持脂质体的稳定性和流动性,也能以其结构中的糖基作为靶向配体与肿瘤细胞末上高表达的GLUT-1进行特异性识别靶向肿瘤,同时作为化学增敏剂与DTX协同作用提高抗肿瘤效果。Rg3-LIP/DTX较单独使用DTX对4T1细胞显示出更好的细胞毒性(IC50值降低近10倍)。此外,Rg3-LIP/DTX通过主动靶向循环肿瘤细胞并防止“转移生态位”的形成,成功抑制TNBC的转移,与溶液、传统脂质体和市售的DTX胶束相比,疗效均有不同程度的提高。
2 Rg3纳米粒
纳米粒是一种由天然或合成聚合物组成的纳米级药物递送系统,粒径通常为10~1000 nm,药物分子可以均匀分布在整个基质材料中(图2),用于改善药物分子在体内的药动学和药效学[51]。
El-Banna等[52]使用乳清蛋白分离物(whey protein isolate,WPI)、麦芽糊精(maltodextrin,MD)、阿拉伯树胶(gum arabic,GA)合成了Rg3纳米颗粒(Rg3-NPs),平均粒径为20 nm,ζ电位为−5.58 mV,外观呈球形。体内实验数据表明,不同剂量的Rg3-NPs和Rg3单体均可呈剂量相关性降低埃利希实体瘤小鼠的肿瘤体积,Rg3-NPs抗肿瘤效果显著优于游离药物。
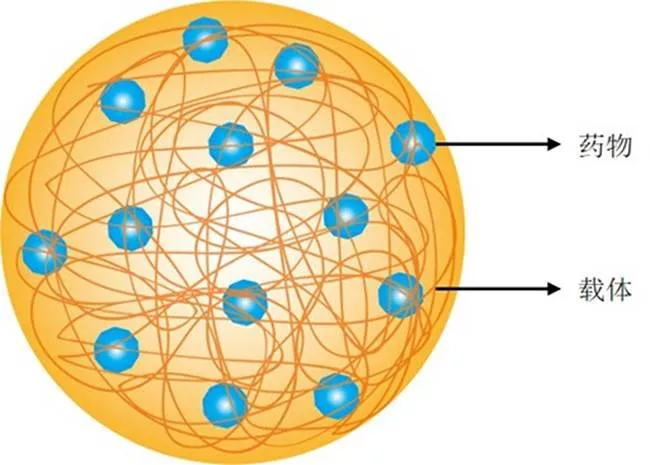
图2 纳米粒结构
Zhang等[53]通过酯化反应合成了mPEG-Rg3,以牛血清白蛋白(bovine serum albumin,BSA)为载体制备了Rg3纳米颗粒(mPEG-Rg3-BSA NPs),粒径149.5 nm,PDI为0.117,ζ电位为−40.2 mV,呈均匀的球形,载药量和包封率分别为17.65%和76.56%。该纳米粒常温放置18 d内粒径无明显变化,120 h内累积释放率为85.8%,具备良好的缓释特性。MTT结果显示mPEG-Rg3-BSA NPs对正常细胞的低毒性及对HepG2细胞和人肺癌A549细胞的选择性能力,较游离药物显著增强了对肿瘤细胞的抑制效率。细胞膜荧光探测红外(detecting infrared rays,DIR)标记的mPEG-Rg3-BSA NPs在肿瘤中的积累比游离的DIR更好,肿瘤部位的荧光强度是游离DIR的5.4倍。
Qiu等[54]合成了聚乙二醇-嵌段-聚(-谷氨酸-共--苯丙氨酸)用以包封Rg3得到Rg3-NPs,平均粒径为90 nm,载药量和包封率分别为8.9%和82.4%,呈现均匀的球形,常温放置7 d内稳定性良好。Rg3-NPs对人结肠癌SW480、SW620、CL40细胞均表现出剂量相关性的细胞毒性,尤其当给药浓度高于100 μmol/L时,Rg3-NPs组的癌细胞活力显著低于对照组。在结肠癌小鼠模型中,游离的Rg3主要聚集在肝脏和肾脏组织中,而Rg3-NPs中的Rg3主要聚集在肿瘤组织,实现了肿瘤靶向作用,并且Rg3-NPs相比游离的Rg3具有更好的肿瘤生长抑制效率,肿瘤体积和重量均为最低。
Zuo等[55]采用纳米沉淀法制备了由Rg3和Rb1组成(质量比1∶5)的无载体纳米颗粒(Rg3-Rb1NPs),粒径为(120±20)nm,透射电子显微镜(transmission electron microscope,TEM)显示为规则的球形结构。因其无载体成分,进而具备更高的载药量和安全性。在4T1荷瘤鼠模型中,Rg3-Rb1NPs较游离的Rg3和Rb1表现出更明显的抗肿瘤和抗侵袭作用,肿瘤生长最为缓慢,肿瘤体积最小。毒理学实验验证了Rg3-Rb1NPs不会对其他器官产生病理损伤,具备良好的生物安全性。
Su等[56]以聚乙二醇-聚已内酯(polyethylene glycol-polycaprolactone,PEG-PCL)为载体采用乳液溶剂蒸发法制备了血管蛋白-2(angiopep-2,ANG-2)功能化的Rg3纳米颗粒(ANG-Rg3NPs)。ANG-2对低密度脂蛋白受体相关蛋白-1具有较高的亲和力,旨在实现靶向递送被包封的Rg3。TEM显示ANG-Rg3NPs呈现均匀的球形,平均粒径(147.1±2.7)nm,载药量和包封率分别为(27.2±1.4)%和(80.6±3.0)%,体外96 h内累积释放率为78.74%,相比Rg3溶液(12 h释放90%)具备一定的缓释特性。体外细胞实验中,ANG-Rg3NPs与游离的Rg3和Rg3NPs相比,对大鼠胶质瘤C6细胞的增殖表现出更强的抑制效率,孵育48 h的IC50值为348 μg/mL,显著低于游离Rg3(540 μg/mL)和Rg3NPs(434 μg/mL)。并且ANG-Rg3NPs可以有效地穿透血脑屏障,特异性在C6细胞中积累,加速了C6细胞的摄取。
3 Rg3胶束
聚合物胶束(polymeric micelles,PM)是由两亲性聚合物在水中自组装形成的,具有疏水性内核与亲水性外壳的特殊结构[57-58](图3)。其中疏水性嵌段构建的疏水核心,可以容纳水溶性差的药物;亲水链形成的外壳,赋予了胶束良好的水溶性,具备空间位阻稳健性和抵抗与内源性物质相互作用的能力[59-62]。
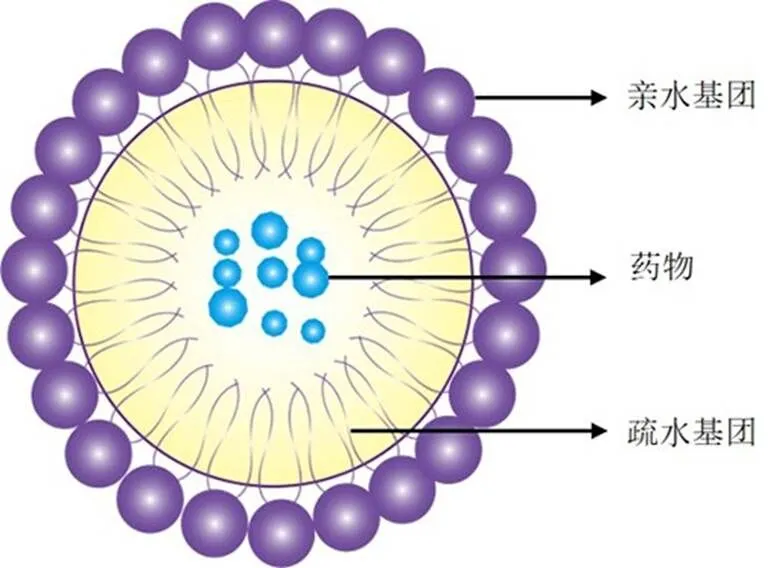
图3 胶束结构
Li等[63]将普朗尼克F127(Pluronic F127,PF127)自组装成PM包封递送Rg3。所制备的P-Rg3胶束粒径(49.44±0.15)nm,PDI为0.340±0.001,包封率高达96%,TEM显示为均匀的球形结构,体外72 h内累积释放率为80%,溶解度相比Rg3单体提高了50~200倍。药动学研究表明,以单次ig P-Rg350 mg/kg后检测大鼠血浆中P-Rg3的药时曲线下面积(area under the curve,AUC)约为Rg3的3.2倍,显著提高了Rg3的口服生物利用度。P-Rg3与多柔比星(doxorubicin,DOX)联合使用时具有化学增敏作用,可增加DOX在4T1细胞中的抑制效率,促进药物在乳腺肿瘤组织中的分布,表现出更好的体内抑瘤率。此外,P-Rg3还可减轻DOX引起的心脏毒性和线粒体损伤,达到“双重”治疗效果。
Yu等[64]通过薄膜分散法制备了基于Rg3的胆盐-磷脂酰胆碱(bile salt-phosphatidylcholine,BS-PC)混合胶束系统(Rg3BS-PC-MIC),平均粒径20 nm,ζ电位为−28.13 mV,包封率高于90%。常温放置5 d后粒径发生变化,采用4倍质量的海藻糖作为冻干保护剂冻干保存。Rg3胶束较游离药物提高了对人黑色素瘤A375细胞的抑制效果。当Rg3胶束浓度增加到0.5 mmol/L时,雏鸡胚绒毛膜上皮新生血管全部消失。
孙瑞阳[65]合成了聚(2-乙基-2-噁唑啉)-胆固醇氯甲酸酯,通过薄膜分散法共包封Rg3和顺式乌头酸酐-阿霉素(-aconitic anhydride-doxorubiocin,CAD)制备了Rg3/CAD-M双载药胶束,TEM观察呈球形,粒径122.9 nm,ζ电位为−2.06 mV,对Rg3的包封率为65.07%。Rg3/CAD-M对人恶性肿瘤U87细胞和MCF-7细胞的增殖均具有一定的抑制效果,且抑制效率显著高于游离药物和单一胶束。
付淑凤[66]以甲氧基聚乙二醇-聚乳酸共聚物(methoxy polyethylene glycol-polylactic acid,mPEG-PLLA)为载体,采用溶剂蒸发-薄膜分散法制备了药载比1∶9的Rg3载药胶束,呈规整的圆球状,粒径、ζ电位、PDI分别为(142.1±8.9)nm、(−8.5±0.4)mV、0.145±0.017,包封率为91.2%。胶束提高了Rg3对HepG2细胞的生长抑制作用,并在接种HepG2细胞的小鼠体内表现出相似的结果。
4 Rg3-纳米结构脂质载体(nanostructured lipid carrier,NLC)
NLC已被引入为新一代固体脂质纳米颗粒(solid lipid nanoparticles,SLN),NLC是由固体和液体脂质的混合物而组成的部分结晶脂质系统,通过用液体脂质代替一部分固体脂质来形成药物而开发[67](图4)。与SLN相比,NLC具备更高的稳定性和载药能力,并且增加了药物释放调节、提高脂溶性药物的口服吸收等优势,是一种极具发展前景的新型纳米给药体系[68-69]。
杨青等[70]构建了以普鲁兰多糖(pullulan,PUL)修饰的Rg3-NLC(PUL-Rg3-NLC),粒径、PDI、ζ电位分别为(102.00±1.89)nm、0.145±0.019、(−15.93±0.91)mV,Rg3的载药量和包封率为6.11%和89.91%。体外MTT、细胞凋亡、划痕和侵袭等实验对人胃腺癌BGC-823细胞均表现出一定的抗肿瘤效果,其中PUL-Rg3-NLC组的IC50值较Rg3和Rg3-NLC分别降低了41.4%和20.1%,细胞凋亡作用分别提高了98.9%和47.8%,细胞划痕愈合率分别降低了47.8%和30.3%。
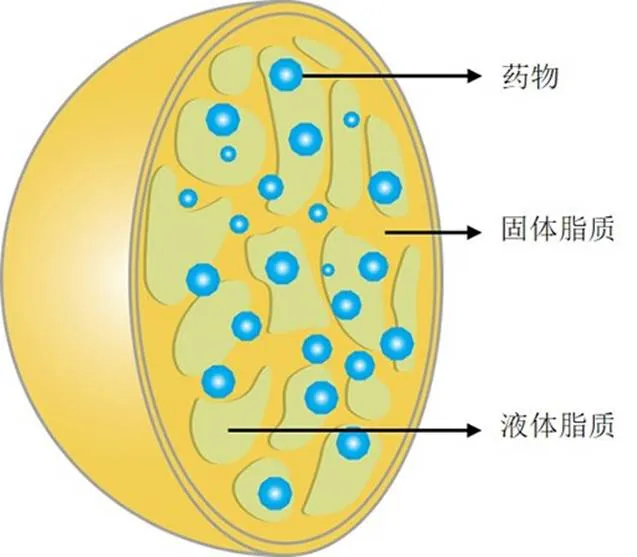
图4 NLC结构
赵程程[71]通过超声溶剂分散法制备的Rg3-NLC经过透明质酸(hyaluronic acid,HA)修饰后,HA-Rg3-NLC的粒径、PDI、ζ电位分别为(165.00±3.84)nm、0.227±0.001和(−22.87±0.97)mV。大鼠体内药动学研究发现,药物在制成纳米制剂后可显著延长药物在体内的滞留时间,达到长循环的效果。药物组织分布显示,HA-Rg3-NLC相比Rg3溶液,在提高肿瘤靶向性的同时还降低了肝肾的毒性。此外,HA-Rg3-NLC可主动靶向人肝癌SMMC-7721细胞,将药物大量富集于SMMC-7721细胞内部。
孙爽等[72]制备了同时包载齐墩果酸(oleanolic acid,OA)、UA和Rg3的纳米脂质载体,并采用HA作为靶向因子进行修饰,得到的纳米脂质载体(HA-OUR-NLC)粒径、PDI值及ζ电位分别为(172.30±2.84)nm、0.227±0.010、(−22.87±0.97)mV,形态圆整且分布均匀,与溶液组相比具有一定的缓释长效作用。细胞摄取和MTT实验结果表明,HA-OUR-NLC可被SMMC-7721细胞所摄取,并对SMMC-7721细胞增殖有抑制作用。
5 Rg3-纳米乳
纳米乳是纳米级别的乳液,尺寸范围从几十到几百纳米不等,典型的纳米乳剂由油相、水相和表面活性剂组成[73](图5)。其粒径较小,物理稳定性好而优于普通乳剂,给药途径多样,可克服常见微米级乳液的许多限制[74]。O/W型纳米乳,其油相中的药物可以经过肠道淋巴管的吸收和运输,避开肝门静脉递送至肝脏,避免首过效应[75]。目前,纳米乳可作为提高Rg3用药效率且具有良好前景的纳米给药系统之一。
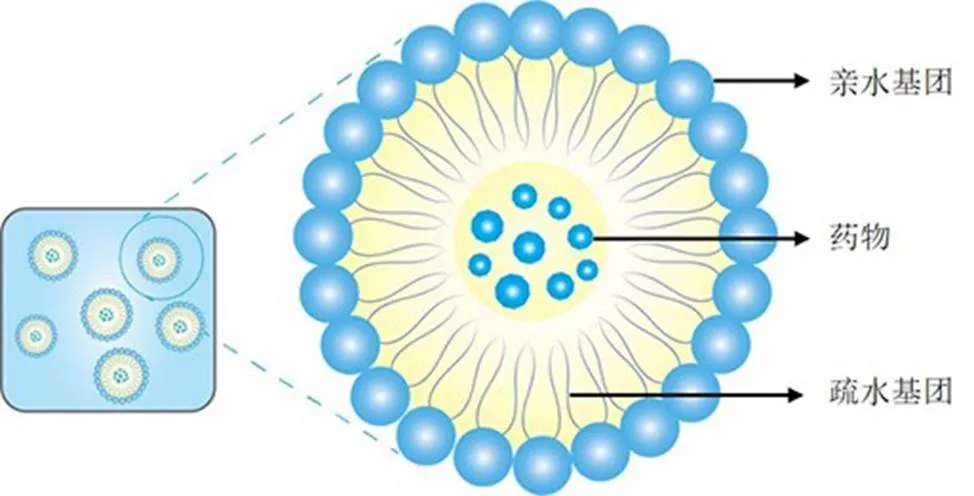
图5 O/W型纳米乳结构
张翡峰等[76]以辛癸酸甘油脂、聚氧乙烯氢化蓖麻油EL35、聚乙二醇400为油相、乳化剂和助乳化剂,制备了共载Rg3和大黄酸(rhein,Rhe)的纳米乳(Rg3/Rhe-NE),平均粒径、PDI、ζ电位分别为(84.8±1.1)nm、(0.21±0.02)和(−11.3±0.43)mV,Rg3和Rhe包封率分别为96.51%、97.47%。体内肿瘤药效学显示,纳米乳较游离药物显著抑制了乳腺癌模型小鼠肿瘤的生长,与程序性死亡受体配体1单抗(anti-programmed cell death ligand 1,aPD-L1)联用效果更佳。
丁健[77]观察了Rg3-纳米乳对胃癌荷瘤小鼠肿瘤生长、生存状态及淋巴结转移的情况。结果Rg3-纳米乳与化疗药5-氟尿嘧啶和生理盐水对照组相比,可显著抑制胃癌模型小鼠肿瘤的生长并提高其生存质量,抑瘤率为69.2%。Rg3-纳米乳组的淋巴转移率为37.5%,优于化疗药5-氟尿嘧啶(50%)和生理盐水(87.5%),原因可能是Rg3-纳米乳通过降低淋巴血管内皮生长因子(vascular endothelial growth factor,VEGF)-C及受体VEGFR-3的表达,减少肿瘤组织中淋巴管的生成,从而达到抑制肿瘤淋巴转移的目的。
6 Rg3-纳米混悬液(nanosuspension,NSP)
NSP是指采用少量的表面活性剂所稳定形成的“纯”药物纳米晶体,是一种无载体的纳米级胶体分散体系[78-82]。NSP作为纳米级药物递送系统之一,在过去几十年获得广泛关注,其能够加载比其他纳米颗粒更多的不溶性药物,具备更高的载药量[83-85]。
俞婷婷[86]采用沉淀法联合高压均质法制备了Rg3-NSP,粒径(284±14)nm,PDI为0.156±0.007,冷冻干燥后含Rg3为36.70 mg/g。常温放置30 d粒径无明显变化,展现了极佳的稳定性。在体外高浓度(50~200 μg/mL)给药时,对HepG2和A549细胞的抑制效率优于参一胶囊,展现了更好的抗肿瘤活性。
7 Rg3-自微乳给药系统(self-microemulsion drug delivery system,SMEDDS)
SMEDDS是由表面活性剂、助表面活性剂、油和少量水组成的均一透明的溶液,其特点是口服后可以在胃肠道的蠕动下自发分散形成粒径小于100 nm的水包油型乳剂[87-88]。与传统乳剂相比,SMEDDS具备更小的液滴尺寸,可作为疏水药物的载体,能显著提高难溶性药物的溶解度。口服后在胃肠道中可以快速吸收分布,形成易于通过胃肠道壁的水合层,增强对肠上皮细胞的渗透性。SMEDDS还可通过淋巴吸收克服首过效应,并在一定程度上避免药物在胃肠道中酶的水解,有利于提高生物利用度,是目前发展前景良好的纳米给药系统之一[89-90]。
He等[91]制备了一种包含Rg3、灵芝多糖(polysaccharide,GLP)和冬凌草甲素(oridonin,ORI)的SMEDDS(RGO- SMEDDS),平均粒径为50~100 nm,3药联用可多途径抑制肿瘤生长,包括减少免疫抑制细胞因子的产生、重塑免疫微环境、抑制信号通路及血管生成等。在体外功能实验中,SMEDDS不仅有效抑制了人肝癌Huh7细胞和HepG2细胞的增殖和侵袭、阻断了细胞周期,还降低了肝癌细胞诱导血管生成的能力,对Huh7细胞和HepG2细胞的抑制率分别为84.7%、86.3%。体内实验考察了裸鼠和C57BL/6肝癌模型小鼠,抑瘤率分别高达94.7%、90.0%,对肝癌肿瘤生长有显著的抑制效果。急毒实验中也未表现出明显的不良反应,安全性良好。
8 Rg3-量子点纳米粒(quantum dot nanoparticles,QDN)
量子点是近年来备受关注的粒径小于10 nm的荧光纳米材料,其表面具有很多易被修饰的官能团,在增加水溶性的同时赋予了优良的载药特性[92]。目前,量子点的表面修饰技术已较为成熟,其中表面配体能够以静电结合或共价结合的方式与药物分子偶联,形成以量子点为载体的纳米药物,进而实现药物分子在细胞或动物体内的荧光示踪研究。
佘亮[92]采用一步水热法制备了N掺杂的碳量子点(carbon quantum dot,CQDs),将其与BSA偶联并通过去溶剂化法成功制备了CQDs修饰的纳米粒BSA-CQDs-Rg3/DOX,粒径121 nm,PDI值为0.015,Rg3的载药量和包封率分别为7.74%、93.75%。在给药浓度达0.5 μg/mL时,BSA-CQDs- Rg3/DOX对A549细胞的抑制活性强于DOX及DOX/Rg3混合药物,不仅能被A549细胞吞噬,还可进入细胞核中发挥药效。在肺癌A549荷瘤裸鼠模型中,BSA-CQDs-Rg3/DOX的肿瘤抑制率为78%,光热疗法协同组抑瘤率为84%,显著高于Rg3溶液(37%)和BSA-CQDs-Rg3(62%),同时减轻游离药物DOX对心脏的不良反应。
9 Rg3-纳米复合物(nanocomplex,NC)
NC是以聚合物为基体连续相,以纳米尺寸的填充物为分散相,通过适当的制备方法将药物均匀分散在载体基质中而形成的NC。相较于传统剂型,NC具有非常多的优点,如粒径小、比表面积大、不容易受外界环境等因素的影响等,是目前常用的纳米给药系统之一[93]。
Lee等[94]制备了基于HA神经酰胺(HA ceramide,HACE)和脂质杂化的NC(HACE/EPC/ DSPE-PEG/Rg3)用于递送Rg3,其粒径为(134.50±5.62)nm、PDI为0.24±0.03。由于脂质与细胞膜间的相互作用,HACE/EPC/DSPE-PEG/Rg3对A549细胞的摄取率较HACE/Rg3有明显提高。大鼠体内药动学研究表明,Rg3在制备成NC后在体内的清除率大大降低,可能是杂化纳米结构和外部PEG链共同作用的结果。
10 Rg3-仿生纳米粒(biomimetic nanoparticle,BMNP)
BMNP是通过将天然或仿生细胞膜材料修饰合成于NPs表面,得到的BMNP可利用细胞膜表面蛋白质和多糖的功能使NPs免受免疫系统攻击,在具备更长效体内循环功能的同时还不会破坏NPs原有的理化性质[95]。同时,细胞膜修饰策略可以提高NPs的肿瘤靶向能力,不同的细胞膜来源可赋予NPs多样的肿瘤治疗作用,使BMNPs在肿瘤治疗领域表现出巨大潜力[96]。
Chen等[97]开发了一种基于血小板膜(platelet membrane,PM)包衣和Rg3/DOX共载的BMNP(DR@PLIP),粒径115 nm,ζ电位为−14.9 mV。TEM显示为明显的双层结构,与相关膜特征蛋白表达一致。急性骨髓系白血病(acute myeloid leukemia,AML)是一种起源于造血细胞的血液系统恶性肿瘤,将AML细胞系C1498 iv C57BL/6小鼠体内构建AML模型。其中PM用于长期循环和更好的靶向AML细胞,Rg3的参与可增强肿瘤对DOX的敏感性,从而启动抗肿瘤免疫激活,有效对抗隐藏在骨髓中的C1498细胞,从而达到治疗效果。
11 Rg3-包合物
包合物技术是一种超微型药物载体,主要是使用羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)为载体材料,药物分子被包合或嵌入HP-β-CD的筒状结构内形成的超微粒分散物,因其独特的空腔结构而被当作宿主分子,作为药物制剂的中间体可大量用于提高药物溶解度、增加药物稳定性,包合物还具有药用效果好、易于吸收、释药缓慢、不良反应低等优点[98-99]。
张明明[100]将Rg3与HP-β-CD(最佳物质的量比为1∶25)在40 ℃下采用磁力搅拌法3 h制备成包合物,Rg3溶解度增大了约19倍。张乃先等[101]通过水溶液搅拌法将Rg3与HP-β-CD进行包合,最佳包合率为86.11%,包合30 min时累积溶出度达73.43%,推断可能是包合物中Rg3的疏水性苷元部分嵌入HP-β-CD分子的疏水性空腔中,从而增加了Rg3在水中溶解度。
12 Rg3-固体分散体(solid dispersion,SD)
SD是指将药物以分子、无定型、微晶态等高度分散状态均匀分散在载体中形成的一种以固体形式存在的分散系统,可增加难溶性药物的溶出度、提高生物利用度、延缓药物释放、增加药物稳定性和液体药物固体化等用途[102]。
李健莹等[103]以醋酸羟丙基甲基纤维素琥珀酸酯(hydroxypropyl methylcellulose acetate succinate,HPMCAS)为载体制备了Rg3-SD,药物以非晶型状态存在,显著提高了Rg3的溶解度。徐杰[104]采用泊洛沙姆188和聚乙二醇6000作为载体通过溶剂法制备了Rg3-SD,有效提高了Rg3的水溶性和生物利用度。
13 结语与展望
综上所述,近年来关于Rg3的研究相对较少,且主要集中在药理活性及其机制研究。关于人参皂苷的制剂研究以纳米制剂居多,在不同程度上改善了Rg3原料药水溶性差、半衰期短、代谢快、生物利用度低等缺点,提高了疗效,iv的Rg3纳米药物还表现出一定的肿瘤聚集性,为Rg3高端制剂的研究和进一步增效奠定了基础。
但多数研究集中在体外的制备、表征和简单的体外药效,系统的体内研究相对较少。多数纳米制剂的制备工艺较为复杂,难以进行大规模工业化生产。一些纳米制剂在制备时需添加较多辅料从而导致载药量偏低,难以达到治疗作用所需的最低有效浓度。大多数研究仍停留在实验室阶段,很少有成功转化为临床试验和医疗实践的案例。相信随着纳米技术的发展和对Rg3药理活性、作用靶点及联用增效研究的深入,Rg3纳米药物在今后的研究中会更加成熟和完善。
利益冲突 所有作者均声明不存在利益冲突
[1] Bray F, Laversanne M, Weiderpass E,. The ever-increasing importance of cancer as a leading cause of premature death worldwide [J]., 2021, 127(16): 3029-3030.
[2] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[3] Sun M Y, Ye Y, Xiao L,. Anticancer effects of ginsenoside Rg3(review) [J]., 2017, 39(3): 507-518.
[4] Dai Y M, Wang W R, Sun Q C,. Ginsenoside Rg3promotes the antitumor activity of gefitinib in lung cancer cell lines [J]., 2019, 17(1): 953-959.
[5] Hong S Z, Cai W J, Huang Z C,. Ginsenoside Rg3enhances the anticancer effect of 5‑FU in colon cancer cells via the PI3K/Akt pathway [J]., 2020, 44(4): 1333-1342.
[6] 李媛, 高睿, 单颖, 等. 人参皂苷抗器官纤维化作用机制研究进展 [J]. 中草药, 2022, 53(7): 2237-2246.
[7] Liu Z Y, Liu T J, Li W,. Insights into the antitumor mechanism of ginsenosides Rg3[J]., 2021, 48(3): 2639-2652.
[8] Wang J, Zeng L, Zhang Y,. Pharmacological properties, molecular mechanisms and therapeutic potential of ginsenoside Rg3as an antioxidant and anti-inflammatory agent [J]., 2022, 13: 975784.
[9] Saba E, Jeong D, Irfan M,. Anti-inflammatory activity of Rg3-enriched Korean red ginseng extract in murine model of sepsis [J]., 2018, 2018: 6874692.
[10] Yang D, Li X, Fu Y H,. Metabolic study of ginsenoside Rg3and glimepiride in type 2 diabetic rats by liquid chromatography coupled with quadrupole-Orbitrap mass spectrometry [J]., 2021, 35(11): e9083.
[11] Kang A, Xie T, Zhu D,. Suppressive effect of ginsenoside Rg3against lipopolysaccharide-induced depression-like behavior and neuroinflammation in mice [J]., 2017, 65(32): 6861-6869.
[12] Han Y J, Wang T, Li C Y,. Ginsenoside Rg3exerts a neuroprotective effect in rotenone-induced Parkinson’s disease mice via its anti-oxidative properties [J]., 2021, 909: 174413.
[13] Nakhjavani M, Smith E, Townsend A R,. Anti-angiogenic properties of ginsenoside Rg3[J]., 2020, 25(21): 4905.
[14] 杨岩涛, 肖佳妹, 杨岩, 等. 基于上皮间质转化的人参活性成分抗肿瘤作用的研究进展 [J]. 中草药, 2021, 52(16): 5052-5061.
[15] Nakhjavani M, Palethorpe H M, Tomita Y,. Stereoselective anti-cancer activities of ginsenoside Rg3on triple negative breast cancer cell models [J]., 2019, 12(3): 117.
[16] Wang J, Zhao L, Gao X J. Ginsenoside Rg3induces low expression of lncRNA ATXN8OS to inhibit colon cancer metastasis [J]., 2023, 49(3): 562-570.
[17] Wu K R, Huang J, Li N,. Antitumor effect of ginsenoside Rg3on gallbladder cancer by inducing endoplasmic reticulum stress-mediated apoptosisand[J]., 2018, 16(5): 5687-5696.
[18] Zeng Z Z, Nian Q, Chen N Z,. Ginsenoside Rg3inhibits angiogenesis in gastric precancerous lesions through downregulation of Glut1 and Glut4 [J]., 2022, 145: 112086.
[19] 王蔚, 王旭, 余苏云, 等. 人参皂苷Rg3调节免疫检查点PD-L1抑制肺癌Lewis细胞增殖的作用及机制研究 [J]. 中草药, 2019, 50(1): 166-171.
[20] Ren Z G, Chen X M, Hong L J,. Nanoparticle conjugation of ginsenoside Rg3inhibits hepatocellular carcinoma development and metastasis [J]., 2020, 16(2): e1905233.
[21] Lu J J, Zhou Y Y, Zheng X,. 20()-Rg3upregulates FDFT1 via reducingto inhibit ovarian cancer progression [J]., 2020, 693: 108569.
[22] Xu Y, Peng W P, Han D,. Combined treatment of non-small-cell lung cancer using Shenyi Capsule and platinum-based chemotherapy: A Meta-analysis and systematic review [J]., 2020, 2020: 3957193.
[23] Pan L L, Zhang T T, Sun H Y,. Ginsenoside Rg3(Shenyi Capsule) combined with chemotherapy for digestive system cancer in China: A Meta-analysis and systematic review [J]., 2019, 2019: 2417418.
[24] Yang L Q, Wang B, Gan H,. Enhanced oral bioavailability and anti-tumour effect of paclitaxel by 20()-ginsenoside Rg3[J]., 2012, 33(8): 425-436.
[25] Kim S M, Lee S Y, Cho J S,. Combination of ginsenoside Rg3with docetaxel enhances the susceptibility of prostate cancer cells via inhibition of NF-kappaB [J]., 2010, 631(1/2/3): 1-9.
[26] Zhai J H, Gao H, Wang S,. Ginsenoside Rg3attenuates cisplatin-induced kidney injury through inhibition of apoptosis and autophagy-inhibited NLRP3 [J]., 2021, 35(11): e22896.
[27] Shan K Z, Deng Y J, Du Z Q,. Examination of combined treatment of ginsenoside Rg3and 5-fluorouracil in lung adenocarcinoma cells [J]., 2022, 2022: 2813142.
[28] Wei Q, Ren Y, Zheng X,. Ginsenoside Rg3and sorafenib combination therapy relieves the hepatocellular carcinomaprogression through regulating the HK2-mediated glycolysis and PI3K/Akt signaling pathway [J]., 2022, 13(5): 13919-13928.
[29] Kim H, Lee J H, Kim J E,. Micro-/nano-sized delivery systems of ginsenosides for improved systemic bioavailability [J]., 2018, 42(3): 361-369.
[30] Pan W L, Xue B L, Yang C L,. Biopharmaceutical characters and bioavailability improving strategies of ginsenosides [J]., 2018, 129: 272-282.
[31] Qian T X, Cai Z W, Wong R N,.rat metabolism and pharmacokinetic studies of ginsenoside Rg3[J]., 2005, 816(1/2): 223-232.
[32] 庞焕, 汪海林, 富力, 等. 20()-人参皂苷Rg3人体药代动力学研究 [J]. 药学学报, 2001, 36(3): 170-173.
[33] Xie H T, Wang G J, Sun J G,. High performance liquid chromatographic-mass spectrometric determination of ginsenoside Rg3and its metabolites in rat plasma using solid-phase extraction for pharmacokinetic studies [J]., 2005, 818(2): 167-173.
[34] Huang K X, Shi B, Xu W G,. Reduction-responsive polypeptide nanogel delivers antitumor drug for improved efficacy and safety [J]., 2015, 27: 179-193.
[35] 陈泳霖, 张文君, 张国锋, 等. 川芎嗪治疗心脑血管疾病的纳米载药系统的研究进展 [J]. 中国现代应用药学, 2022, 39(22): 3038-3044.
[36] Aminu N, Bello I, Umar N M,. The influence of nanoparticulate drug delivery systems in drug therapy [J]., 2020, 60: 101961.
[37] Bangham A D, Standish M M, Watkins J C. Diffusion of univalent ions across the lamellae of swollen phospholipids [J]., 1965, 13(1): 238-252.
[38] Gregoriadis G, Swain C P, Wills E J,. Drug-carrier potential of liposomes in cancer chemotherapy [J]., 1974, 303(7870): 1313-1316.
[39] Bruch G E, Fernandes L F, Bassi B L T,. Liposomes for drug delivery in stroke [J]., 2019, 152: 246-256.
[40] He H S, Lu Y, Qi J P,. Adapting liposomes for oral drug delivery [J]., 2019, 9(1): 36-48.
[41] Nakhaei P, Margiana R, Bokov D O,. Liposomes: Structure, biomedical applications, and stability parameters with emphasis on cholesterol [J]., 2021, 9: 705886.
[42] Olusanya T O B, Ahmad R R H, Ibegbu D M,. Liposomal drug delivery systems and anticancer drugs [J]., 2018, 23(4): 907.
[43] Li T, Cipolla D, Rades T,. Drug nanocrystallisation within liposomes [J]., 2018, 288: 96-110.
[44] Wang S L, Chen Y Y, Guo J C,. Liposomes for tumor targeted therapy: A review [J]., 2023, 24(3): 2643.
[45] Andresen T L, Larsen J B. Compositional inhomogeneity of drug delivery liposomes quantified at the single liposome level [J]., 2020, 118: 207-214.
[46] 郑淇予. 人参皂苷Rg3脂质体的制备及其抗肝癌活性与机制研究 [D]. 长春: 长春中医药大学, 2021.
[47] Wang B, Xu Q Q, Zhou C J,. Liposomes co-loaded with ursolic acid and ginsenoside Rg3in the treatment of hepatocellular carcinoma [J]., 2021, 68(4): 711-715.
[48] Zhu Y, Wang A N, Zhang S Y,. Paclitaxel-loaded ginsenoside Rg3liposomes for drug-resistant cancer therapy by dual targeting of the tumor microenvironment and cancer cells [J]., 2023, 49: 159-173.
[49] Miao L N, Ma H, Dong T J,. Ginsenoside Rg3liposomes regulate tumor microenvironment for the treatment of triple negative breast cancer [J]., 2023, 49(1): 139-148.
[50] Xia J X, Ma S J, Zhu X,. Versatile ginsenoside Rg3liposomes inhibit tumor metastasis by capturing circulating tumor cells and destroying metastatic niches [J]., 2022, 8(6): eabj1262.
[51] Sun Y Z, Chen D M, Pan Y H,. Nanoparticles for antiparasitic drug delivery [J]., 2019, 26(1): 1206-1221.
[52] El-Banna M A, Hendawy O M, El-Nekeety A A,. Efficacy of ginsenoside Rg3nanoparticles against Ehrlich solid tumor growth in mice [J]., 2022, 29(29): 43814-43825.
[53] Zhang L J, Hui J F, Ma P,. PEGylation of ginsenoside Rg3-entrapped bovine serum albumin nanoparticles: Preparation, characterization, andbiological studies [J]., 2019, 2019: 1-13.
[54] Qiu R N, Qian F, Wang X F,. Targeted delivery of 20()-ginsenoside Rg3-based polypeptide nanoparticles to treat colon cancer [J]., 2019, 21(1): 18.
[55] Zuo S T, Wang J, An X Q,. Fabrication of ginsenoside-based nanodrugs for enhanced antitumor efficacy on triple-negative breast cancer [J]., 2022, 10: 945472.
[56] Su X M, Zhang D S, Zhang H W,. Preparation and characterization of angiopep-2 functionalized ginsenoside-Rg3loaded nanoparticles and the effect on C6 glioma cells [J]., 2020, 25(3): 385-395.
[57] Agrawal R D, Tatode A A, Rarokar N R,. Polymeric micelle as a nanocarrier for delivery of therapeutic agents: A comprehensive review [J]., 2020, 10(1-s): 191-195.
[58] Yu G P, Ning Q, Mo Z C,. Intelligent polymeric micelles for multidrug co-delivery and cancer therapy [J]., 2019, 47(1): 1476-1487.
[59] Hwang D, Ramsey J D, Kabanov A V. Polymeric micelles for the delivery of poorly soluble drugs: From nanoformulation to clinical approval [J]., 2020, 156: 80-118.
[60] Hu Q Q, Bai L, Zhu Z J,. β-Elemene-loaded polymeric micelles intensify anti-carcinoma efficacy and alleviate side effects [J]., 2020, 31(3): 915-918.
[61] Zoya I, He H S, Wang L T,. The intragastrointestinal fate of paclitaxel-loaded micelles: Implications on oral drug delivery [J]., 2021, 32(4): 1545-1549.
[62] Zhang Y, Liu Y, Wang N,. Preparation of mPEG-b-PLA/TM-2 micelle lyophilized products by mixed lyoprotectors and antitumor effect[J]., 2021, 22(1): 38.
[63] Li L, Ni J Y, Li M,. Ginsenoside Rg3micelles mitigate doxorubicin-induced cardiotoxicity and enhance its anticancer efficacy [J]., 2017, 24(1): 1617-1630.
[64] Yu X, Xu H, Hu M N,. Ginsenoside Rg3bile salt-phosphatidylcholine-based mixed micelles: Design, characterization, and evaluation [J]., 2015, 63(5): 361-368.
[65] 孙瑞阳. 人参皂苷Rg3和顺式乌头酸酐-阿霉素共载药胶束的制备与评价 [D]. 大连: 辽宁师范大学, 2019.
[66] 付淑凤. 人参皂苷Rg3-mPEG-PLLA载药胶束的构建与药效学评价 [J]. 中药材, 2019, 42(8): 1860-1865.
[67] Salvi V R, Pawar P. Nanostructured lipid carriers (NLC) system: A novel drug targeting carrier [J]., 2019, 51: 255-267.
[68] Gomaa E, Fathi H A, Eissa N G,. Methods for preparation of nanostructured lipid carriers [J]., 2022, 199: 3-8.
[69] Viegas C, Patrício A B, Prata J M,. Solid lipid nanoparticlesnanostructured lipid carriers: A comparative review [J]., 2023, 15(6): 1593.
[70] 杨青, 蔡宁, 车道标, 等. 普鲁兰多糖修饰的人参皂苷Rg3纳米结构脂质载体促吸收及其体外抗肿瘤评价 [J]. 中国中药杂志, 2020, 45(21): 5184-5192.
[71] 赵程程. 透明质酸修饰的Rg3-NLC纳米递药系统初步研究 [D]. 哈尔滨: 黑龙江中医药大学, 2015.
[72] 孙爽, 尚尔雨, 肖洪彬, 等. 同时包载人参3种成分的透明质酸修饰的纳米脂质载体的制备及表征 [J]. 中草药, 2018, 49(16): 3815-3820.
[73] Wilson R J, Li Y, Yang G Z,. Nanoemulsions for drug delivery [J]., 2022, 64: 85-97.
[74] Sheth T, Seshadri S, Prileszky T,. Multiple nanoemulsions [J]., 2020, 5(3): 214-228.
[75] Sánchez-López E, Guerra M, Dias-Ferreira J,. Current applications of nanoemulsions in cancer therapeutics [J]., 2019, 9(6): 821.
[76] 张翡峰, 钱柯, 马莉莎, 等. 人参皂苷Rg3和大黄酸纳米乳的制备及其联合aPD-L1治疗三阴性乳腺癌的药效学研究 [J]. 中草药, 2022, 53(16): 4973-4981.
[77] 丁健. 人参皂苷Rg3纳米乳对胃癌荷瘤裸鼠淋巴转移影响的实验研究 [D]. 南京: 南京中医药大学, 2014.
[78] dos Santos A M, Meneguin A B, Fonseca-Santos B,. The role of stabilizers and mechanical processes on physico-chemical and anti-inflammatory properties of methotrexate nanosuspensions [J]., 2020, 57: 101638.
[79] Guan W H, Ma Y Y, Ding S J,. The technology for improving stability of nanosuspensions in drug delivery [J]., 2022, 24(1): 14.
[80] Nandwani Y, Kaur A, Bansal A K. Generation of ophthalmic nanosuspension of prednisolone acetate using a novel technology [J]., 2021, 38(2): 319-333.
[81] Karakucuk A, Teksin Z S, Eroglu H,. Evaluation of improved oral bioavailability of ritonavir nanosuspension [J]., 2019, 131: 153-158.
[82] Huang S, Zhang Q, Li H,. Increased bioavailability of efonidipine hydrochloride nanosuspensions by the wet-milling method [J]., 2018, 130: 108-114.
[83] Ao H, Li Y J, Li H W,. Preparation of hydroxy genkwanin nanosuspensions and their enhanced antitumor efficacy against breast cancer [J]., 2020, 27(1): 816-824.
[84] Patel D, Zode S S, Bansal A K. Formulation aspects of intravenous nanosuspensions [J]., 2020, 586: 119555.
[85] Dong Z Q, Wang R, Wang M Y,. Preparation of naringenin nanosuspension and its antitussive and expectorant effects [J]., 2022, 27(3): 741.
[86] 俞婷婷. 人参皂苷Rg3纳米混悬液的制备及体外抗肿瘤活性筛选 [D]. 杭州: 浙江中医药大学, 2015.
[87] Yan B B, Ma Y Y, Guo J,. Self-microemulsifying delivery system for improving bioavailability of water insoluble drugs [J]., 2020, 22(1): 1-14.
[88] Rahman M A, Hussain A, Hussain M S,. Role of excipients in successful development of self-emulsifying/ microemulsifying drug delivery system (SEDDS/ SMEDDS) [J]., 2013, 39(1): 1-19.
[89] Laffleur F, Keckeis V. Advances in drug delivery systems: Work in progress still needed? [J]., 2020, 590: 119912.
[90] Nardin I, Köllner S. Successful development of oral SEDDS: Screening of excipients from the industrial point of view [J]., 2019, 142: 128-140.
[91] He S X, Tian S R, He X Q,. Multiple targeted self-emulsifying compound RGO reveals obvious anti-tumor potential in hepatocellular carcinoma [J]., 2021, 22: 604-616.
[92] 佘亮. 人参皂苷Rg3纳米复合物的制备、表征及其抗肿瘤活性研究 [D]. 昆明: 昆明理工大学, 2021.
[93] 郭呈斌. 花生分离蛋白-姜黄素纳米复合物的构建和应用 [D]. 开封: 河南大学, 2019.
[94] Lee J Y, Yang H, Yoon I S,. Nano complexes based on amphiphilic hyaluronic acid derivative and polyethylene glycol-lipid for ginsenoside Rg3delivery [J]., 2014, 103(10): 3254-3262.
[95] 石雯, 胡芳芳, 尹铁英, 等. 细胞膜仿生修饰纳米粒肿瘤治疗的研究进展 [J]. 生物化学与生物物理进展, 2022, 49(3): 525-539.
[96] Zhao X F, Yan C. Research progress of cell membrane biomimetic nanoparticles for tumor therapy [J]., 2022, 17(1): 36.
[97] Chen M, Qiao Y Y, Cao J,. Biomimetic doxorubicin/ginsenoside co-loading nanosystem for chemoimmunotherapy of acute myeloid leukemia [J]., 2022, 20(1): 273.
[98] Tang P X, Wang L, Ma X L,. Characterization andevaluation of the complexes of posaconazole with β- and 2,6-di--methyl-β-cyclodextrin [J]., 2017, 18(1): 104-114.
[99] Tang P X, Li S S, Wang L L,. Inclusion complexes of chlorzoxazone with β- and hydroxypropyl-β-cyclodextrin: Characterization, dissolution, and cytotoxicity [J]., 2015, 131: 297-305.
[100]张明明. 20()-原人参二醇及人参皂苷-Rh2、Rg3羟丙基-β-环糊精包合物的研究 [D]. 扬州: 扬州大学, 2016.
[101]张乃先, 艾莉, 董英杰, 等. 人参皂苷Rg3羟丙基-β-环糊精包合物的制备和表征 [J]. 沈阳药科大学学报, 2017, 34(12): 1033-1037.
[102]Yaghoubi A, Ghojazadeh M, Abolhasani S,. Correlation of serum levels of vitronectin, malondialdehyde and Hs-CRP with disease severity in coronary artery disease [J]., 2015, 7(3): 113-117.
[103]李健莹, 栾晓娇, 王凯乾, 等. 人参皂苷Rg3固体分散体的制备及表征 [J]. 中国药学杂志, 2015, 50(10): 872-875.
[104]徐杰. 人参皂苷Rg3改善肥胖胰岛素抵抗的机制研究及其固体分散体的制备 [D]. 长春: 长春中医药大学, 2022.
Research progress on antitumor nanoscale drug delivery system of ginsenoside Rg3
LIU Xiao-rui1, 2, ZHANG Kun-feng2, LI Xin1, WANG Xiang-tao1, 2
1. School of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
Ginsenoside Rg3(Rg3) is one of the main active ingredients in ginseng and has a wide range of pharmacological activities, especially in the field of antitumor. However, the poor solubility and low bioavailability of Rg3in water have greatly limited the clinical application of Rg3. Nano drug delivery systems have made progress in improving the poor water solubility of Rg3and delaying the metabolism of Rg3, and have developed Rg3nanodrugs with different therapeutic functions, which have significantly improved the anti-cancer effect of Rg3. In this paper, the recent research of Rg3nanomedicine and its application in antitumor was reviewed to provide a reference for further research on Rg3.
ginsenoside Rg3; antitumor; nano drug delivery system; bioavailability; nanomedicine
R283
A
0253 - 2670(2023)22 - 7577 - 11
10.7501/j.issn.0253-2670.2023.22.034
2023-05-30
中国医学科学院医学与健康创新工程项目资助(2021-I2M-1-071);黑龙江省重点研发计划指导类项目(GZ20210092)
刘晓瑞(1999—),男,硕士研究生,研究方向为药剂学。E-mail: liuxrqcsj@163.com
通信作者:李 鑫,男,副教授,从事药物传输系统研究。E-mail: 102105@hrbcu.edu.cn
王向涛,男,研究员,博士生导师,从事药物新剂型研究。E-mail: xtaowang@163.com
[责任编辑 赵慧亮]
