药用昆虫凹纹胡蜂化学成分及抗炎活性研究
2023-11-27刘超贺庞秀琴李成功许静蕾钱晓莉常雅萍杨志斌杨银河王家鹏
刘超贺,庞秀琴#,李成功,许静蕾,钱晓莉,常雅萍,杨志斌,杨银河,王家鹏,肖 怀
药用昆虫凹纹胡蜂化学成分及抗炎活性研究
刘超贺1,庞秀琴1#,李成功2,许静蕾1,钱晓莉1,常雅萍1,杨志斌1,杨银河1,王家鹏1*,肖 怀1*
1. 云南省昆虫生物医药研发重点实验室,大理大学药学院,云南 大理 671000 2. 祥云县综合检验检测院,云南 祥云 672100
研究药用昆虫凹纹胡蜂的化学成分及其抗炎活性。采用硅胶柱色谱、Sephadex LH-20凝胶和半制备高效液相等色谱技术进行分离纯化,通过核磁共振技术对化合物的结构进行表征和解析。以脂多糖(lipopolysaccharide,LPS)联合γ干扰素(interferon-γ,IFN-γ)诱导小鼠巨噬细胞RAW264.7作为炎症模型,探讨提取物及单体对炎症因子mRNA表达的影响。从凹纹胡蜂醋酸乙酯部位分离鉴定了16个化合物,分别为邻苯二酚(1)、对羟基苯甲醛(2)、对羟基苯丙酸甲酯(3)、4-羟基苯醋酸乙酯(4)、3,4-二羟基苯乙醇(5)、3,4-二羟基苯酰乙醇(6)、3,4-二羟基苯甲酸(7)、-乙酰基-2-乙氧基-2-(3,4-二羟基苯基)乙胺(8)、2-(2-羟基丙酰氧基)丙酸甲酯(9)、对甲氧基苯甲醇(10)、3,4-二羟基苯甲酸甲酯(11)、α-乙基葡萄糖苷(12)、2-羟基-3-苯基丙酸甲酯(13)、-乙酰基-2-(3,4-二羟基苯基)乙胺(14)、对甲基苯乙醇(15)和胸腺嘧啶(16)。凹纹胡蜂醇提物及提取物醋酸乙酯部位、正丁醇部位和水部位在300 µg/mL时均能有效减少由LPS联合IFN-γ诱导RAW264.7细胞炎症因子一氧化氮合酶(inducible nitric oxide synthase,)基因相对表达量;化合物2、3、5、6、9~11对LPS联合IFN-γ诱导RAW264.7细胞肿瘤坏死因子α(tumor necrosis factorα,)mRNA表达有抑制作用(<0.01)。凹纹胡蜂醇提物及不同极性部位能降低炎症细胞中的表达,具有一定的抗炎作用。化合物1~16均为首次从凹纹胡蜂分离鉴定,其中2、3、5、6、9~11可能为潜在的活性单体。
凹纹胡蜂;抗炎活性;对羟基苯甲醛;3,4-二羟基苯乙醇;2-(2-羟基丙酰氧基)丙酸甲酯;对甲氧基苯甲醇
凹纹胡蜂Smith为膜翅目胡蜂科胡蜂属昆虫,民间俗称葫芦蜂、白脚蜂、吊包蜂等,是《中国药典》记载胡蜂酒的原药材物种之一,多以干燥成虫入药,性味甘、辛、凉,能祛风除湿,解毒,用于治疗胸腹胀痛、干呕、急性风湿和风湿性关节炎等。凹纹胡蜂中含有丰富的蛋白质和外源必需氨基酸,可作为滋补营养品[1-2]。蜂房和蜂巢中的黄酮、多酚和多糖有强抗氧化活性[3-4]。目前,该昆虫已实现规模化、标准化养殖,成为西南地区的产业化昆虫。
《中国药典》2020年版一部记载:“胡蜂酒用于风湿闭阻所致的痹病,急性风湿病、风湿性关节炎”[5],云南省很多少数民族尤其是景颇族长期采用胡蜂泡制的胡蜂酒来预防和治疗风湿性关节炎。研究表明蜂毒中的多肽类、酶类和非肽类等物质具有抗炎、抗菌、镇痛和免疫调节等作用[6-7],胡蜂粗毒可以通过免疫调节和抑制炎症因子改善类风湿性关节炎,还能改善胶原诱导性类风湿关节炎大鼠的关节指数、关节肿胀及滑膜炎症等症状[8],抑制多种肿瘤细胞的生长繁殖[9-10],但对胡蜂虫体的化学成分研究鲜有报道。课题组对凹纹胡蜂进行物质基础及活性筛选研究,以期探寻其中的潜在活性组分或单体。本研究报道了凹纹胡蜂乙醇提取物醋酸乙酯部位分离得到的16个化合物,分别为邻苯二酚(hydroquinone,1)、对羟基苯甲醛(4-hydroxy- benzaldehyde,2)、对羟基苯丙酸甲酯 [methyl 3- (4-hydroxyphenyl)propionate,3]、4-羟基苯醋酸乙酯(4-hydroxyphenethy acetate,4)、3,4-二羟基苯乙醇(3,4-dihydroxyphenethyl alcohol,5)、3,4-二羟基苯酰乙醇(3,4-dihydroxyphenyl ethanol ketone,6)、3,4-二羟基苯甲酸(protocatechuic acid,7)、-乙酰基-2-乙氧基-2-(3,4-二羟基苯基)乙胺(divesamides A,8)、2-(2-羟基丙酰氧基)丙酸甲酯[methyl-2- (2-hydroxy-propionyloxy) propionate,9]、对甲氧基苯甲醇(4-methoxybenzyl alcohol,10)、3,4-二羟基苯甲酸甲酯(protocatechuic acid methyl ester,11)、α-乙基葡萄糖苷(α-ethyl glucoside,12)、2-羟基-3-苯基丙酸甲酯(papuline,13)、-乙酰基-2-(3,4-二羟基苯基)乙胺(-acetyl-dopamine,14)、对甲基苯乙醇 [2-(4-methylphenyl) ethanol,15] 和胸腺嘧啶(thymine,16)。并对其相应的体外抗炎活性进行研究。
1 仪器与材料
Bruker AV-400超导核磁共振仪(德国Bruker公司);Bruker Compact QTOF质谱仪(德国Bruker公司);Reveleris®制备型高效液相色谱仪(瑞士BUCHI公司);荧光定量PCR仪、基因扩增仪(美国Bio-Rad公司)。
Sephadex LH-20葡聚糖凝胶(美国GE公司);柱色谱硅胶(80~100、200~300、300~400目,青岛海洋化工厂分厂);噻唑蓝(北京索莱宝科技有限公司,批号303H0352);胎牛血清(Gibco公司,批号1618862);逆转录试剂盒(南京诺唯赞生物科技股份有限公司);小鼠巨噬细胞RAW264.7(武汉普诺赛生物科技有限公司);实验所用化学试剂均为分析纯或色谱纯。脂多糖(lipopolysaccharide,LPS,批号026M4021V,美国Sigma公司),γ干扰素(interferon-γ,IFN-γ,批号061798-1J1221,美国Peprotech公司)。
凹纹胡蜂原料由云南省德宏州胡蜂养殖基地于2019年11月提供,大理大学杨自忠教授鉴定为凹纹胡蜂.Smith,模式标本(I12075032)保存于大理大学昆虫生物医药研发重点实验室。
2 方法
2.1 提取与分离
凹纹胡蜂成虫虫体32 kg,粉碎,95%乙醇室温浸泡提取4次,合并提取液,减压浓缩得浸膏,加适量纯水混悬,用石油醚、三氯甲烷、醋酸乙酯、正丁醇分别萃取得到5个萃取部位(A~E)。
醋酸乙酯萃取部位(C,92 g)经硅胶柱色谱(200~300目)分离,以石油醚-氯仿(1∶1、3∶7、0∶1)和氯仿-甲醇(25∶1、10∶1、5∶1、1∶1、0∶1)梯度洗脱,TLC检查合并,得组分C1~C11。组分C3经反复硅胶柱色谱,石油醚-氯仿(1∶1、1∶2、1∶5)及醋酸乙酯-丙酮(1∶1、1∶2、1∶5)梯度洗脱;组分C3-5-4,再通过半制备高效液相色谱(体积流量17 mL/min,流动相:甲醇-水5∶95~95∶5,色谱柱:Sepax bio C18)和Sephadex LH-20凝胶反复分离得化合物3(5.0 mg)、4(2.5 mg)、9(45.5 mg)和10(17.6 mg);组分C3-5-5经半制备HPLC及LH-20 凝胶分离得到化合物1(3.1 mg)和2(5.8 mg)、C3-5-6反复分离得化合物11(11.2 mg),C3-5-7分离得化合物13(11.6 mg);组分C3-7用半制备HPLC及LH-20反复分离得化合物5(3.4 mg)、6(8.3 mg)和7(9.6 mg)。组分C6过硅胶柱,氯仿-丙酮(5∶1、2∶1、1∶1、1∶2、1∶5)梯度洗脱得组分C6-1~C6-7,组分C6-3和C6-5采用半制备HPLC分离得到化合物8(6.7 mg)、15(62.8 mg)和16(9 mg)。组分C7过硅胶柱,以氯仿-甲醇(50∶1、25∶1、10∶1、5∶1、4∶1、7∶3、1∶1)梯度洗脱得到C7-1~C7-6,继续采用半制备HPLC和LH-20凝胶纯化,获得化合物14(16.8 mg)。组分C8采用正相硅胶和凝胶反复分离得到化合物12(7 mg)。
2.2 提取物及单体化合物体外抗炎活性筛选
2.2.1 细胞毒性测定 采用MTT法检测提取物及部分化合物对RAW264.7细胞活力,提取物分别给予300、30 μg/mL,单体化合物分别给予30、10 μg/mL刺激RAW264.7细胞,24 h后检测细胞活力。选取对细胞存活率不低于80%的浓度用作抗炎活性筛选。
2.2.2 样品对细胞中炎症因子mRNA表达的影响 选择处在对数生长期的RAW264.7细胞,轻轻将细胞吹落并收集细胞沉淀,调整细胞密度为3×105个/mL,按每孔1 mL的体积接种至12孔板中,置于37 ℃、5% CO2条件下培养24 h。之后对细胞进行处理:空白组、模型组(LPS 1mg/mL+IFN-γ20 ng/mL)、样品组(LPS 1mg/mL+IFN-γ20 ng/mL),培养24 h后样品组加入100mL含有样品的培养基,其余2组加入相应体积的培养基,每组3个复孔。相同条件下培养24 h后,取细胞沉淀根据相应试剂盒说明书要求进行提取总RNA、逆转录[11]和RT-PCR[12]的操作,检测细胞中炎症因子一氧化氮合酶(inducible nitric oxide synthase,)及肿瘤坏死因子α(tumor necrosis factor-α,)mRNA表达情况。相关引物设计信息见表1。

表1 逆转录引物序列
3 结果
3.1 结构鉴定
化合物1:淡黄色粉末,HR-ESI-MS/: 111.042 4 [M+H]+(计算值111.044 6),分子式为C6H6O2。1H-NMR (400 MHz, CD3OD): 6.75 (2H, dd,= 5.9, 3.6 Hz, H-4, 5), 6.65 (2H, dd,= 5.9, 3.6 Hz, H-3, 6);13C-NMR (100 MHz, CD3OD): 146.5 (C-1, 2), 121.1 (C-3, 6), 116.6 (C-4, 5)。以上数据与文献报道一致[13],故鉴定化合物1为邻苯二酚。
化合物2:黄色油状物,HR-ESI-MS/: 123.041 7 [M+H]+(计算值123.044 6),分子式为C7H6O2。1H-NMR (400 MHz, CDCl3): 7.81 (2H, d,= 8.6 Hz, H-2, 6), 6.98 (2H, d,= 8.6 Hz, H-3, 5);13C-NMR (100 MHz, CDCl3):191.5 (C-7), 162.1 (C-4), 131.3 (C-2, 6), 128.9 (C-1), 116.2 (C-3, 5)。以上数据与文献报道一致[14],故鉴定化合物2为对羟基苯甲醛。
化合物3:淡黄色粉末,HR-ESI-MS/: 181.083 3 [M+H]+(计算值181.086 5),分子式为C10H12O3。1H-NMR (400 MHz, CD3OD): 7.01 (2H, d,= 8.5 Hz, H-2, 6), 6.69 (2H, d,= 8.5 Hz, H-3, 5), 3.63 (3H, s, -OCH3), 2.81 (2H, t,= 7.6 Hz, H-7), 2.57 (2H, t,= 7.6 Hz, H-8);13C-NMR (100 MHz, CD3OD)175.9 (C-9), 157.0 (C-4), 132.8 (C-1), 130.4 (C-2, 6), 116.4 (C-3, 5), 52.2 (-OCH3), 35.3 (C-7), 31.3 (C-8)。以上数据与文献报道一致[15],故鉴定化合物3为对羟基苯丙酸甲酯。
化合物4:淡黄色粉末,HR-ESI-MS/: 181.084 1 [M+H]+(计算值181.086 5),分子式为C10H12O3。1H-NMR (400 MHz, CD3OD): 7.04 (2H, d,= 8.5 Hz, H-2, 6), 6.71 (2H, d,= 8.6 Hz, H-3, 5), 4.19 (2H, t,= 7.1 Hz, H-8), 2.80 (2H, t,= 7.1 Hz, H-7), 2.00 (3H, s, H-2′);13C-NMR (100 MHz, CD3OD): 173.1 (C-1′), 157.2 (C-4), 131.0 (C-2, 6), 130.1 (C-1), 116.3 (C-3, 5), 66.8 (C-8), 37.2 (C-7), 21.0 (C-2′)。以上数据与文献报道一致[16],故鉴定化合物4为4-羟基苯醋酸乙酯。
化合物5:淡黄色粉末,HR-ESI-MS/: 155.073 1 [M+H]+(计算值155.070 8),分子式为C8H10O3。1H-NMR (400 MHz, CD3OD): 6.67 (1H, d,= 8.0 Hz, H-5), 6.65 (1H, d,= 2.1 Hz, H-2), 6.52 (1H, dd,= 8.0, 2.1 Hz, H-6), 3.67 (1H, t,= 7.1 Hz, H-8), 2.66 (1H, t,= 7.3 Hz, H-7)。以上数据与文献报道一致[17],故鉴定化合物5为3,4-二羟基苯乙醇。
化合物6:淡黄色粉末,HR-ESI-MS/: 169.051 3 [M+H]+(计算值169.050 1),分子式为C8H8O4。1H-NMR (400 MHz, CD3OD):7.44 (1H, dd,= 2.0, 8.0 Hz, H-6), 7.36 (1H, d,= 2.1 Hz, H-2), 6.83 (1H, d,= 8.2 Hz, H-5), 4.80 (2H, s, H-8);13C-NMR (100 MHz, CD3OD): 198.8 (C-7), 152.8 (C-4), 146.8 (C-3), 127.8 (C-1), 122.5 (C-6), 116.2 (C-5), 115.5 (C-2), 65.9 (C-8)。以上数据与文献报道一致[18],故鉴定化合物6为3,4-二羟基苯酰乙醇。
化合物7:淡黄色粉末,HR-ESI-MS/: 155.033 2 [M+H]+(计算值 155.034 4),分子式为C7H6O4。1H-NMR (400 MHz, CD3OD):7.44 (1H, dd,= 2.1, 8.3 Hz, H-6), 7.42 (1H, d,= 2.1 Hz, H-2), 6.80 (1H, d,= 8.3 Hz, H-5);13C-NMR (100 MHz, CD3OD):170.5 (C-7), 151.6 (C-4), 146.2 (C-3), 124.0 (C-6), 123.3 (C-1), 117.8 (C-5), 115.9 (C-2)。以上数据与文献报道一致[19],故鉴定化合物7为3,4-二羟基苯甲酸。
化合物8:黄色粉末,HR-ESI-MS/: 240.124 5 [M+H]+(计算值240.123 6),分子式为C12H17NO4。1H-NMR (400 MHz, CD3OD): 6.76 (1H, d,= 2.1 Hz, H-2), 6.74 (1H, d,= 8.1 Hz, H-5), 6.63 (1H, dd,= 8.4, 2.4 Hz, H-6), 4.22 (1H, dd,= 8.2, 4.8 Hz, H-7), 3.39 (2H, m, H-1′′), 3.31~3.20 (2H, m, H-8), 1.93 (3H, s, H-2′), 1.15 (3H, t,= 7.0 Hz, H-2′′);13C-NMR (100 MHz, CD3OD):171.9 (C-1′), 145.2 (C-4), 144.8 (C-3), 131.5 (C-1), 118.1 (C-6), 114.8 (C-5), 113.2 (C-2), 80.0 (C-7), 63.5 (C-1′′), 45.2 (C-8), 21.2 (C-2′), 14.1 (C-2′′)。以上数据与文献报道一致[20],故鉴定化合物8为-乙酰基-2-乙氧基-2-(3,4-二羟基苯基)乙胺。
化合物9:无色油状物,HR-ESI-MS/: 177.074 6 [M+H]+(计算值177.076 3),分子式为C7H12O5。1H-NMR (400 MHz, CD3OD):5.10 (1H, q,= 7.1 Hz, H-1′), 4.32 (1H, q,= 7.0 Hz, H-2), 3.74 (3H, s, OCH3), 1.49 (3H, d,= 7.1 Hz, H-3′), 1.41 (3H, d,= 7.0 Hz, H-3);13C-NMR (100 MHz, CD3OD):175.8 (C-1), 172.8 (C-2′), 70.5 (C-1′), 67.9 (C-2), 53.0 (-OCH3), 20.6 (C-3), 17.3 (C-3′)。以上数据与文献报道一致[21],故鉴定化合物9为2-(2-羟基丙酰氧基)丙酸甲酯。
化合物10:黑色油状物,HR-ESI-MS/: 139.078 5 [M+H]+(计算值139.075 9),分子式为C8H10O2。1H-NMR (400 MHz, CD3OD): 7.07 (2H, d,= 8.5 Hz, H-2, 6), 6.72 (2H, d,= 8.5 Hz, H-3, 5), 3.65 (3H, s, -OCH3), 3.52 (2H, s, H-7)。以上数据与文献报道一致[22],故鉴定化合物10为对甲氧基苯甲醇。
化合物11:白色粉末,HR-ESI-MS/: 169.052 4 [M+H]+(计算值169.050 1),分子式为C8H8O4。1H-NMR (400 MHz, CD3OD):7.42 (1H, dd,= 8.0, 1.9 Hz, H-6), 7.40 (1H, d,= 2.1 Hz, H-2), 6.80 (1H, d,= 8.9 Hz, H-5), 3.83 (3H, s, H-8);13C-NMR (100 MHz, CD3OD): 169.0 (C-7), 151.9 (C-4), 146.4 (C-3), 123.8 (C-6), 122.7 (C-1), 117.5 (C-2), 116.0 (C-5), 52.4 (C-8)。以上数据与文献报道一致[23],故鉴定化合物11为3,4-二羟基苯甲酸甲酯。
化合物12:黄色粉末,HR-ESI-MS/: 209.104 4 [M+H]+(计算值209.102 5),分子式为C8H16O6。1H-NMR (400 MHz, CD3OD): 4.79 (1H, d,= 3.7 Hz, H-1), 3.84~3.75 (2H, m, H-6), 3.69~3.34 (6H, m, H-2~5, 1′), 1.24 (3H, t,= 7.1 Hz, H-2′);13C-NMR (100 MHz, CD3OD): 100.0 (C-1), 75.3 (C-3), 73.7 (C-5), 72.1 (C-2), 72.0 (C-4), 64.6 (C-6), 62.8 (C-1′), 15.5 (C-2′)。以上数据与文献报道一致[24],故鉴定化合物12为α-乙基葡萄糖苷。
化合物13:黄色粉末,HR-ESI-MS/: 181.084 2 [M+H]+(计算值181.086 5),分子式为C10H12O3。1H-NMR (400 MHz, CD3OD): 7.28~7.19 (5H, m, H-2~6), 4.36 (1H, dd,= 7.8, 4.9 Hz, H-8), 3.69 (3H, s, -OCH3), 3.05 (1H, dd,= 13.8, 4.9 Hz, H-7a), 2.91 (1H, dd,= 13.8, 7.8 Hz, H-7b);13C-NMR (100 MHz, CD3OD): 175.9 (C-9), 138.7 (C-1), 130.7 (C-2, 6), 129.4 (C-3, 5), 127.8 (C-4), 73.2 (C-8), 52.5 (-OCH3), 41.8 (C-7)。以上数据与文献报道一致[25],故鉴定化合物13为2-羟基-3-苯基丙酸甲酯。
化合物14:黑色粉末,HR-ESI-MS/: 196.098 7 [M+H]+(计算值196.097 4),分子式为C10H13NO3。1H-NMR (400 MHz, CD3OD): 6.68 (1H, d,= 7.9 Hz, H-5), 6.64 (1H, d,= 2.0 Hz, H-2), 6.52 (1H, dd,= 8.0, 1.9 Hz, H-6), 3.34 (2H, t,= 7.3 Hz, H-8), 2.62 (2H, t,= 7.4 Hz, H-7), 1.90 (3H, s, H-2′);13C-NMR (100 MHz, CD3OD): 173.4 (C-1′), 146.4 (C-4), 144.9 (C-3), 132.2 (C-1), 121.1 (C-6), 117.0 (C-2), 116.5 (C-5), 42.6 (C-8), 36.0 (C-7), 22.7 (C-2′)。以上数据与文献报道一致[17],故鉴定化合物14为-乙酰基-2-(3,4-二羟基苯基)乙胺。
化合物15:黄色粉末,HR-ESI-MS/: 137.093 1 [M+H]+(计算值137.096 7),分子式为C9H12O。1H-NMR (400 MHz, CD3OD): 7.02 (2H, d,= 8.4 Hz, H-2, 6), 6.70 (2H, d,= 8.5 Hz, H-3, 5), 3.33 (2H, t,= 6.7 Hz, H-8), 2.67 (2H, t,= 6.7 Hz, H-7), 1.90 (3H, s, 4-CH3)。以上数据与文献报道一致[26],故鉴定化合物15为对甲基苯乙醇。
化合物16:白色粉末,HR-ESI-MS/: 127.050 4 [M+H]+(计算值127.050 8),分子式为C5H6N2O2。1H-NMR (400 MHz, DMSO-6):11.02 (1H, s, 3-NH), 10.62 (1H, s, 1-NH), 7.25 (1H, s, H-6), 1.71 (3H, s, H-7);13C-NMR (100 MHz, DMSO-6):165.0 (C-4), 151.5 (C-2), 137.8 (C-6), 107.7 (C-5), 11.8 (C-7)。以上数据与文献报道一致[27],故鉴定化合物16为胸腺嘧啶。
3.2 凹纹胡蜂提取物不同部位及单体的抗炎活性
采用LPS联合IFN-γ诱导的巨噬细胞RAW264.7炎症模型,检测样品对炎症因子(、)mRNA表达的影响考察提取物及单体化合物的抗炎活性。
3.2.1 提取物不同部位及单体对RAW264.7细胞的细胞毒性 提取物不同部位对巨噬细胞RAW264.7的细胞毒性测试结果见图1,与空白组比较,氯仿部位质量浓度为30 μg/mL,醇提物、醋酸乙酯部位、正丁醇部位、石油醚部位及水部位质量浓度为300 µg/mL时,对细胞无明显毒性。因此,抗炎活性检测中氯仿部位给药质量浓度为30 µg/mL,其余样品质量浓度均为300 µg/mL。
单体化合物对RAW264.7的细胞毒性如图2所示,化合物在30、10 µg/mL质量浓度下培养24 h后,与空白组比较,各给药组细胞存活率均不小于80%,说明在30 µg/mL下化合物对RAW264.7细胞的毒性较小,可选用30 µg/mL进行抗炎实验。
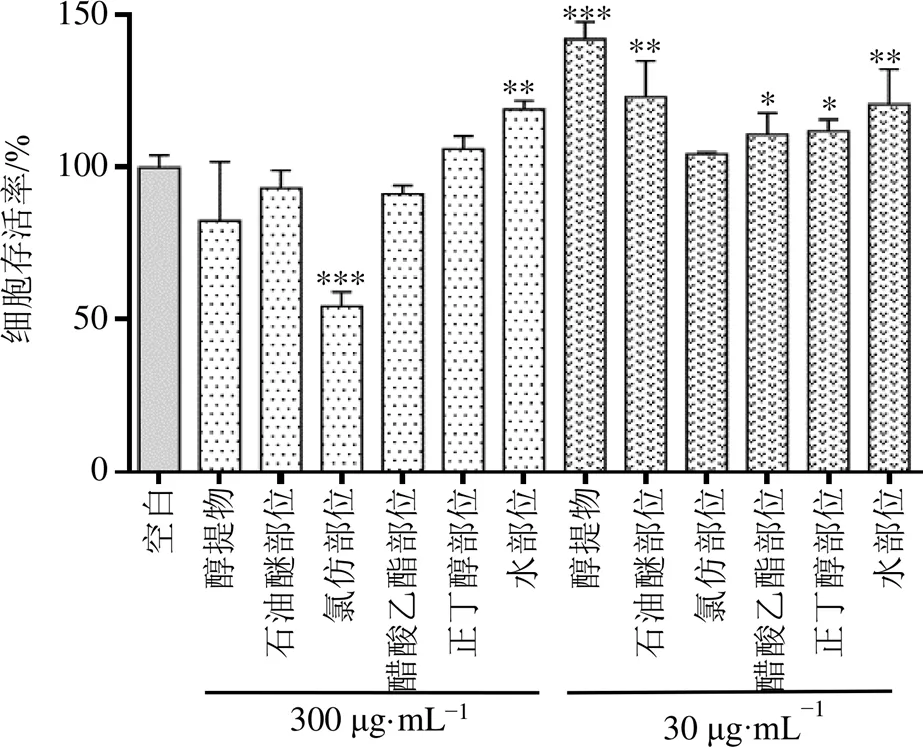
与空白组比较:*P<0.05 **P<0.01 ***P<0.001,图2同
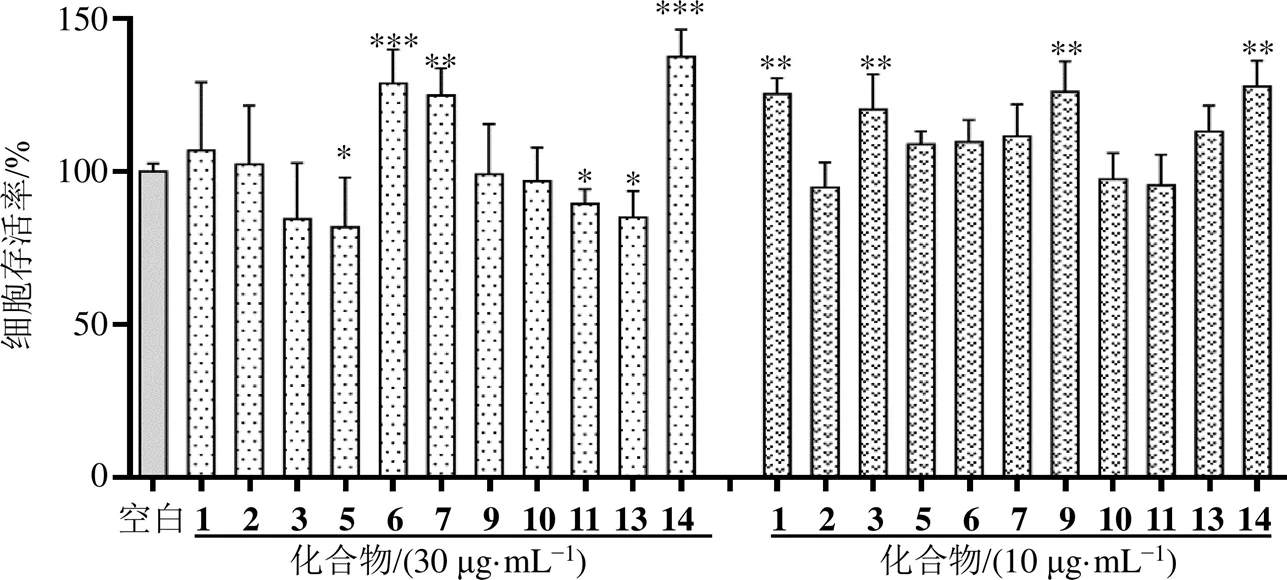
图2 单体化合物对RAW264.7细胞存活率的影响(, n = 5)
3.2.2 不同部位提取物对RAW264.7细胞炎症模型中炎症因子mRNA表达的影响 如图3所示,与空白组比较,模型组中的基因相对表达量显著上调(<0.01),说明模型组造模成功。与模型组比较,凹纹胡蜂醇提物、醋酸乙酯部位、正丁醇部位及水部位在质量浓度为300 µg/mL时均能有效地减少由LPS+IFN-γ诱导的RAW264.7细胞炎症因子基因相对表达量(<0.05、0.01)。
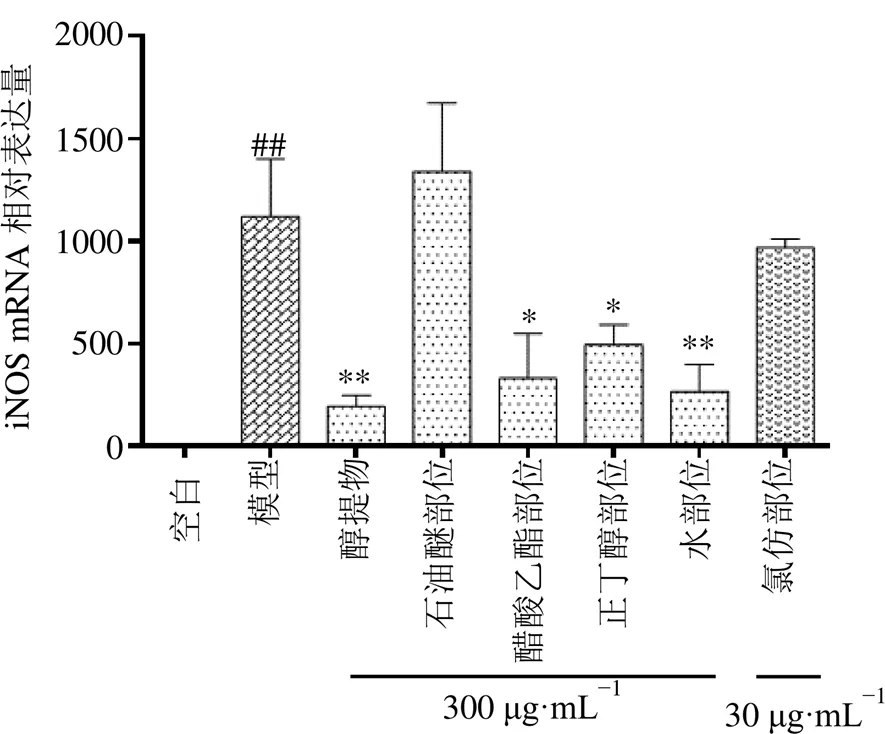
与空白组比较:# #P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01,图4同
3.2.3 单体对RAW264.7细胞炎症模型中炎症因子mRNA表达的影响 单体化合物的抗炎活性见图4。在质量浓度为30 µg/mL时,化合物2、3、5、6、9~11对LPS+IFN-γ诱导RAW264.7细胞炎症因子mRNA的表达有着明显抑制作用,差异有统计学意义(<0.01)。而化合物7能够使炎症因子基因相对表达量上调,可能与LPS+IFN-γ产生了协同刺激作用,存在一定的致炎性。
4 讨论
本实验对凹纹胡蜂醋酸乙酯部位的化学成分进行研究,从中分离鉴定了16个化合物,包括2个乙酰多巴胺类化合物、8个酚类化合物和6个其他化合物,均为首次从凹纹胡蜂虫体中分离得到。乙酰多巴胺类和多酚类化合物是昆虫的主要化学成分,在蝗虫[28]、九香虫[29]、琵琶甲[30]和美洲大蠊[31]等昆虫中均广泛分布,有着较好的抗炎和抗氧化活性。活性实验结果表明,醇提物、醋酸乙酯部位、正丁醇部位及水部位在300 µg/mL的给药质量浓度下均能显著降低由LPS+IFN-γ诱导的RAW264.7细胞炎症因子基因相对表达量;而在30 µg/mL给药质量浓度下,化合物2、3、5、6、9~11对LPS+IFN-γ诱导RAW264.7细胞炎症因子mRNA的表达有着明显抑制作用。抗炎活性筛选结果显示,凹纹胡蜂抗炎活性部位主要是中等极性、大极性的醋酸乙酯、正丁醇及水部位,低极性的石油醚、氯仿部位无活性。化合物1~16自活性比较好的醋酸乙酯部位分离得到,而其中化合物2、3、5、6、9~11也对LPS+IFN-γ诱导RAW264.7细胞炎症模型中细胞炎症因子mRNA的表达有明显抑制作用,具有潜在的抗炎活性,可能为醋酸乙酯部位的抗炎有效物质,同时也提示凹纹胡蜂的抗炎作用是一个多组分的协同作用。
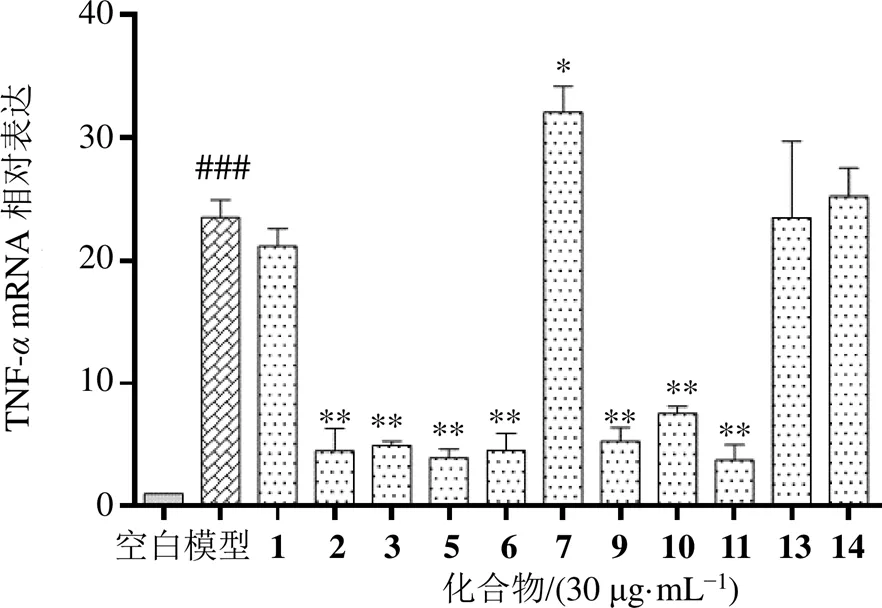
图4 单体化合物对LPS联合IFN-γ诱导RAW264.7细胞后TNF-α mRNA相对表达量的影响(, n = 3)
综上所述,本实验丰富了凹纹胡蜂化学成分和药理活性的研究,阐明了其发挥抗炎活性的物质基础,但抗炎的作用机理仍需进行深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 王云珍, 董大志, 陆源, 等. 凹纹胡蜂与黑尾胡蜂蛋白氨基酸分析研究 [J]. 动物学研究, 1988, 9(2): 140-170.
[2] 杨志斌, 翟宝祺, 杨红, 等. 改良Lowry法测定不同产地凹纹胡蜂药材蛋白质含量 [J]. 中国民族民间医药, 2017, 26(18): 26-28.
[3] 杨新周, 刘贵有, 梁建平, 等. 凹纹胡蜂蜂巢不同部位黄酮、多酚、多糖提取工艺及抗氧化活性研究 [J]. 西南农业学报, 2020, 33(8): 1679-1684.
[4] 王振吉, 杨宏昌, 杨申明, 等. 凹纹胡蜂蜂房总黄酮超声波辅助提取工艺及抗氧化活性研究 [J]. 饲料研究, 2020, 43(8): 69-73.
[5] 中国药典 [S].一部. 2020: 1250.
[6] 李玉梅, 陈永强, 顾伟. 蜂毒及其主要成分蜂毒素抗肿瘤机制研究进展 [J]. 中国中医药信息杂志, 2008, 15(1): 96-97.
[7] 莫湘桂, 赵琴, 谭垦. 凹纹胡蜂蜂毒中一种新型多肽的识别与活性检测 [J]. 云南农业大学学报: 自然科学版, 2022(1): 126-130.
[8] 段晓梅. 胡蜂毒提取物Ento-Ⅳ对类风湿关节炎的疗效及机制研究 [D]. 大理: 大理大学, 2019.
[9] 袁仕梦, 车逸豪, 杨志斌, 等. 基胡蜂蜂毒的组成分析及生物活性评价 [J]. 中国药学杂志, 2021, 56(7): 531-538.
[10] 周思彤, 车逸豪, 倪连丽, 等. 大胡蜂蜂毒中多肽和蛋白质结构和功能的多样性 [J]. 天然产物研究与开发, 2019, 31(9): 1596-1601.
[11] 郭勇, 陈运芳, 王丽森, 等. 木犀草素通过HIF-1α抗胃癌细胞增殖和迁移的作用研究 [J]. 中国药学杂志, 2021, 56(16): 1313-1319.
[12] 肖维刚. 动脉管壁“孙络—微血管”滋生在动脉粥样硬化早期病变中的作用及通络干预研究 [D]. 石家庄: 河北医科大学, 2014.
[13] 李雅静, 孙辉, 王国才, 等. 密脉鹅掌柴的化学成分研究 [J]. 中药材, 2018, 41(1): 115-118.
[14] 韩瑞杰, 赵晨, 陈豪杰, 等. 景天三七化学成分研究 [J]. 中华中医药杂志, 2021, 36(7): 4223-4226.
[15] 杨杰, 王丽莉, 周鑫堂, 等. 黄花草木犀化学成分研究 [J]. 中草药, 2014, 45(5): 622-625.
[16] 蒋瑞娟, 宋骏, 何权, 等. 新疆阿魏内生菌sp. TA26-16化学成分的研究 [J]. 中成药, 2019, 41(9): 2135-2138.
[17] 肖怀. 云南彝族药用昆虫喙尾琵琶甲物质基础及抗肿瘤相关活性研究 [D]. 昆明: 云南大学, 2018.
[18] 牛雪梅, 黎胜红, 纳智, 等. 疏花毛萼香茶菜的化学成分研究 [J]. 中草药, 2003, 34(4): 300-303.
[19] 吴志军, 欧阳明安, 杨崇仁. 苣叶丹参的多酚类化合物 [J]. 云南植物研究, 1999, 21(3): 393-398.
[20] Tang J J, Luo Q, Di L,. Compounds from the Chinese black ant () and NMR behavior of the isomers with formamide group [J]., 2015, 17(1): 20-26.
[21] Petrus R, Fałat P, Sobota P. Use of lithium aryloxides as promoters for preparation of α-hydroxy acid esters [J]., 2020, 49(3): 866-876.
[22] 李琰. 干姜和玛咖化学成分的研究 [D]. 郑州: 河南中医药大学, 2016.
[23] 周兴栋, 余绍福, 程淼, 等. 锡叶藤的化学成分 [J]. 暨南大学学报: 自然科学与医学版, 2015, 36(4): 302-306.
[24] 于嘉陵, 严小红, 候惠欣, 等. 桂山厚丛柳珊瑚化学成分的研究(二) [J]. 天然产物研究与开发, 2004, 16(2): 118-120.
[25] 周先丽, 王鹏程, 梁斌, 等. 地蚕化学成分的分离鉴定 [J]. 中国实验方剂学杂志, 2018, 24(5): 55-58.
[26] 王发左, 朱天骄, 张敏, 等. 海洋真菌sp. 2-PDA-61化学成分的研究 [J]. 天然产物研究与开发, 2011, 23(2): 199-201.
[27] Han A R, Song J I, Jang D S,. Cytotoxic constituents of the octocoral[J]., 2005, 28(3): 290-293.
[28] Lee W, Lee H, Kim M A,. Evaluation of novel factor Xa inhibitors fromwith anti- platelet aggregation activity [J]., 2017, 7: 7934.
[29] Yan Y M, Ai J, Shi Y N,. (±)- Aspongamide A, an-acetyldopamine trimer isolated from the insectis an inhibitor of p-Smad3 [J]., 2014, 16(2): 532-535.
[30] Yan Y M, Li L J, Qin X C,. Compounds from the insectwith COX-1 and COX-2 inhibitory activities [J]., 2015, 25(12): 2469-2472.
[31] Yan Y M, Meng X H, Bai H F,. Nonpeptide small molecules with a ten-membered macrolactam or a morpholine motif from the insectand their antiangiogenic activity [J]., 2021, 8(7): 1401-1408.
Chemical constituents of medicinal insectand its anti-inflammatory activities
LIU Chao-he1, PANG Xiu-qin1, LI Cheng-gong2, XU Jing-lei1, QIAN Xiao-li1, CHANG Ya-ping1, YANG Zhi-bin1, YANG Yin-he1, WANG Jia-peng1, XIAO Huai1
1. Yunnan Key Laboratory of Entomological Biopharmaceutical R&D, College of Pharmacy, Dali University, Dali 671000, China 2. Xiangyun County Comprehensive Inspection and Testing Institute, Xiangyun, 672100, China
To study the chemical constituents and anti-inflammatory activities of medicinal insect.The compounds were isolated and purified by silica gel, Sephadex LH-20 and semi-preparative liquid chromatography, while the structures of compounds were characterized and analyzed by nuclear magnetic resonance (NMR) technique. The mouse macrophage RAW264.7 inflammation model was induced by lipopolysaccharide (LPS) combined with interferon γ (IFN-γ), the effects of extracts and monomers on the mRNA expression of inflammatory factors were investigated.A total of 16 compounds were isolated from ethyl acetate fractions and identified as catechol hydroquinone (1), 4-hydroxybenzaldehyde (2), methyl 3-(4-hydroxyphenyl)propionate (3), 4-hydroxyphenethy acetate (4), 3,4-dihydroxy-phenethyl alcohol (5), 3,4-dihydroxyphenyl ethanol ketone (6), 3,4-dihydroxy-benzoic acid (7), divesamides A (8), methyl-2- (2-hydroxy-propionyloxy) propionate (9), 4-methoxybenzyl alcohol (10), 3,4-dihydroxy-benzoic methyl ester (11), α-ethyl glucoside (12), papuline (13),-acetyl-dopamine (14), 2-(4-methylphenyl) ethanol (15), thymine (16). The alcohol extracts, ethyl acetate fractions,-butanol fractions and water fractions of.could effectively reduce the relative expression ofgene of cellular inflammatory factor in RAW264.7 induced by LPS + IFN-γ when the administration concentration of ethyl acetate,-butanol and water fractions was 300 µg/mL. Compounds 2, 3, 5, 6, 9—11 inhibited the expression ofmRNA in RAW264.7 cells induced by LPS combined with IFN-(< 0.01).The alcoholic extracts and different polar parts of.can reduce the expression of iNOS in inflammatory cells and have some anti-inflammatory effects. Compounds 1—16 are isolated and identified from the ethyl acetate portion of.for the first time, of which 2, 3, 5, 6, 9—11 may be potential active monomers.
Smith; anti-inflammatory activity; 4-hydroxybenzaldehyde; 3,4-dihydroxy-phenethyl alcohol; methyl-2-(2-hydroxy-propionyloxy) propionate; 4-methoxybenzyl alcohol
R284.1
A
0253 - 2670(2023)22 - 7351 - 07
10.7501/j.issn.0253-2670.2023.22.012
2023-04-06
国家自然科学基金项目(82160822);国家自然科学基金项目(82160798);国家自然科学基金项目(82060765);国家自然科学基金项目(82260163);云南省“兴滇英才支持计划”团队专项(202305AS350001);云南省重大科技专项计划(202002AA100007);云南省自然科学基金(2017FA050);云南省科技厅基础研究计划面上项目(202101AT070029)
刘超贺(1998—),男,在读硕士研究生,研究方向为药理学。E-mail: lch412728@163.com
通信作者:肖 怀,女,教授,博士,从事药用昆虫活性物质基础及药理药效研究。E-mail: xiaohuai@dali.edu.cn
王家鹏,男,讲师,博士,从事天然药物化学研究。E-mail:jpwang@dali.edu.cn
#共同第一作者:
庞秀琴(1996—),女,硕士研究生,研究方向为天然药物化学。E-mail: p18787230348@163.com
[责任编辑 王文倩]
