基于“质-量”双标的丹参质量分析方法研究
2023-11-27丁昕瑶包永睿李天娇孟宪生
丁昕瑶,包永睿, 2, 3,王 帅, 2, 3,李天娇, 2, 3,孟宪生, 2, 3*
基于“质-量”双标的丹参质量分析方法研究
丁昕瑶1,包永睿1, 2, 3,王 帅1, 2, 3,李天娇1, 2, 3,孟宪生1, 2, 3*
1. 辽宁中医药大学药学院,辽宁 大连 116600 2. 辽宁省中药多维分析专业技术创新中心,辽宁 大连 116600 3. 辽宁省现代中药研究工程实验室,辽宁 大连 116600
建立以对照药材为基准物质的定性和不依赖多种对照品定量的丹参药材“质-量”双标控制方法。采用HPLC法,以对照药材为基准物质建立丹参特征图谱,通过四极杆-飞行时间质谱(quadrupole-time of flight mass spectrometry,Q-TOF-MS)技术鉴定共有峰的化学成分,以对照药材和供试药材特征峰的相似度,明确药材真伪,即“质”;对内标成分丹酚酸B进行准确定量,以内标成分计,计算不同批次供试品中各特征峰的相对含量,取“平均数-标准差”作为特征峰化学成分相对于内标物质化学成分的相对含量下限,依据特征峰相对含量下限明确枳壳药材优劣,即“量”。建立的特征图谱及含量测定方法符合方法学考察要求;确定了6个共有色谱峰,分别为迷迭香酸、紫草酸、丹酚酸B、隐丹参酮、丹参酮I、丹参酮IIA,各供试药材与对照药材的相似度均大于0.90;确定了丹参药材特征峰化学成分相对含量下限。该方法不依赖多种对照品,能清晰、快速地判断药材的真伪优劣,为丹参的质量控制提供参考。
丹参;“质-量”双标;对照药材;质量控制;特征图谱;丹酚酸B;迷迭香酸;紫草酸;隐丹参酮;丹参酮I;丹参酮IIA
丹参为唇形科鼠尾草属植物丹参Bge.的干燥根及根茎[1]。丹参药材广泛分布于我国华北、华东、中南和西北诸省,各地气候条件及生长环境不同,导致各地丹参药材在质量上存在着很大差异[2]。丹参富含多种有效成分,如丹参酮类、丹酚酸类等[3]。近年来的研究表明,丹参及其有效成分有抗肿瘤、抗血栓、抗炎、护肝等作用[4]。目前,丹参药材质量控制方法主要包括单指标含量测定法及指纹图谱与含量测定结合法,以上方法具有灵敏度高、重复性好的优点。而整体评价丹参药材优劣,需依赖多种对照品比对,但消耗量大、步骤繁琐,且某些指标成分不能反映药效;指纹图谱只能模糊地评价药材相似性不能清晰地判断供试品真伪优劣的不足。而中药复杂体系质量评控技术难度和高额成本给中药企业带来了巨大的压力,因此对中药临床合理用药和临床疗效提升的指导和支持作用一直难以体现。
为弥补以上方法的不足,本研究提出了丹参药材的“质-量”双标控制方法,紧扣中药多成分、多功效和整合作用的质量内涵和特点,其指标为能够反映其药效的化学成分;采用1种内标物质对特征峰化学成分进行相对定量,尽可能控制供试药材有效化学成分含量同时,不需要大量购买对照品,在满足中药化学成分“整体性”与“清晰性”的同时减轻了中药复杂体系质量评控成本。本方法以对照药材为基准物质构建特征图谱,并以可代表丹参药效的有限个代表性成分作为特征峰,评价对照药材和供试药材特征峰的相似度,用于判断丹参的真伪;选用保留时间稳定且价格低廉、易获得的内标物质作为定量评价指标,开展基于内标物质的特征峰化学成分相对定量研究,通过内标物质化学成分准确定量,计算供试药材特征峰化学成分的相对含量,用于判断丹参的优劣。基于“质-量”双标的丹参质量分析方法可有效解决丹参有效成分同时快速测定和中药复杂体系质量评控成本高的问题。
1 仪器与材料
1.1 仪器
HS6150型超声波清洗器(天津恒奥科技发展有限公司);ME55十万分之一电子分析天平(上海梅特勒-托利多仪器有限公司);Agilent 1260Ⅱ高效液相色谱仪、Agilent 6550 Q-TOF-MS质谱仪(美国安捷伦科技有限公司)。
1.2 材料
丹参对照药材(批号120989-201705,中国食品药品检定研究院)。10批丹参供试药材来源及批号信息见表1,经辽宁中医药大学张慧教授鉴定为唇形科植物Bge.的根及根茎。丹酚酸B对照品(经HPLC检测质量分数≥96.1%,批号111562-201917)由中国食品药品检定研究所提供。乙腈(质谱级,德国Merck公司);水(纯净水,杭州娃哈哈集团有限公司)。
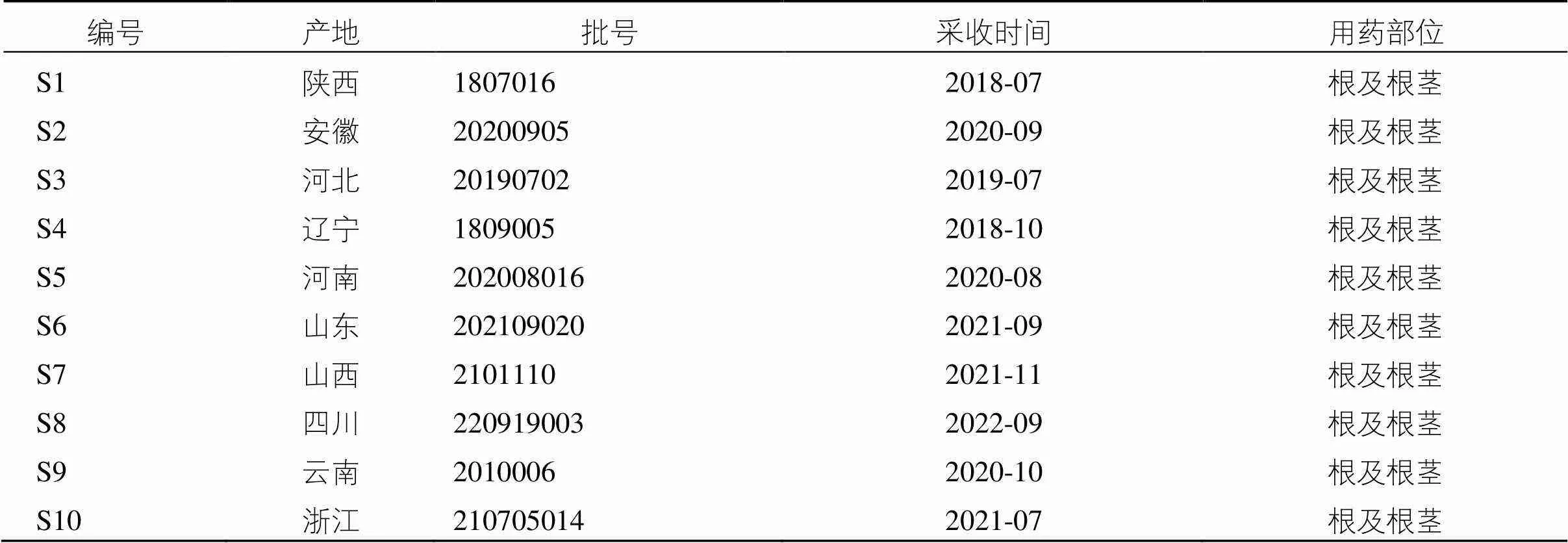
表1 丹参来源及批号信息
2 方法与结果
2.1 基于丹参对照药材的特征图谱建立
2.1.1 溶液的制备 取丹参对照药材粉末(过4号筛)0.50 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇50 mL,称定质量,超声30 min,放冷,再称定质量,用80%甲醇补足失重,摇匀,滤过挥干,80%甲醇定容至10 mL量瓶,摇匀,过0.22 μm滤膜,续滤液作为参照物溶液。取丹参供试药材粉末(过4号筛)0.50 g,按上述方法制成供试品溶液。
2.1.2 色谱条件 色谱柱:Agilent Poroshell 120 SB-C18色谱柱(100 mm×4.6 mm,2.7 μm),流动相为水(A)-乙腈(B);梯度洗脱程序:0~5 min,15%~25% B;5~10 min,25% B;10~12 min,25%~35% B;12~20 min,35%~48% B;20~30 min,48%~55% B;30~35 min,55% B;35~40 min,55%~56% B;体积流量0.6 mL/min;柱温30 ℃,DAD检测波长280 nm,进样量5 μL。
2.1.3 精密度试验 精密吸取同一供试品溶液5 μL,按“2.1.2”项色谱条件测定,连续进样6次,测定各色谱峰相对保留时间、相对峰面积,计算RSD。各色谱峰相对保留时间、相对峰面积RSD在0.9%~1.0%,表明仪器精密度良好。
2.1.4 稳定性试验 精密吸取同一供试品溶液5 μL,按“2.1.2”项色谱条件分别在0、2、4、8、12、24 h进样6次,测定各色谱峰相对保留时间、相对峰面积,计算RSD。各色谱峰相对保留时间、相对峰面积RSD在2.1%~2.3%,表明供试品溶液在24 h内稳定。
2.1.5 重复性试验 按供试品溶液制备方法制备6份供试样品,按“2.1.2”项色谱条件分别进样检测,测定各色谱峰相对保留时间、相对峰面积,计算RSD。各色谱峰相对保留时间、相对峰面积RSD在1.6%~1.7%,表明方法重复性良好。
2.1.6 特征图谱的建立 将参照物溶液和供试品溶液,每份样品平行2次,按色谱条件依次进样检测,将280 nm波长下的图谱数据由分析检测仪器中导入中国药典委员会“中药指纹图谱相似度评价软件”(2012.130727版本),获得10批丹参药材的HPLC特征叠加图谱,见图1。以丹参对照药材的图谱为参照谱图,使用中位数进行自动匹配,加以多点校正,共标定6个共有峰,其中3号峰稳定性、重复性、分离度好、位置居中,故以其作为参照峰(S);将共有模式与对照药材特征图谱进行比对,见图2。供试品色谱在相应位置呈现6个特征峰,并与对照药材色谱图中的6个特征峰保留时间相对应,见表2。
2.2 相似度评价
以丹参对照药材和供试药材特征峰的相似度明确丹参药材真伪。采用中国药典委员会“中药指纹图谱相似度评价软件”(2012.130727版本)进行数据处理,利用夹角余弦法计算供试品与对照药材特征图谱的相似度应不得低于0.90。丹参供试药材与丹参对照药材的相似度均大于0.96,说明本研究所收集的丹参供试药材的特征峰化学成分基本一致,质量相对稳定[5-6],相似度结果见表3。
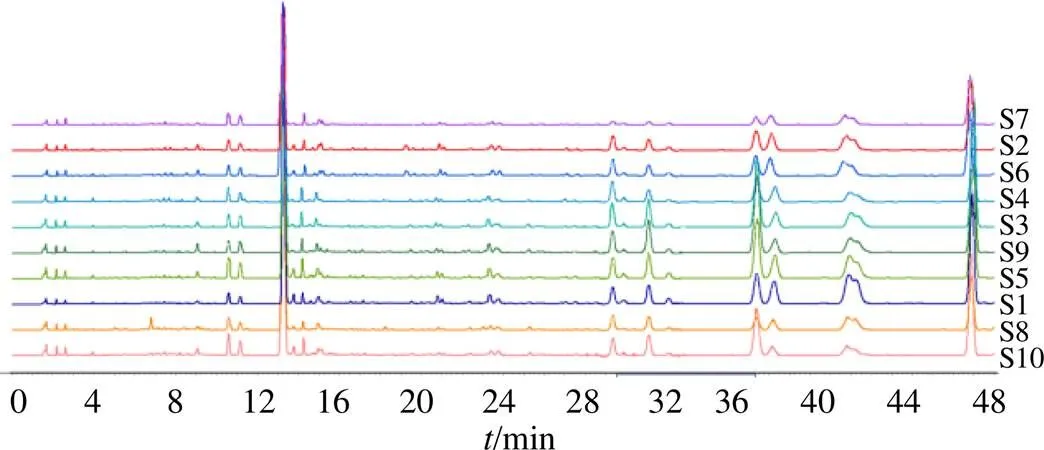
图1 10批丹参供试药材的HPLC叠加图谱
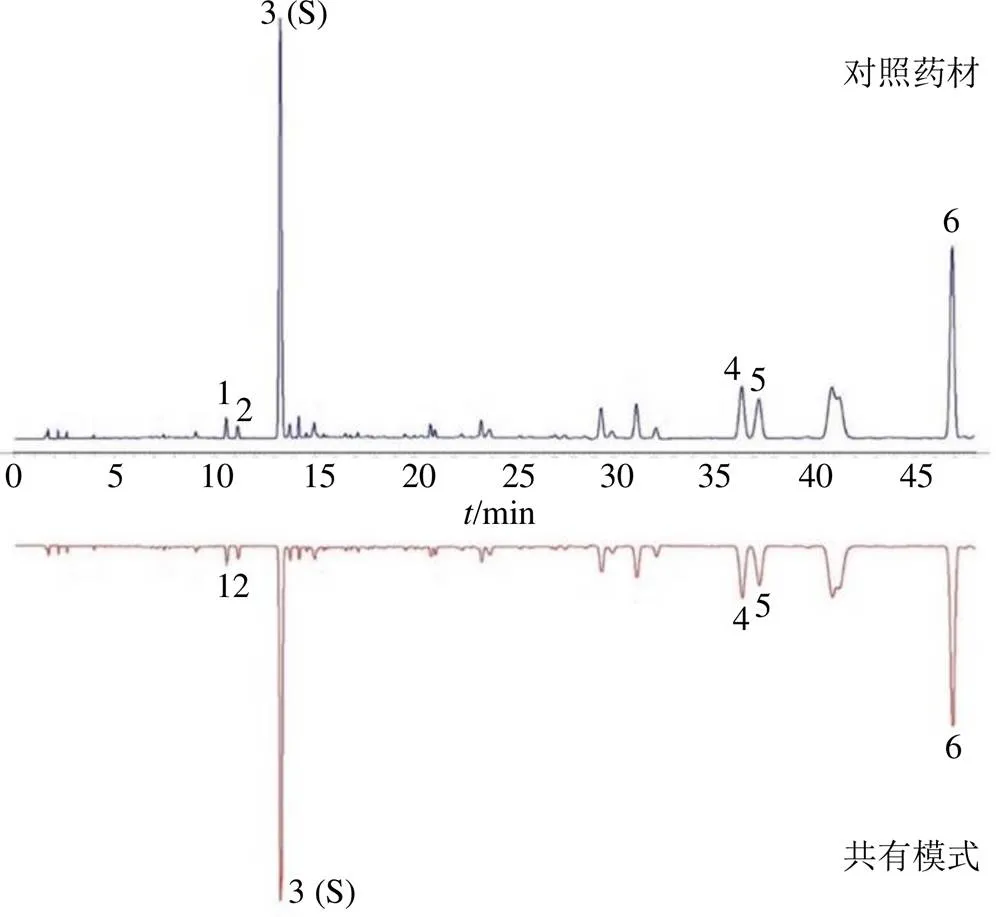
图2 丹参对照药材特征图谱及供试药材共有模式

表2 特征峰保留时间及相对保留时间
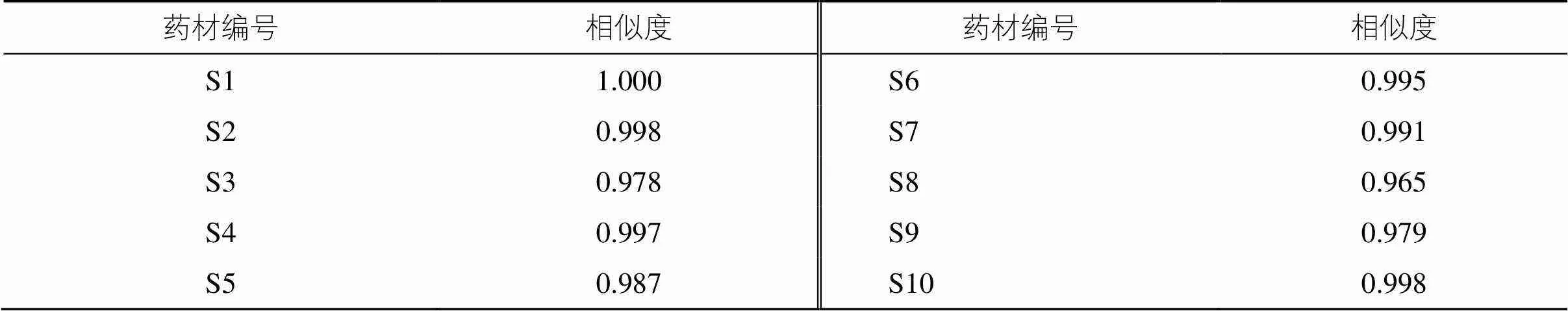
表3 丹参供试药材相似度评价
2.3 特征峰化学成分解析
在初步采用Agilent-1260Ⅱ高效液相色谱仪利用相对保留时间与对照品比对的基础上,采用Agilent 6550 Q-TOF-MS质谱仪,进行质谱分析,运用Agilent MassHunter Qualitative Analysis软件,通过对照品比对的方法对正、负离子模式进行化学成分解析,进一步明确特征峰所代表的化学成分。
2.3.1 色谱条件 色谱柱:Agilent poroshell 120 SB-C18色谱柱(100 mm×2.1 mm,2.7 μm);流动相:水(A)-乙腈(B);梯度洗脱程序:0~5 min,15%~25% B;5~10 min,25% B;10~12 min,25%~35% B;12~20 min,35%~48% B;20~30 min,48%~55% B;30~35 min,55% B;35~49 min,55%~56% B;体积流量0.6 mL/min;柱温30 ℃;进样量1 μL。
2.3.2 质谱条件 电喷雾离子源(Dual AJS ESI),正、负离子模式,毛细管电压(Vcap)为3500 V,干燥气体体积流量为11 L/min,干燥气体温度为150 ℃,雾化器压力为172.4 kPa,鞘气温度为350 ℃,鞘气体积流量为10 L/min,质量扫描范围/100~1000。
采用auto MS/MS模式,利用对照品比对及数据库查询等方法对特征峰化学成分进行解析。正、负离子模式鉴定出了6个特征峰所代表的化学成分,见图3。其中,1号峰为迷迭香酸、2号峰为紫草酸、3号峰为丹酚酸B、4号峰为隐丹参酮、5号峰为丹参酮I、6号峰为丹参酮IIA,鉴定结果见表4。
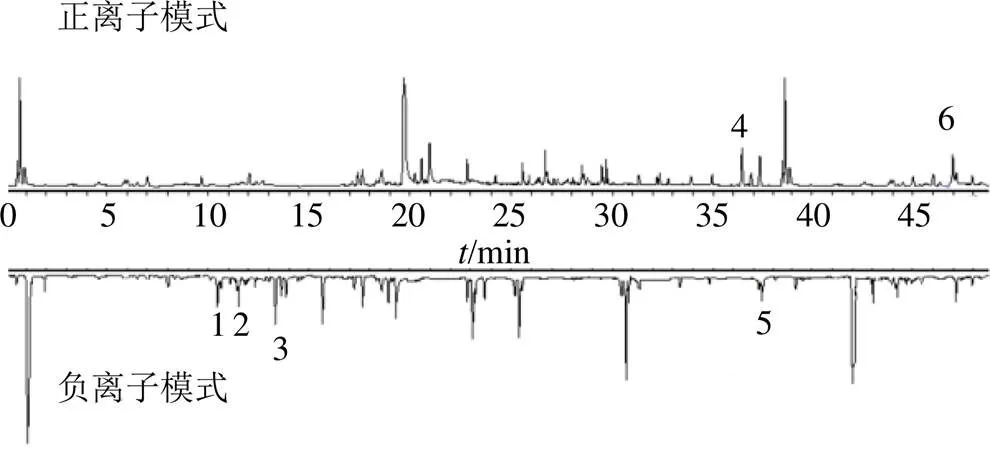
1-迷迭香酸 2-紫草酸 3-丹酚酸B 4-隐丹参酮 5-丹参酮I 6-丹参酮IIA
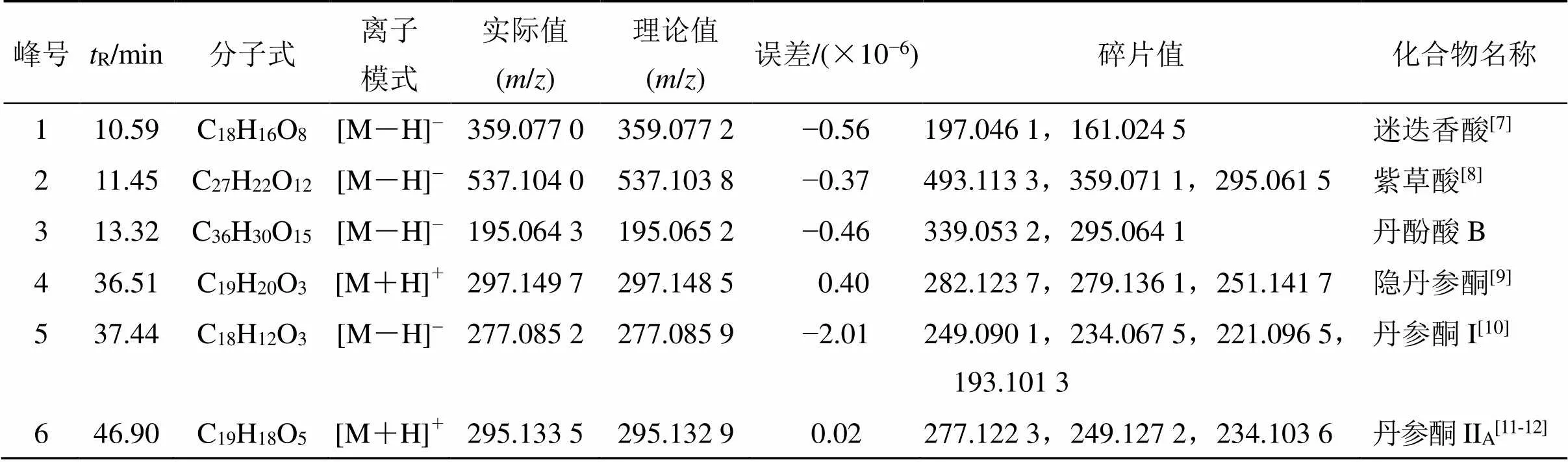
表4 丹参药材特征峰的UPLC-Q-TOF-MS鉴定
2.4 基于内标物质的特征峰化学成分相对定量研究
丹酚酸B(3号峰)为《中国药典》2020年版中丹参“含量测定”项下的指标成分之一,该峰分离效果好、峰面积大、保留时间稳定、对照品价格低廉,故以其作为内标物质,开展基于内标物质的特征峰化学成分相对定量研究。
2.4.1 线性关系考察 配制丹酚酸B的6个不同质量浓度溶液,按“2.1.2”项下色谱条件,分别进样检测,以质量()为横坐标,峰面积()为纵坐标,绘制标准曲线并进行线性回归,得到线性回归方程=1 767.0-6.498 9,=1.000 0,线性范围0.906 6~1.976 0 μg。结果表明进样量范围内与峰面积呈良好的线性关系。
2.4.2 精密度试验 取同一对照品溶液,按“2.1.2”项色谱条件连续进样6次,测定丹酚酸B峰面积的RSD为1.26%,表明仪器精密度良好。
2.4.3 稳定性试验 取同一供试品溶液,按“2.1.2”项色谱条件分别在0、2、4、8、12、24 h进样,测定丹酚酸B峰面积的RSD为2.14%,表明供试品溶液在24 h内稳定。
2.4.4 重复性试验 精密称取同一供试品药材粉末6份,按“2.1.1”项下方法平行制备6份供试品溶液,按“2.1.2”项色谱条件测定峰面积,计算丹酚酸B质量分数的RSD为2.62%,表明方法重复性良好。
2.4.5 加样回收率试验 精密称定丹参药材粉末6 份,分别精密加入丹酚酸B对照品适量,按“2.1.1”项下方法制备供试品溶液,按“2.1.2”项下色谱条件,分别进样检测,计算得到丹酚酸B的平均加样回收率为99.45%,RSD为1.25%。
2.4.6 耐用性试验 精密吸取同一供试品溶液,考察不同规格的色谱柱(Agilent poroshell 120 SB-C18、Agilent poroshell 120 EC-C18)、不同的高效液相色谱仪(Agilent-1260Ⅱ高效液相色谱仪、Agilent-1290型高效液相色谱仪)、不同柱温(25、30、35 ℃)及不同体积流量(0.6、0.8、1.0 mL/min)对检测结果的影响。结果显示,指认出的6个化学成分的相对保留时间的RSD均小于2.89%,相对峰面积的RSD均小于2.0%~2.1%,表明该方法的耐用性良好。
2.4.7 相对含量测定 取丹参供试品药材,按“2.1.1”项下方法制备供试品溶液,按“2.1.2”项下色谱条件分析测定丹酚酸B含量,每个供试品平行2份,结果见表5。每个供试品中特征峰化学成分的相对含量计算方法:特征峰化学成分相对含量=特征峰峰面积×(丹酚酸B含量/丹酚酸B峰面积),结果见表6。以“平均数-标准差”作为特征峰化学成分相对于内标物质的相对含量下限,根据此方法测得的供试药材特征峰化学成分相对含量不应低于该含量下限[13]。
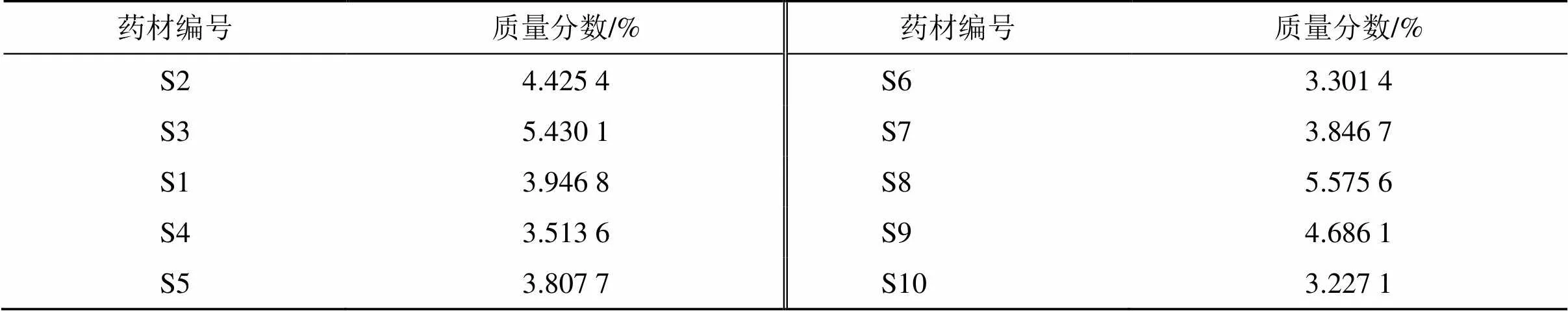
表5 内标物质丹酚酸B的准确定量结果(n =2)
特征峰化学成分相对含量=特征峰峰面积×(丹酚酸B含量/丹酚酸B峰面积) 相对含量下限=平均数-标准差
Relative content of characteristic peak chemical composition = characteristic peak area × (salvianolic acid B content/salvianolic acid B peak area) lower limit of relative content = mean-standard deviation
3 讨论
中药化学成分复杂、品种来源宽泛,导致中药质量良莠不齐。而市面上伪品同时作为丹参入药,容易造成鉴别困难与临床用药混乱的现象,影响中药丹参的临床合理使用。目前,中药材(饮片)质量控制方法存在着单一指标不能反映药材整体特征且依赖于多种对照品,而指纹图谱只能模糊地评价药材相似性,不能清晰地判断供试品真伪优劣[12]。
为解决上述问题,本研究创新研究思路,提出不依赖多种对照品,以价格低廉、易获得的对照药材为基准物质的定性和不依赖多种对照品定量的丹参药材“质-量”双标控制方法。通过构建丹参对照药材及10个不同产地丹参供试药材的特征图谱,以对照药材为基准物质,评价对照药材和供试药材特征峰的相似度,判断丹参药材的真伪,即“质”;同时准确定量1种内标物质化学成分,计算丹参药材其余各特征峰的相对含量,通过确定各特征峰相对含量的下限来判断丹参药材优劣,即“量”。本研究所提出的丹参药材的“质-量”控制方法能够有效判断药材的真伪优劣,形成一个科学、可控的中药质量控制体系。
本研究以信噪比大于10、分离度大于1.5作为特征峰的选取依据。采用质谱联用技术指认出6个化学成分。丹参酮I可通过抑制基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)和MMP-9的表达以及Toll样受体4(toll-like receptor 4,TLR4)/ 核因子抑制蛋白-α(inhibitor kappa B alpha,IκBα)/核因子-κB(nuclear factor-κB,NF-κB)信号通路,调控肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-1β等炎症因子的释放而发挥抗炎活性[14]。丹参酮ⅡA联合癌易感性候选基因2(cancer susceptibility candidate 2,CASC2)可以抑制甲状腺癌细胞的增殖、迁移和侵袭,以及诱导细胞凋亡[15];隐丹参酮通过抑制脑胶质瘤GL261细胞的增殖发挥抗脑胶质瘤作用[16];丹酚酚B可通过Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路抑制胸主动脉瘤的发生发展,并改善免疫功能、炎性反应及氧化应激状态[17]。上述研究结果与丹参治疗心脑血管疾病、抗炎、抗肿瘤等功效相关,从而进一步证明本方法特征峰的选择能够较科学地阐述丹参的药效。
4 结论
本研究所收集的丹参供试药材与丹参对照药材的相似度均大于0.90[18],说明所收集的丹参供试药材的特征峰化学成分基本一致,但仅采用10批不同产地的药材规定特征峰相对含量下限,缺乏全面性,因此,需要更进一步大量收集不同产地、不同批次的药材,完善该方法,以期有效判断药材的真伪优劣,形成一个科学、可控的中药质量控制体系,在满足药材多项质量控制项的同时减轻企业需大量购买对照品的经济压力,推动中医药事业可持续发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 78.
[2] 阎正, 阎海荣, 赵坤娇, 等. 丹参药材的HPLC指纹图谱 [J]. 河北大学学报: 自然科学版, 2008, 28(1): 69-73.
[3] Wang R N, Zhao H C, Huang J Y,. Challenges and strategies in progress of drug delivery system for traditional Chinese medicineet(Danshen) [J]., 2021, 2020, 13(1): 78-89.
[4] 冯科冉, 李伟霞, 王晓艳, 等. 丹参化学成分、药理作用及其质量标志物 (Q-Marker) 的预测分析 [J]. 中草药, 2022, 53(2): 609-618.
[5] 任慧, 胡静, 崔小敏, 等. 基于指纹图谱结合化学模式识别及多酚类成分含量测定的大盘龙七质量评价 [J]. 中草药, 2023, 54(19): 6452-6460.
[6] 曾慧婷, 沙秀秀, 宿树兰, 等. 不同产地丹参茎叶UPLC指纹图谱与化学模式识别研究 [J]. 中草药, 2017, 48 (4): 767-772.
[7] Guo X R, Chen X H, Li L,. LC-MS determination and pharmacokinetic study of six phenolic components in rat plasma after taking traditional Chinese medicinal-preparation: Guanxinning lyophilized powder for injection [J]., 2008, 873(1): 51-58.
[8] 王淑萍. 济泰片药效物质基础及药代动力学研究 [D]. 上海: 第二军医大学, 2013.
[9] 邵坚, 熊艳霞, 谢斌, 等. 基于UPLC-Q-TOF/MS的肿节风化学成分分析 [J]. 药物分析杂志, 2021, 41(6): 1054-1063.
[10] 秦伟瀚, 冉继春, 叶良红, 等. UPLC-Q/TOF法同时定性定量分析滇芹药材中主要化学成分 [J]. 中草药, 2018, 49(15): 3576-3582.
[11] 孙宁宁, 张可佳, 耿婉丽, 等. 基于UPLC-Q-TOF-MS的加参片提取物化学成分分析 [J]. 中草药, 2018, 49(2): 293-304.
[12] 闫旭, 张楠, 冀召帅, 等. 基于UPLC-Q-Orbitrap HRMS技术的参坤养血颗粒化学成分研究 [J]. 中草药, 2018, 49(18): 4231-4240.
[13] 王梦林, 巴寅颖, 武秋红, 等. 基于有效基准特征图谱质量表征的中药荷叶质量评价研究[J]. 环球中医药, 2022, 15(6): 40-948.
[14] 侯道荣, 刘振, 崔斯童, 等. 丹参酮IIA通过调控TLR4/IκBα/NFκB信号通路抑制LPS诱导的细胞炎症 [J]. 中国药理学通报, 2021, 37(2): 210-214.
[15] 黄敏, 杨燕. 丹参酮ⅡA联合CASC2对甲状腺癌细胞增殖、凋亡、迁移、侵袭的影响固有淋巴细胞在脂质代谢中的研究进展 [J]. 中国细胞生物学学报, 2021, 43(5): 947-955.
[16] 赵华聪, 王永明, 崔季维, 等. 隐丹参酮靶向脂质体的构建及其体外抗脑胶质瘤考察 [J]. 药学学报, 2021, 56(12): 3268-3276.
[17] 陈路, 胡何节, 方征东, 等. 丹酚酸B通过JAK2/ STAT3信号通路抑制大鼠胸主动脉瘤的机制研究 [J]. 中药材, 2021, 44(8): 1971-1975.
[18] 张智, 龙华, 曾罗, 等. 不同产地杜仲雄花指纹图谱的建立及其化学模式识别研究 [J]. 中草药, 2022, 53(22): 7207-7213.
Study on quality analysis method ofetbased on “quality-quantity” double standard
DING Xin-yao1, BAO Yong-rui1, 2, 3, WANG Shuai1, 2, 3,LI Tian-jiao1, 2, 3, MENG Xian-sheng1, 2, 3
1. College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China 2. Liaoning Multi-dimensional Analysis of Traditional Chinese Medicine Technical Innovation Center, Dalian 116600, China 3. Liaoning Modern Traditional Chinese Medicine Research and Engineering Laboratory, Dalian 116600, China
To establish a “quality-quantity” double standard control method for Danshen (et), which was qualitative based on the reference traditional Chinese medicinal materials (TCMM) as standard substances and quantified without relying on multiple reference substances.HPLC technology was used to establish the characteristic chromatogram ofetbased on the reference TCMM as standard substances. The chemical constituents of common peaks were identified by quadrupole-time of flight mass spectrometry (Q-TOF-MS) technology, and the authenticity ofetwas determined by the similarity of characteristic peaks of the reference TCMM and the tested TCMM. The above statement is “quality”. The relative content of each characteristic peak in different batches of the tested TCMM was calculated by accurate quantition of internal standard component salvianolic acid B. The “average value-standard deviation” was taken as the lower limit of the relative content of characteristic peak chemical components relative to chemical composition of internal standard substance, and the merits ofetwas determined according to the lower limit of the relative content of characteristic peak. The above statement is “quantity”.The characteristic chromatogram and content determination method met the requirements of methodology investigation. A total of six common chromatographic peaks were determined, which were rosmarinic acid, alkannic acid, salvianolic acid B, cryptotanshinone, tanshinone I, tanshinone IIA. The similarity between the tested TCMM and reference TCMM was greater than 0.90. The lower limit of relative content of chemical components ofetcharacteristic peak was defined.The method can judge the authenticity of medicinal materials clearly and quickly without many reference substances, and provide reference for quality control ofet.
et; “quality-quantity” double standard; reference traditional Chinese medicinal materials; quality control; characteristic chromatogram; salvianolic acid B; rosmarinic acid; alkannic acid; cryptotanshinone; tanshinone I; tanshinone IIA
R286.02
A
0253 - 2670(2023)22 - 7287 - 06
10.7501/j.issn.0253-2670.2023.22.002
2023-05-10
辽宁省教育厅创新团队项目(LT2017015)
丁昕瑶,女,研究生,主要从事药物分析研究。Tel: 15140621102 E-mail: dxy07172021@163.com
通信作者:孟宪生,男,博士生导师,主要从事药效物质组学和作用机制整合研究。E-mail: mxsvvv@126.com
[责任编辑 潘明佳]
