心安Ⅰ号胶囊对动脉粥样硬化模型大鼠血管炎症及PI3K/AKT/GRP78信号通路的作用机制研究
2023-11-25王久和李彬彬王慧敏
王久和,张 晶,李彬彬,王慧敏
动脉粥样硬化(AS)是炎性因子及趋化因子等表达升高导致的一系列病理改变[1]。炎症反应存在于AS疾病发生发展的各个阶段,核转录因子κB(NF-κB)在AS疾病中表达升高,其激活可以加快脂质因子、炎性细胞因子表达,提高血管炎症水平,促进斑块进展[2]。磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)是目前研究较广泛的信号通路,该信号通路可参与AS的发生发展,且通过抑制PI3K/AKT激活可有效减少AS的形成[3]。内质网应激(ERS)可贯穿AS发展的始终,内质网上的新生肽链中葡萄糖调节蛋白78抗原(GRP78)表达激活后可导致细胞凋亡[4]。ERS可通过增加巨噬细胞凋亡而加重AS斑块的形成[5]。因此,减少AS过程中的ERS对于改善疾病意义重大。中医学中无AS之称,但根据临床表现可将其归属于“眩晕”“健忘”“痴呆”“胸痹”等范畴,病机与气血失养、肾精亏虚及情志失调等相关,建议采用健脾益气、滋阴养血及补益肝肾为主的方法治疗[6]。心安Ⅰ号胶囊是用于治疗冠心病心律失常的中成药,具有活血、养阴、通络的作用[7]。本研究探讨心安Ⅰ号胶囊对AS大鼠血管炎症及PI3K/AKT/GRP78信号通路的影响,为AS疾病的治疗及机制研究提供依据。
1 材料与方法
1.1 实验仪器与试剂
酶联免疫吸附法(ELISA)试剂盒(中国天津安诺瑞康生物,批号:208180418),二氨基联苯胺3(DBA)显色液(中国北京索莱宝科技,批号:20181120),磷酸盐缓冲液(PBS)(美国Santa Curz),增强化学发光法(ECL)试剂盒(中国上海碧云天生物,批号:82417170930),辣根酶标记羊抗兔抗体IgG(中国北京中山金桥生物,批号:136080),甘油醛-3-磷酸脱氢酶(GAPDH)单抗(中国上海生工生物,批号:1914526843);PI3K单抗、AKT单抗及GRP78单抗(中国武汉博欧特生物科技有限公司,批号:orb137259,10763-T16,102056-T40-50),C2500-R-230V型微型高速离心机(美国labnet);DYCZ-24DN型垂直电泳槽、DYCZ-40型电泳仪电源(中国北京六一仪器厂生产)。
1.2 药物
心安Ⅰ号胶囊为我院院内制剂,由黄芪、炙甘草、麦冬、丹参、玉竹组成,经水提取、浓缩、干燥后低温保存,每克含有生药2.5 g;阿司匹林购自广东九明制药有限公司,每片0.3 g,国药准字:H44021139。
1.3 动物模型的构建
60只4~5周龄健康雄性SD大鼠,体质量180~200 g,购自广东省医学实验动物中心,动物许可证号:SYXK(粤)2020-0011。5只1笼,在23 ℃、湿度50%左右环境中饲养。大鼠饲养7 d后随机分为假手术对照(Sham)组、AS组、心安Ⅰ号胶囊低剂量组、心安Ⅰ号胶囊中剂量组、心安Ⅰ号胶囊高剂量组、阿司匹林组。参考文献[8]构建AS动物模型,腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉大鼠,于颈部中段开3 mm切口,暴露左侧颈部总动脉,2根4号丝线结扎颈部远端动脉,结扎处做V形切口,将球囊沿着切口处插入主动脉,扩张球囊,放松丝线保证血流畅通,抽离球囊,结扎动脉近端,抽去丝线,确保血流畅通后检测颈动脉是否充盈搏动良好。碘附消毒后缝合皮肤,腹腔注射青霉素16×104U以预防感染。术后7 d内喂养普通饲料,术后第8~14 d给予高脂饲料,Sham组仅结扎远端颈部动脉。饲养6周后,大鼠总胆固醇(TC)及三酰甘油(TG)水平升高及HE染色出现粥样硬化斑块,说明造模成功[7,9]。
1.4 干预方法
建模成功后,心安Ⅰ号胶囊低剂量组、心安Ⅰ号胶囊中剂量组、心安Ⅰ号胶囊高剂量组分别给予0.47、0.94、1.88 g/kg的心安Ⅰ号胶囊药液灌胃。阿司匹林组给予0.25 g/kg阿司匹林药液灌胃,Sham组及AS组大鼠灌胃等量蒸馏水,每日1次,连续灌胃7 d。
1.5 ELISA检测各组大鼠血清炎性因子水平
采集各组大鼠尾静脉血1.5 mL,分3次抽取,每次0.5 mL,3 500 r/min,离心10~15 min,离心半径12 cm,实验步骤严格按照说明书进行,检测白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF-α)、细胞间黏附分子-1(ICAM-1)及血管内皮黏附分子-1(VCAM-1)的含量。
1.6 各组大鼠血脂水平检测
采集各组大鼠尾部静脉血1 mL,采用AU400全自动生化分析仪检测TC、TG、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)含量。
1.7 颈动脉病理学变化
处死大鼠后迅速取出损伤部位动脉组织,使用4%的多聚甲醛固定24 h,乙醇梯度脱水,包埋剂处理后切片,苏木精染色3 min,清水冲洗2 min至返蓝,1%盐酸处理后采用伊红试剂复染3 min,清水冲洗2 min,梯度乙醇脱水,透明处理,中性树脂封片,显微镜下观察组织病理学变化。
1.8 免疫组化检测颈动脉组织NF-κB及NF-κB p65阳性细胞数
取颈部动脉组织,石蜡切片,常规脱蜡脱水后,采用PBS冲洗3次,间隔5 min,37 ℃下用羊血清封闭60 min,加入NF-κB(1∶500)及NF-κB p65(1∶500)一抗,4 ℃下孵育24 h,加入二抗辣根过氧化物酶标记山羊抗兔IgG(1∶1 000),孵育30 min,冲洗后加入50 μL的链霉亲和素-生物素复合物,DBA显色,冲洗,终止显色,透明、封片,选择5个不重复视野观察阳性细胞数,细胞核中有棕黄色颗粒者为阳性细胞。
1.9 蛋白免疫印迹(Western Blot)检测颈动脉组织PI3K、AKT、GRP78蛋白表达
取冰冻颈动脉组织,4 ℃解冻后,冰上匀浆提取蛋白,双辛可宁酸(BCA)法检测蛋白。取100 μg蛋白进行电泳及转膜,加入1抗PI3K(1∶1 000)、AKT(1∶1 000)、GRP78(1∶500)及内参GAPDH(1∶2 500),4 ℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔二抗(1∶2 000),室温孵育3 h,增强发光法染色,ECL化学发光试系统JY-Clear分析蛋白值。
1.10 统计学处理

2 结 果
2.1 各组大鼠血清炎性因子水平比较
与Sham组比较,AS组大鼠血清TNF-α、IL-6、IL-1β、ICAM-1及VCAM-1水平升高(P<0.05);与AS组比较,心安Ⅰ号胶囊低、中、高剂量组TNF-α、IL-6、IL-1β、ICAM-1及VCAM-1水平降低(P<0.05),且呈剂量依赖性(P<0.05);心安Ⅰ号胶囊高剂量组与阿司匹林组TNF-α、IL-6、IL-1β、ICAM-1及VCAM-1水平比较差异无统计学意义(P>0.05)。详见表1。

表1 各组大鼠血清炎性因子水平比较
2.2 各组大鼠血脂水平比较
与Sham组比较,AS组大鼠血清TG、TC及LDL-C水平升高,HDL-C水平降低(P<0.05);与AS组比较,心安Ⅰ号胶囊低、中、高剂量组TG、TC及LDL-C水平降低,HDL-C水平升高(P<0.05),且呈剂量依赖性(P<0.05);心安Ⅰ号胶囊高剂量组与阿司匹林组TG、TC、LDL-C、HDL-C水平比较差异无统计学意义(P>0.05)。详见表2。

表2 各组大鼠血脂水平比较 单位:mmol/L
2.3 各组大鼠颈动脉组织病理形态比较
Sham组大鼠颈部动脉壁未见增厚,未见斑块形成及损伤脱落;AS组大鼠动脉壁有斑块蓄积,同时出现胆固醇结晶、血管内皮损伤及坏死组织沉积;心安Ⅰ号胶囊低剂量组存在稍许的动脉壁增厚,细胞排列整齐度较差;心安Ⅰ号胶囊中剂量组未见坏死细胞,增生纤维组织有所改善;心安Ⅰ号胶囊高剂量组及阿司匹林组未见坏死细胞,排列整齐,结构完整。详见图1。
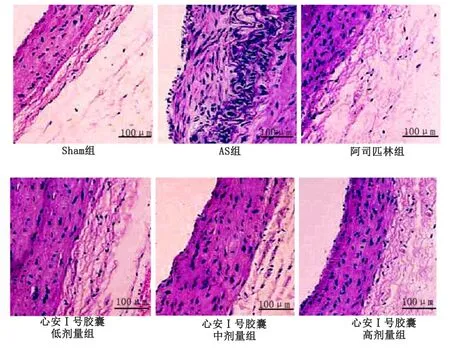
图1 各组大鼠颈动脉组织病理形态变化(HE染色,×400)
2.4 各组大鼠颈动脉组织NF-κB及NF-κB p65阳性细胞数比较
与Sham组比较,AS组大鼠NF-κB、NF-κB p65阳性细胞数升高(P<0.05);与AS组比较,心安Ⅰ号胶囊低、中、高剂量组NF-κB、NF-κB p65阳性细胞数降低(P<0.05),且呈剂量依赖性(P<0.05);心安Ⅰ号胶囊高剂量组与阿司匹林组NF-κB、NF-κB p65阳性细胞数比较差异无统计学意义(P>0.05)。详见表3、图2。

图2 各组大鼠颈动脉组织NF-κB及NF-κB p65阳性细胞数(DAB染色,×400)

表3 各组大鼠颈动脉组织NF-κB及NF-κB p65阳性细胞数比较 单位:%
2.5 各组大鼠PI3K、AKT、GRP78蛋白水平比较
与Sham组比较,AS组大鼠PI3K、AKT、GRP78蛋白表达升高(P<0.05);与AS组比较,心安Ⅰ号胶囊低、中、高剂量组PI3K、AKT、GRP78蛋白表达降低(P<0.05),且呈剂量依赖性(P<0.05);心安Ⅰ号胶囊高剂量组与阿司匹林组PI3K、AKT、GRP78蛋白表达比较差异无统计学意义(P>0.05)。详见表4、图3。

图3 各组大鼠PI3K、AKT、GRP78蛋白表达条带图

表4 各组大鼠PI3K、AKT、GRP78蛋白表达比较
3 讨 论
AS属于血管炎性疾病,是脂质因子及炎性细胞大量聚集损伤血管内皮细胞,损伤的内皮细胞释放化学物质,吸引白细胞和血小板进入血管壁,并逐渐沉积在损伤的部位促进血管管腔狭窄[10]。本研究结果显示,AS大鼠外周血中TNF-α、IL-6、IL-1β、ICAM-1及VCAM-1水平升高,与动脉内壁的炎性细胞浸润相关,并可促进疾病进展,而采用不同剂量的心安Ⅰ号胶囊干预后均降低,表明心安Ⅰ号胶囊具有较好的抗炎作用,且疗效随药物剂量的升高而增加。AS导致的血管狭窄与局部炎症紊乱有关,TNF-α、IL-6、IL-1β为常见的炎性因子,在AS发生发展过程中均呈高表达状态,并可通过激活NF-κB增加炎症反应[11]。NF-κB是一种重要的转录因子,与炎症反应和免疫应答密切相关,激活的NF-κB可以诱导IL-6、TNF-α、黏附分子等的产生,这些炎性因子可引起动脉内皮细胞的黏附、炎性细胞的浸润以及斑块的形成,进一步加剧AS的发展[12]。阿司匹林作为一种非甾体抗炎药,主要通过抑制环氧化酶和前列腺素的合成发挥抗炎作用,还可以抑制血小板聚集,从而防止血栓形成,研究发现,阿司匹林可以通过抑制NF-κB炎症通路发挥抗炎作用[13]。心安Ⅰ号胶囊是在经典古方甘草汤及生脉饮的基础上衍生的中药制剂,主要由黄芪、炙甘草、麦冬、丹参、玉竹等组成,其中,黄芪滋补正气,炙甘草补气、散寒,麦冬养阴生津、安神,玉竹润肺、养胃生津[13]。心安Ⅰ号胶囊中黄芪为君药,化学结构复杂,包含皂苷类、多糖类及黄酮类等,生物学活性较广,对心血管疾病的应用价值较高。梁荣寿等[14]研究显示,在损伤的内皮细胞中采用黄芪注射液干预后,IL-6及ICAM-1等炎性因子表达降低,推测是通过抑制炎性因子水平而发挥内皮细胞保护作用。炙甘草汤是治疗阴血阳气虚弱、心脉失养的经典方,研究表明,心肌纤维化大鼠外周血TNF-α过表达可减少心脏成纤维细胞的增殖,进而抑制心肌纤维化的发生和发展,其机制与炙甘草汤可下调NF-κB表达相关[15]。本研究结果显示,AS大鼠外周血TG、TC及LDL-C水平升高,HDL-C降低,而采用心安Ⅰ号胶囊干预后,TG、TC及LDL-C水平降低,HDL-C升高,说明心安Ⅰ号胶囊可改善血脂紊乱。Nakagawa等[16]研究表明,AS与血脂水平异常相关,表现为TG、TC、LDL-C升高,HDL-C降低。AS病人机体血脂紊乱,TG、TC、LDL-C升高,HDL-C降低,当脂质紊乱改善后,斑块的产生及脱落将减少。心安Ⅰ号胶囊中丹参可抑制血小板聚集,改善血液循环[17];炙甘草可抗血脂并扩张血管而抑制斑块形成[18];黄芪中的黄酮类可抗氧化减轻氧化应激引起的血管内皮损伤[19]。
PI3K/AKT是一条重要的细胞信号传导通路,参与调控多种细胞生理功能和代谢过程。研究表明,PI3K/AKT通路能够促进平滑肌细胞的增殖和迁移,参与调控炎性因子的产生和释放,从而促进AS的发生[20]。AS发生过程中PI3K/AKT可与NF-κB结合而加快病理损伤,并认为抑制PI3K/AKT/NF-κB活性可减轻血管炎症反应[21]。心安Ⅰ号胶囊对PI3K/AKT/NF-κB具有抑制作用。阎卉芳等[22]研究表明,在球囊导管损伤导致血管平滑肌细胞增加,PI3K/AKT激活而加快动脉损伤,单独使用黄芪或与当归配伍均可以抑制PI3K/AKT磷酸化而改善血管内皮损伤,从而发挥血管内皮保护作用。GRP78是一种分子伴侣蛋白,广泛存在于内质网(ER)中。GRP78能够促进血管平滑肌细胞的增殖和迁移,参与动脉内膜的增厚和斑块形成,抑制其表达而改善血管内皮细胞凋亡[23]。牛晓峰等[24]研究表明,黄芪总黄酮可以通过抑制内质网应激,降低GRP78表达而改善心肌炎小鼠的心肌细胞凋亡。
综上所述,心安Ⅰ号胶囊可通过抑制PI3K/AKT/GRP78活性,降低AS大鼠血管炎症损伤及脂质紊乱且呈随剂量依赖性。
