影响颈椎后纵韧带骨化症单开门术疗效的因素△
2023-11-23吴继德拓一帆马达顾文波张潇罗迪袁海峰
吴继德,拓一帆,马达,顾文波,张潇,罗迪,袁海峰
(1.宁夏医科大学总医院,宁夏银川 750000;2.宁夏医科大学临床医学院,宁夏银川 750000)
颈椎后纵韧带骨化症(ossification of the posterior longitudinal ligament,OPLL)是以颈椎后纵韧带发生骨化,继而引起颈椎椎管内狭窄导致脊髓、神经根受压,临床上患者常常出现感觉、运动及膀胱功能障碍的疾病[1]。现阶段对于颈椎OPLL 手术方式的选择,尚无公认的指南,各种减压方法均有优缺点,手术可以通过前路、后路、前后联合入路进行[2]。单开门术,又称为颈后路单开门椎管扩大成形术(posterior unilateral expansive open-door cervical laminoplasty)由于相对安全、并发症发生率低、且疗效尚佳[3,4],是目前对于颈椎OPLL 后路最常用的术式。影响颈椎OPLL 行单开门术疗效的因素甚多,以往的研究报道了几种可能的危险因素,以年龄、病程、椎管占位率、骨化灶形态和颈椎矢状位平衡参数等为著[5,6]。目前对于颈椎OPLL 行单开门术疗效的前瞻性文献较少,尤其对于多个预测因子构建预测模型甚少。因此,结合患者临床症状及影像学资料来构建一个列线图模型是有意义的,根据回归分析得到独立危险因素,将每个预测因子得分对应值相加,从而得到颈椎OPLL 行后路单开门术后疗效的大致概率,进而对每个患者进行个体化的治疗和术前干预措施。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)具有完整的影像学和病历资料的颈椎OPLL 患者;(2)行单开门术;(3)内固定物均为微型钛板;(4)随访时间>6 个月,随访期间未进行脊柱手术。
排除标准:(1)因创伤、肿瘤、感染、先天性疾病等而接受手术的患者;(2)需要二期前路手术的患者;(3)术后出现神经功能恶化和影响JOA 评分疾病(如脑血管疾病、脊髓空洞症等)的患者;(4)既往有脊柱手术史。
1.2 一般资料
回顾性分析宁夏医科大学总医院2015年—2022年就诊颈椎病患者的临床资料,其67 例符合上述标准,纳入本研究。术前所有患者均已被告知手术内容,并已签署《手术知情同意书》。且该研究的实施已通过本院医学伦理委员会批准(批准号:KYLL-2023-0026)。
1.3 手术方法
以C2~T1棘突为中心取后正中纵行切口,显露C3~C7椎板,常规取症状重侧为开门侧,对侧为铰链侧。电动磨钻在双侧椎板侧块移行处打磨出平行于棘突的骨槽,使用球形磨钻直至椎板内层皮质为止。再用枪式咬骨钳切断开门侧全层椎板,并咬除C3椎板上缘与C7椎板下缘的黄韧带。用手指将棘突压向椎板铰链侧并掀开,同时用硬膜剥离器分离硬脊膜下粘连。翻至开门侧端端距离1.2~1.4 cm,铰链侧“V”形骨槽自然闭合,可见硬膜囊膨起,搏动良好,取Arch 钛板分别固定于开门侧的侧块处和棘突根部(评价指标中间断钛板均放置于C3、C5、C7,全板均放置于C3~C7),取明胶海绵覆盖于显露的硬脊膜上。
1.4 评价指标
参考黄宇[7]等依据JOA 评分改善率判定手术疗效标准,术后JOA 评分改善率<60%列为不佳组,JOA 评分改善率≥60%列为良好组。记录所有患者的一般资料及术前临床资料,包括病程、合并症、锥体束征、感觉运动评级、视觉模拟评分法(visual analogue scale,VAS)、日本骨科协会评分(Japanese Orthopaedic Assocoation Scores,JOA)及美国脊髓损伤协会分级(American Spinal Injury Association,ASIA)。术前影像指标,包括:OPLL 分型;K 线(Kyphosis line,Kline);颈椎前凸角(C2~C7Cobb 角)(图1a);T1倾斜角(T1slope,T1S),当X 线没有拍摄胸部或第1 胸椎被肩部遮挡时,可以使用C7S 来替代T1S[8](图1a);整体活动度(range of motion,ROM)(图1b,1c);椎管占位率(见图1e);以及髓信号强度(图1f)。记录手术资料,包括手术时间、术中失血量、术后引流量。

图1 患者,男,36 岁,颈椎后纵韧带骨化症,行C3~C7 行后路单开门椎管扩大成形术,术前JOA 评分10 分,术后1年JOA 评分15 分。1a:术前侧位X 线片示颈椎曲度变直;1b,1c:术前颈椎过伸和过屈位;1d:术前CT 示C4~C6 节段型后纵韧带骨化;1e:椎管占位率测量;1f:术前髓内MRI T2WI 明显高信号;1g,1h:术后1年正侧位X 线示颈椎曲度良好,内固定位置满意,椎板持续于张开位。Figure 1.A 36-year-old male underwent C3~C7 posterior unilateral open-door cervical laminoplasty for ossification of the posterior longitudinal ligament(OPLL)with JOA score of 10 preoperatively,and JOA score of 15 one year postoperatively.1a:Preoperative lateral radiographs showed decreased cervical curvature.1b,1c:Preoperative cervical X-rays in hyperextension and hyperflexion positions.1d:Preoperative CT showed OPLL of C4~C6 segments.1e:Measurement of cervical canal occupying rate.1f:Preoperative MRI T2WI revealed significantly high intramedullary signal.1g,1h:Anteroposterior and lateral X-rays showed good cervical curvature,satisfactory internal fixation position,and continuous opened cervical lamina in the open-door range.
1.5 统计学方法
所有数据均采用IBM SPSS 26.0 和R studio 4.2.1等统计软件进行统计学分析。符合正态的定量资料以±s表示,采用独立样本t检验;计数资料采用卡方检验或校正卡方检验;等级资料采用秩和检验。以临床结果是否优良的二分变量为因变量,其他因素为自变量,行多因素逻辑回归分析。构建列线图模型,并绘制ROC 曲线和校准曲线,利用曲线下面积(aera under cure,AUC)和校准曲线来验证模型的区分度和校准度。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床结果
所有患者均行C3~C7节段减压+微型钛板内固定,均顺利完成手术,随访24 个月以上,按末次随访时JOA 评分改善率<60%或≥60%,33 例列为不佳组,占49.3%;34 例列为良好组,占50.7%。并发症方面,不佳组术后C5神经根麻痹2 例,术后切口感染2 例,脑脊液漏1 例,轴性症状3 例,再关门0例,总发生率为24.2%(8/33);良好组术后出现C5神经根麻痹1 例,术后切口感染1 例,脑脊液漏1例,轴性症状1 例,再关门0 例,总发生率为11.8%(4/34)。两组患者随访期间均未发生死亡、翻修、神经功能恶化等情况。
2.2 单因素比较
不佳组与良好组单项因素比较见表1,两组性别、BMI、病程、有无糖尿病、高血压病、骨质疏松症、吸烟、锥体束征例数、肌力、感觉减退、骨化灶累积节段是否≥3、OPLL 分型、C2~C7Cobb 角、整体ROM、病变节段ROM、钛板个数、术前JOA、VAS、SF-36 评分、ASIA 分级、手术时间、术中失血量、术后引流量、开门维持例数及切口长度的差异均无统计学意义(P>0.05)。不佳组在年龄、椎管占位率、T1S、髓内高信号比率、K 线阴性例数比率均显著大于良好组(P<0.05)。

表1 临床结果不佳与良好两组患者的单因素比较Table 1 Univariate comparison between the two groups marked as poor and good clinical outcomes
2.3 多因素逻辑回归分析
多因素逻辑回归分析模型分类能力为12.6%,经卡方检验模型有效(x2=12.9,P=0.012),结果见表2,椎管占位率(OR=83.5,P=0.006)、髓内明显高信号(OR=3.13,P=0.004)、T1S(OR=1.11,P=0.036)是临床疗效不佳的独立危险因素。

表2 临床结果不佳与多因素逻辑回归分析结果Table 2 Results of multivariate logistic regression analysis of poor clinical outcomes
根据多因素逻辑回归分析结果,椎管占位率、髓内信号强度和T1S 3 个独立危险因素构建列线图模型见图2。
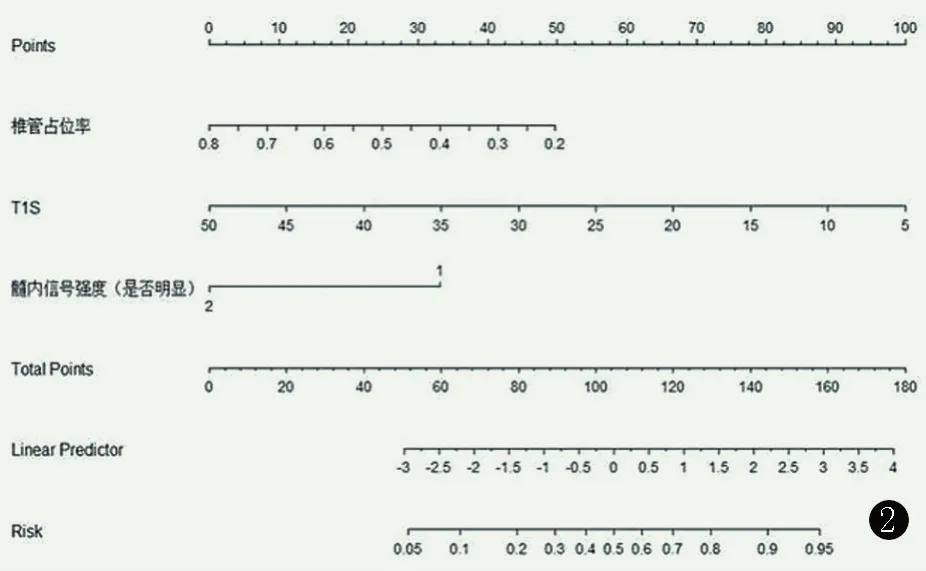
图2 单开门术后预测疗效良好的列线图。Figure 2.Nomogram of predicting efficacy of the model for unilateral cervical open-door laminoplasty.
2.4 ROC 分析
预测模型的ROC 曲线见图3a,AUC=0.80,95% CI0.70~0.91,P<0.001。当截断值为2.45 时,约登指数为0.60,灵敏度为0.91,特异度为0.68,代表该预测模型区分度良好。校准曲线结果表现为模型预测值分布曲线与重复抽样矫正拟合偏倚后的分布曲线良好贴合,校准曲线斜率接近1,表明该预测模型准确性良好,见图3。
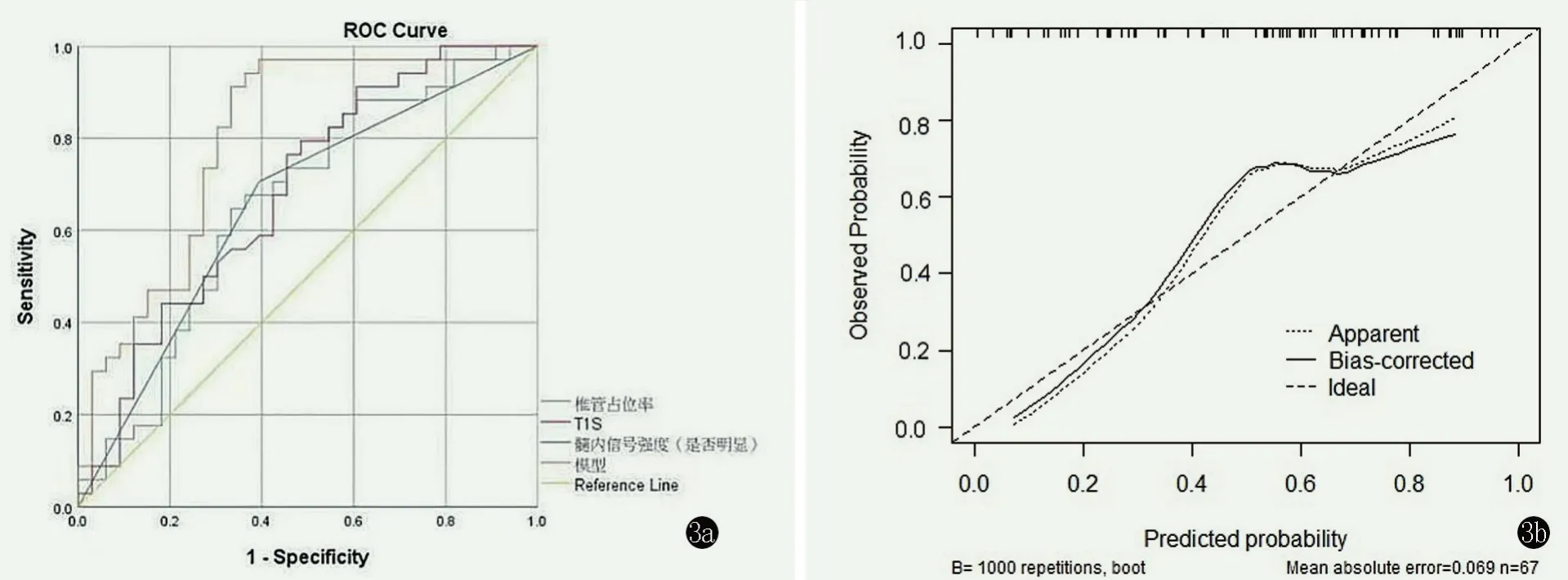
图3 ROC 曲线。3a:单开门术后疗效良好预测模型的ROC 曲线;3b:校准图。Figure 3.Receiver operating characteristic(ROC)curve.3a:ROC curve showed the model with good predicting efficacy for open-door laminoplasty.3b:Calibration chart of ROC.
3 讨论
颈椎OPLL 在临床中具有多因素致病、起病隐匿、进展缓慢且不可逆转等特点,患者常常出现不同程度的神经功能损害,致使其生活质量下降[9]。考虑目前对多因素影响颈椎OPLL 行单开门术的疗效尚缺乏较好的判断方法,本研究对危险因素进行整合并成功构建了一个预测术后疗效的列线图模型,可以对术后疗效做出预估判断。
本研究通过临床结果良好与不佳两组患者的单因素比较中得出年龄、随访时间、K 线、椎管占位率、T1S、髓内信号强度差异有统计学意义(P<0.05)。对于年龄而言,越来越多的文献报道高龄者颈椎OPLL 患者预后较差[10~14],这与本研究中结论一致。究其原因是高龄患者滋养脊髓的血管易发生不同程度的动脉粥样硬化,使得脊髓在应激状态下更容易缺血。再者,随着机体的衰老,神经元细胞抵御神经退行性疾病危害的能力变差[11]。其次,高龄患者大多伴有四肢关节退行性疾病,在一定程度上会对肢体功能评分造成影响。Nakashima 等[15]提出颈椎OPLL患者行单开门术随访期间至5年时JOA 评分达到峰值,后逐渐出现下降趋势。在本研究中,疗效不佳组随访时间较良好组长,也说明了随访时间对术后疗效有一定的影响。对于K 线而言,本研究中单因素分析结果显示,两组比较差异有统计学意义,但其并非独立危险因素。因此,K 线能否成为预测颈椎OPLL行后路单开门术的预后因素还有待争议。
本研究多因素Logistic 回归分析显示椎管占位率、髓内信号强度和T1S 是影响颈椎OPLL 行后路单开门术后神经功能恢复情况的独立危险因素。Hirabayashi[16]研究发现术前椎管占位率≥50%容易造成术后脊髓前方残余骨化物压迫,进而影响术后神经功能恢复情况。本研究中术前良好组椎管占位率(41.7%±12.2%)较不佳组(50.1%±15.2%)低,采用多因素Logistic 回归分析,控制混杂因素后,得出椎管占位率是影响手术疗效最重要的独立危险因素。此外已有相关文献证实,后路手术术前较大的T1S(T1S≥25°)总体疗效要低于较小T1S[17]。亦有研究表明,术前T1S 较大者采用前路手术,术后颈椎矢状位平衡方面更佳,临床疗效更好[18]。因此在术前应该综合评估选择合适的术式来改善预后。本研究结果还显示,髓内信号强度对判断神经恢复情况也有重要的参考价值。Miyazaki[19]在报道中提到,术前髓内MRI T2WI 高信号常常提示预后不佳,且为影响术后疗效的独立危险因素[20],这与本研究的结论一致,考虑可能与胶质增生、水肿、脱髓鞘改变、微空洞等多个病理因素相关[21]。而张健[22]认为髓内MRI T2WI 高信号并不意味着手术疗效差,另有观点认为髓内长节段高信号才提示预后不佳。
列线图模型是基于多个因素将原本复杂的回归方程转化为可视化的图形,使得抽象的结局具有了可读性,并且可以从每个预测变量的值得到某一临床事件的大致发生概率[23]。本研究建立的列线图预测模型,能够为临床医师早期识别预后较差的高危人群、判断预后、并为科学的术前干预提供一定的参考价值。
本研究的不足之处:(1)样本量少且为单中心研究,在统计方面可能会产生信息偏倚;(2)该列线图未进行外部验证,模型是否可以普遍应用还有待确定;(3)临床预测模型本身存在校准度漂移现象,其性能将会随之下降[24]。总之,数字预测模型仅仅作为一种辅助评估预后的工具,具体临床病例还需综合考虑。
