南通嗜铜菌X1T对丙溴磷手性对映体的选择性降解特性
2023-11-22陈天铭方连城花日茂
陈天铭,方连城,花日茂
南通嗜铜菌X1T对丙溴磷手性对映体的选择性降解特性
陈天铭,方连城,花日茂*
(安徽省农产品质量安全重点实验室,安徽农业大学资源与环境学院,合肥 230036)
有机磷杀虫剂已被广泛用于控制农业害虫,其在农产品与环境样本中的残留引起人们的关注。课题组前期筛选了一株有机磷杀虫剂高效降解菌株,南通嗜铜菌X1T(X1T)。研究了菌株X1T对手性有机磷杀虫剂丙溴磷对映体在不同底物浓度、菌量、pH、金属离子条件下的降解特性。结果表明,菌株X1T可以优先选择性降解高毒低效对映体S-丙溴磷。随着底物浓度的升高,菌株X1T对丙溴磷对映体的降解速率逐渐减慢;菌株X1T降解丙溴磷的最适pH为7.5;金属离子价态是影响丙溴磷降解的重要影响因素,其中Cr3+与 Fe3+等3价金属阳离子显著抑制菌株对丙溴磷降解,Ca2+、Mn2+、Mg2+、Co2+、Ni2+等2价金属阳离子显著促进菌株对S-丙溴磷降解。同时,菌株X1T中降解酶粗酶与异源表达的纯酶对丙溴磷手性对映体的降解速率无显著性差异。结果为丙溴磷残留污染的生物修复技术提供理论依据。
丙溴磷;南通嗜铜菌X1T;手性;对映体选择性;生物降解
丙溴磷是我国常用的一种有机磷杀虫剂,主要用于水稻、棉花、甘蓝等作物上二化螟、稻纵卷叶螟、棉铃虫、红蜘蛛等害虫的防治[1-5]。丙溴磷除了对靶标昆虫有杀虫活性,对人等哺乳动物同样有毒。研究发现,丙溴磷具有发育和生殖毒性,对体细胞和生殖细胞的染色体畸变均有影响,具有潜在的致突变性[6]。同时,丙溴磷在土壤中有着较长的残留期,半衰期长达100多天。其在环境中较长的半衰期不仅造成农田环境污染,同时对于农产品质量安全产生较高风险。
丙溴磷还是一种手性农药,手性农药是神经抑制剂,破坏神经传导,对映体差异率达到 60 多倍。其具有2个手性对映体,其中R-丙溴磷表现主要的杀虫活性,而S-丙溴磷对人等哺乳动物的毒性更 大[7]。
有研究发现,农田土壤中R-丙溴磷降解速率快于S-丙溴磷[8]。微生物降解是手性农药降解和产生对映体差异的主要原因,丙溴磷进入农田环境后微生物可以选择性降解同一手性农药的不同对映体,而对映体降解速度的差异将导致防治效果及环境毒性的差异[9-10]。近年来,虽然一些丙溴磷的降解菌株被筛选、分离与鉴定,如Da Silva等[11]筛选得到了CBMAI 935 和CBMAI 931,前者能将50 mg·L-1丙溴磷在10 d 时降解 50%,在20 d降解71%,后者能将50 mg·L-1丙溴磷在10 d 降解64.7%;Salunkhe等[12]筛选得到的DR-39能将5 mg·L-1丙溴磷在15 d 降解79%。但是,这些降解菌株在丙溴磷降解过程中并没有发现具有对映体选择性降解效应。
课题组前期筛选了1株有机磷农药高效降解菌株,南通嗜铜菌X1T(X1T),该菌株可以高效降解毒死蜱、甲基对硫磷、对硫磷、辛硫磷、三唑磷和丙溴磷等10余种有机磷农药及多种卤代苯酚。本研究在前期研究基础上进一步探明菌株X1T对丙溴磷的对映体选择性降解特性,可以为丙溴磷等有机磷手性杀虫剂在农田环境中的生物修复技术提供理论指导。
1 材料与方法
1.1 材料
丙溴磷标准品(纯度 99.5%)购自Dr. Ehrenstorfer。R-丙溴磷与S-丙溴磷由大赛璐药物手性技术(上海)有限公司拆分。除色谱纯乙腈与丙酮用于丙溴磷及其代谢物提取与检测外,其余培养试剂均为分析纯。
南通嗜铜菌X1T为实验室前期筛选保存。
LB液体培养基:称取酵母浸粉 5 g、NaCl 5 g、胰蛋白胨 10 g于适量 ddH2O 中,加热至完全溶解,调节 pH 值至 7.4,定容至 1 L,121 ℃高压蒸汽灭菌 20 min,冷却至室温,保存备用。
无机盐培养基(MSM):称取 NaCl 1.0 g,MgSO4·7H2O 0.1 g,KH2PO40.3 g 和 KH2PO41.32 g 于适量 ddH2O 中,加热至完全溶解,调节 pH 值至 7.4,定容至 1 L,121℃高压蒸汽灭菌 20 min,冷却至室温,保存备用。
Tris-HCl缓冲液:称取Tris-HCl 7.88 g于适量去离子水中,加热至完全溶解,调节pH值为7.0~7.5,超纯水定容至1 L。121 ℃高压蒸汽灭菌20 min,冷却至室温,保存备用。
PB缓冲液:称取NaH2PO4·2H2O 2.434 g 和Na2HPO4·12H2O 8.74 g,于1 000 mL的去离子水中溶解,保存备用。
1.2 方法
1.2.1 菌悬液的制备 从-80℃超低温冰箱中拿出已经保存好的含有菌株 X1T的甘油管,用接种环蘸取含有菌株X1T的甘油管,在提前倒好并已经冷却凝固的LB培养基上进行平板划线。倒置于 37 ℃恒温培养箱孵育24 h。活化培养后,用接种环挑取单菌落,接种于含100 mL的LB液体培养基的锥形瓶中,放置37 ℃,150 r·min-1的恒温震荡培养箱中培养12 h。从恒温摇床中取出培养好的菌株 X1T,转置50 mL离心管中,以10 000 r·min-1离心 8 min收集菌体,弃去上清液,用MSM重悬菌株 X1T,涡旋使细胞混合均匀,再次离心,重复3次重悬洗菌。在紫外可见分光光度计600 nm波长条件下,用MSM调成菌悬液OD值至0.6,保存备用。
1.2.2 粗酶液的制备 用接种环挑取菌株X1T单菌落,接种于含100 mL的LB液体培养基的锥形瓶中,放置37 ℃,150 r·min-1的恒温震荡培养箱中培养12 h。从恒温摇床中取出培养好的菌株 X1T,转置50 mL离心管中,以10 000 r·min-1离心 8 min收集菌体,弃去上清液,用MSM重悬菌株 X1T,涡旋使细胞混合均匀,再次离心,重复3次重悬洗菌。在紫外可见分光光度计600 nm 波长条件下,用PB缓冲液调成菌悬液OD值至0.6,保存备用。
将调好的菌悬液用超声波破碎仪在冰浴条件下破碎,250 W功率,工作20 min(运行3 s,停止 3 s),工作200次至溶液变清亮。在4 ℃以12 000 r·min-1离心20 min,收集上清液(粗酶液),保存备用。
1.2.3 无机盐中丙溴磷的添加回收实验 在比色管中加入5 mL无机盐培养基和一定浓度的丙溴磷标准品母液,使溶液的终浓度为 1、5和25 mg·L-1,涡旋混匀静置4 h后,加入等体积的乙腈提取,过0.22 μm有机滤膜并打入进样瓶待测,每个浓度和空白对照均设置5个平行,计算回收率、相对标准偏差。
1.2.4 菌株X1T对丙溴磷手性对映体分子选择性降解特性 取1 mL活化后的菌株X1T菌悬液于100 mL LB液体培养基中,37 ℃恒温振荡培养至OD600达到0.8。用灭菌的无机盐培养基(MSM)洗涤菌体2次,离心收集菌体。将收集后的菌株X1T加入到含有一定浓度Rac-丙溴磷,R-丙溴磷与S-丙溴磷的MSM培养基中37 ℃恒温振荡培养,分别于0、2、4、6、12、24、36、48和72 h取样,利用UPLC测定丙溴磷残留量。分别利用上述方法测定不同初始浓度(10、20和50 mg·L-1),不同pH(3~11),不同菌量(106、107和108CFU),5 mmol·L-1不同金属离子(Na+、K+、Ca2+、Mg2+、Mn2+、Co2+、Ni2+、Cr3+和 Fe3+)条件下丙溴磷的降解动力学和降解率。
1.2.5 菌株X1T中粗酶对丙溴磷手性对映体的降解动力学 取与1.2.3相同菌量的菌株X1T,重悬于预冷的Tris-HCl缓冲液,利用超声破碎仪对细胞进行破碎,待破碎完全后,离心取上清液即为粗酶液。取1 mL粗酶液,分别加入R-丙溴磷与S-丙溴磷,至终浓度为20 mg·L-1,37 ℃恒温孵育。分别于0、30、60、120、240和360 min取样,各反应液中加入1 mL乙腈终止反应,反应液离心后过0.22 μm滤膜后,利用UPLC测定丙溴磷的残留浓度。
1.2.6 纯酶对丙溴磷手性对映体的降解动力学 取1 mL OpdB纯酶,分别加入R-丙溴磷与S-丙溴磷,至终浓度为10 mg·L-1,37 ℃恒温孵育。分别于0、12、24、36、48和60 h取样,各反应液中加入1 mL乙腈终止反应,反应液离心后过0.22 μm滤膜后,利用UPLC测定丙溴磷的残留浓度。
1.2.7 丙溴磷手性对映体的UPLC检测方法 利用UPLC测定反应液中丙溴磷的残留浓度。色谱柱:Chiralpak AD-3R,3 µm,2.1×150 mm;柱温:40℃;流动相:0.1%甲酸水溶液(A)∶乙腈(B)=44∶45,/,等度洗脱;检测波长230 nm;流速:0.35 mL·min-1;进样体积:20 μL。
2 结果与分析
2.1 无机盐水溶液中丙溴磷的添加回收实验
在 MSM 中,不同浓度水胺硫磷和丙溴磷的添加回收结果如表1所示,丙溴磷的平均添加回收率在 95.6%~101.9%,说明该方法准确度和灵敏度满足农药残留分析降解测定的要求。

表1 丙溴磷在MSM中的添加回收率
2.2 菌株X1T对丙溴磷手性对映体分子选择性降解特性
2.2.1 不同底物浓度对菌株X1T降解丙溴磷手性对映体的影响 菌株X1T对10、20和50 mg·L-1Rac-丙溴磷的降解动力学结果(表2)显示,菌株X1T对S-丙溴磷的降解速率快于R-丙溴磷。在10、20和50 mg·L-1Rac-丙溴磷初始浓度条件下,菌株X1T作用条件下S-丙溴磷的降解速率常数分别是R-丙溴磷的1.86、2.17与2.09倍。同时,随着底物浓度的升高,菌株X1T对丙溴磷的降解速率逐渐减慢。其可能的原因是丙溴磷在环境中的主要代谢产物,2-氯-4-溴苯酚,该物质具有抑菌活性,其在反应液中的积累会抑制母体化合物的降解。

表2 不同底物浓度下菌株X1T对丙溴磷手性对映体的降解动力学参数
2.2.2 不同接菌量对菌株X1T降解丙溴磷手性对映体的影响 不同菌量条件下菌株X1T对20 mg·L-1丙溴磷手性对映体的降解(图1)显示,当菌量低于106CFU时,丙溴磷几乎不能降解;当菌量为107CFU时,菌株X1T仅能降解-丙溴磷,而不能降解R-丙溴磷;当菌量高于108CFU时,菌株X1T既可以降解S-丙溴磷,又可以降解R-丙溴磷,但对S-丙溴磷的降解速率要快于R-丙溴磷。
2.2.3 不同pH对菌株X1T降解丙溴磷手性对映体的影响 不同pH条件下菌株X1T对20 mg·L-1丙溴磷手性对映体的降解率(图2)显示,菌株X1T在pH 5~10范围内均可以降解丙溴磷,其最适降解pH为7.5,这与菌株X1T的最适生长pH一致。进一步将36 h后的反应液中的活菌数量进行测定发现,pH主要通过影响活菌数量而影响菌株对丙溴磷的降解。同时,菌株X1T在不同pH条件下对S-丙溴磷的降解速率仍然快于R-丙溴磷。

(a)106 CFU;(b)107 CFU;(c)108 CFU;红色曲线代表S-丙溴磷降解动态;黑色曲线代表R-丙溴磷降解动态
Figure 1 Degradation kinetics of profenofos chiral enantiomers by strain X1Tunder different bacterial abundance

图2 不同pH菌株X1T对丙溴磷手性对映体的降解动力学
Figure 2 Degradation kinetics of profenofo chiral enantiomers by strain X1Tat different pH
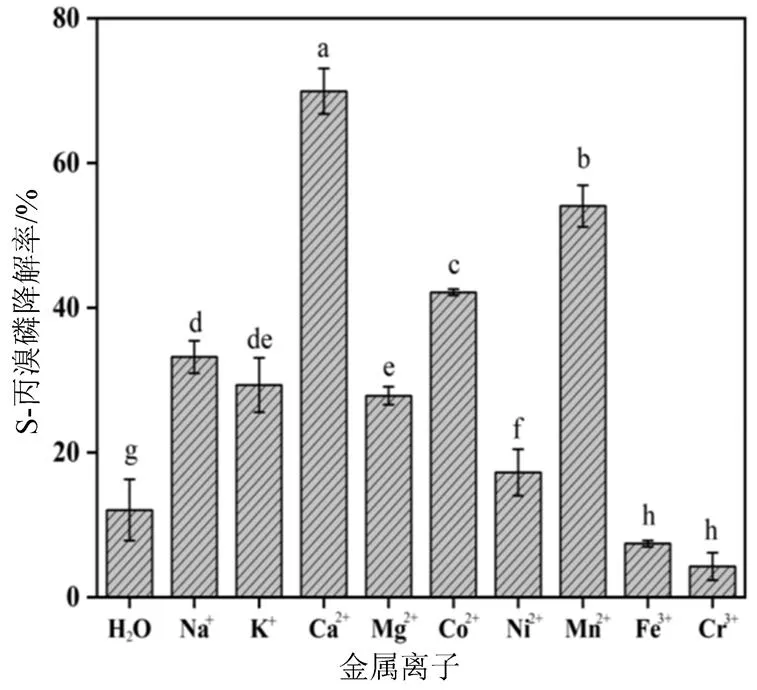
图3 不同金属离子对菌株X1T降解S-丙溴磷对映体的影响
Figure 3 Effects of different metal ions on degradation of S-profenofos enantiomers by strain X1T
2.2.4 不同金属离子对菌株X1T降解丙溴磷手性对映体的影响 不同金属离子条件下菌株X1T对丙溴磷的降解率如图3和图4所示。与不含金属离子对照组的降解率相比,三价金属阳离子(Cr3+与 Fe3+)可以显著抑制菌株X1T对S-丙溴磷和R-丙溴磷的降解。同时,二价金属阳离子(Ca2+、Mn2+、Mg2+、Co2+、Ni2+)可以显著促进菌株X1T对S-丙溴磷的降解。这可能与菌株X1T细胞内的有机磷水解酶活性有关,有研究报道,有机磷水解酶是一种金属 酶[13],其催化中心还有2个二价金属阳离子构成的结合位点,反应体系中添加二价金属阳离子可以显著提高菌株对S-丙溴磷的降解活性。
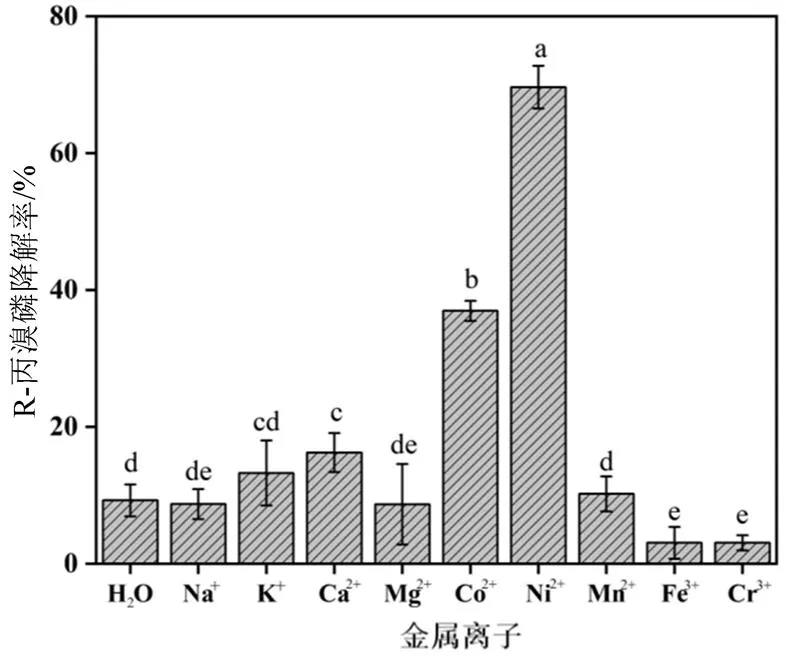
图4 不同金属离子对菌株X1T降解R-丙溴磷对映体的影响
Figure 4 Effects of different metal ions on degradation of-profenofos enantiomers by strain X1T

表3 粗酶对丙溴磷手性对映体的降解动力学参数
2.3 粗酶对丙溴磷手性对映体的降解动力学
菌株X1T破碎获得的粗酶对10 mg·L-1丙溴磷手性对映体的降解动力学参数(表3)显示,粗酶可以降解S-丙溴磷与R-丙溴磷。但与菌株不同的是,粗酶对S-丙溴磷与R-丙溴磷的降解速率无显著性差异。
2.4 OpdB纯酶对丙溴磷手性对映体的降解动力学
菌株X1T中有机磷水解酶OpdB纯酶对5 mg·L-1丙溴磷手性对映体的降解动力学参数(表4)显示,opdB纯酶可以降解S-丙溴磷与R-丙溴磷。与菌株X1T粗酶相同,OpdB纯酶对S-丙溴磷与R-丙溴磷的降解速率无差异。

表4 OpdB纯酶对丙溴磷手性对映体的降解动力学参数
3 讨论和结论
菌株X1T可以高效降解有机磷杀虫剂丙溴磷。同时可以优先选择性降解丙溴磷高毒低效对映体S-丙溴磷,而保留高效低毒对映体R-丙溴磷。初始接种量的大小也对农药污染场地的生物修复过程的有效性起着重要作用[14]。有研究发现,辛硫磷降解菌株XSP-1初始接菌量与降解速率呈正比,但是当接菌量超过10% 时降解速率没有显著性差异[15]。苯酚降解菌株F5-2 在降解苯酚时也发现相同的规律,这可能是降解菌的群感效应所导致[16]。金属离子价态是影响丙溴磷降解的重要影响因素,张立志等实验发现,Mg2+能促进丛毛单胞菌降解邻甲芬和对甲酚,Co2+、Ni2+和Cu2+则对降解具有抑制作用[17]。本研究中Ca2+、Mn2+、Mg2+、Co2+、Ni2+等2价金属阳离子均促进菌株对丙溴磷降解,3价金属阳离子Cr3+与 Fe3+则抑制菌株对-丙溴磷降解。
在微生物降解时,应选择最佳的降解条件,以最大限度的发挥菌株X1T的作用。研究手性丙溴磷的环境行为具有重要的理论和实际应用价值,能更准确地评价其生态毒性及其对人体健康的影响,符合我国农业可持续发展的要求。本实验研究结果为丙溴磷等有机磷手性杀虫剂在农田环境中的生物修复技术提供理论依据。
[1] HE J, FAN M T, LIU X J. Environmental behavior of profenofos under paddy field conditions[J]. Bull Environ Contam Toxicol, 2010, 84(6): 771-774.
[2] TALEBI K, GHASSAMI M R. Residues of profenofos in spring onion[J]. Commun Agric Appl Biol Sci, 2004, 69(4): 799-802.
[3] LATHEEF M A. Influence of spray mixture rate and nozzle size of sprayers on toxicity of profenofos and thiodicarb formulations against tobacco budworm on cotton[J]. Crop Prot, 1995,14(5):423-427.
[4] KELAGERI S S, RAO C S, BHUSHAN V S, et al. Risk analysis of profenofos on tomato in poly house and open fields and risk mitigation methods for removal of profenofos residues from tomato for food safety[J]. Intern Jour Agricul, Environ And Biotech, 2014, 8(1): 163-170.
[5] ROSELEEN S S J, RAMARAJU K. Acaricidal effects and residues of profenofos and abamectin on the nut-infesting eriophyid mite,Keifer (Acari: Prostigmata) on coconut[J]. Int J Acarol, 2012, 38(6): 465-470.
[6] FAHMY M A, ABDALLA E F. Genotoxicity evaluation of buprofezin, petroleum oil and profenofos in somatic and germ cells of male mice[J]. J Appl Toxicol, 1998, 18(5): 301-305.
[7] NILLOS M G, GAN J, SCHLENK D. Chirality of organophosphorus pesticides: analysis and toxicity[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2010, 878(17/18): 1277-1284.
[8] 李朝阳, 张烨, 罗湘南, 等. 手性有机磷农药在土壤中对映体选择性降解特征[J]. 生态环境学报, 2009, 18(4): 1247-1250.
[9] DIAO J L, LV C G, WANG X Q, et al. Influence of soil properties on the enantioselective dissipation of the herbicide lactofen in soils[J]. J Agric Food Chem, 2009, 57(13): 5865-5871.
[10] MEIJER S N, HALSALL C J, HARNER T, et al. Organochlorine pesticide residues in archived UK soil[J]. Environ Sci Technol, 2001, 35(10): 1989-1995.
[11] DA SILVA N A, GARCIA BIROLLI W, REGALI SELEGHIM M H, et al. Biodegradation of the organophosphate pesticide profenofos by marine fungi[M]// YOGESH B PATIL, PRAKASH RAO. Applied bioremediation: Active and passive approaches. InTech, 2013.
[12] SALUNKHE V P, SAWANT I S, BANERJEE K, et al. Biodegradation of profenofos by Bacillus subtilis isolated from grapevines ()[J]. J Agric Food Chem, 2013, 61(30): 7195-7202.
[13] SHI T Z, FANG L C, QIN H, et al. Minute-speed biodegradation of organophosphorus insecticides byX1T[J]. J Agric Food Chem, 2019, 67(49): 13558-13567.
[14] RAMADAN M A, EL-TAYEB O M, ALEXANDER M. Inoculum size as a factor limiting success of inoculation for biodegradation[J]. Appl Environ Microbiol, 1990, 56(5): 1392-1396.
[15] 沈雨佳, 洪源范, 洪青, 等. 辛硫磷降解菌XSP-1的分离、鉴定及其降解特性研究[J]. 环境科学, 2007, 28(12): 2833-2837.
[16] 何熙璞, 刘鸿杰, 张敏, 等. 苯酚降解菌F5-2的分离鉴定及其降解特性[J]. 高校化学工程学报, 2012, 26(6): 1001-1008.
[17] 张立志, 余思彤, 袁欣, 等. 丛毛单胞菌对邻甲酚及对甲酚的降解特性[J]. 环境污染与防治, 2020, 42(7): 820-825.
Enantioselective degradation characteristic of chiral profenofos byX1T
CHEN Tianming, FANG Liancheng, HUA Rimao
(Key Laboratory of Anhui Agricultural Product Quality and Safety, School of Resources and Environment,Anhui Agricultural University, Hefei 230036)
Organophosphorus insecticides (OPs) have been widely used to control agricultural pests, which has raised concerns about OPs residues in crops and the environment. The research group had previously isolated a highly efficient OPs degradation strain ,X1T. In this study, the degradation characteristics of chiral organophosphorus pesticide profenofos by strain X1Tunder different substrate concentrations, bacterial counts, pH and metal ions were measured. The results showed that strain X1Tcould preferentially degrade-profenofos with high toxicity and low insecticidal activity. With the increase of substrate concentration, the degradation rate of profenofos by strain X1Tgradually slowed down the optimal pH of profenofos degradation by strain X1Twas 7.5; the valence state of metal ions was an important factor to affect the degradation of profenofos, of which Cr3+and Fe3+could inhibit the degradation of profenofos, while Ca2+, Mn2+, Mg2+, Co2+, Ni2+could promote the degradation of S-profenofos. Meanwhile, there was no significant difference between the degradation rate of S-profenofos and R-profenofos by the crude enzyme in strain X1Tand purified enzyme opdB. The results provide a theoretical basis for bioremediation of profenofos residuals.
profenofos;X1T; chiral; enantioselective; biodegradation
X592
A
1672-352X (2023)05-0876-05
10.13610/j.cnki.1672-352x.20231030.011
2023-10-31 08:13:33
[URL] https://link.cnki.net/urlid/34.1162.S.20231030.0955.020
2022-11-02
国家自然科学基金(31972314)资助。
陈天铭,硕士研究生。E-mail:846947007@qq.com
花日茂,博士,教授,博士生导师。E-mail:rimaohua@ahau.edu.cn
