整合网络药理学和实验验证复方脉络宁抗脑缺血的作用机制
2023-11-22王可楼烨亮高倩徐水凌
王可 ,楼烨亮 ,高倩 ,徐水凌
(1.嘉兴学院 医学院,浙江嘉兴314001;2.丽水市人民医院,浙江丽水323000)
缺血性脑血管病为常见的中枢神经系统疾病,以脑血液循环障碍为主要特征.具有高发生率、高死亡率、高致残率、高复发率等特征,严重危害人体健康,目前,西医治疗脑缺血的临床效果仍难以让人满意.[1]中药由于可多靶点、多途径整体干预脑缺血的发生发展,在脑缺血治疗中具有独特的优势和潜力.脉络宁源自著名医方“四妙勇安汤”,由玄参、牛膝、石斛、金银花等组成,化学成分包括香豆素类、苯丙素类、昆虫变态激素、三萜皂苷等,具有养阴清热、活血化瘀的功效.[2-3]临床上广泛用于治疗缺血性脑血管病,[4]疗效可靠,副作用小.有研究表明,脉络宁注射液能明显缩小MCAO大鼠的脑梗死范围.[5]另外,脉络宁抗脑缺血与保护线粒体功能相关,但具体机制尚未完全清晰.本文利用网络药理学方法,同时构建PC12细胞氧糖剥夺模型,探讨脉络宁抗脑缺血的作用机制,为后续研究提供支持.
1 资料与方法
1.1 脉络宁活性成分靶点获取及靶点网络图的构建
从TCMSP中检索筛选玄参、牛膝、石斛及金银花的化学成分,将符合口服生物利用度(OB)>30%、类药性(DL)>0.18的化合物确定为潜在的活性成分;[6]通过Pubchem数据库检索所含成分对应的SMILES号,借助Swiss Target Prediction 数据库进行靶点预测,[7]获得脉络宁活性成分合集及对应靶点合集.
1.2 脑缺血疾病相关靶点及药物-疾病共同靶点获取
利用疾病数据库 Genecards 、DisGeNET 和 CTD,以“Cerebral ischemia”为检索词条,对脑缺血的靶点进行检索收集,获取脑缺血相关作用靶点.将 1.1 项获得的脉络宁活性成分靶点与脑缺血疾病靶点导入 Venny 2.1 在线工具绘制 Venny 图,获得脉络宁-脑缺血共同靶点.
1.3 蛋白质-蛋白质相互作用(PPI)网络构建及可视化
将脉络宁-脑缺血共同靶点导入 STRING 数据库进行分析,设置条件:物种=Homo sapiens,最低相互作用阈值=medium confidence(0.4),[8]获得蛋白质相互作用关系,利用Cytoscape 3.9.0 软件中的插件 CytoNCA 进行关键靶点的筛选.
1.4 GO 生物功能和 KEGG 通路富集分析
基于 DAVID 6.8 数据库对交集靶点进行基因本体(Gene Ontology,简称GO)功能注释和通路富集(Kyoto Encyclopedia of Genes and Genomes,简称KEGG)分析.[9]最后,将分析得到的靶点、信号通路相对应,运用Cytoscape 3.9.0软件构建靶点-信号通路网络模型.
1.5 “活性成分-靶点”分子对接验证
根据 KEGG 通路富集结果,利用autodock vina将相关通路涉及靶点与脉络宁活性成分进行分子对接.Vina半柔性分子对接后的结合能越低,表明活性成分与靶点存在相互作用的可能性越大.当结合能小于-5.0 kcal·mol-1时,表明脉络宁潜在活性分子与核心靶点结合得比较好;当结合能小于-7.0 kcal·mol-1时,表明脉络宁潜在活性分子与核心靶点之间的结合极为强烈.[10]
1.6 脉络宁防治脑缺血体外实验验证
1.6.1 细胞
PC12细胞株由浙江中医药大学提供.
1.6.2 药物与试剂
脉络宁注射液(南京金陵制药厂,批号:20210412);依达拉奉(MCE,批号:34266);MTT(Sigma-Aldrich,批号:EZ7890B255);线粒体膜电位检测试剂盒(碧云天,批号:032421211103);RT-PCR反应试剂盒引物购自上海生物工程公司;RNA 逆转录试剂盒(日本 TaKaRa 公司,批号:AK3017).
1.6.3 PC12细胞氧糖剥夺模型(OGD)的建立
通过OGD方法模拟脑缺血神经细胞损伤模型.培养至对数培养期的PC12细胞,再在37℃下全部换成无糖Earle's 缓冲液,最后通95%N2+5%CO2的混合气6 h后取出缺氧盒进行后续实验.
1.6.4 MTT检测
按MTT实验检测相关步骤操作.脉络宁预保护48 h,OGD后每孔加 MTT(5 mg/m1)20 μl,置于37℃、5%CO2培养箱中继续培养4 h,吸去上层清液,每孔加入 DMSO 150 μl,以空白对照调零,用酶标仪检测570 nm波长处各孔 OD 值.计算细胞的存活率.
1.6.5 线粒体膜电位检测
取对数生长期的PC12细胞,以每孔 1×105个细胞密度接种于24孔板,脉络宁组干预48 h,依达拉奉组干预24 h,吸出每孔培养液,用JC-1孵育30 min后在荧光显微镜下检测.
1.6.6 qRT-PCR 检测靶基因
TaKaRa 试剂盒提取总 RNA.使用逆转录—聚合酶链RT-PCR反应试剂盒,将 mRNA 逆转录为 cDNA,并对Real-time PCR 进行扩增.反应条件:94°C 预变性 5 min,94°C 变性 30 s,60°C 退火 45 s,72°C 延伸 30 s,35 个循环后在72°C下延伸 7 min.最后用荧光定量 PCR 仪检测常规溶解曲线,分析测定Ct值,以 2-ΔΔCt的计算值作为相对表达水平.
1.6.7 统计学分析
采用 GraphPad Prism 9 统计学软件分析,定量资料以χ±s表示,同时采用单因素方差分析、多重比较法进行分析.以P值表示:P<0.05 表示有显著性差异,P<0.01 表示有极显著性差异.
2 结果
2.1 脉络宁活性成分筛选及靶点预测结果
通过检索各文献数据库并采用Swiss ADME平台预测和Swiss Target Prediction对各个成分进行靶点预测,共获得存在靶点的脉络宁活性成分58个(见表1),共获得活性成分的靶点1 051个,删除重复靶点后最终获得317个靶点.

表1 脉络宁活性成分
2.2 脉络宁活性成分治疗脑缺血靶点筛选
通过Genecards和CTD对脑缺血治疗靶点进行检索,筛选整理后共获得脑缺血治疗相关靶点276个,将脑缺血与脉络宁活性成分的靶点输入 Venny 2.1.0 软件,绘制韦恩图,取其交集后获得脉络宁-脑缺血共同靶点84个,见图1.
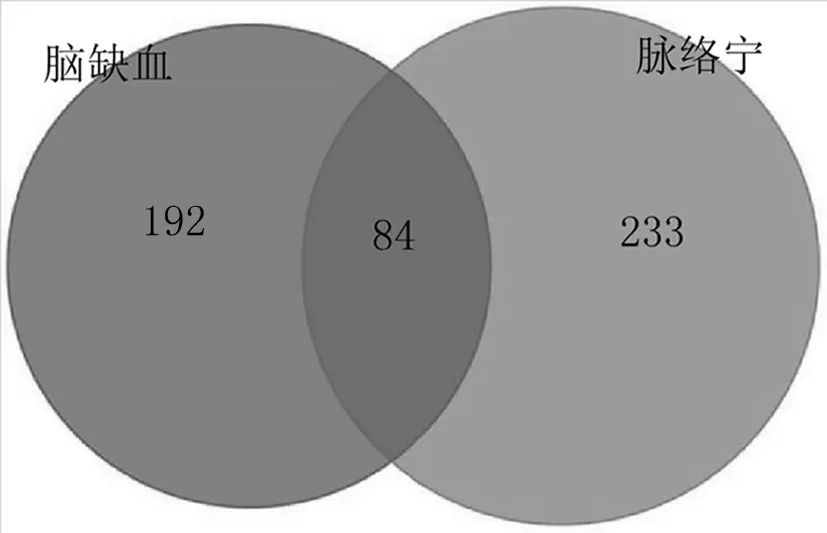
图1 脉络宁活性成分——脑缺血交集基因韦恩图
2.3 脉络宁活性成分——脑缺血靶点网络
根据2.2项分析得到的潜在作用靶点及靶点与活性成分之间的关系,应用cytoscape软件构建脉络宁活性成分——抗脑缺血靶点网络图(见图2A).该网络中包含115个节点及215条边,其中31个节点表示脉络宁活性成分(不同形状代表来自不同药物),84个长方形节点表示脑缺血靶点,203条边代表脉络宁活性成分与脑缺血靶点间的相互作用.各活性成分按度值大小进行排序,选取排名靠前的5个活性成分并筛选相对应的靶点构建脉络宁活性成分——脑缺血靶点网络的核心网络(见图2 B),该网络中包含73个节点和133条边,其中活性成分节点5个,靶点节点128个.核心网络包含的活性成分分别为槲皮素、芦丁、山奈酚、汉黄芩素、β胡萝卜素,表明这五种成分是脉络宁治疗脑缺血时发挥作用的关键性成分.
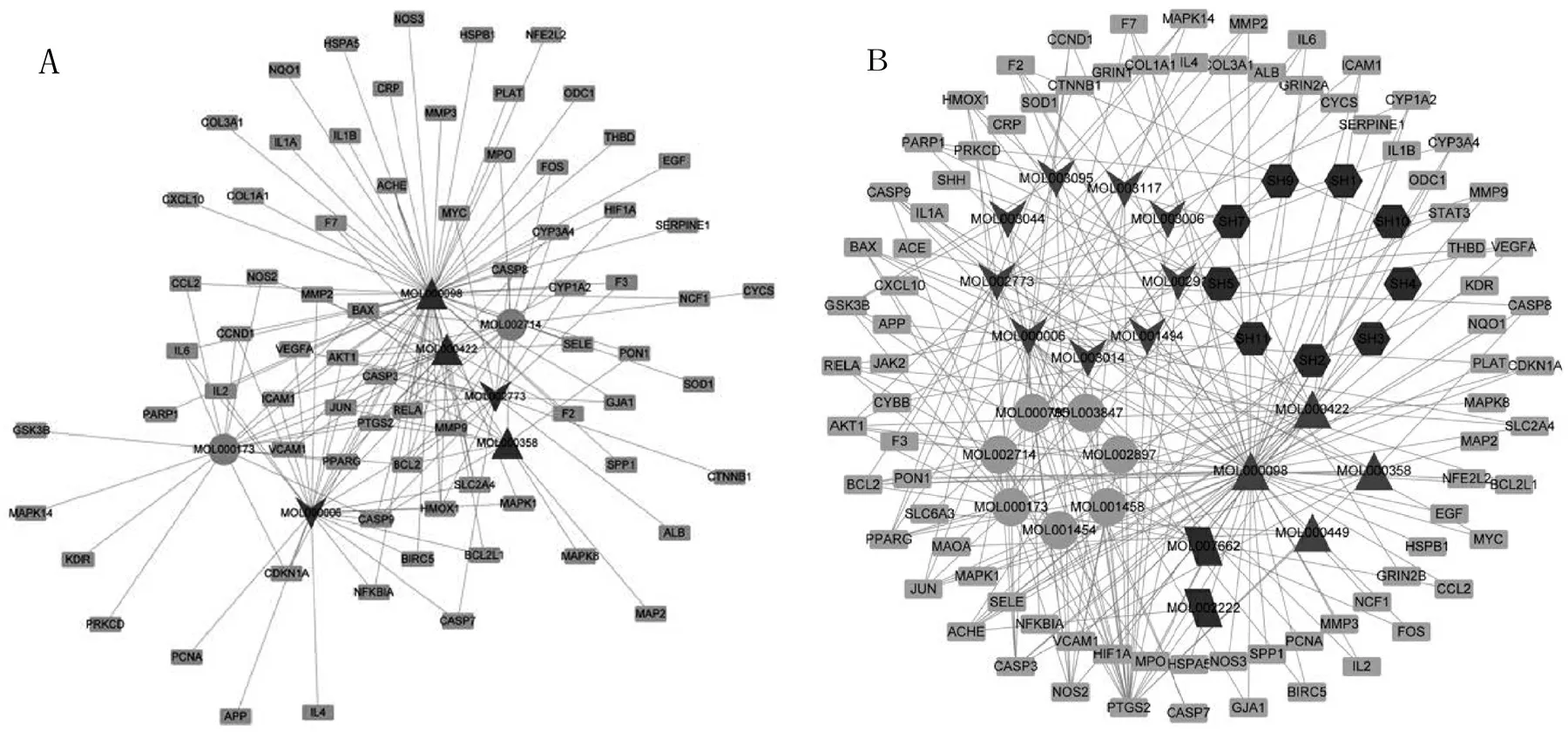
图2 脉络宁活性成分——脑缺血靶点网络图
注:六边形为石斛成分;箭头为金银花成分;圆形为牛膝成分;菱形为玄参成分;三角形为共同成分;长方形为脑缺血靶点
2.4 靶点PPI网络及网络拓扑分析
将脉络宁活性成分治疗脑缺血的潜在作用靶点导入STRING平台,应用Cytoscape软件绘制成一个包含84个节点和1547条边的PPI网络图,获得蛋白相互作用的关系.将结果进一步导入Cytoscape 3.7.3软件进行拓扑分析,并构建PPI网络(见图3).最终得到PPI核心网络中排名靠前的蛋白,分别为ALB、AKT1、IL6、CASP3、VEGFA、JUN、PTGS2、MMP9,这些靶点与其他靶点关联密切,可能在治疗脑缺血的过程中占据重要地位.

图3 PPI网络拓扑分析图
2.5 GO分类与KEGG富集分析结果
GO和KEGG分析的主要区别在于它们所依据的数据不同.GO分析是基于序列信息,而KEGG分析则是通过对基因的表达信息进行分析来确定基因的功能的.本文利用 DAVID 6.8 数据库对交集靶点进行生物富集分析,得到具有统计学意义(P<0.05)的 GO 功能富集条目 602 条,其中生物过程(biological process,BP)466 条,分子功能(molecular function,MF)74 条,细胞组分(cellular component,CC)62 条.对 GO 富集条目按照P进行排序,P越小表示富集程度越高,分别选取 BP、CC 和 MF 中排名前 10 的条目绘制图形,如图 4.GO分类富集结果表明,脉络宁活性成分是通过多种生物学过程的作用来治疗脑缺血的.
KEGG 通路富集结果显示,共涉及 140 条通路,将P排序前20名的绘制成KEGG 通路气泡图,由图 5可知,脉络宁活性成分对脑缺血的防治主要分布在TNF信号通路、IL-17信号通路、HIF-1信号通路、松弛素信号通路等,表明脉络宁活性成分可通过多条信号通路发挥治疗脑缺血的作用.
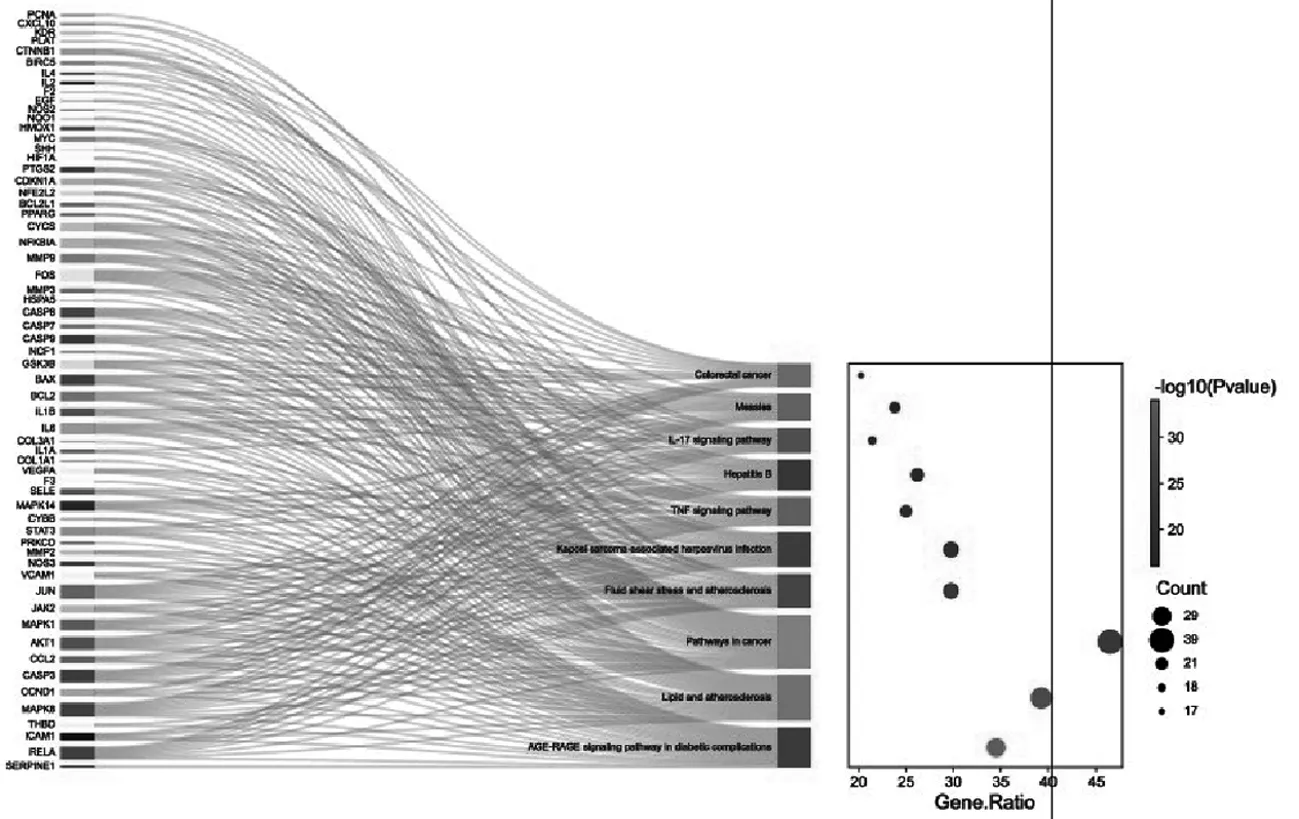
图5 脉络宁活性成分治疗脑缺血的相关通路KEGG富集结果
2.6 靶点-信号通路网络模型
将排名前20的KEGG信号通路及相对应的靶点导入 Cytoscape 3.9.0 软件中构建脑缺血靶点-信号通路网络(见图6),该网络中共包含35个节点和145条边,其中三角形为信号通路节点,长方形为靶点节点.结果显示,脉络宁活性成分是通过多靶点、多途径的共同作用下治疗脑缺血的.该网络中度值排名靠前的靶点为RelA、AKT1、CASP3、MAPK1、MAPK8、NFκb,CASP8、JUN等,分别调控了多条信号通路,表明该8个靶点在脉络宁活性成分治疗脑缺血的过程中起到了重要的作用.

图6 脉络宁活性成分治疗脑缺血靶点-信号通路网络模型注:三角形为信号通路节点,长方形为靶点节点
2.7 分子对接验证结果
由2.4项可知,PPI核心网络中的关键蛋白为ALB、AKT1、IL6、CASP3、VEGFA、JUN、PTGS2、MMP9,靶点-信号通路中的核心基因为RelA、AKT1、CASP3、MAPK1、MAPK8、NFκb、CASP8、JUN,结合2.3项中获得的关键活性成分,利用autodock vina对上述基因与可作用于这些基因的活性成分进行半柔性分子对接.
表2显示,活性成分与其对应的靶点分子对接的结合能均小于-5.0 kJ/mol,表明活性成分与靶点具有较好的结合活性.选取结合能最高(MOL000173与JUN)和最低(MOL000006与PTGS2)的进行对接,结果见图7.
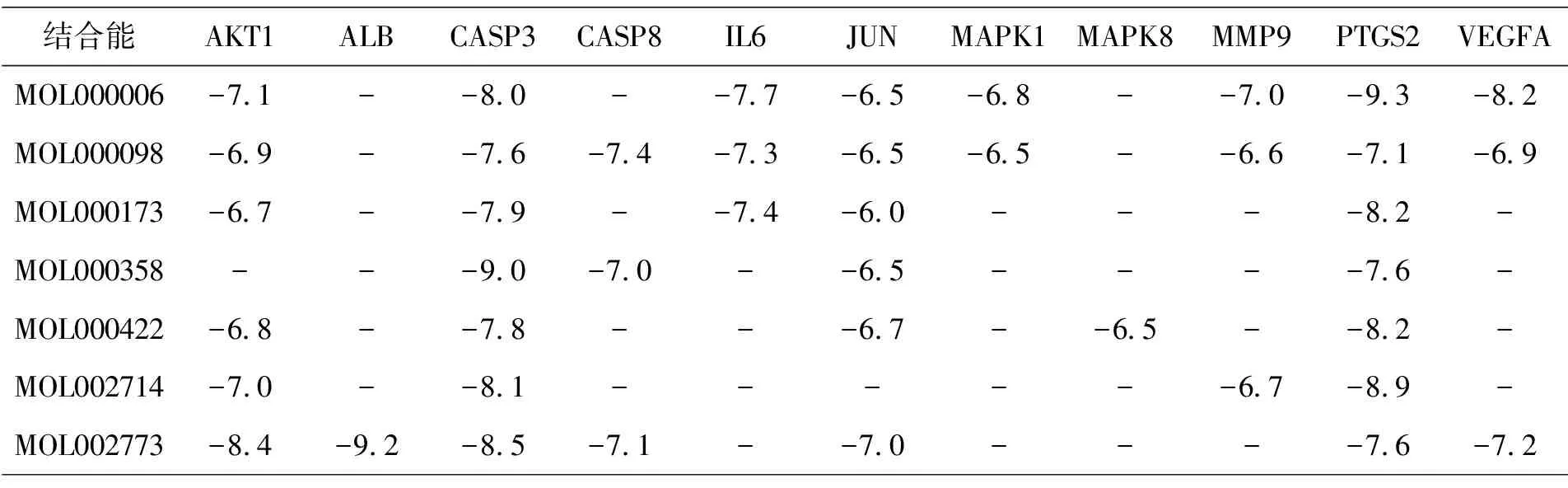
表2 分子对接验证结果
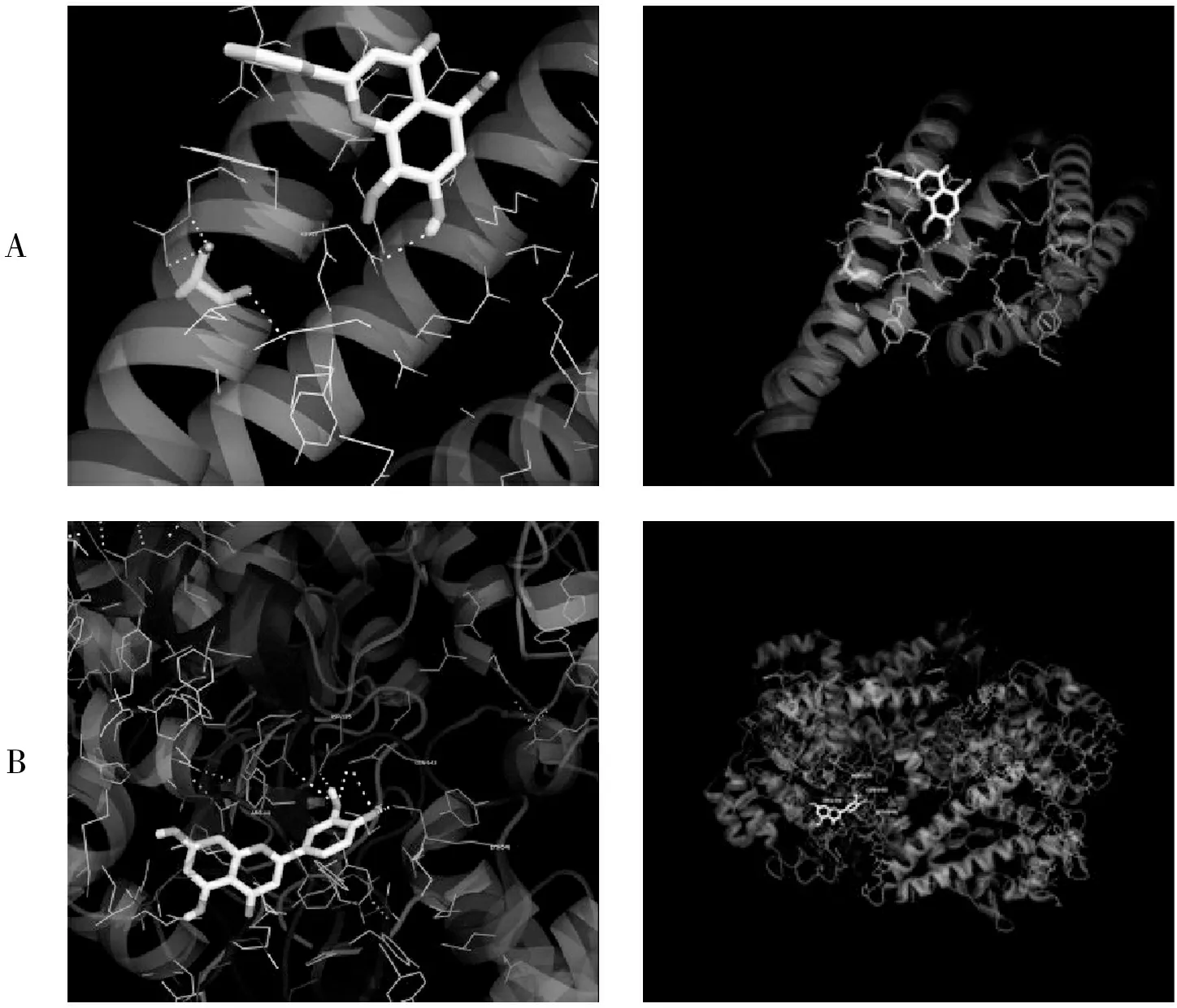
图7 结合能最高和最低的分子对接结果图
2.8 体外实验验证
2.8.1 脉络宁对PC12细胞存活率的影响
与 control 组相比,OGD 损伤组的神经元吸光度明显下降,细胞存活率降低(P<0.05);与 OGD 组相比,PC12细胞经浓度为0.2 μmol/L、0.02 μmol/L 的脉络宁干预后,吸光度明显增加,说明脉络宁能显著改善经OGD后PC12细胞的存活率,并呈浓度依赖性,对PC12细胞有保护作用,如表3、图8所示.
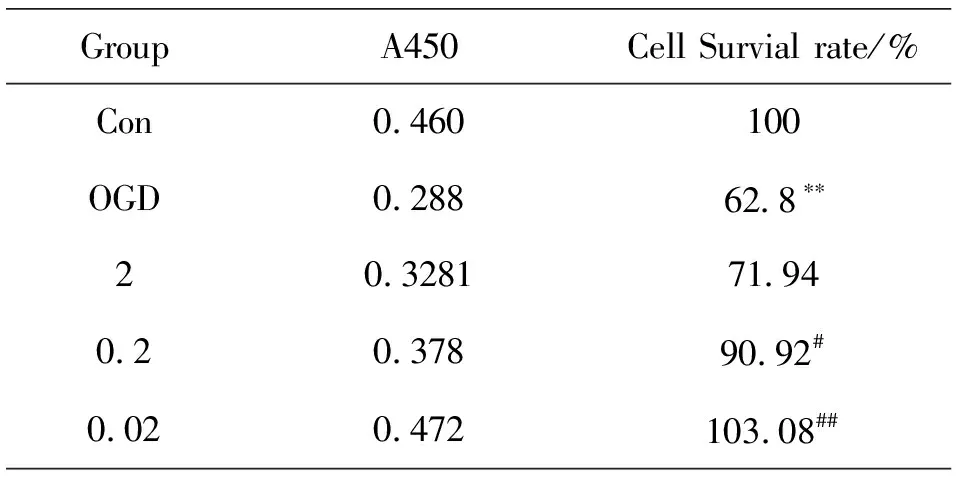
表3 脉络宁对PC12细胞存活率的影响(χ±s,n=9)

图8 脉络宁对 OGD 损伤后PC12细胞存活率的影响(χ±s,n=9)
2.8.2 脉络宁对OGD诱导的PC12细胞线粒体膜电位水平的影响
与假手术组相比,OGD组细胞线粒体膜电位显著降低(P<0.01);与OGD组相比,脉络宁0.2 μmol/L、0.02 μmol/L剂量组和依达拉奉0.1 μmol/L细胞线粒体膜电位均显著增加 (P<0.05,P<0.01)(见表4,图 9).
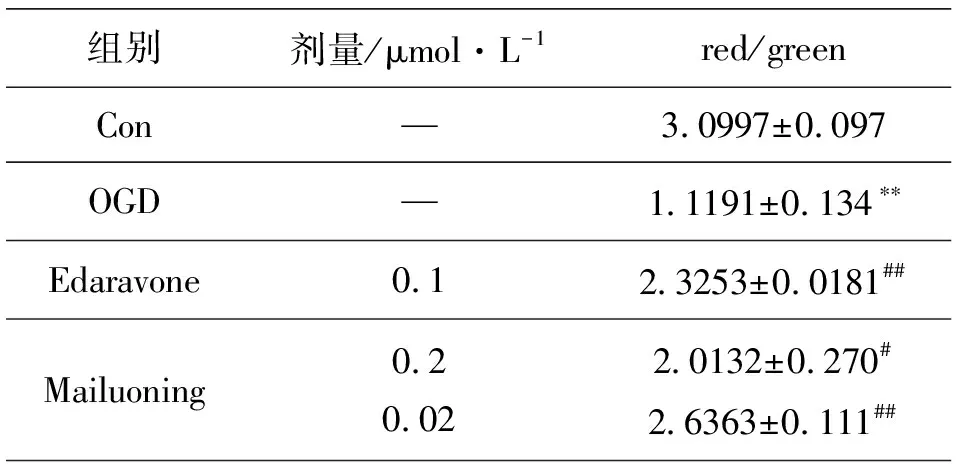
表4 脉络宁对OGD诱导PC12 细胞线粒体膜电位的影响(¯χ±s,n=3)
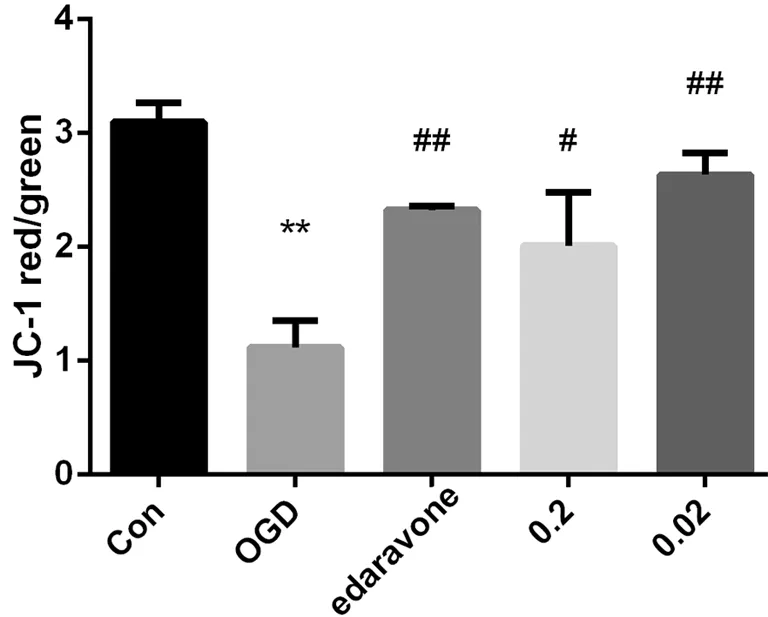
图9 脉络宁对OGD诱导的PC12 细胞线粒体膜电位的影响
2.8.3脉络宁关键靶点基因变化对OGD诱导PC12细胞的影响
RT-PCR 结果显示,与control 组相比,OGD组的Caspase3、Caspase8、RelA、NFκb、MAPK1、MAPK8、Jun mRNA 表达显著上调(P<0.05,P<0.01),而 AKT1 mRNA 水平则下调(P<0.01);与OGD组比较,脉络宁组与依达拉奉组的Caspase3、Caspase8、RelA、NFκb、MAPK1、MAPK8、Jun mRNA 表达显著下调(P<0.05,P<0.01),而AKT1 mRNA 表达上调(P< 0.01),见表5.
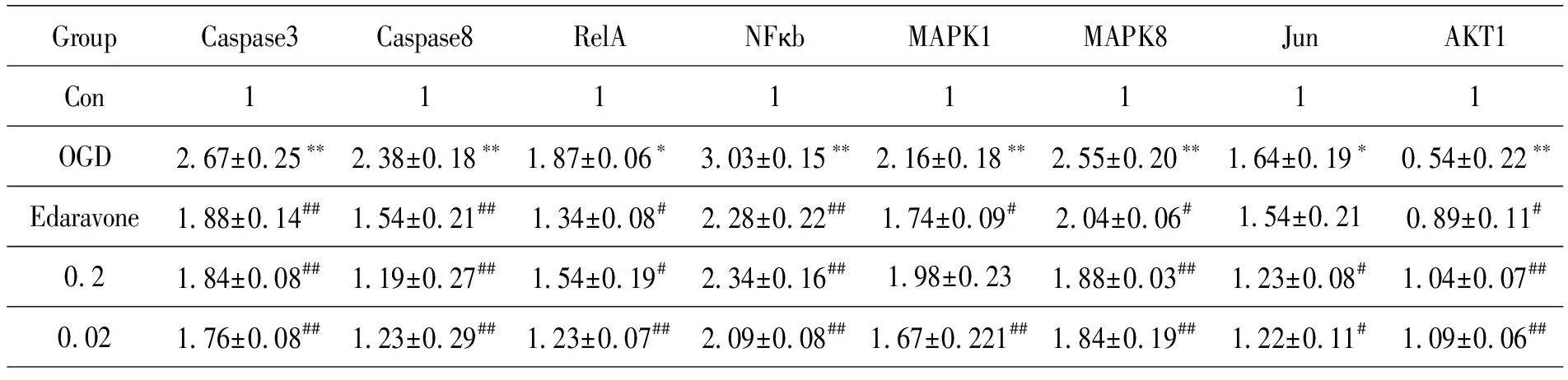
表 5 脉络宁对OGD诱导PC12细胞关键靶点基因mRNA 表达的影响(χ ±s,n=3)
3 讨论
本研究利用网络药理学研究方法,搜集脉络宁注射液中中药成分共含58种,对应276个靶点,与脑缺血交集的靶点84个,核心靶点8个,分别为RelA、AKT1、CASP3、MAPK1、MAPK8、NFκb、CASP8、JUN.核心靶点的 GO 富集分析结果表明,脉络宁注射液抗脑缺血主要在细胞因子介导的信号通路、对脂多糖的反应、基因表达的正向调节、细胞凋亡过程的负向调节、细胞对镉离子的反应等;细胞组分主要涉及细胞外空隙、胞外区、内质网腔、膜筏等;分子功能主要涉及酶结合、蛋白结合、转录因子结合、血红素结合等.KEGG 富集分析前 20 项结果并结合现有研究报道显示:TNF信号通路、IL-17信号通路、HIF-1信号通路、松弛素信号通路等都与脑缺血相关.[11-14]由此可见,脉络宁注射液可能通过上述多个生物过程、靶点和通路共同参与抗脑缺血,其机制主要涉及抗炎、保护线粒体功能及改善血流动力学相关的信号通路.
为验证脉络宁通过保护线粒体活性抗脑缺血的有效性,本研究通过OGD构建体外脑缺血模型进行实验验证.依达拉奉是一种自由基清除剂,被广泛应用于脑血管病的治疗,[15]故本研究使用依达拉奉作为阳性对照药物进行干预,结果发现脉络宁的PC12细胞OGD损伤明显下降,说明可明显改善因OGD诱导的线粒体膜电位下降,表明脉络宁的抗脑缺血作用与保护线粒体活性相关.
为进一步探讨脉络宁抗脑缺血可能的机制,本研究对网络药理学预测的8个关键靶基因RelA、AKT1、CASP3、MAPK1、MAPK8、NFκb、CASP8、JUN进行验证.RelA是NFκB通路的主要功能亚基,翻译后修饰能有效调控NFκB的转录激活,进而在炎症反应及脑缺血的发生和发展中发挥重要作用.[16]近年来,许多研究证明MAPK8信号通路与脑缺血损伤后的神经细胞凋亡有密切关系.[17-19]JUN属于核转录基因,脑缺血时被激活,调控目的基因的转录,进而诱导细胞发生凋亡,[20]这与本研究RT-PCR结果趋势相同.大量证据表明,脑缺血后导致的线粒体功能障碍最终可引起细胞自噬或凋亡,[21-23]脑缺血时,PI3K/Akt磷酸化水平显著降低,Caspase3、Caspase8表达增加,通过级联反应引起线粒体途径的细胞凋亡.[24-26]研究还发现,AKT1在急性中风病、阿尔茨海默病等多种神经系统疾病中,可通过线粒体途径抗凋亡机制保护神经元,对神经元存活起促进作用.[27]本研究中,经OGD后,脉络宁可显著上调AKT1 mRNA,下调Caspase3、Caspase8、mRNA.进一步证实了脉络宁可通过线粒体途径抗脑缺血损伤.结合关键靶基因的相关研究报道和本实验结果,脉络宁治疗脑缺血可能与通过PI3K/Akt信号通路抑制炎症反应、进而抑制线粒体介导的细胞凋亡有关,这为进一步研究其作用机制提供了参考.
