270例新生儿听力及耳聋基因联合筛查与听力诊断结果分析*
2023-11-22周怡王雪瑶金欣李颖郝津生郑之芃陈敏史吉峰刘冰刘海红
周怡 王雪瑶 金欣 李颖 郝津生 郑之芃 陈敏 史吉峰 刘冰 刘海红
传统的新生儿听力筛查在我国已实施多年,覆盖面广,测试简单快捷,可以及时发现先天性听力损失患儿,但对迟发性、渐进性及药物性聋的检出有一定的局限性。新生儿耳聋基因筛查对新生儿听力筛查的局限有了很好的补充,可有效提升遗传性聋的检出率,使得听力损失和潜在听力损失儿童能够得到早发现、早诊断和早干预[1]。故新生儿听力和耳聋基因联合筛查尤为重要,既可以发现先天性聋,又可以对迟发性聋及药物性聋作出预警,有效避免或延迟听力损失的发生。本研究对新生儿耳聋基因筛查未通过的群体,结合新生儿听力筛查结果分析其听力水平、确诊时间、干预时间及干预效果,旨在为临床耳聋基因遗传咨询提供科学依据。
1 资料与方法
1.1研究对象 北京地区2019年至2021年因新生儿耳聋基因筛查未通过来北京儿童医院咨询并进一步行听力学诊断的儿童共270例(540耳),男141例,女129例,男女比例1.1∶1;就诊年龄2~24月龄,平均4月龄,其中:2~3月龄113例(占41.85%),4~6月龄111例(占41.11%),7~9月龄26例(占9.63%),10~12月龄15例(占5.56%),1~2岁5例(占1.85%)。
1.2耳聋基因筛查及听力筛查方法 新生儿耳聋基因筛查在新生儿出生后3~5天内采集足跟末梢血,用15项遗传性聋基因检测试剂盒(微阵列芯片法)检测中国人群中常见的4个耳聋相关基因的15个突变位点,即GJB2(c.35delG、c.176_191del16、c.235delC、c.299_300delAT)、GJB3 c.538C>T、SLC26A4(c.2168A>G、c.IVS7-2A>G、c.1174A>T、c.1226 G>A、c.1229C>T、c.1975G>C、c.2027T>A、c.IVS15+5G>A)、线粒体DNA 12SrRNA(m.1494C>T、m.1555A>G)。在新生儿出生后48 h,采用TEOAE筛查方法进行新生儿听力筛查。
1.3听力学评估方法
1.3.1ABR检测 使用Interacoustics Eclipse客观听觉测试平台系统,用95%酒精及磨砂膏进行皮肤清洁、脱脂后,将电极片分别固定于前额近发际处、眉心及两侧乳突位置,测量极间电阻≤3 kΩ,耳机类型为3A插入式耳机,刺激声为交替短声,刺激速率为19.9次/秒,带通滤波为100~3 000 Hz,叠加次数为2 000次,刺激声强从80 dB nHL开始,如引出ABR依次递减,否则递增至100 dB nHL,以可以引出波Ⅴ的最小刺激声强作为ABR反应阈。
1.3.2ASSR检测 使用Interacoustics Eclipse客观听觉测试平台系统,刺激声为CE-chirp声,电极放置位置同ABR测试,耳机类型为3A插入式耳机,刺激重复率90次/秒,载波频率为500、1 000、2 000和4 000 Hz,排斥水平为80 μV。以500、1 000、2 000和4 000 Hz四个频率的平均反应阈作为ASSR反应阈。
1.3.3DPOAE检测 使用Interacoustics Eclipse客观听觉测试平台系统,两初始刺激音频音频比f1/f2=1.22,刺激声强度L1=65 dB SPL,L2=55 dB SPL,排斥声级为20 dB SPL,以大于本底噪声6 dB为DPOAE引出的标准。500、1 000、2 000、3 000、4 000、6 000和8 000 Hz 7个频率中4个及以上频率引出DPOAE为通过标准。
1.3.4声导抗检测 使用MAICO MI44声导抗仪,进行226及1 000 Hz探测音声导抗测试。测试结果以A型曲线、正峰作为中耳功能正常的标准。
1.4听力诊断标准
1.4.1听力损失程度 ABR以波Ⅴ反应阈30 dB nHL作为2 000~4 000 Hz范围听力正常的指标;以波Ⅴ反应阈>30 dB nHL作为听力损失指标,听力损失分级如下,轻度:31~50 dB nHL;中度:51~70 dB nHL;重度:71~90 dB nHL;90 dB nHL以上为极重度[2]。ASSR反应阈以500、1 000、2 000和4 000 Hz 4个频率的平均反应阈值进行评估。
1.4.2听力损失性质 由于本研究受试儿童平均年龄仅4月龄,配合进行骨导ABR检查较困难,仅以声导抗检查结果作为评估中耳功能的主要指标,对7月龄以下婴幼儿加做1 000 Hz探测音鼓室声导抗测试[3]。在听力损失儿童中,只有226 Hz声导抗A型曲线且1 000 Hz声导抗为正峰方可视为感音神经性听力损失。
1.5分组方法 将新生儿耳聋基因筛查结果为纯合突变或复合杂合突变视为有明确致病突变基因型,将单杂合突变和线粒体DNA 12SrRNA基因均质突变或异质突变的情况均视为无明确致病突变基因型。依据新生儿耳聋基因筛查及新生儿听力筛查结果分为四组:A1组(新生儿耳聋基因筛查无明确致病突变基因型、新生儿听力筛查通过)、A2组(新生儿耳聋基因筛查无明确致病突变基因型、新生儿听力筛查未通过)、B1组(新生儿耳聋基因筛查有明确致病突变基因型、新生儿听力筛查通过)及B2组(新生儿耳聋基因筛查有明确致病突变基因型、新生儿听力筛查未通过)。
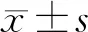
2 结果
2.1新生儿耳聋基因筛查结果 270例儿童中新生儿耳聋基因筛查结果有明确致病突变基因型8例,分别为GJB2基因c.235delC纯合突变3例(占1.11%,3/270);c.299_300delAT纯合突变2例(占0.74%,2/270);c.235delC/c.299_300delAT复合杂合突变1例(占0.37%,1/270),SLC26A4基因c.IVS7-2A>G纯合突变1例(占0.37%,1/270);c.2168A>G/c.1174A>T复合杂合突变1例(占0.37%,1/270)(表1)。
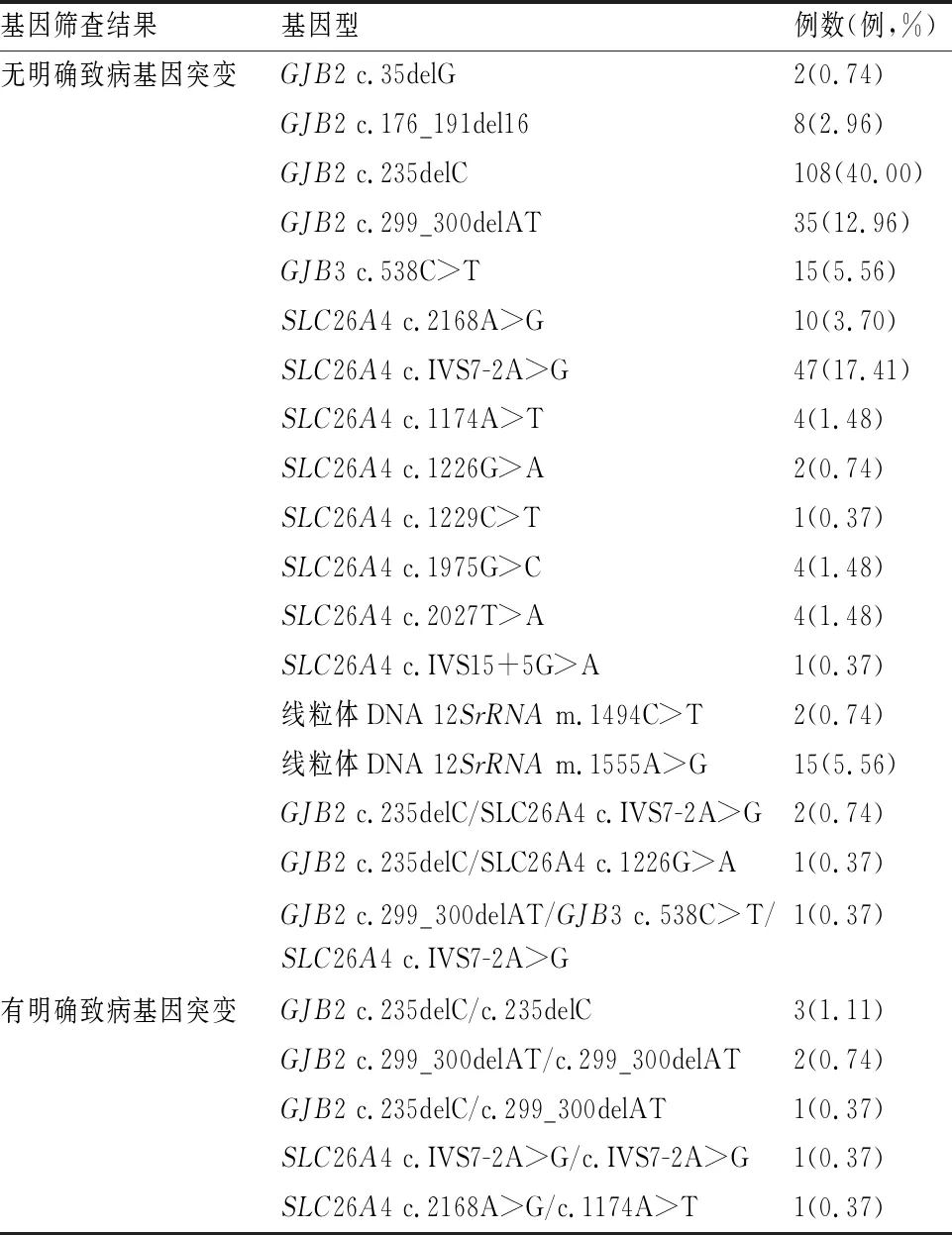
表1 270例新生儿耳聋基因筛查结果
2.2新生儿听力筛查结果 270例(540耳)儿童中,新生儿听力筛查双耳通过213例426耳(占78.89%),单耳未通过26例26耳(占9.63%),双耳未通过31例62耳(占11.48%)。
2.3分组结果 A1组238例450耳(占83.33%,450/540);A2组50例74耳(占13.70%,74/540);B1组1例2耳(占0.37%,2/540);B2组7例14耳(占2.59%,14/540)。
2.4四组儿童听力评估结果 A1组ABR阈值、ASSR平均反应阈正常率为100%,DPOAE通过率为78.44%;A2组ABR阈值、ASSR平均反应阈正常率为70.27%,其中15例22耳存在轻度到重度不等的听力损失,DPOAE通过率为43.24%;B1组ABR阈值、ASSR平均反应阈正常率为0,均为轻度听力损失,DPOAE通过率为0;B2组ABR阈值、ASSR平均反应阈正常率为0,为中度到极重度不等的听力损失,DPOAE通过率为0(表2)。
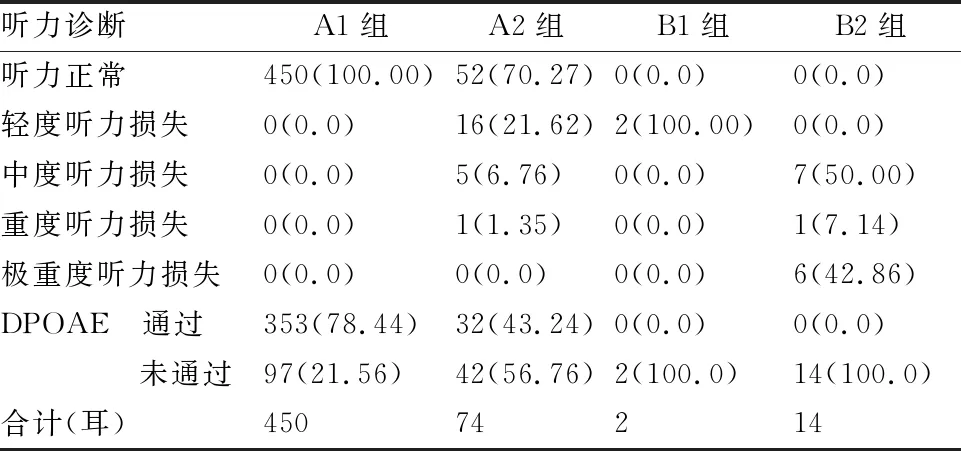
表2 不同组别儿童听力诊断结果分布(耳,%)
2.5统计学分析结果 采用非参数秩和检验两两比较不同分组儿童的听力诊断(ABR阈值、ASSR平均听阈和DPOAE通过率)结果,分析显示四组儿童听力学诊断结果具有显著性差异(P值<0.05),具体为A1组儿童较其他三组儿童ABR阈值、ASSR平均反应阈更趋于正常,DPOAE通过率最高;B2组儿童较其它三组儿童ABR阈值、ASSR平均反应阈最高,DPOAE通过率最低;A2和B1组儿童的ABR阈值、ASSR平均反应阈及DPOAE通过率差异无统计学意义(表3)。
表3 四组儿童听力学诊断结果比较
2.6听力异常儿童听力诊断及随访结果 270例中23例(38耳)儿童听力结果异常,其后续治疗及干预情况见表4。8例有明确致病突变基因型儿童中,GJB2基因c.235delC纯合突变的3例均为极重度听力损失(平均听阈为89.38 dB nHL),而c.299_300delAT纯合突变的2例和c.235delC/c.299_300delAT复合杂合突变的1例均为中度听力损失(平均听阈为59.79 dB nHL)。SLC26A4基因c.IVS7-2A>G纯合突变的1例为中度听力损失(平均听阈为61.25 dB nHL),而c.2168A>G/c.1174A>T复合杂合突变的1例为轻度听力损失(平均听阈为36.25 dB nHL)(表5)。
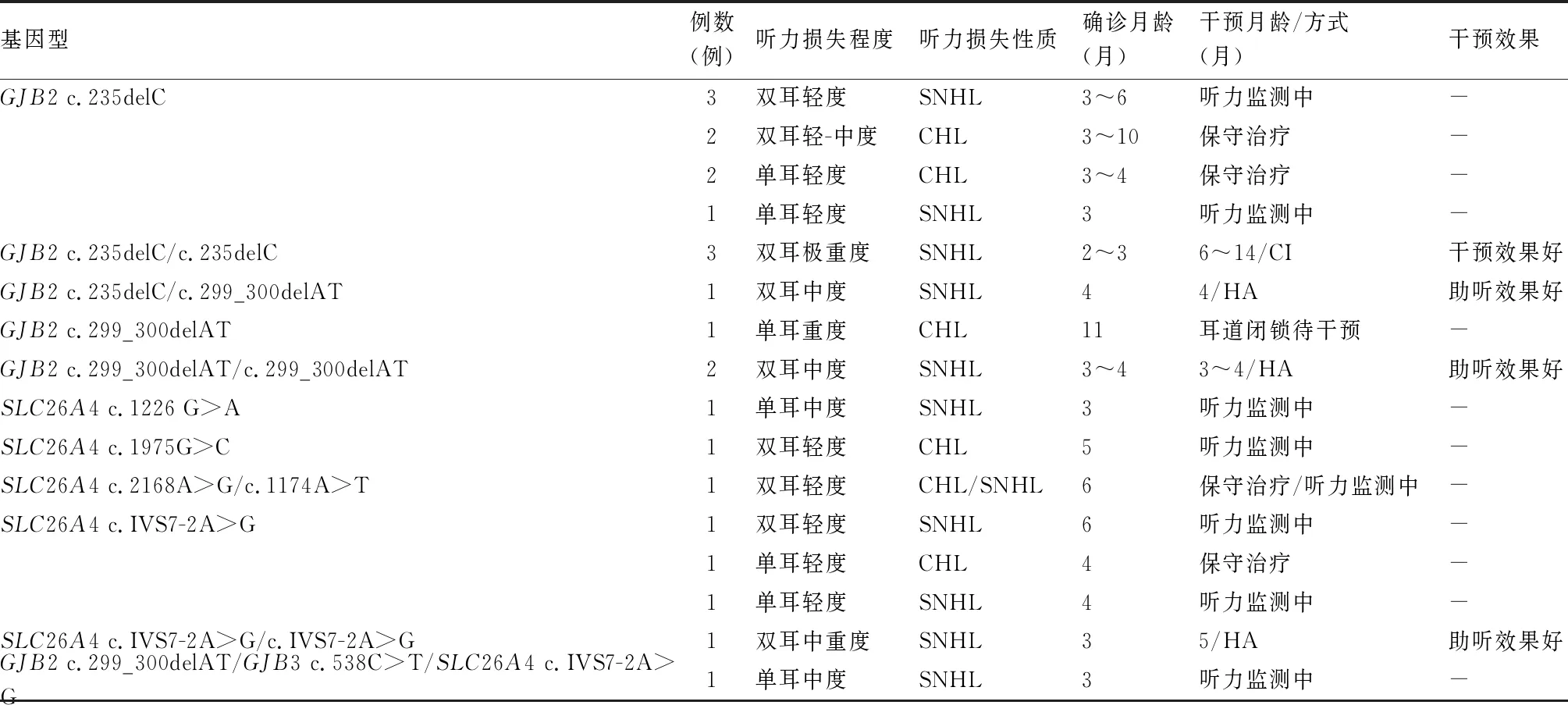
表4 23例(38耳)听力异常儿童具体情况
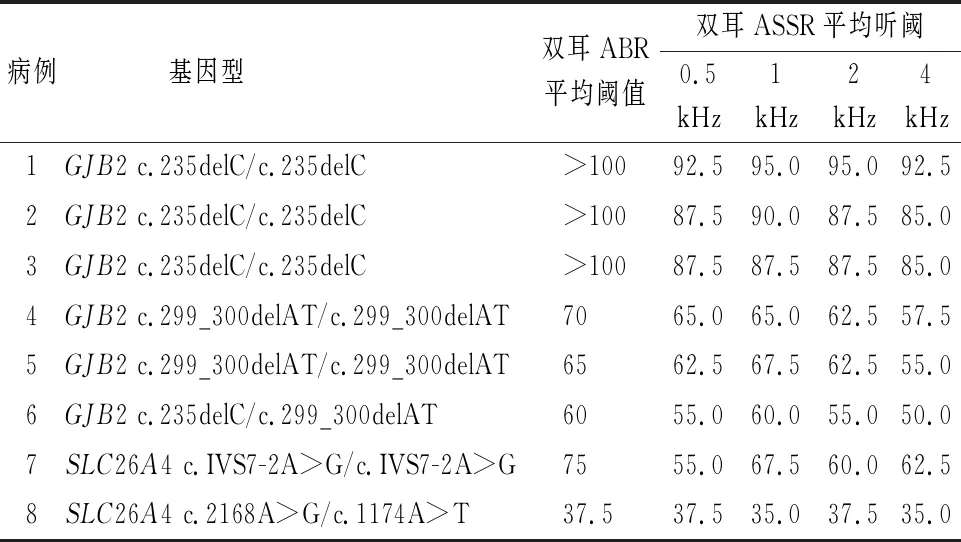
表5 8例明确致病突变基因型儿童听力水平(dB nHL)
3 讨论
耳聋基因遗传咨询应遵循基因型表型对应性的原则[4],详细询问家族史、采集临床信息,必要时应建议儿童完善相关检查(听力学、影像学和耳聋基因检测)以进一步明确诊断,获得准确的遗传咨询和康复指导。在临床咨询[5,6]中,对存在SLC26A4基因突变的儿童需做好疾病科普宣教及生活指导,尽量避免感冒、摔倒和头部碰撞等诱因引发迟发性聋。对存在线粒体DNA 12SrRNA基因突变的儿童需做好用药指导、配发耳毒性药物卡片,明确提示此类儿童及母系家庭成员对氨基糖苷类药物高度敏感,应终身禁止接触此类耳毒性药物,避免药物性聋的发生。对有再生育需求的家庭要筛查儿童父母的相应基因,如夫妻双方携带同一基因的相同或不同突变位点,要及时预警再生育聋儿的风险,必要时进行产前诊断。
本研究显示A1组听力诊断结果全部正常,提示目前存在听力异常的可能性较小,但也不排除迟发性听力损失及药物致聋的风险。因此,建议本组儿童做好听力监测、密切随诊,一旦发现听力异常应及时就诊。
A2组听力正常率为70.27%(52/74)。其中,10耳(占13.51%,10/74)为传导性听力损失,12耳(占16.22%,12/74)为感音神经性听力损失,提示本组儿童也有一定的概率发生感音神经性听力损失[7]。这12耳中10耳为轻度感音神经性听力损失,诊断月龄在6月龄以内,家长均表示待听力复查后视结果再定进一步检查及干预措施;另2耳为单侧中度感音神经性听力损失,基因型分别为SLC26A4 c.1226 G>A单杂合突变和GJB2 c.299_300delAT、GJB3 c.538C>T、SLC26A4 c.IVS7-2A>G三位点杂合突变,需进一步进行基因测序明确有无本研究耳聋基因筛查范围外的致病突变,同时也需要结合临床综合考虑是否存在环境、巨细胞病毒感染等[8]或其他原因导致耳聋。针对本组儿童,咨询人员一定要谨慎并重视,无论新生儿耳聋基因筛查有无明确致病突变基因型都要结合耳聋基因诊断、影像学检查及其他相关检查,必要时可三个月后进行听力学二次评估,建议与家长共同商讨,找出对儿童听力发育最有效的干预方式。
B1组仅一例听力诊断结果示双耳轻度听力损失,基因型为SLC26A4 c.2168A>G / c.1174A>T复合杂合突变,6月龄时听力学诊断结果显示1耳轻度传导性听力损失、1耳轻度感音神经性听力损失,属于迟发性听力损失,需监测听力有无波动。本组儿童尽管病例少,但更容易发生漏诊、延迟康复的可能。杨亚利等[9]研究发现部分LVAS患儿表现为迟发性或渐进性听力损失,尤其是轻中度听力损失,该患儿情况与之相符。新生儿耳聋基因筛查从分子水平对耳聋高危新生儿提前预警,有利于迟发性聋或隐匿性聋个体的检出及临床指导。遗传咨询时,此类儿童无论新生儿听力筛查通过与否,均建议3月龄进行听力学、影像学及耳聋基因诊断,确定病因后早期干预、积极康复。
B2组全部确诊为中度至极重度感音神经性听力损失,提示此种情况发生先天性感音神经性听力损失的概率极高,需高度重视。研究表明[10,11],GJB2及SLC26A4基因突变的听力损失儿童及时佩戴助听器、人工耳蜗植入干预效果好。本组儿童得益于新生儿听力联合耳聋基因筛查,确诊年龄较小,干预时间较早,干预效果较好,也充分得到了家长的认可和配合,提高了听力评估及康复的依从性,有利于明确病因的聋儿言语正常发育。遗传咨询时,本组儿童应按时在3月龄进行听力学诊断,一旦明确诊断尽早进行听力学干预及康复指导,以免影响言语及心理的正常发育。
值得注意的是,本研究发现8例有明确致病突变基因型的儿童均为双耳对称性听力损失,听力曲线为平坦型。进一步分析发现,GJB2基因c.235delC纯合突变的儿童较c.299_300delAT纯合突变和c.235delC/c.299_300delAT复合杂合突变的儿童听力损失程度更重、确诊年龄更早,与王芳等[12]的研究结果相近,表明GJB2基因突变导致更为严重的听力损失时更易于被发现;SLC26A4基因c.IVS7-2A>G纯合突变的儿童较c.2168A>G/c.1174A>T复合杂合突变的儿童听力损失程度偏重,发病年龄更小,也说明发病越迟引起的听力损失越轻[13]。
综上所述,不同耳聋基因筛查和听力筛查结果的儿童听力诊断结果有显著差异,证实了新生儿耳聋基因筛查和听力联合筛查的模式是非常有效的。对耳聋基因筛查存在明确致病突变基因型的儿童,无论新生儿听力筛查通过与否都要引起重视,建议及时进行诊断性听力检查及必要的影像学、遗传学检查;对新生儿听力筛查未通过的儿童,无论新生儿耳聋基因筛查有无明确致病突变基因型,也应进一步行诊断性听力检查及必要的影像学、遗传学检查。期望通过双筛查模式使听力障碍儿童能够得到早发现、早诊断、早干预,正常融入健康生活。
