乙型肝炎病毒感染与肝细胞癌血管生成及侵袭转移的相关性*
2023-11-22才袁刘洵祺李国军胡曼莉黄湘荣
才袁 刘洵祺 李国军 胡曼莉 黄湘荣
(深圳市第三人民医院,深圳 龙岗 518000)
肝细胞癌是由肝细胞发生的恶性肿瘤。其发病率在全球恶性肿瘤中排名第五,死亡率仅次于肺癌。中国是肝癌发病率最高的国家之一。肝癌的早期发病具有隐蔽性,症状并不明显。在诊断时,大多数患者处于中晚期,错过最佳治疗时间,使得大多数患者在肝癌诊断后约1年内死亡[1-2]。肝细胞癌血管生成与侵袭转移是患者病情加重的主要特征,与正常组织相类似,肿瘤组织也需要足够的营养从而维持肿瘤的生长及转移[3-4]。肝细胞癌的发病机制较为复杂,乙型肝炎病毒(Hepatitis B virus ,HBV)、丙型肝炎病毒感染以及非酒精性脂肪肝炎等均为肝癌发生的因素,其中,HBV感染为肝细胞癌的主要致病因素,据相关统计,我国有超过80%的肝细胞癌患者伴有HBV感染[5]。但关于HBV感染与肝细胞癌血管生成及侵袭转移的相关关系尚不明确。本研究通过观察HBV感染及未感染患者VEGF、CD34表达及微血管密度水平,分析VEGF表达与微血管密度的关系及HBV感染情况与患者临床病理特征的关系,探讨HBV与肝细胞癌血管生成及侵袭转移的相关性。现报告如下。
1 资料与方法
1.1 一般资料 选取2019年3月—2020年11月本院收治的75例肝细胞癌患者作为研究对象,根据患者是否合并HBV感染分为感染组(n=44)及未感染组(n=31)。纳入标准:①均符合肝细胞癌的相关诊断及治疗指南[6],且经病理学检查确诊。②入院前未接受相关治疗。③一般情况良好,无明显的心、肺、肾等重要脏器器质性病变。④无肝外转移灶。⑤患者及家属均知情同意并签订知情同意书。排除标准:①病历资料不全或中途退出者。②合并其他恶性肿瘤疾病。③自身免疫性疾病、严重心肝肾功能衰竭者。④妊娠及哺乳期妇女。本研究通过医院伦理委员会审核批准,均符合医学伦理学相关原则。
1.2 免疫组化法检测 以CD34标记血管生成情况,采用免疫组化法[7]测定血管内皮生长因子(Vascular endothelial growth factor,VEGF)、CD34表达水平。患者给予全麻,经腹腔镜手术获取患者肝细胞癌组织及癌旁正常组织,使用福尔马林溶液进行固定,常规制作石蜡切片,取石蜡切片,将其经二甲苯脱蜡,梯度酒精脱水,蒸馏水清洗,滴加3%过氧化氢去离子水,在室温下孵育5 min,磷酸盐缓冲液冲洗,加入枸橼酸钠缓冲液进行水浴修复,自然冷却,磷酸盐缓冲液冲洗,加入一抗,在37 ℃湿盒孵育2 h,磷酸盐缓冲液冲洗,加入二抗,37 ℃湿盒孵育2 h,磷酸盐缓冲液冲洗,滴加DAB显色液,在室温下显色,苏木素复染,盐酸酒精分化,氨水返蓝,烘干并中性树胶封片。以染色黄色、棕黄色视为阳性表达。
1.3 观察指标 ①收集患者临床基本资料,包括年龄(<55岁、≥55岁)、性别(男、女)、HBeAg表达(阳性、阴性)、甲胎蛋白(<20 μg/L、≥20 μg/L)、肿瘤直径(<4 cm、≥4 cm)、临床分期(Ⅰ期、Ⅱ期、Ⅲ期)、包膜浸润(无、有)、Edmondson分级[8](Ⅰ级+Ⅱ级、Ⅲ级+Ⅳ级)、侵袭转移(低转移、高转移)、术后复发转移率(低、高)等。②两组VEGF、CD34、微血管密度水平对比。③分析VEGF表达与微血管密度的关系。
1.4 统计学分析 应用SPSS 21.0软件进行数据统计分析,患者临床病理特征等计数资料以率(%)表示,采用2检验;微血管密度等计量资料数据均以均数±标准差表示,采用t检验;采用2检验和Fisher确切概率法[9]分析HBV感染与肝细胞癌患者临床病理特征的相关性;采用Kaplan-Meier生存曲线[10]分析肝细胞癌组织HBV感染与肝细胞癌患者生存预后的关系。以P<0.05 为差异有统计学意义。
2 结果
2.1 肝细胞癌患者临床资料分析 75例肝细胞癌患者中年龄<55岁、≥55岁分别占57.33%(43例)、42.67%(32例);男性、女性分别占77.33%(58例)、22.67%(17例);HBeAg表达阳性、阴性患者分别占25.33%(19例)、74.67%(56例);甲胎蛋白<20 μg/L、≥20 μg/L分别占32.00%(24例)、68.00%(51例);肿瘤直径<4 cm、≥4 cm分别占21.33%(16例)、78.67%(59例);临床分期Ⅰ期、Ⅱ期、Ⅲ期分别占21.33%(16例)、54.67%(41例)、24.00%(18例);包膜浸润者占56.00%(42例);Edmondson分级中Ⅰ级+Ⅱ级、Ⅲ级+Ⅳ级分别占13.33%(10例)、86.67%(65例);侵袭转移者中低转移、高转移分别占58.67%(44例)、41.33%(31例),术后低、高复发转移率分别为53.33%(40例)、46.67%(35例)。
2.2 两组VEGF、CD34、微血管密度水平对比 HBV感染组与未感染组患者VEGF、CD34、微血管密度水平对比差异具有统计学意义(P<0.05)。见表1、图1。
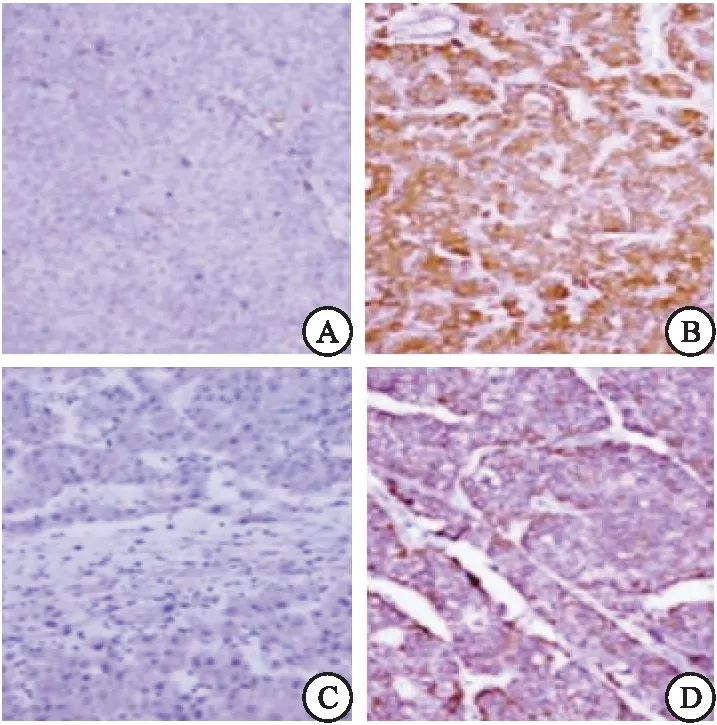
图1 肝癌组织中VEGF、CD34表达(400×)

表1 两组VEGF、CD34、微血管密度水平对比[n(×10-2)]
2.3 VEGF表达与微血管密度的关系 与VEGF表达阴性组对比,VEGF表达阳性组微血管密度水平明显升高(P<0.05)。见表2。
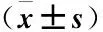
表2 VEGF表达与微血管密度的关系
2.4 HBV感染情况与临床病理特征的关系 两组患者在年龄、性别、甲胎蛋白、肿瘤直径方面比较差异无统计学意义(P>0.05);在不同HBeAg表达、TNM分期、包膜浸润、Edmondson分级、侵袭转移及术后复发转移率方面比较差异具有统计学意义(P<0.05)。见表3。
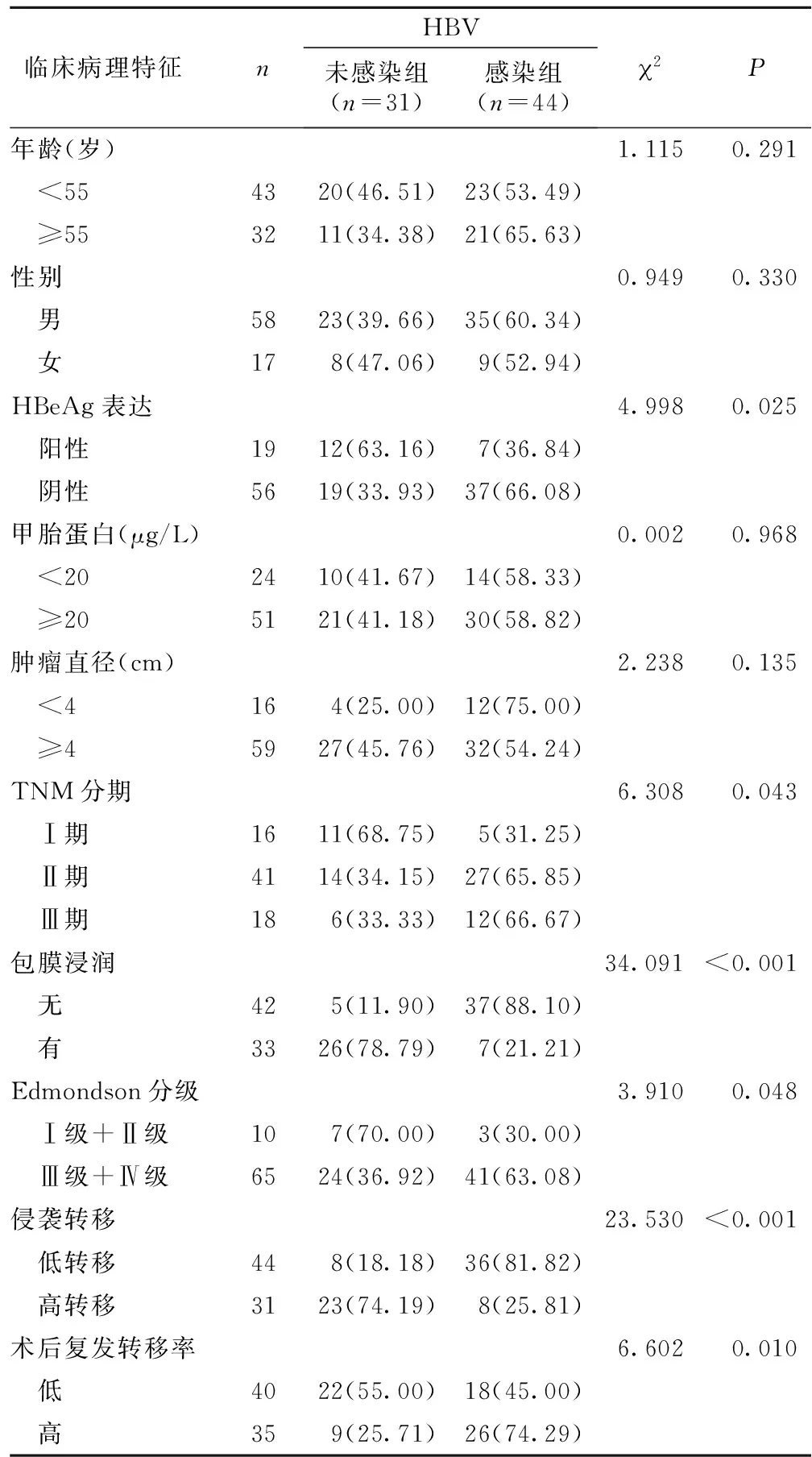
表3 HBV感染情况与临床病理特征的关系[n(×10-2)]
2.5 HBV感染与肝细胞癌患者生存预后的关系 采用Kaplan-Meier生存曲线分析,HBV未感染患者生存期明显长于HBV感染患者(P<0.05)。见图2。
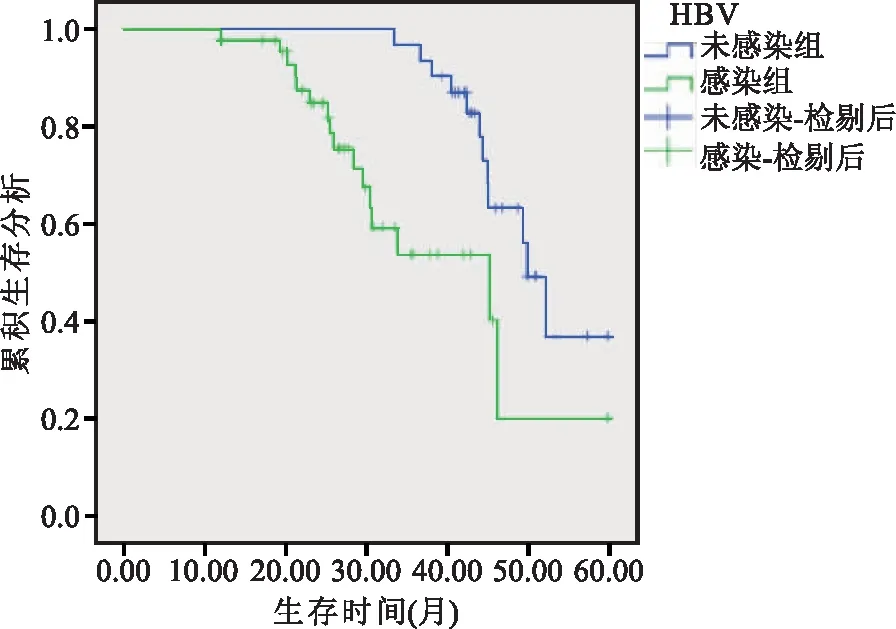
图2 HBV感染与肝细胞癌患者生存预后的关系
3 讨论
肝细胞癌作为肝癌中最常见的一种,其恶性程度较高,且其发病较为隐匿,随着医学科技的进步,各种治疗方法的不断改进,但患者的死亡率仍居高不下[11]。侵袭及迁移被认为是影响肝癌预后的重要因素,也是阻碍疗效提高的主要障碍[12]。肝细胞癌的发病机制较为复杂,其发生、发展可能受多基因、多种因素调控,相关因子的异常表达均有可能引起肝细胞癌细胞功能性的改变[13]。HBV感染引起的肝细胞癌作为临床上最常见的肝细胞癌类型,其可能造成肝功能衰竭及肝硬化等的发生[14]。因此,注重HBV感染的防治工作,重视HBV感染对肝细胞癌的发病及患者预后的影响具有重要意义。
HBV感染引起肝癌的主要原因是HBV侵入肝细胞,然后在肝细胞内沉积和复制,进一步抑制免疫复合物的形成,并沉积在肝脏中激活补体。相关资料显示[15-16],HBV为原发性肝癌的主要病因,HBV X基因可激活多种癌基因、抑癌基因的转录,参与肝细胞的恶性转化。HBV X在HBV感染的肝癌细胞中可通过上调血管生成因子进一步影响肝癌细胞生物学行为,因此HBV在肿瘤形成过程中可加速血管生成。随着研究的不断深入,有学者研究发现[17],肝细胞癌患者的血管生成、侵袭和转移可能是肝微血管转移和扩散的重要途径,进而导致肝肿瘤细胞的肝内转移。肝细胞癌的血管生成、侵袭和转移可能是影响患者预后的重要因素[18]。VEGF被认为是目前最重要的血管促成因子,是肿瘤血管形成因子的研究热点。众多研究发现[19-20],VEGF在肝细胞癌中呈现高表达水平,并与癌细胞增殖、转移及复发密切相关。CD34作为一种跨膜磷酸糖蛋白,主要在内皮细胞的迁移及黏附作用中扮演着重要角色,其主要在新生血管内皮细胞中阳性表达。CD34的阳性表达标志着新生血管的生成[21]。HBV中X基因可增强转录子活动,进而诱导VEGF等低氧反应表达因子表达[22]。因此HBV在癌细胞形成过程中可促进血管生成。
本研究结果中通过分析HBV感染组与未感染组VEGF、CD34、微血管密度水平变化,结果发现,HBV感染组与未感染组患者VEGF、CD34、微血管密度水平对比差异明显。与VEGF表达阴性组对比,VEGF表达阳性组微血管密度水平明显升高,表明HBV感染可上调肝细胞癌中VEGF高表达,促进肿瘤组织中血管形成,并促进癌细胞的侵袭转移;证实了HBV感染与VEGF、CD34、微血管密度存在相关性,有助于揭示HBV感染导致肝细胞癌发生与发展的机制;同时HBV感染肝细胞癌中VEGF表达升高也说明肝癌细胞容易发生肝内和远处转移的特性。通过分析HBV感染与临床病理特征发现,HBV感染与未感染患者在不同HBeAg表达、临床分期、包膜浸润、Edmondson分级及侵袭转移及术后复发转移率方面比较具有明显差异,进而推测肝细胞癌的恶性特征与HBV感染有关。此外,本研究中采用Kaplan-Meier生存曲线通过分析HBV感染与肝细胞癌患者生存预后的关系,结果发现,HBV未感染患者生存期明显长于HBV感染患者,由此可见HBV感染不仅可影响肝癌细胞血管生成及侵袭转移,并进一步影响肝细胞癌患者预后生存情况。
4 结论
HBV感染可能通过上凋VEGF、CD34表达,促进肿瘤血管的生存,进而促进肝细胞癌的生长、浸润和转移,缩短患者生存期,为探讨HBV感染与未感染型肝细胞癌的临床表现和转归以及探索治疗方法提供了启示和方法。
