新疆伊犁昭苏健康鸡源大肠杆菌耐药性及耐药基因分析
2023-11-22李宏博陈月月杨玉洁徐琦琦秦蕾蔡鑫夏利宁
李宏博, 陈月月, 杨玉洁, 徐琦琦, 秦蕾, 蔡鑫, 夏利宁*
(1.新疆农业大学动物医学学院,乌鲁木齐 830052; 2.霍城县职业技术学校,新疆 伊犁 835200)
大肠杆菌属于肠杆菌科的革兰氏阴性菌,主要栖息在温血动物的肠道中,是畜禽小肠内的共生菌[1]。同时,大肠杆菌也是条件致病菌,可引发多种胃肠道疾病,还可继发尿道感染、败血型感染、脑膜炎等疾病,所有家畜均有患病风险,其中以鸡和猪最为易感[2]。每年鸡场因该病造成的经济损失可达上亿元[3]。禽源大肠杆菌血清型种类十分多样,难以针对其研发有效的疫苗,因此抗菌药物仍然是防治大肠杆菌病的主要手段。目前,用于防治禽大肠杆菌病的药物种类繁多,但由于临床上不规范用药甚至私自使用禁用药物,导致大肠杆菌耐药现象日益严重。肠道中的大肠杆菌具有“蓄水池”作用,在获得耐药性的同时也可将携带的耐药基因及可移动遗传元件传递给其他病原菌,如沙门菌等[2,4],进而加剧耐药性的扩散,也使耐药谱不断扩大[5]。
尽管新疆地区关于动物源大肠杆菌耐药性的报道逐渐增多,但与我国其他省(自治区、直辖市)相比,仍处在较低水平,且关于伊犁昭苏地区鸡源大肠杆菌耐药性的研究更是鲜有报道。相比于患病动物,对健康动物耐药性进行监测更能反映畜禽携带菌株对常用抗菌药物的耐药现状。因此,本研究以新疆伊犁昭苏地区3 个不同村落健康鸡体内大肠杆菌为研究对象,比较分析不同村落鸡源大肠杆菌的耐药性和耐药基因的流行情况,为昭苏地区鸡源大肠杆菌病的防治提供参考。
1 材料与方法
1.1 材料
1.1.1培养基、试剂和药物标准品 伊红美蓝琼脂(eosin methylene blue agar, EMB)、麦康凯琼脂(McConkey agar, MAC)和MH 肉汤(muellerhinton broth,MHB)购自海博生物技术有限公司;DL 2000,2×TaqPCR Master Mix 购自天根生化有限公司;TE(Tris-EDTA)缓冲液购自生工生物有限公司;药敏试验所用抗菌药物标准品均购自上海源叶生物科技有限公司,引用由生工生物工程(上海)有限公司合成。
1.1.2试验菌株 2020年11月分别在伊犁昭苏克马克加尔村、森塔斯村、乌克勒加尔村采集鸡源肛拭子样品200、20、80份,共计300份样品,用于分离试验用大肠杆菌。 标准质控大肠杆菌(ATCC25922)由新疆农业大学动医学院药理研究室提供。
1.2 方法
1.2.1细菌分离鉴定 将灭菌棉签插入鸡肛门内约1 cm 旋转一周,放入装有1 mL MHB 灭菌的2 mL EP 管中。带回实验室后,从采集的样品中吸取5~10 µL 肉汤置于含有1 mL MHB 灭菌的2 mL EP 管中,于37 ℃恒温摇床中培养4~6 h 后,将菌液划线于MAC 平板,37 ℃过夜培养后,挑取粉红色单菌落直接划线于EMB平板,37 ℃过夜培养,将带黑色金属光泽的单个菌落初步鉴定为大肠杆菌。用枪头挑取单菌落置于含有1 mL 灭菌MHB 的2 mL EP 管中,37 ℃恒温摇床培养4~6 h,保存备用。用水煮法提取DNA 模板,使用细菌16S rDNA 通用引物进行PCR 扩增[6],扩增产物送生工生物工程(上海)有限公司测序,用BLAST 软件比对结果,同源性大于96.0%判定为大肠杆菌。
1.2.2菌株保存 在测序结果鉴定为大肠杆菌的菌株中,每1 000 µL菌液中加入500 µL 60.0%(体积分数)的灭菌甘油,制成终体积分数为20.0%的甘油菌,-20 ℃保存备用。
1.2.3耐药表型的检测 按照美国临床和实验室标准协会(Clincal and Laboratory Standards Institute,CLSI)建议的琼脂稀释法[7]对分离的大肠杆菌进行硫酸粘菌素(colistin sulfate, COL)、氨苄西林(ampicillin, AMP)、头孢唑啉(cefazolin, CFZ)、头孢噻呋(ceftiofur, TIO)、氟苯尼考(florfenicol,FFC)、恩诺沙星(enrofloxacin, ENR)、四环素(tetracycline, TET)、庆大霉素(gentamicin sulfate,GEN)、阿米卡星(amikacin, AMK)6 大类9 种抗菌药物的耐药性进行测定。试验结果以敏感(sensitivity,S)、中等(intermediary,I)和耐药(resistance,R)3种形式进行判定。
1.2.4耐药基因型的检测 进行耐药基因型的检测。包括β-内酰胺类(blaOXA、blaTEM、blaCTX-M)、酰胺醇类(floR、fexA、fexB、pexA、estDL136)、喹诺酮类(qnrD、qnrS、oqxA、oqxB)、四环素类(tet(A)、tet(B)、tet(M)、tet(K))、氨基糖苷类[acc(6´)/aph-(2´´)、aph(3´)-Ⅲ、ant(3´´)-Ⅰa、aac6´-Ⅰb、ant(4´,4´´)]、多肽类(mcr-1)共6 大类22 个基因。根据已有序列设计耐药基因引物(表1)进行PCR。
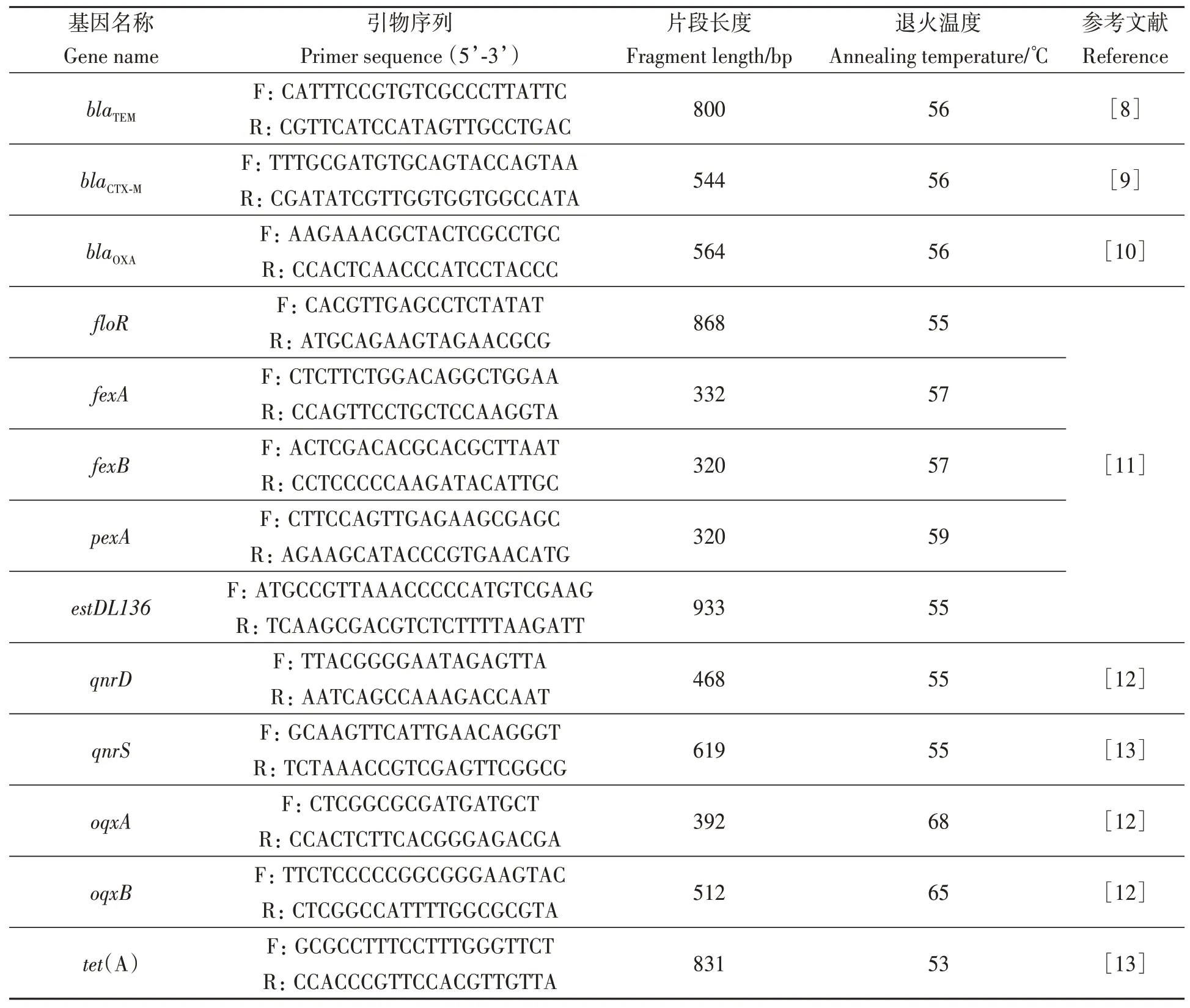
表1 引物序列及片段大小Table 1 Length of fragment and primer sequence
1.3 数据分析
使用SPSS 26.0 分析数据,单因素变量采用分割卡方检验或费舍尔精确检验。
2 结果与分析
2.1 样品分离鉴定结果
300份样品共分离出大肠杆菌289株,分离率为96.3%。克马克加尔村、森塔斯村和乌克勒加尔村分别有289、194、20 份样品分离出大肠杆菌,分离率分别为97.0%、100.0%和93.8%(表2)。

表2 伊犁昭苏县鸡源大肠杆菌的分离Table 2 Isolation of Escherichia coli from chicken in Zhaosu, Yili
2.2 大肠杆菌耐药表型结果
分离的鸡源大肠杆菌对氨苄西林、氟苯尼考和四环素的耐药率分别为36.5%、26.0% 和20.1%,均超过20.0%;对头孢唑啉、恩诺沙星、头孢噻呋、硫酸粘菌素和庆大霉素的耐药率分别为19.0%、13.5%、10.4%、6.2%和2.4%,均低于20.0%;对阿米卡星敏感。
对3 个村落鸡源大肠杆菌的耐药结果进行比较,严重程度表现为森塔斯村 > 克马克加尔村 > 乌克勒加尔村(表3)。森塔斯村鸡源大肠杆菌对氨苄西林、头孢唑啉、恩诺沙星、和硫酸粘菌素的耐药率分别为40.0%、35.0%、40.0%、30.0%,极显著高于其他村(P< 0.01);对头孢噻呋、氟苯尼考、庆大霉素的耐药率分别为20.0%、45.0%、10.0%,显著高于其他村(P< 0.05)。克马克加尔村鸡源大肠杆菌对四环素的耐药率极显著高于其他村(P< 0.01);对氨苄西林、头孢唑啉、头孢噻呋、氟苯尼考、恩诺沙星、庆大霉素、硫酸粘菌素的耐药率分别为37.6%、21.6%、11.3%、27.8%、14.9%、1.7%、6.2%,均高于乌克勒加尔村。乌克勒加尔村鸡源大肠杆菌对被检抗菌药物的耐药率均低于15.0%,且未检出对庆大霉素和硫酸粘菌素具有耐药性的菌株。
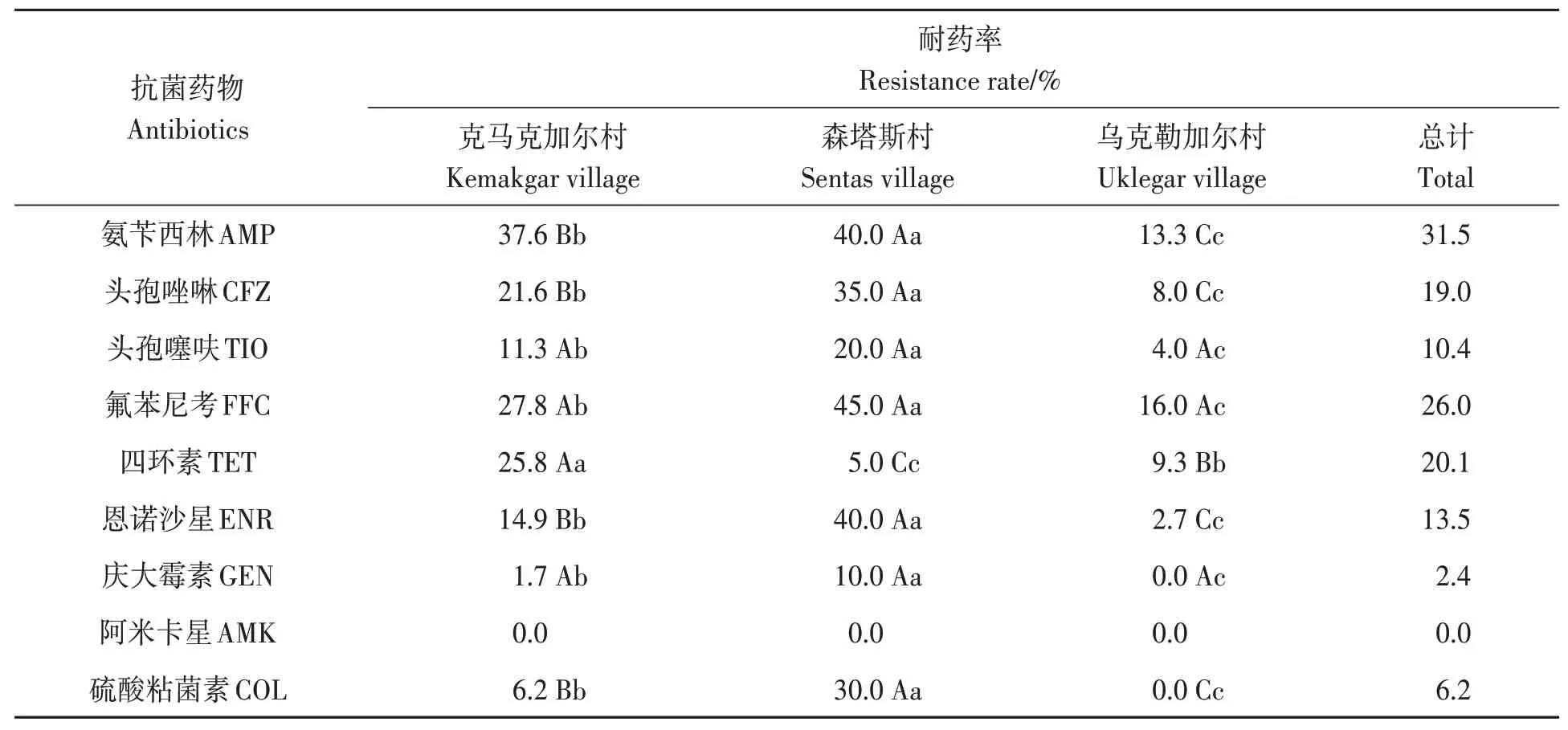
表3 大肠杆菌对10种抗菌药物的耐药率Table 3 Resistant rate of Escherichia coli on ten kinds of antimicrobial agents
2.3 大肠杆菌多药耐药结果
289株鸡源大肠杆菌的耐药率为54.0%,分布于1~7 耐之间,其中以1 耐为主,占39.1%;多药(3 种及3 种以上药物)耐药率为34.0%,耐药结果详见表4。克马克加尔村和乌克勒加尔村鸡源大肠杆菌以1 耐为主,分别占42.6%和45.0%;森塔斯村鸡源大肠杆菌以2耐为主,占35.7%。
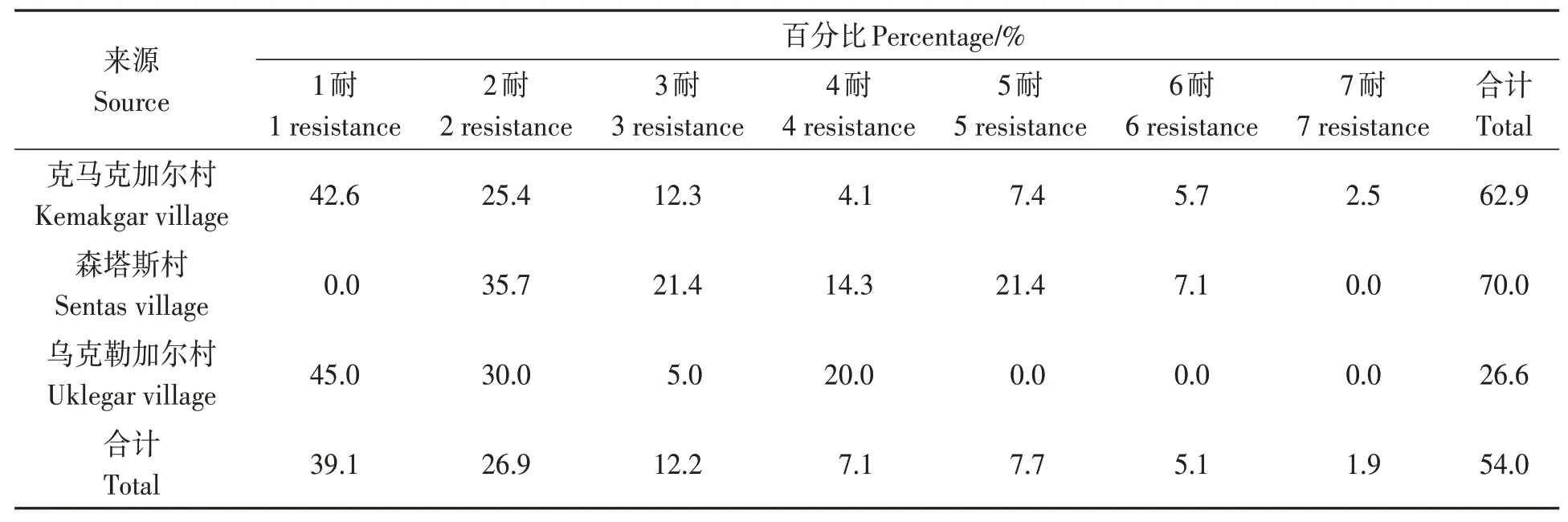
表4 大肠杆菌的耐药谱型Table 4 Multidrug resistant condition of Escherichia coli
3 个村落鸡源大肠杆菌共存在47 种耐药谱型,以AMP 为主。其中克马克加尔村鸡源大肠杆菌有32 种耐药谱型,同样以AMP 为主,占14.8%;森塔斯村鸡源大肠杆菌有12 种耐药谱型,以ENR-COL、AMP-CFZ-FFC 和AMP-CFZ-FFC-TIOGEN 为主,各占14.3%;乌克勒加尔村鸡源大肠杆菌有13种耐药谱型,以FFC为主,占25.0%。
2.4 大肠杆菌耐药基因型结果
289株鸡源大肠杆菌中共检出9 种耐药基因,基因检出率在0.3%~25.6%之间(表5)。其中,blaTEM基因在克马克加尔村和森塔斯村鸡源大肠杆菌的检出率分别为22.7%和20.0%,极显著高于乌克勒加尔村(P< 0.01);oqxA、oqxB、tet(M)、ant(3″)-Ⅰa、mcr-1、blaCTX-M、floR和tet(A)在3 个村的基因检出率差异不显著(P> 0.05)。
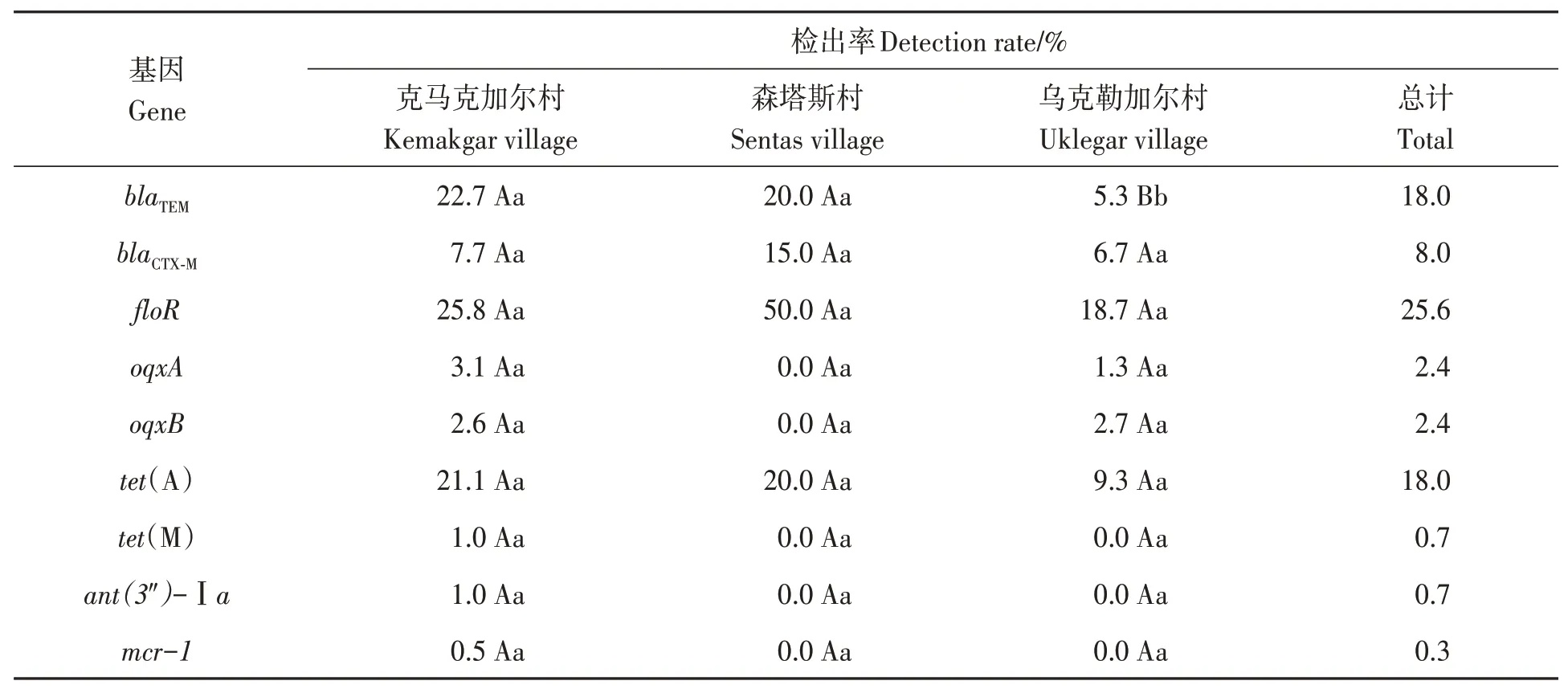
表5 大肠杆菌耐药基因的检出率Table 5 Detection rate of drug resistance genes in Escherichia coli
2.5 大肠杆菌耐药表型与耐药基因型结果比较
耐药基因检出率和大肠杆菌耐药率进行比较,结果(表6)表明,耐药率整体高于耐药基因的检出率。对β-内酰胺类药物的耐药率为36.0%,相应基因的检出率为9.3%;对喹诺酮类药物的耐药率为13.8%,相应基因的检出率为2.8%;对氨基糖苷类药物的耐药率为2.4%,相应基因的检出率为0.7%;对多肽类药物的耐药率为6.2%,相应基因的检出率为0.3%;对四环素类药物的耐药率为20.1%,相应基因的检出率为18.7%;对酰胺醇类药物的耐药率为26.0%,相应基因的检出率为25.6%。
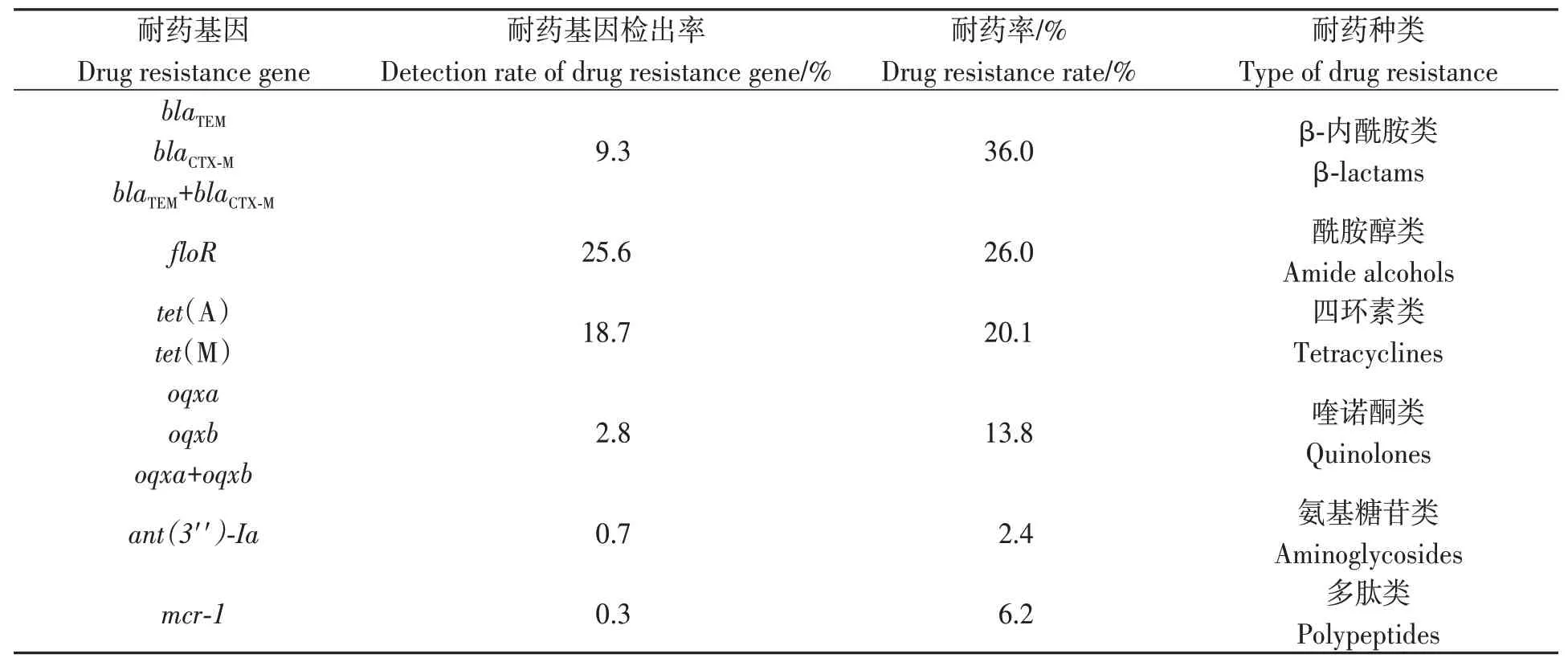
表6 耐药基因检出率与耐药表型结果对比Table 6 Comparison of detection rate of drug resistance gene and drug resistance phenotype
3 讨论
抗菌素耐药性已成为全球范围内的重大问题。世界各地的公共医疗保健系统都面临着巨大的挑战。如今最大的威胁来自肠杆菌科成员,尤其是大肠杆菌[19]。由于养殖人员缺乏相应的用药知识,过度追求经济效益,健康动物往往也会大量使用抗菌药物来预防疾病的发生。这无疑提升动物体内大肠杆菌的耐药性。而这些大肠杆菌的耐药性很可能通过层层递进最后传递给人类。作为耐药基因的重要储存库,大肠杆菌的耐药基因也会传递给其他致病菌[2],从而加大了临床治疗的难度。
本研究中大肠杆菌的分离率为96.3%,略低于唐标等[20]报道的浙江省金华市和台州市畜禽养殖场肛拭子大肠杆菌的分离率(100.0%);高于张海龙[21]报道的河北省部分地区鸡源大肠杆菌的分离率(80.4%)和Alhababi 等[22]报道的食用动物中共生大肠杆菌的分离率(88.7%)。3 个村落鸡源大肠杆菌的总耐药率为54.0%,这与徐小艳等[23]报道的1975—2002 年江苏部分地区大肠杆菌耐药率变化中2002 年的耐药率一致(53.5%);但低于高玉斌等[24]报道的新疆部分地区鸡源大肠杆菌的耐药率(超过90.0%),也低于林居纯等[25]报道的江西、广东、四川、河南、北京、广西、贵州禽源大肠杆菌的耐药率(95.1%)。本研究中鸡源大肠杆菌的耐药率略低于其他地区,这可能是由于本研究所采集的样本来自散养户,养殖规模较小,且仅有73 只鸡少量使用庆大霉素,其他养殖户均没有使用任何抗菌药物,因此,耐药率较低。随着耐药性日益严重,对动物源耐药性的监测也逐渐加强,陈伟[26]对安徽省巢湖流域不同动物源大肠杆菌进行了20 种抗菌药物的耐药表型检测,鸡源大肠杆菌对氨苄西林的耐药率高达91.7%,高于本研究。陈月月等[27]对2016 年新疆伊犁地区霍城县鸡源大肠杆菌的耐药性调查发现,鸡源大肠杆菌对氨苄西林、氟苯尼考和恩诺沙星的耐药率分别为74.4%、71.1%和65.9%,也高于本研究。由此表明,我国鸡源大肠杆菌对临床常用抗菌药物具有较高的耐药率,应加强抗菌药物的规范使用,降低耐药菌的出现和传播。此外,本研究中的鸡源大肠杆菌对阿米卡星具有较好的敏感性,未发现耐药菌株,这与于桂阳等[28]报道的湖南永州市鸡大肠杆菌对阿米卡星的耐药率(5.5%)相近,因此,阿米卡星可作为治疗细菌性疾病的备选药物。
尽管3 个村落鸡源大肠杆菌的耐药率不高,但是耐药谱型十分丰富,多达47 种。克马克加尔村鸡源大肠杆菌的耐药谱型最多,可能与该村散户的养殖模式有关,由于缺乏统一的管理,各养殖户用药差异较大。森塔斯村和乌克勒加尔村以养殖小区的模式进行养殖,各散户在统一的地点集体养殖,统一用药,因此耐药谱型较少;而且同为养殖小区模式,乌克勒加尔村相比于森塔斯村用药更少,更加规范。森塔斯村的用药比例最大,所以其对被检抗菌药物的耐药率最高。由此表明,抗菌药物使用越多,产生的相应耐药菌越多[29]。
耐药基因检测结果显示,3 个村落鸡源大肠杆菌总体携带的耐药基因较少,但涵盖了被检的6 大类抗菌药物。不同耐药基因在3 个村落中的检出率各不相同。其中,blaTEM和blaCTX-M基因可以介导细菌对多种β-内酰胺类药物产生耐药性,尽管blaTEM和blaCTX-M基因在本研究中的检出率低于王彬婷[30]报道的安徽鸡源大肠杆菌中上述2 个基因的携带率(36.1%和19.8%),但是森塔斯村鸡源大肠杆菌blaCTX-M基因的检出率却与其接近,说明森塔斯村需要减少β-内酰胺类药物的使用,降低健康鸡源大肠杆菌中相关耐药基因的检出率。药敏试验表明共有75 株大肠杆菌对氟苯尼考耐药,基因检测结果显示有74 株大肠杆菌携带floR基因,这是由于floR基因是氟苯尼考的特异性耐药基因之一[31],因此在对氟苯尼考耐药的菌株中该基因的检出率极高。tet(A)基因的检出率为18.0%,tet(M)基因的携带率为0.7%,与张雅为等[32]报道的阜新鸡场大肠杆菌四环素类耐药基因的检出率存在差异(0.0%和13.9%)。这说明不同地区耐药表型相同的同种细菌所携带的耐药基因也可能存在差异。tet(A)基因主要定位在转座子及接合性质粒上,具备水平转移的能力[33],克马克加尔村和乌克勒加尔村对四环素耐药的菌株中该基因的检出率较高,表明该基因在这两个村落存在水平传播的可能,应加强对鸡进行分笼饲养,并减少四环素类药物的使用。本研究中只检出2 株携带ant(3´´)-Ⅰa基因的菌株,未检出acc(6´)/aph-(2´´)、aph(3´)-Ⅲ、aac6´-Ⅰb、ant(4´,4´´)基因。3 个村落氨基糖苷类耐药基因的检出率较低,这可能因为该类药物有肾、耳毒性[34],故临床应用具有一定限制。根据对养殖户的走访调查,3 个村落均较少使用喹诺酮类药物,可能是这3 个村落鸡源大肠杆菌中oqxA和oqxB基因的携带率较低的原因。克马克加尔村发现了1 株携带mcr-1基因的大肠杆菌,虽然只有1 株,但仍应引起重视。mcr-1基因主要介导细菌对多粘菌素产生耐药性,该药物被认为是针对多重耐药革兰氏阴性菌感染的“最后一道防线”[35],一旦病原菌对其产生耐药性,人类将面临无药可医的窘境。不仅如此,携带mcr-1基因的质粒还可同时携带ESBLs、PMQR等其他耐药基因,可引起多耐药基因共转移[36]。大肠杆菌是最易携带mcr-1基因的细菌[37],应持续对该基因携带情况进行监测。
