miR-449c通过抑制c-Myc的表达抑制肺腺癌细胞周期进程
2023-11-21朱佳浩曹海霞
娄 芮,朱佳浩,茆 勇,曹海霞
1江南大学附属医院肿瘤内科,江苏 无锡 214000;2江苏省肿瘤医院(南京医科大学附属肿瘤医院)临床肿瘤实验中心,江苏省肿瘤防治研究所,江苏 南京 210009
肺癌是全球最常见、死亡率最高的恶性肿瘤[1-4]。肺腺癌是肺癌中最常见的一个组织学亚型,约占所有肺癌的40%[2,5-6]。尽管目前有手术、化疗、放疗、靶向治疗、免疫治疗等多种治疗手段,但仍有多数肺腺癌患者因治疗后出现肿瘤进展而死亡[7-11]。因此,阐明肺腺癌发生发展的分子机制和确定新的治疗靶点非常重要。
microRNA(miRNA)是一类长度为17~24 nt 的短链、非编码RNA,通过与mRNA 内的互补序列结合,在转录过程后调节基因的表达[12-13]。miRNA 可以调节多种正常生理过程以及调控恶性肿瘤的发生发展[14-15]。大量研究证明miRNA 在肺癌中发挥着重要作用,如miR-205 能够下调COMMD1 基因促进肺腺癌生长[16],miR-218通过调节Slug/ZEB2 信号通路促进肺腺癌转移[17],miR-483-3p通过靶向整合素β3 促进表皮生长因子受体突变的非小细胞肺癌产生获得性吉非替尼耐药[18],但关于miR-449c在肺腺癌中的报道仍然有限。本研究通过生物信息学分析揭示了miR-449c在肺腺癌中的作用,并探索了miR-449c对肺腺癌细胞株生长、细胞周期和凋亡以及相关基因表达的调控,旨在探讨miR-449c对肺腺癌发生发展的影响,并初步分析其可能机制。
1 材料和方法
1.1 材料
1.1.1 组织标本和细胞系
11 对肺腺癌组织(均经病理学确诊)及癌旁组织(距肺癌组织5 cm 以外的肺组织)取自南京医科大学附属肿瘤医院,于2011年1月10日—12月15日在手术时采集。本研究得到了南京医科大学伦理委员会的批准[南医大伦审(2018)067 号],所有患者均在手术前签署知情同意书,同意病理标本供实验研究使用。肺腺癌细胞PC9、A549、HCC827、H1650 和H358 购自中国科学院上海生命科学研究所细胞资源中心。
1.1.2 主要试剂
miR-449c 和U6 引物、miR-449c 模拟物(miR-449c-mimic)及其阴性对照(miR-NC)(广州市锐博生物科技有限公司),c-Myc、CDK6、MET 和β-actin引物(Life Technologies 公司,美国),c-Myc 过表达质粒(pENTER-c-Myc)及其阴性对照(pENTER)(Vigene Biosciences 公司,美国);转染试剂Lipofectamine 3000及提取细胞RNA的TRIzol试剂(Invitrogen 公司,美国),Prime-Script RT 试剂(TaKaRa 公司,日本),SYBR Select Master Mix 试剂、NuPAGE 10% Bis-Tris 凝胶(Life Technologies 公司,美国);CCK-8 试剂盒、RIPA 缓冲液、BCA 蛋白质测定试剂盒、ECL Plus试剂盒(上海碧云天生物技术公司);兔c-Myc 多克隆抗体、兔CDK6 多克隆抗体、兔MET 多克隆抗体、兔Cyclin D1 多克隆抗体、兔Cyclin D2 多克隆抗体、兔Cyclin E2多克隆抗体、羊抗兔IgG-HRP二抗(Cell Signaling Technology公司,美国),兔β-actin多克隆抗体(Bioworld 公司,美国);FITC Annexin V凋亡检测试剂盒(BD公司,美国)。
1.2 方法
1.2.1 差异表达基因筛选
利用The Cancer Genome Atlas(TCGA)数据库获得520个肺腺癌组织和46 个癌旁组织的miRNA 表达数据和相应的临床信息,分析时剔除存在缺失数据的病例。本研究将半年内复发患者定义为高复发风险组[无病生存期(disease free survival,DFS)≤6 个月],5年内无复发的患者定义为低复发风险组(DFS>60个月),利用R软件的Limma包筛选出两组差异表达的miRNA(differentially expressed miRNA,DEM),筛选标准为P<0.05且|log2FC|>1[19]。
1.2.2 miR-449c 与临床病理特征的相关性分析及生存分析
利用R 软件分析11 例肺腺癌患者miR-449c 表达与肿瘤分期、淋巴结状态等临床病理数据的关系,并进一步利用R 软件survival 程序包分析miR-449c 对DFS 和疾病特异性生存期(disease specific survival,DSS)的影响[20]。
1.2.3 体细胞突变分析及富集分析
通过Maftools R/Bioconductor 软件从MAF 文件中提取miR-449c 低表达患者详细的突变信息并进行分析[21]。利用GSEA 软件和edgeR 包进行单基因富集分析,筛选显著富集的信号通路,P<0.05为筛选标准。利用TargetScan(http://www.targetscan.org)、miRanda(http://www.microrna.org)和 mirTarBase(http://mirtarbase.mbc.nctu.edu.tw)网站预测miR-449c的靶基因。进行KEGG和GO通路分析和功能注释,评估识别候选靶基因中重要的信号转导通路和富集通路,P<0.05为筛选标准。
1.2.4 细胞培养及转染
将细胞置于37 ℃、5%CO2的培养箱中用含有10%胎牛血清的RPMI 1640培养基培养,每隔3~4 d传代。取对数生长期细胞接种于6 孔板,24 h 后根据Lipofectamine 3000 说明书的步骤,将miR-449cmimic及miR-NC和/或pENTER-c-Myc及pENTER转染肺腺癌细胞。
1.2.5 RT-PCR实验
根据说明书,使用TRIzol 试剂从细胞中提取总RNA,使用Prime-Script RT 试剂进行逆转录反应。实时荧光定量PCR 使用SYBR Select Master Mix 在7300 Real-Time PCR 系统上进行。引物序列见表1。以2-ΔCt计算组织标本和细胞中miR-449c 相对表达量,以2-ΔΔCt计算转染后细胞中基因相对表达水平。

表1 用于RT-PCR的引物序列Table 1 Primers used for RT-PCR
1.2.6 CCK-8实验
取对数生长期细胞以5 000 个/孔接种于96 孔板中,24 h 后转染,每组设6 个平行孔,分别在转染后1、2、3 d 加入CCK-8 试剂孵育1 h,用酶标仪测定450 nm处吸光度。
1.2.7 流式细胞术分析细胞周期
细胞转染3 d 后,收集细胞,1 000 r/min 离心5 min,PBS 清洗细胞2 次,在-20 ℃下置于70%乙醇中固定。固定后,PBS 洗涤2次,加入含有RNase A的50 mg/mL PI 染色溶液,室温下避光孵育30 min。FACScan流式细胞仪分析细胞周期。
1.2.8 流式细胞术检测细胞凋亡
细胞转染3 d 后,收集细胞,1 000 r/min 离心5 min;PBS洗涤2次,Binding Buffer重悬细胞,分别加入FITC-Annexin V 和PI 各5 μL,避光孵育20 min。用Binding Buffer 补足体积至500 μL,FACScan 流式细胞仪检测细胞凋亡率。
1.2.9 Western blot分析
转染3 d后细胞用预冷PBS清洗2次,加入预冷RIPA缓冲液裂解,收集裂解液,于4 ℃、14 000g离心15 min,取上清液用BCA 蛋白质测定试剂盒测定蛋白质浓度。蛋白变性后在NuPAGE 10%Bis-Tris 凝胶上电泳,电泳完毕后用300 mA湿转2 h,待蛋白转移到PVDF 膜上后,用5%脱脂奶粉溶液封闭1 h。加入一抗在4 ℃下孵育过夜,TBST清洗后常温孵育二抗1 h。TBST清洗后ECL化学发光法显影后经化学发光成像系统曝光检测目的条带。
1.3 统计学方法
使用GraphPad Prism 第8 版进行统计分析。计量资料采用均数±标准差()表示。Student’st-检验或Wilcoxon 秩和检验评估组间差异。所有实验均重复3次,P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌患者miR-449c 表达与临床病理学特征和预后的关系
共有25个显著差异表达的miRNA,其中肺腺癌高复发风险组中有18 个miRNA 下调(包括miR-449c),7 个miRNA 上调(图1A)。miR-449c 的表达与肿瘤分期(Ⅲ/Ⅳ期与Ⅰ/Ⅱ期比较,P=0.006,图1B)和淋巴结状态(阳性与阴性比较,P=0.03,图1C)相关,肿瘤分期高的患者miR-449c 表达低,淋巴结阳性患者miR-449c 表达低。生存分析显示,miR-449 与肺腺癌患者的DFS 和DSS 相关(P=0.012 和P=0.011,图1D、E),低表达提示预后不良。
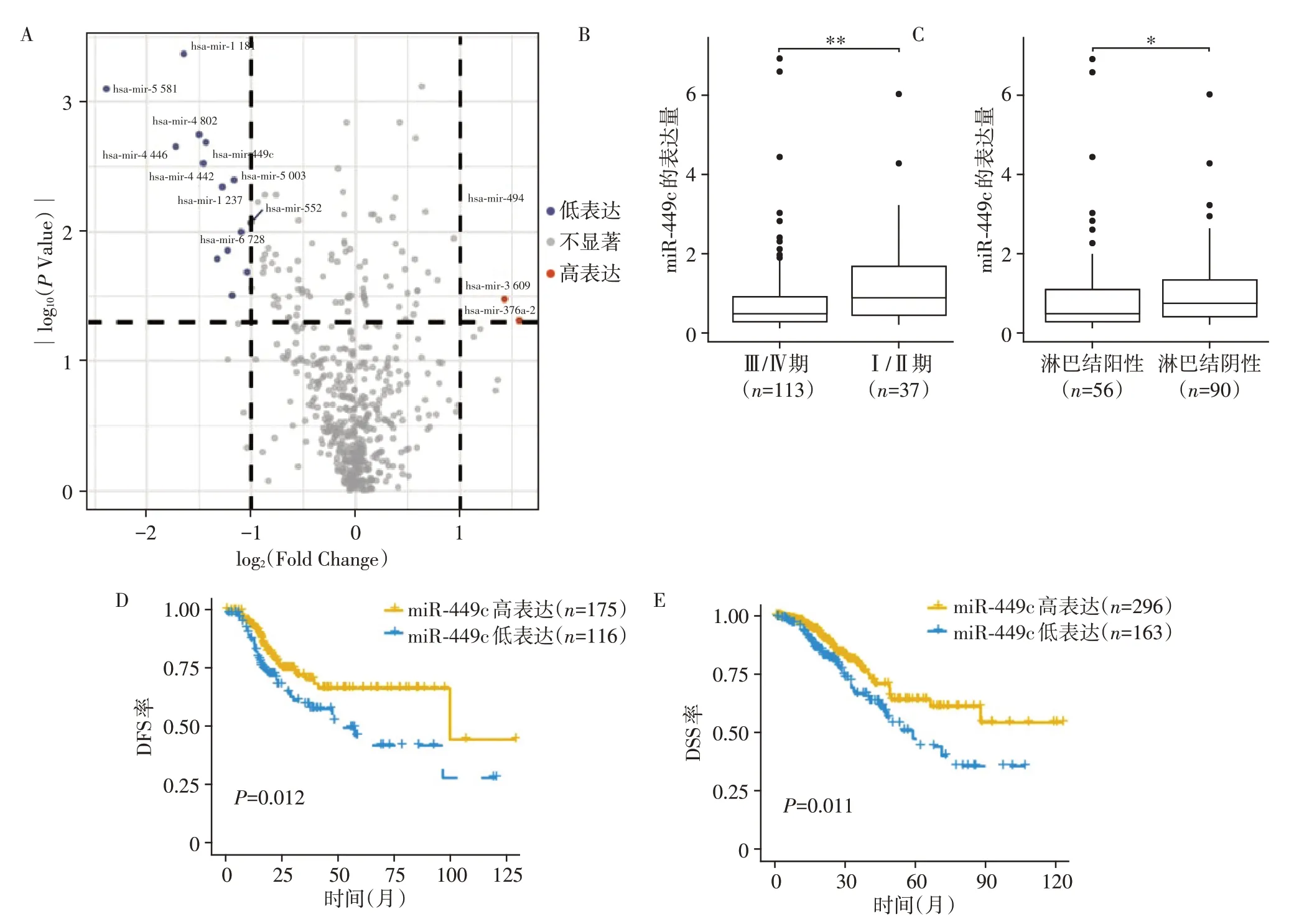
图1 miR-449c的表达水平、miR-449c与临床病理特征的相关性和生存分析Figure 1 The expression of miR-449c,correlation between miR-449c and clinicopathological features,and survival analysis
2.2 突变和富集分析
在miR-449c 低表达肺腺癌病例的外显子组中分析了多种体细胞突变。引起复发和转移高风险的前10 个突变基因是:TP53(39%)、TTN(36%)、MUC16(34%)、CSMD3(33%)、RYR2(30%)、ZFHX4(29%)、LRP1B(26%)、USH2A(26%)、SPTA1(23%)和XIRP2(23%)(图2A)。
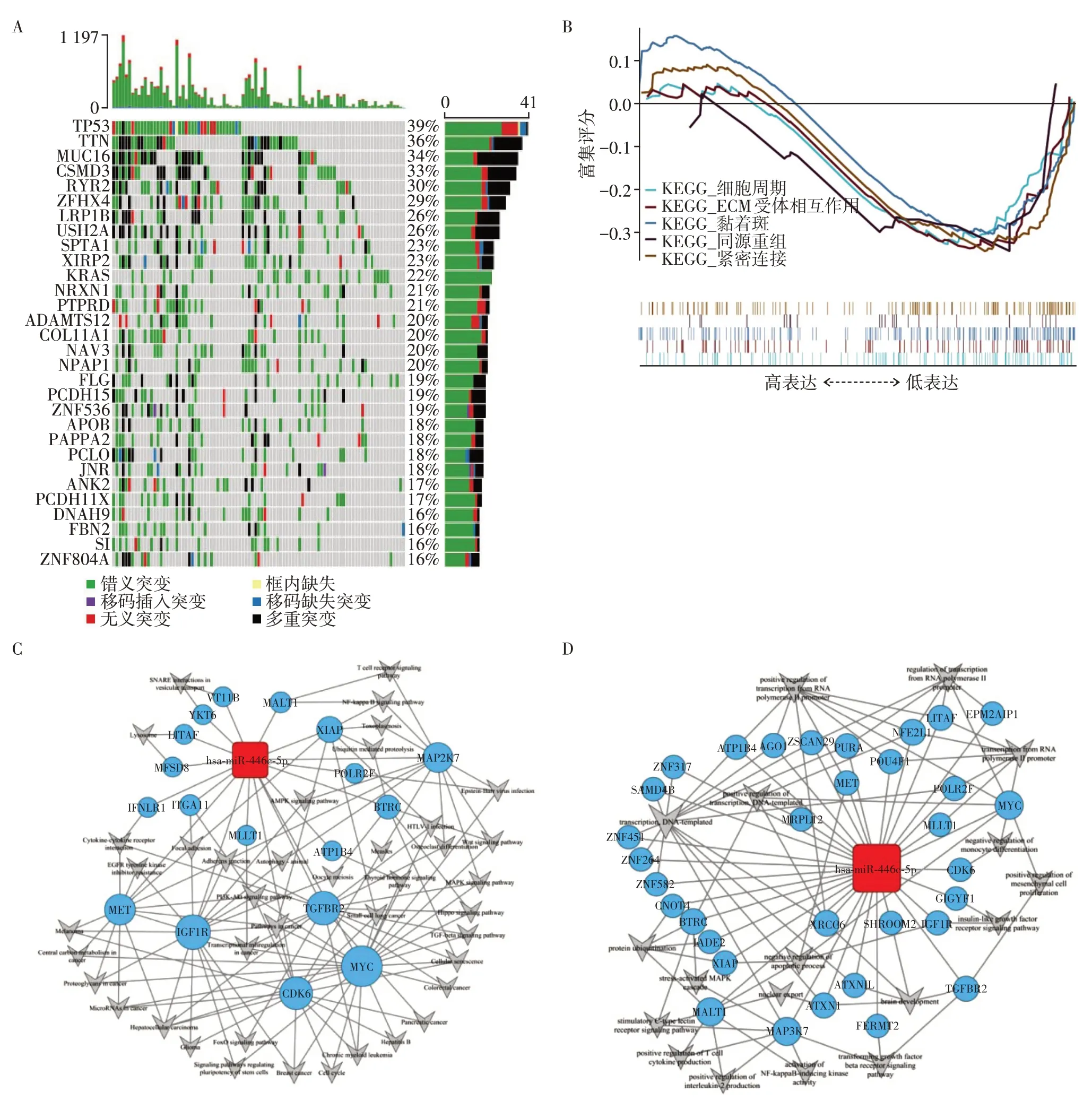
图2 突变和富集分析Figure 2 Mutates and enrichment analysis
显著富集的信号通路(图2B),包括细胞周期、ECM 受体相互作用、黏着斑、同源重组、紧密连接。miR-449c 的靶基因预测及通路(图2C)和功能分析结果(图2D)表明肺腺癌中miR-449c可能通过靶向c-Myc 和CDK6 参与调控细胞周期,靶向MET 基因参与细胞凋亡。
2.3 miR-449c在肺腺癌组织和细胞中低表达
通过RT-PCR检测了11对肺腺癌组织和癌旁组织中miR-449c 的表达,发现肺腺癌组织中的miR-449c 水平显著低于癌旁组织(图3A)。与该结果一致,miR-449c 在肺腺癌细胞系PC9、A549、HCC827、H1650 和H358 中的表达均较低(图3B)。选取表达较低的PC9、A549 和HCC827 细胞株进行下一步研究。
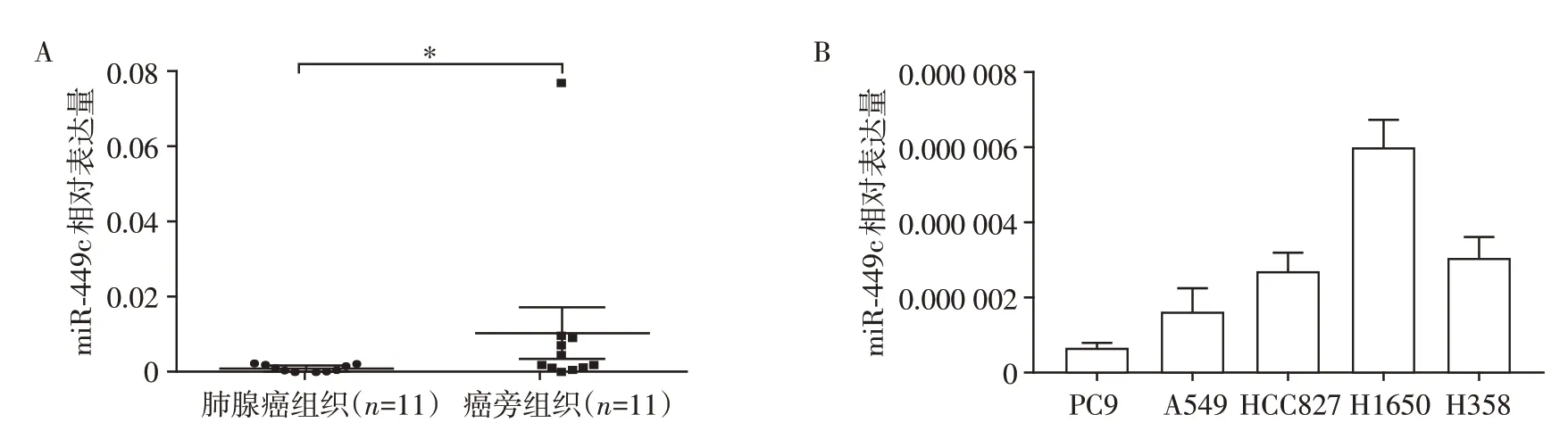
图3 miR-449c在肺腺癌组织和细胞中的表达水平Figure 3 Expression of miR-449c in lung adenocarcinoma tissues and cells
2.4 miR-449c上调导致肺腺癌细胞周期阻滞
将miR-449c-mimic 和miR-NC 分别转染PC9、A549 和HCC827 细胞后,RT-PCR 结果均显示miR-449c-mimic 组细胞miR-449c 表达量显著高于miRNC 组(P均<0.001),说明miR-449c 均成功过表达(图4A~C)。CCK-8实验结果表明miR-449c过表达显著抑制了PC9、A549 和HCC827 细胞增殖(图4D~F)。
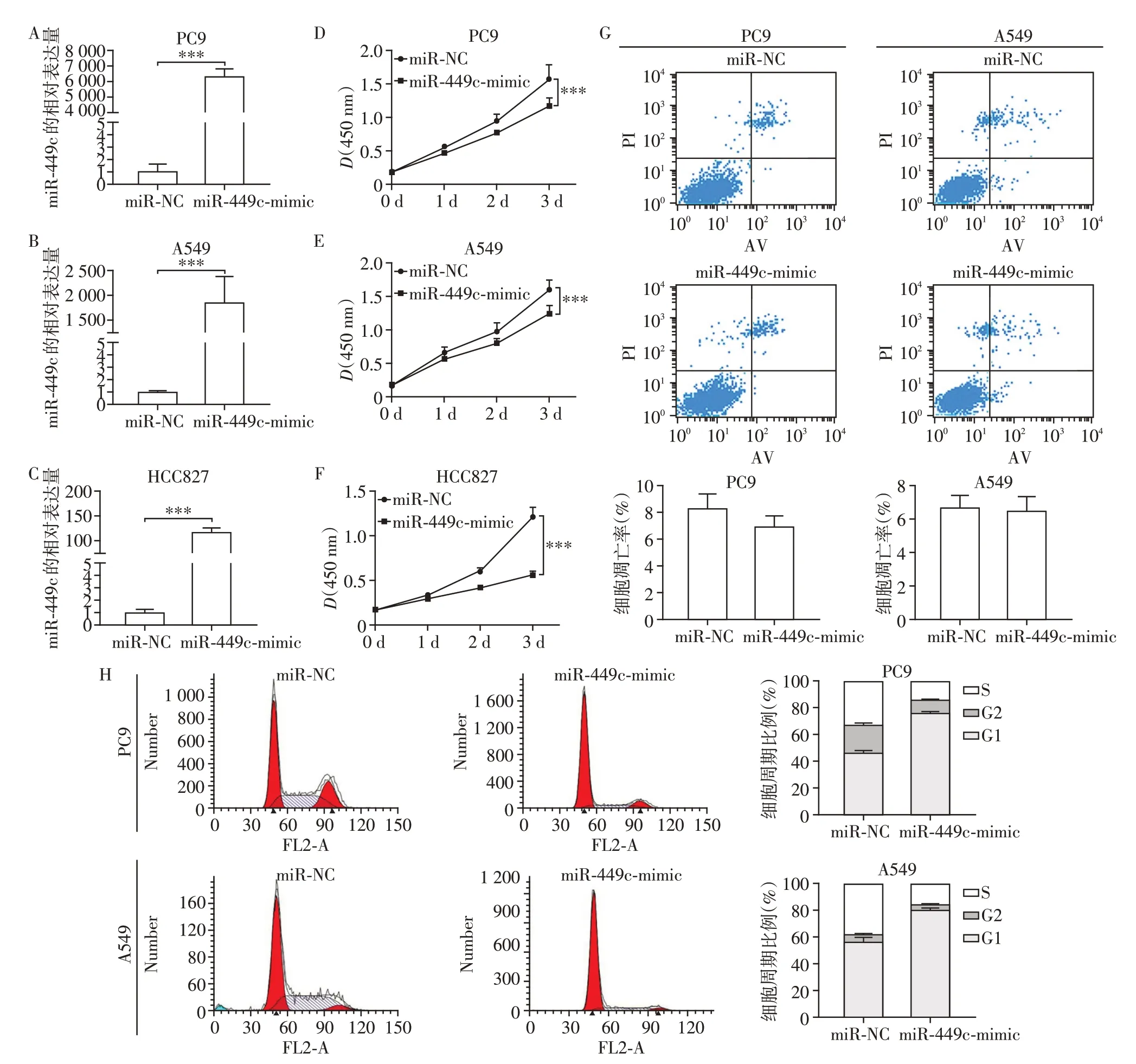
图4 miR-449c对肺腺癌细胞凋亡和周期的影响Figure 4 The effects of miR-449c on apoptosis and cell cycle of lung adenocarcinoma cells
进一步取PC9 和A549 细胞系进行流式细胞术分析,结果显示两株细胞中,miR-449c-mimic组与对照miR-NC 组间细胞凋亡率均未见显著差异(图4G);而细胞周期结果显示两株细胞中miR-449cmimic组G1期细胞均显著增加,S期细胞均显著减少(图4H),说明miR-449c 过表达后PC9和A549细胞被阻滞于G1期。
2.5 miR-449c可以调节肺腺癌细胞中c-Myc、CDK6和MET基因的表达
为了验证在肺腺癌细胞中miR-449c 是否在c-Myc、CDK6和MET信号转导通路中发挥着相应的作用,首先检测了miR-449c过表达后c-Myc、CDK6和MET mRNA水平的变化。结果显示,与对照miR-NC组相比,miR-449c过表达后A549和PC9细胞中c-Myc和MET mRNA 表达显著降低(图5A、B),但CDK6 mRNA表达显著升高(图5C),差异均有统计学意义。

图5 miR-449c调控c-Myc、CDK6和MET基因并影响周期蛋白表达Figure 5 miR-449c regulates c-Myc,CDK6 and MET and affects cyclin expression
进一步Western blot 检测蛋白表达,结果显示miR-449c 过表达后,PC9 和A549 细胞中c-Myc 及其下游细胞周期调节因子Cyclin D1、Cyclin D2 和Cyclin E2 蛋白表达均显著降低;miR-449c过表达后MET蛋白表达在两株细胞中结果并不一致;在PC9细胞中,miR-449c过表达后CDK6蛋白表达显著增加,但A549细胞中CDK6蛋白表达量均较低(图5D),因此选择c-Myc进行下一步研究。
2.6 共转染对肺腺癌细胞周期蛋白的影响
将c-Myc 质粒和miR-449c-mimic 共转染到PC9细胞中,RT-PCR 结果显示转染miR-449c-mimic 后上调c-Myc 降低了miR-449c 的过表达水平(图6A)。Western blot 结果(图6B)显示与转染miR-NC和pENTER 的对照组相比,c-Myc 单基因过表达后,Cyclin D1、Cyclin D2 和Cyclin E2 的表达显著上调,共转染miR-449c-mimic后逆转了c-Myc 引起的细胞周期蛋白表达量的上调;然而与共转染miR-449cmimic和pENTER的细胞相比,转染miR-449c-mimic和pENTER-c-Myc的细胞中仅Cyclin E2的表达显著升高,说明c-Myc 过表达逆转了miR-449c 过表达引起的Cyclin E2的下调。
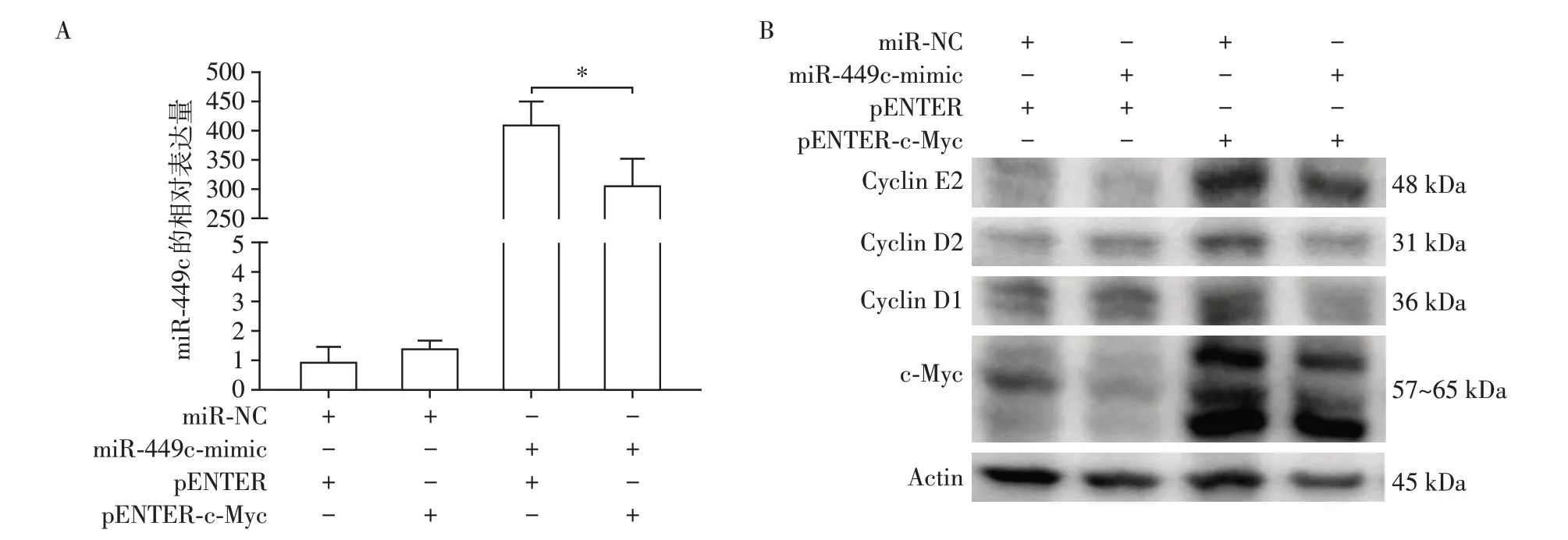
图6 miR-449c和c-Myc共转染结果Figure 6 Results of co-transfection of miR-449c and c-Myc
3 讨论
miRNA 在不同类型肿瘤中受到多系统调控,miRNA失调不可避免地会改变细胞中的mRNA谱,进一步通过反馈回路影响miRNA的表达和功能,最终影响其靶标mRNA的基因表达调控网络[15,22]。
本研究通过生物信息学分析发现高复发风险肺腺癌患者的miR-449c 表达水平显著低于低复发风险患者,miR-449c在临床分期晚期和淋巴结阳性患者中表达水平较低,并且低表达提示患者预后不良。既往研究表明,miR-449c 能通过靶向抑制SOX4基因抑制肝癌细胞的增殖和迁移,诱导细胞凋亡,并减少肿瘤生长,然而这种靶向作用较弱[12]。在胃癌中,miR-449c 可以通过靶向抑制PFKFB3 基因抑制胃癌细胞的侵袭和迁移[23]。与正常肺组织相比,非小细胞肺癌组织中的miR-449c 显著下调,其过表达后非小细胞肺癌细胞增殖和侵袭能力下降并抑制了肿瘤的生长[24]。因此,miR-449c表达水平可能与肺腺癌的进展以及侵袭转移相关,这仍需后续临床研究证实。
本研究分析了11 对肺腺癌及癌旁组织中miR-449c 的表达,结果显示相对于癌旁组织,miR-449c在肺腺癌组织中的表达显著下调;肺腺癌细胞过表达miR-449c后细胞增殖活性显著低于对照组,这与非小细胞肺癌中研究结果一致[24]。通路和功能分析表明miR-449c与细胞周期进程显著相关,细胞学结果同样显示miR-449c 过表达后细胞被阻滞于G1期,细胞周期蛋白(Cyclin D1、Cyclin D2 和Cyclin E2)显著下调,说明miR-449c 过表达通过调控细胞周期而不是细胞凋亡来抑制肺腺癌细胞增殖。
以往研究已证实c-Myc表达水平与细胞周期密切相关,c-Myc 的下调或失活会导致细胞周期进程阻滞[25-26]。MET基因也在细胞增殖和干细胞调控中起着重要作用[27-28]。靶基因预测及通路和功能分析显示肺腺癌中miR-449c可能通过靶向c-Myc参与调控细胞周期,靶向MET基因参与细胞凋亡。实验结果显示在两株肺腺癌细胞中,过表达miR-449c对细胞凋亡并无显著影响,对MET基因的调控作用也并不一致,但均显著抑制了c-Myc 表达,而c-Myc 过表达逆转了miR-449c 过表达引起的Cyclin E2 的下调。进一步发现c-Myc基因能通过反作用抑制miR-449c 的表达,miR-449c 过表达也能逆转c-Myc 引起的细胞周期蛋白的上调。说明miR-449c通过c-Myc抑制肺腺癌细胞周期从而影响细胞增殖。这与骨肉瘤中的研究结果一致,在体外骨肉瘤细胞中研究发现DNA 甲基化介导miR-449c 下调,miR-449c 通过直接靶向c-Myc抑制骨肉瘤细胞周期从而影响细胞增殖和集落形成能力[29]。然而与Miao 等[24]的研究结果并不一致,该研究结果显示,过表达miR-449c后通过直接靶向c-Myc促进非小细胞肺癌细胞NCI-H23和NCI-H838凋亡,该研究未进行细胞周期实验以及细胞周期或凋亡相关蛋白验证,也可能与细胞株不同相关,因此结果仍需进一步验证。
CDK6 是另一种与细胞周期相关的癌基因,根据靶基因预测结果,它同样可能在miR-449c抑制肺腺癌细胞的生长过程中发挥潜在作用。以往多项研究证实,CDK6能够加快细胞周期进程,促进肿瘤的发生发展[30]。实验结果表明,与对照组相比,miR-449c 过表达后A549 和PC9 细胞中CDK6 mRNA 水平均显著升高,但两株细胞中尤其在A549 细胞中CDK6 蛋白表达量均较低。据此推测CDK6 可能并不是miR-449c参与调控肺腺癌细胞周期、抑制细胞增殖的主要分子。
综上所述,miR-449c低表达的肺腺癌患者预后较差,miR-449c 过表达通过下调c-Myc 调控细胞周期而不是细胞凋亡来抑制肺腺癌细胞增殖,提示miR-449c与肺腺癌的发生发展以及预后显著相关,并可能成为肺腺癌潜在的治疗靶标之一。
