CT 增强动脉晚期扫描联合AFP、CEA、CA125 检测对原发性肝癌介入术后残癌的评估价值
2023-11-21管修远龙成琴
刘 永,管修远,龙成琴
(廉江市人民医院放射科 广东 湛江 524400)
现阶段,肝动脉化疗栓塞术是原发性肝癌非切除手术治疗的首选,将混化疗药物通过栓塞剂的方式置入病变组织附近的供血动脉中,保证药物直接进入病灶组织内,致使癌变细胞缺血、缺氧,促进癌变细胞凋亡,达到抑制癌症生长的作用[1-2]。但单次肝动脉化疗栓塞术很难彻底使肿瘤完全凋亡,且部分病变体积较大,在术后病灶周边常伴有残余癌细胞,进一步增加术后复发风险,需要及早对残癌予以诊断,预防术后残癌发生[3]。其中数字减影血管造影(digital subtraction angiography,DSA)是诊断残癌的金标准,但DSA 检测是侵入性方式,会对患者造成创伤且操作复杂[4]。CT 增强动脉晚期扫描是在CT 检测过程中在注射造影剂后延迟进行扫描,能够对患者病灶位置予以更有效检测,而甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)均属于评估原发性肝癌的最常用的标志物[5]。因此,本文将针对CT 增强动脉晚期扫描联合AFP、CEA、CA125 检测对原发性肝癌介入术后残癌的评估价值展开分析。
1 资料与方法
1.1 一般资料
选取2018 年4 月—2022 年4 月期间收录廉江市人民医院行肝动脉化疗栓塞术治疗的100 例原发性肝癌患者,根据DSA 检测结果分为残癌组(n=46)、无残癌组(n=54)。残癌组男女比例为21:25,年龄为35~70 岁,均龄(52.76±10.76)岁。无残癌组男女比例为26:28,年龄为35~70 岁,均龄(53.42±9.54)岁。两组一般资料差异无统计学意义(P>0.05),有可比性。
纳入标准:①经病理穿刺活检确诊为原发性肝癌;②均予以肝动脉化疗栓塞术治疗;③各项生命体征稳定;④无心肝肾功能衰竭;⑤无严重出血感染征象。排除标准:①合并严重甲状腺功能亢进症;②合并其他原发性疾病;③合并大量腹水;④合并胆囊炎等肝胆疾病。
1.2 方法
CT 增强动脉晚期扫描:在患者手术治疗6 个月后进行检查,设备采用多层螺旋CT。设备参数:管电压120~140 k V,管电流300 m A s,层厚100,层距5 mm,螺距1.5,重建矩阵512×512。经上肢静脉注射碘海醇,流量60~80 m L,流速2.0~4.0 m L/s,其中延迟扫描设置:动脉晚期延迟到注射造影剂48 s后扫描;门脉期延迟到注射造影剂70s 扫描;延迟期为注射造影剂2 min 后扫描。对检测原始轴位图像予以薄层处理,再对病灶区域予以多平面重建技术及曲面重建技术重组处理。图像后处理:测量病灶增强前后不同时相CT 值数据,然后绘制TDC。病灶感兴趣区(ROI)选择标准:选择病灶增强最明显区域,每一层选取3 个,每个ROI 面积>1 cm2,每例至少测量2 个层面,所有数据计算取平均值。强化峰值(PH)为病灶增强最大值:所选ROI 最大增强CT 值与平扫CT 值之差。肿块与主动脉强化峰值之比(M/A):病灶最大增强值/主动脉最大增强值。灌注值为病灶组织单位体积血流:病灶TDC 最大斜率值/主动脉增强峰值。
DSA 检测:在CT 增强动脉晚期扫描5 d 后进行检查,通过Seldinger 技术为患者右股动脉予以穿刺,置管后为患者注射碘海醇(厂家:扬子江药业集团有限公司;国药准字:H10 970358;规格:100 mL:30 mg),为患者予以动脉造影,经高压注射器注入,参考靶血管选择剂量、注射流率,对比剂总量30~80 mL,流速2~6 mL/ s,在注射后观察肿瘤血管以及染色状态。
生化实验室检查:在患者术后1~6 个月时采集清晨空腹肘静脉血3 mL,常温静置30 min,经离心设备以2 000 r/min 转速予以离心处理15 min,取上层血清样本,经化学发光免疫分析仪测量AFP、CEA、CA125 等指标数据。
1.3 观察指标
①肿瘤标志物指标:AFP 阳性标准:>20 μg/ L;CEA 阳性标准:>10 μg/L;CA125 阳性标准:>35 U/ mL,在检测中任意一项阳性则判断为阳性。②CT 增强动脉晚期扫描定量参数:肿块强化到达峰值时间(Tp)、强化峰值(PH)、肿块于主动脉强化峰值比(M/A),并计算灌注值。③以DSA 检测结果为金标准,比较不同方法的诊断效能,指标包括准确率、灵敏度、特异度。准确率=(真阳性+真阴性)例数/总数×100%,灵敏度=真阳性例数/(真阳性+假阴性)例数×100%,特异度=真阴性例数/(真阴性+假阳性)例数×100%。
1.4 统计学方法
采用SPSS 22.0 统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组肿瘤标志物指标比较
残癌组肿瘤标志物指标数据均高于无残癌组(P<0.05)。见表1。
表1 两组肿瘤标志物指标数据比较()

表1 两组肿瘤标志物指标数据比较()
2.2 两组定量参数比较
残癌组PH、M/A、灌注值高于无残癌组,Tp 低于无残癌组(P<0.05)。见表2。
表2 两组肿瘤标志物指标数据比较()
2.3 不同方法检测结果
肿瘤标志物检测:真阴性45 例,假阳性9 例,真阳性39 例,假阴性7 例。CT 增强动脉晚期扫描检测:真阴性42 例,假阳性12 例,真阳性36 例,假阴性10 例。联合检测结果:真阴性53 例,假阳性1 例,真阳性45 例,假阴性1 例。见表3。

表3 不同方法检测结果 单位:例
2.4 不同检测方法诊断效能比较
联合检测的准确率、灵敏度、特异度均高于各项单一检测(P<0.05)。见表4。
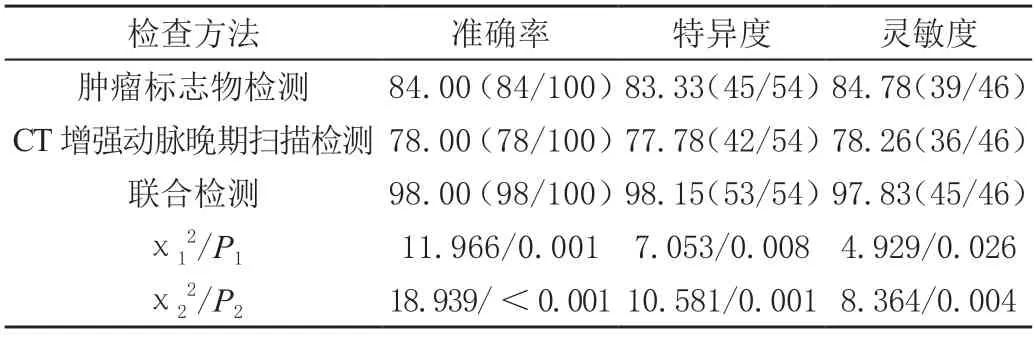
表4 不同检测方法诊断效能比较[%(n/m)]
3 讨论
原发性肝癌是指起源于人体肝脏内胆管上皮细胞、肝细胞的恶性肿瘤疾病,是我国发病数量最高的几种恶性肿瘤之一,患者在发病后病灶进展速度快、预后差、恶性程度高,且手术切除率相对较低[6]。部分患者在治疗期间均需要通过动脉栓塞的形式予以化疗干预,并在术后对患者病情予以全面、准确的检查,确定患者体内是否存在残癌[7]。
CT 检查具有耗时短、无创、图像清晰度高等技术特点,通过注射造影剂进行扫描可更清晰地观察病灶组织内碘油沉积情况,显示出手术区域是否存在强化,进而来评估癌变病灶术后活性程度[8-9]。而CT 增强动脉晚期扫描是对传统CT 技术的优化发展,是在注射造影剂后延迟低动脉血管进行扫描,患者在手术后,病灶位置血供情况较差,而通过CT 增强延迟扫描能够让造影剂进入侧支血管内,更加清晰地显示出肝癌病灶的血供情况,然后通过检测医师主观观察分析癌变组织周围血管网分布状态,对肝癌病灶的肝动脉化疗栓塞术的效果进行评估,确定患者病灶复发风险以及残癌程度[10]。CT 增强动脉晚期扫描能够准确分析术后的残癌大小、数量以及血供分布等信息,可以评估出残癌组织是否转移或生出新病灶[11]。此外,通过多平面重建技术及曲面重建技术重组处理能够获得更为准确的扫描定量参数,数据提示:残癌组各项CT 增强动脉晚期扫描定量参数指标数据与无残癌组患者存在明显差异,残癌组PH、M/A、灌注值高于无残癌组,Tp 低于无残癌组(P<0.05),说明通过CT 增强动脉晚期扫描能够对患者残癌情况予以有效鉴别。赖婳妤[12]在针对60 例原发性肝癌患者展开研究后发现,通过CT 增强动脉晚期扫描检测能够对患者残癌情况予以有效鉴别,研究数据与本文结果一致。肿瘤标志物则是反映癌变组织生长情况的重要物质,通过血清样本进行检测,可以评估原发性肝癌术后肿瘤组织功能以及血供情况[13]。其中,AFP 是由人体肝脏器官合成,当肝细胞发生癌变后,AFP 功能会通过特殊信号被激活,并进入到血液中,导致血清内AFP 水平上升。CEA 来源于内胚层,是酸性糖蛋白中的重要类型,通过上皮与间充质的转化来促进癌变细胞发生转移、侵袭等活动,因此在发病后CEA 数量会明显增多。CA125 则是胚胎体腔中的糖蛋白类物质,在肝功能不足时影响肝脏代谢能力,当肝脏出现癌变后,CA125 降解速度降低,造成血清CA125 水平上升[14]。结合文中数据显示:残癌组肿瘤标志物指标数据高于无残癌组(P<0.05)。而单纯通过CT 检测或者肿瘤标志物检测均容易出现不同情况的误诊,因此将两种检测方式联合应用能够有效提高诊断的准确度,降低误诊的情况。本文数据显示:联合检测的诊断效能均高于各项单一检测(P<0.05)。
综上所述,在为原发性肝癌患者予以术后残癌检测时,通过CT 增强动脉晚期扫描检测联合肿瘤标志物检测可以提升检测的准确度,可以为术后治疗和康复工作提供更多的参考依据,建议在原发性肝癌的术后残癌检测中积极参考。
