灵菌红素的性质及其在柑橘保鲜中的应用
2023-11-20冯苗黄艳红王珊珊刘建军徐慧
冯苗,黄艳红,王珊珊,刘建军,徐慧
(齐鲁工业大学(山东省科学院) 山东省食品发酵工业研究设计院,山东 济南 250000)
灵菌红素是一种微生物天然色素,具有抗菌性、抗癌性、抗紫外线活性及抗藻类活性等作用[1-2],已报道的应用大多为医学领域,部分为食品领域、纺织领域及新能源领域,在食品中的潜在应用包括食品着色剂及可用于饮料等的微胶囊[3-6]。除此之外,众多研究表明灵菌红素具有抗菌性,可同时抑制细菌和真菌的生长[7]。因此可将其应用于食品保鲜中,达到抑制细菌及真菌的作用[8-15]。而灵菌红素难溶于水,因此可将其制成保鲜涂膜加以利用。保鲜涂膜是均匀涂在果蔬表面的薄膜,在果蔬表面形成隔绝外界空气环境的屏障从而阻止果蔬与外界的接触起到保鲜作用[16]。在果蔬保藏中,保鲜涂膜还可以起到保水作用及阻止果蔬内部与外界环境的气体交换作用,从而通过降低酶促褐变及减少乙烯的产生来延长果蔬的保质期[17],同时保鲜涂膜还可以防止果蔬表面厌氧菌及真菌的生长[18]。目前保鲜涂膜的种类有淀粉膜、蛋白质膜以及复合膜等[16]。将具有生物活性的物质添加到涂膜中还可制备成功能性复合涂膜[17],某些微生物本身及其产生的代谢物质具有生物学功能,如细菌芽孢杆菌属、乳酸菌等,真菌酵母菌属、木霉属等,将其制成复合涂膜,对果蔬保鲜的水分、质地以及风味等指标起到更好的维持作用[19]。
灵菌红素为微生物产生的功能性代谢物,将其制备成功能性复合涂膜可用于食品保鲜。目前未见灵菌红素在食品保鲜中的应用报道,鉴于此,本研究先通过对照处理法、国家标准法及抑菌圈法分析灵菌红素的稳定性、毒理性及抗菌性,基于灵菌红素对青霉菌明显的抑制作用,选择青霉菌的常见载体柑橘作为保鲜实验的材料,初步探究灵菌红素在柑橘保鲜中的作用,以期为灵菌红素的在柑橘保鲜中的应用研究奠定基础。
1 材料与方法
1.1 材料与试剂
SPF 级KM 小鼠(质量合格证号:No.3707262111 00974553):济南朋悦实验动物繁育有限公司。本实验中采用实验动物为SPF 级KM 小鼠20 只,雌雄各半(雌性动物未交配过、未妊娠),体质量为18~22 g,实验动物使用许可证号:SYXK(鲁)2021 0015。鼠料(质量合格证号:No.120210927048)、实验用玉米芯垫料(质量合格证号:No.120210802001):江苏省协同医药生物工程有限责任公司。
灵菌红素(纯度98%)由粘质沙雷氏菌发酵后分离纯化所得;葡萄糖、麦芽糊精(优级品):山东西王糖业有限公司;蛋白胨(分析纯):安琪酵母股份有限公司;NaCl、琼脂、乙醇、NaOH(均为分析纯)、淀粉(优级品):国药集团化学试剂有限公司;抗性糊精(优级品):山东百龙创园生物科技股份有限公司;壳聚糖(分析纯):上海伊卡生物技术有限公司;维生素C(标准品,纯度95%以上):上海源叶生物科技有限公司。
1.2 仪器与设备
UV-9000 紫外可见分光光度计:上海元析仪器有限公司;HH-6 恒温水浴锅:常州国华电器有限公司;UB-7 pH 测量仪:美国DENVER 公司;AlphaClean 1300 超净工作台:上海立新仪器有限公司;CH-8853水分活度仪:瑞士novasina 公司;WYT-4 手持式折光仪:泉州中友光学仪器有限公司;BSA322S-CW 电子天平(精度0.01):北京赛多利斯科学仪器有限公司;BMJ-160C 霉菌培养箱:上海博迅医疗生物仪器有限公司。
1.3 方法
1.3.1 灵菌红素的稳定性试验
配制一定浓度的灵菌红素-乙醇溶液,并在535 nm处测定其起始吸光值,取相同体积配制好的灵菌红素溶液,分别在不同温度(20、40、60、80 ℃)、不同pH值(2、4、6、7、8、9、10)以及不同光照处理条件下(避光和暴露于日光灯)放置,不同温度处理后每隔1 h 测定1 次OD535nm值,不同pH 值处理及不同光照处理后每隔12 h 测定1 次OD535nm值,以此判断不同处理条件对灵菌红素稳定性的影响。
1.3.2 灵菌红素的毒理学实验
按照GB 15193.3—2014《食品安全国家标准急性经口毒性试验》4.3.2 限量法进行灵菌红素的急性经口毒性实验。称10.020 3 g 灵菌红素样品加纯水配制成20 mL样品溶液,混合均匀,标识备用(终浓度为501 mg/mL)。KM 小鼠在实验室屏障环境动物房中预饲养3 d,以适应环境。实验前,KM 小鼠禁食4 h,自由饮水。采用限量法进行实验,灌胃给予剂量10 020 mg/(kg bw),灌胃体积为20 mL/(kg bw)。给予受试物后继续禁食1 h。给予受试物后,每天观察小鼠的中毒症状和行为变化;在实验开始和结束时称取并记录KM 小鼠体质量,并且在观察期每周称KM 小鼠体质量1 次。观察期内全面观察并记录KM 小鼠发生变化的时间、程度及持续时间。对中毒死亡KM 小鼠和实验结束处死的KM 小鼠进行大体解剖检查,出现大体解剖病理改变时做病理组织学观察。
1.3.3 灵菌红素的抑菌作用试验
分别进行灵菌红素对细菌和真菌的抑菌作用实验,细菌来自于空气中自然生长的菌落,真菌灰霉菌(Botrytis cinerea)、指状青霉菌(Penicillium digitatum)、扩展青霉菌(Penicillium expansum)、尖刀镰孢菌(Fusarium oxysporum)及禾谷镰孢菌(Fusarium graminearum)来自于实验室现有的保存菌种。
1.3.3.1 灵菌红素对细菌的抑菌试验
灵菌红素对细菌的抑菌试验作为预试验,细菌培养基:2%葡萄糖、1%蛋白胨、1% NaCl、2%琼脂。
装有培养基的平板在室内开盖10 min,使空气中的细菌自然落到平板上,10 min 后于35 ℃培养,待菌落长好分别在平板上扩大培养以及挑单菌落到试管斜面上保存。用5 mL 无菌生理盐水冲洗每个菌种的试管斜面保存菌,将其制备成菌悬液,取制备好的各菌悬液0.3 mL 均匀涂布于平板上,将预先在浓度为0.100 0、0.020 0、0.004 0、0.000 8 g/L 的灵菌红素-乙醇溶液浸泡1 h 的滤纸圆片(直径6 mm)按标记好的位置放在涂好菌液的平板上,待菌液全部渗透到培养基后放入35 ℃的培养箱中培养24 h 观察抑菌圈大小。每个浓度做3 个平行,抑菌圈直径取平均值。
1.3.3.2 灵菌红素对真菌的抑菌作用试验
真菌生长所需要的培养基为马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA),PDA 培养基:马铃薯200~300 g/L、葡萄糖20 g/L、琼脂粉18 g/L,121 ℃灭菌20 min。
培养基配制并灭菌后,制备平板培养基,并用牛津杯打孔。平板上均匀地涂抹菌悬液或者在平板的中心位置放一小块由打孔器取样的菌块,再在孔中倾注不同浓度的灵菌红素-乙醇溶液或者乙醇溶液(作为对照,所使用的乙醇浓度为95%),在各菌种适宜的生长条件下培养,观察抑菌圈的大小判断灵菌红素对各菌种的抑菌作用。菌悬液的制备方法:用5 mL 无菌生理盐水冲洗试管斜面菌种制备菌悬液。温度及湿度是影响真菌生长的重要因素[20-23],禾谷镰孢菌、尖刀镰孢菌、指状青霉菌及扩展青霉菌最适生长温度25 ℃,灰霉菌最适生长温度20 ℃,湿度均为70%。
1.3.4 灵菌红素保鲜涂膜的制备
称取壳聚糖、淀粉、抗性糊精、麦芽糊精各1 g,分别溶于20 mL 水中,配制成5 g/100 mL 的不同溶液,取20 mL 灵菌红素-乙醇溶液与溶好的不同溶液混合,70 ℃加热搅拌至酒精完全挥发,制成灵菌红素复合涂膜[5,24-25]。根据各种复合涂膜的成膜效果选择后续保鲜试验中采用的复合涂膜。
1.3.5 灵菌红素在柑橘保鲜中各项指标的测定
试验分为5 组,分别为阴性对照组:不做处理组;阳性对照组:抗性糊精涂膜处理组;试验组:灵菌红素抗性糊精复合涂膜处理组(共3 个灵菌红素浓度组成的复合涂膜,分别为0.125、0.250、0.500 g/L 灵菌红素+5%抗性糊精),挑选大小一致、成熟的柑橘小叶桔进行试验,各组处理后在常温下进行保存,每次每组随机取样测3 个平行,每隔7 d 测1 次。选择测定的指标分别为失重量、水分活度、可溶性固形物含量、可滴定酸含量、维生素C 含量[26-29]。5 个指标的测量方法如下。
1)失重量:用每次测得的各组总质量计算,失重量为储前鲜重和储后鲜重的差。
2)水分活度:剥离每个柑橘的一小瓣,使用水分活度仪测量其水分活度来代表整个柑橘的水分活度。
3)可溶性固形物含量:将柑橘果实榨汁后,直接滴1~2 滴到手持式折光仪的折光棱镜上,合上进光板后将进光板对准光源,通过目镜读取数值。
4)可滴定酸含量:参考文献[27],采用酸碱滴定法测量可滴定酸的含量。
5)VC含量:柑橘中维生素C 含量测定参考代甜甜等[29]方法。
1.4 数据处理与分析
所有数据均进行3 次重复实验,并采用Excel 2010进行绘图分析,结果表示为平均值±标准差。
2 结果与分析
2.1 灵菌红素的稳定性
2.1.1 温度对灵菌红素稳定性的影响
温度对灵菌红素稳定性的影响结果见图1。
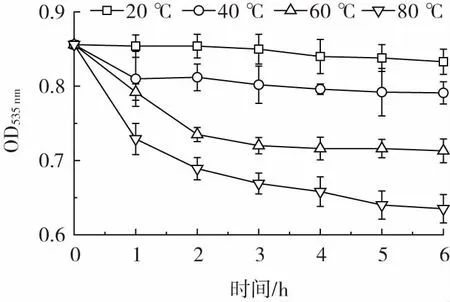
图1 温度对灵菌红素稳定性的影响Fig.1 Effect of temperature on stability of prodigiosin
测定的初始OD535nm为0.855。由图1 可知,温度越高,灵菌红素越不稳定。20 ℃条件下灵菌红素的OD 值基本上没有变化,处于稳定状态。60 ℃和80 ℃条件下灵菌红素的OD535nm值下降较快,灵菌红素处于较不稳定状态。因此温度高于60 ℃时,灵菌红素的稳定性在短时间内急剧下降。温度对灵菌红素稳定性的影响原因推测为高温对灵菌红素的结构具有破坏作用,从而降低其稳定性。
2.1.2 pH 值对灵菌红素稳定性的影响
pH 值对灵菌红素稳定性的影响结果见图2。
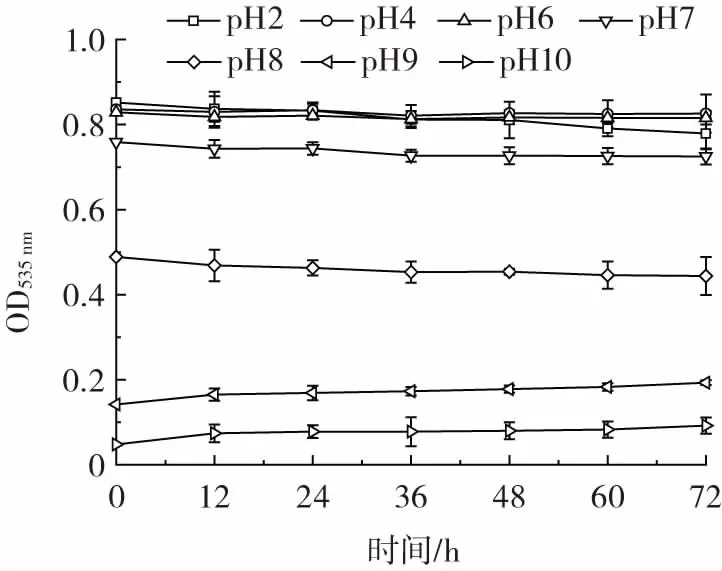
图2 pH 值对灵菌红素稳定性的影响Fig.2 Effect of pH on stability of prodigiosin
由图2 可知,pH4、6、7 时灵菌红素基本处于稳定状态,但pH4 和pH6 时灵菌红素的OD535nm值明显大于pH7 时灵菌红素溶液的OD535nm值,pH2 时灵菌红素的OD535nm值下降较快,由此说明过酸条件不利于灵菌红素的稳定。在碱性环境中,灵菌红素在最开始就降解,pH8 时灵菌红素的OD535nm值较小,pH9、10 时灵菌红素的OD535nm值极小,因此灵菌红素在碱性条件下极不稳定。
2.1.3 光照对灵菌红素稳定性的影响
光照对灵菌红素的稳定性影响结果见图3。
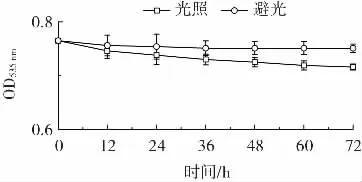
图3 光照对灵菌红素稳定性的影响Fig.3 Effect of light on stability of prodigiosin
测定的初始OD535nm为0.765。由图3 可知,随着时间的延长,避光条件下灵菌红素的OD535nm值基本没有变化,而光照条件下灵菌红素的OD535nm值呈下降趋势,但下降程度较轻,日光灯照射环境和避光环境中灵菌红素的稳定性相差不大。因此光照会对灵菌红素造成轻微的影响,相对温度和pH 值影响较小。灵菌红素的稳定性研究结果与已有研究结果一致[4]。根据温度、pH 值及光照对灵菌红素的稳定性影响结果可知,灵菌红素在一般条件下稳定,在食品保鲜过程中稳定不易分解。
2.2 灵菌红素的毒理学实验
根据GB 15193.3—2014《食品安全国家标准急性经口毒性试验》进行灵菌红素的急性经口毒性实验,结果如表1 所示。
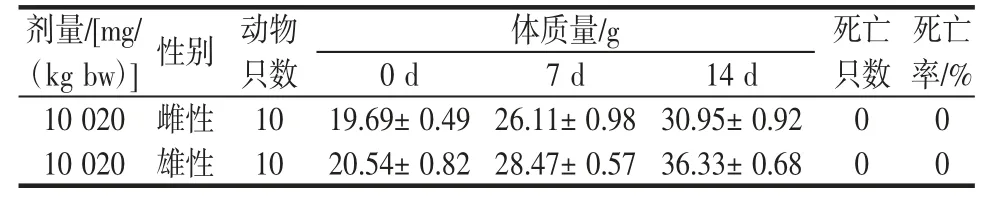
表1 灌胃14 d 后小鼠体质量变化结果及死亡情况Table 1 Results of body weight changes and mortality of mice after 14 days of intragastric administration
由表1 可知,KM 小鼠在灌胃14 d 内未见任何异常症状和死亡,体质量稳定增长,且实验观察结束后对小鼠大体解剖检查未见异常。灵菌红素对KM 小鼠的半数致死量(median lethal dose,LD50)>10 020 mg/(kg bw)。根据不同动物之间的剂量换算关系,计算得小鼠剂量换算成大鼠剂量6 936 mg/(kg bw),换算后灵菌红素对大鼠的LD50=6 936 mg/(kg bw)>5 000 mg/(kg bw),因此,灵菌红素属实际无毒。
2.3 灵菌红素的抑菌作用
2.3.1 灵菌红素对细菌的抑菌作用
灵菌红素对细菌的抑制作用见图4。
图4 灵菌红素对细菌的抑菌作用Fig.4 Antibacterial effect of prodigiosin on bacteria
由图4 可知,0.100 0 g/L 的灵菌红素对细菌具有一定程度上的抑菌作用[抑菌圈直径(7.22±0.11)mm],0.020 0 g/L 的灵菌红素有微弱的抑菌作用[抑菌圈直径(6.43±0.14)mm],0.004 0、0.000 8 g/L 的灵菌红素对细菌没有抑菌作用。据报道灵菌红素的抑菌作用为浓度依赖型,即抑菌程度大小与灵菌红素的浓度有关,浓度越大抑菌程度越强,因此提高灵菌红素的浓度应具有更强的抑制细菌作用[30]。
2.3.2 灵菌红素对真菌的抑菌作用
灵菌红素对5 种真菌的抑制作用见图5~图9。
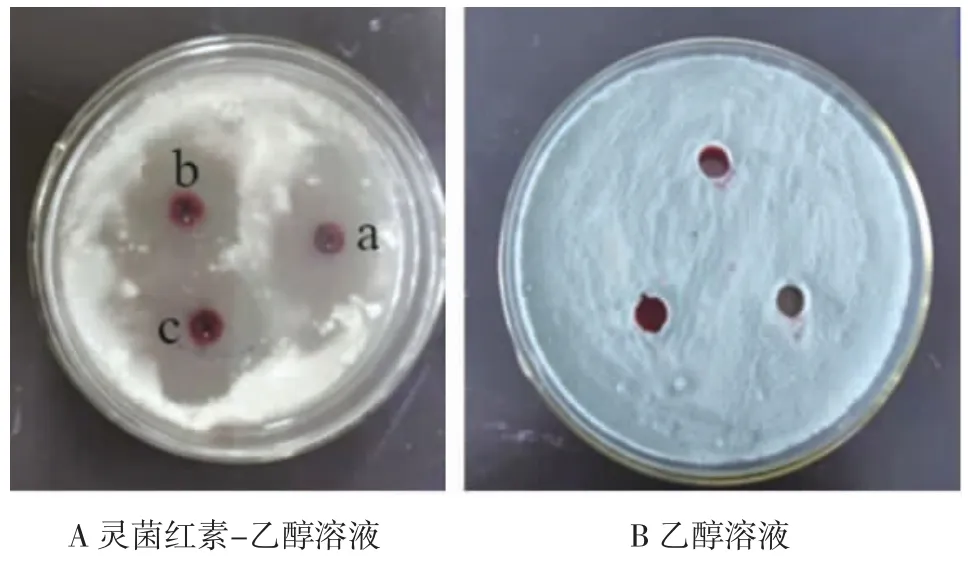
图5 灵菌红素对指状青霉菌的抑菌作用Fig.5 Antibacterial effect of prodigiosin on Penicillium digitatum
由图5A 可知,3 个质量浓度的灵菌红素对指状青霉菌的抑菌圈大小没有明显的差异,平均直径约24.5 mm,而对照组乙醇(图5B)对指状青霉菌没有抑制作用。
由图6 可知,乙醇对扩展青霉菌没有抑制作用,而灵菌红素对扩展青霉菌有明显的抑制作用,1.00 g/L 和0.50 g/L 质量浓度的抑菌圈直径约为30 mm,0.25 g/L质量浓度的抑菌圈直径约为20 mm。
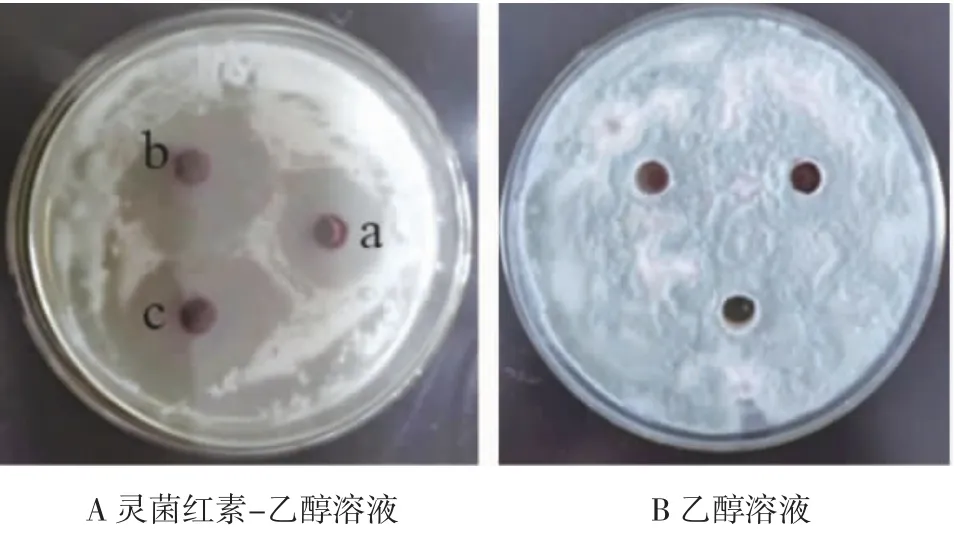
图6 灵菌红素对扩展青霉菌的抑菌作用Fig.6 Antibacterial effect of prodigiosin on Penicillium expansum
如图7 所示,乙醇对禾谷镰孢菌没有抑制作用,而灵菌红素对禾谷镰刀菌的抑菌作用较明显,0.25 g/L 灵菌红素对禾谷镰孢菌的抑菌圈直径约为17 mm。
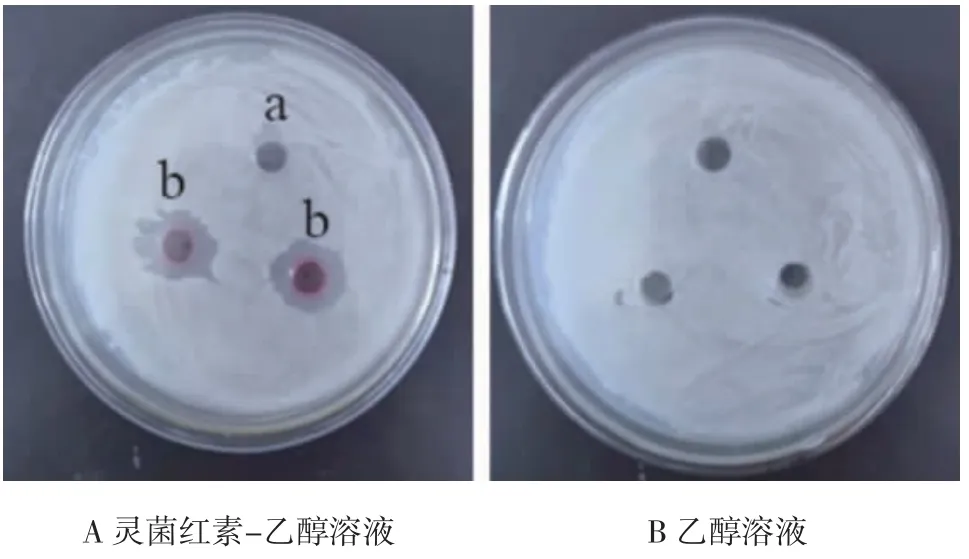
图7 灵菌红素对禾谷镰孢菌的抑菌作用Fig.7 Antibacterial effect of prodigiosin on Fusarium graminearum
如图8 所示,对照组乙醇对尖刀镰孢菌没有抑制作用,根据测量结果,灵菌红素对尖刀镰孢菌具有明显的抑制作用,其中0.25 g/L 灵菌红素对尖刀镰孢菌的抑菌圈直径约为9 mm,0.50 g/L 的灵菌红素溶液对尖刀镰孢菌的抑菌圈直径约为15 mm。
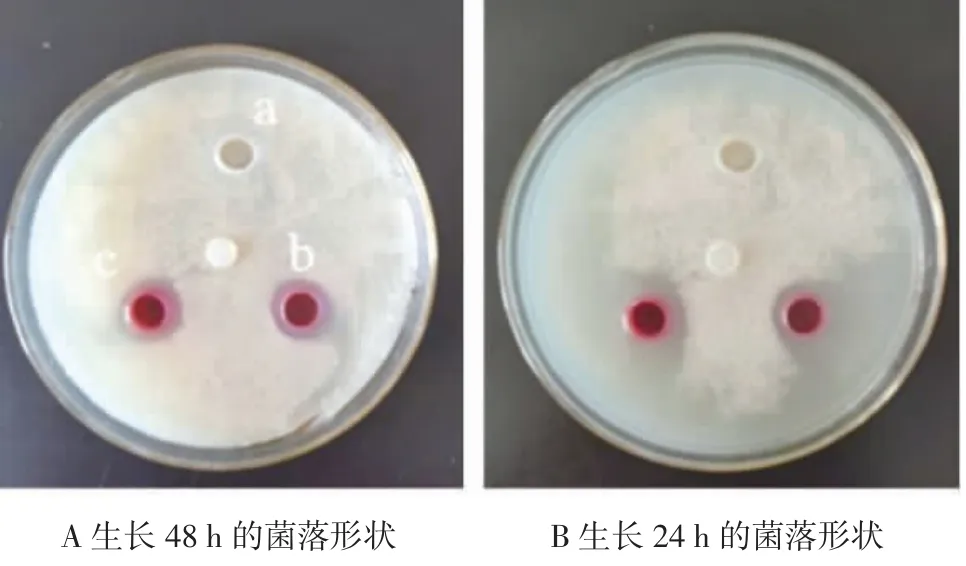
图8 灵菌红素对尖刀镰孢菌的抑菌作用Fig.8 Antibacterial effect of prodigiosin on Fusarium oxysporum
如图9 所示,灵菌红素与乙醇对照组结果相同,没有抑菌圈的出现,因此灵菌红素对灰霉菌没有明显的抑菌作用。
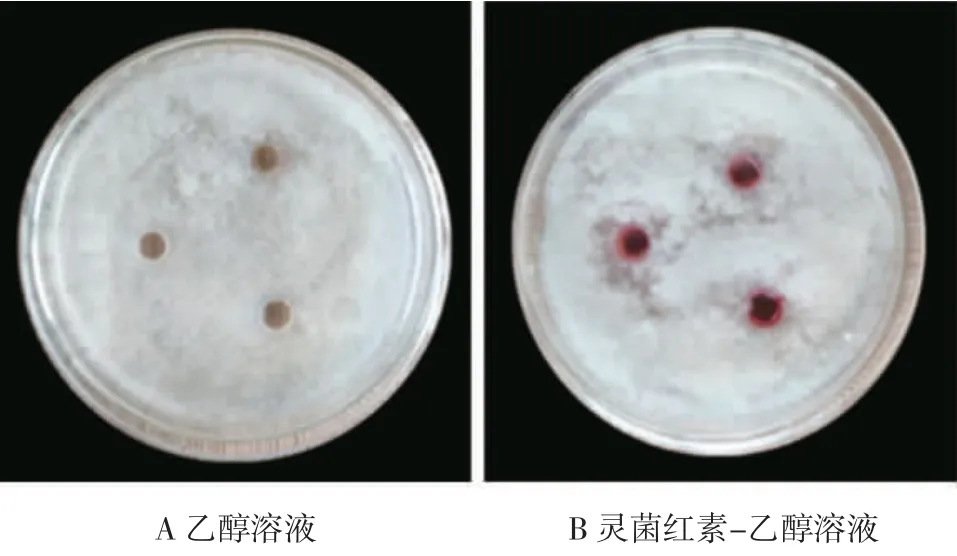
图9 灵菌红素对灰霉菌的抑菌作用Fig.9 Antibacterial effect of prodigiosin on Botrytis cinerea
灵菌红素对真菌的抑制作用如表2 所示。
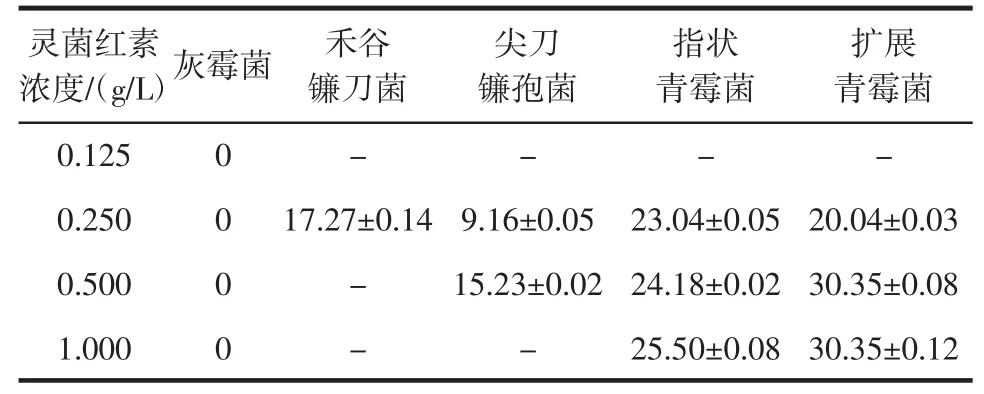
表2 灵菌红素对真菌的抑菌直径Table 2 Antibacterial effect of prodigiosin on fungi mm
灵菌红素对细菌的抑菌机制可总结为灵菌红素破坏细菌细胞膜结构,抑制蛋白质、核糖核酸、脱氧核糖核酸以及细胞生长所必需的酶等合成,抑制细胞呼吸等造成细菌细胞线粒体功能障碍[7,31]。灵菌红素对真菌的抑菌机制与真菌细胞膜上的甾醇有关,有报道称灵菌红素对真菌中1,4-α-去甲基化酶的活性具有抑制作用,而麦角固醇合成过程中需要1,4-α-去甲基化酶,麦角固醇为真菌细胞膜上组成甾醇类物质的一部分[32]。甾醇含量的下降使真菌细胞膜的结构被破坏,因此其正常的细胞膜功能受到影响,最终导致其死亡[32]。这与纳他霉素对真菌的抑制作用机制类似,同样为通过影响甾醇类化合物的合成,进而使真菌细胞膜损伤导致菌体死亡[19]。灵菌红素对细菌及真菌的抑制作用均与灵菌红素的浓度相关[30]。
2.4 灵菌红素复合涂膜的制备
利用淀粉、抗性糊精、壳聚糖、麦芽糊精与灵菌红素制备的复合涂膜成膜效果见图10。

图10 各种复合涂膜成膜效果Fig.10 Film-forming result of various composite coatings
如图10 所示,复配后的涂膜中灵菌红素麦芽糊精复合涂膜成膜性较差,灵菌红素壳聚糖复合涂膜成膜性较好,但其中灵菌红素呈明显的颗粒状,且灵菌红素麦芽糊精复合涂膜、灵菌红素壳聚糖复合涂膜成膜后的黏性较大,与麦芽糊精和壳聚糖的本身性质有关。灵菌红素淀粉复合涂膜、灵菌红素抗性糊精复合涂膜成膜性较强,可在试管表面形成一层致密薄膜,且成膜后几乎呈白色,黏性较小,但是糊化后的淀粉很快凝结成块不能再次使用造成浪费,而抗性糊精溶解性较好,制备的灵菌红素抗性糊精复合涂膜保持溶液状态,因此选择灵菌红素抗性糊精复合涂膜进行后续试验。
2.5 灵菌红素在柑橘保鲜中的各项指标
灵菌红素复合涂膜对保鲜过程中柑橘失重量、水分活度、可溶性固形物含量、可滴定酸含量及VC含量的影响见图11~图16。
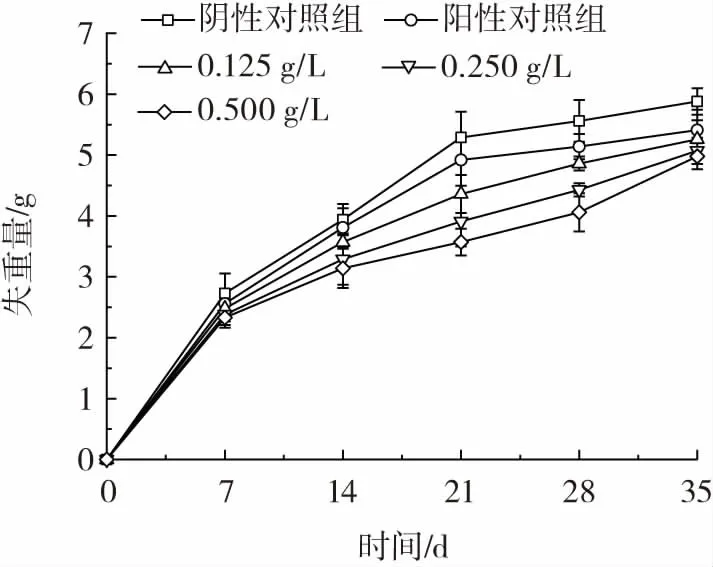
图11 柑橘保鲜过程中各组的失重量变化Fig.11 Weight loss changes of each group during citrus preservation
如图11 所示,5 组试验中,随着时间的延长失重量均呈现上升趋势,且相对于阴性对照组和阳性对照组,试验组的失重较小,且0.500 g/L 的灵菌红素复合涂膜处理组中失重量最小。因此灵菌红素复合涂膜用于柑橘的保鲜过程中柑橘的失重量减少,即有利于柑橘的储存保藏,且该作用与灵菌红素的浓度呈正相关。
如图12 所示,5 组试验中水分活度随着时间的延长均呈现下降趋势,且处理组相较于对照组水分活度下降更慢,且0.5 g/L 灵菌红素复合涂膜处理组水分活度下降最小。因此灵菌红素复合涂膜在柑橘保鲜过程中一定程度上起到减少水分流失的作用,即起到保水作用,且该作用与灵菌红素的浓度相关。
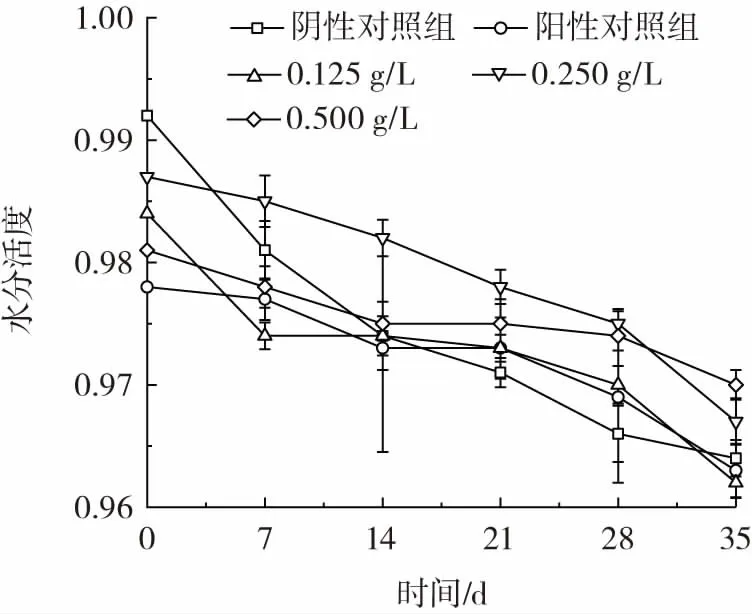
图12 柑橘保鲜过程中各组的水分活度变化Fig.12 Water activity changes of each group during citrus preservation
如图13 所示,5 组试验中可溶性固形物含量呈现不规则变化,可能原因为柑橘之间可溶性固形物含量本身存在较大差异或试验误差,导致保鲜后测得的可溶性固形物含量变化无固定规律。
可滴定酸常作为评价果实风味的检测指标。由图14 可知,可滴定酸含量的测定结果与可溶性固形物含量的结果类似,呈现无规律变化,推测原因与可溶性固形物的测定相同,因此保存之后测得的结果同样存在较大差异。
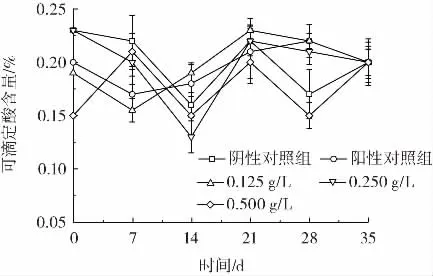
图14 柑橘保鲜过程中各组的可滴定酸含量变化Fig.14 Titratable acid changes content of each group during citrus preservation
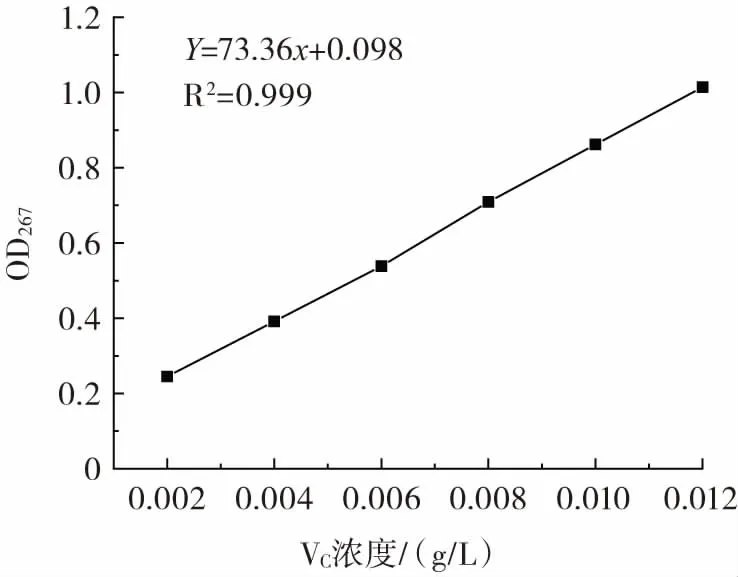
图15 维生素C 标准曲线Fig.15 Vitamin C standard curve
在果蔬营养价值的评定以及果蔬保鲜效果评价中通常将维生素C 含量作为评价的重要指标[17,20],由图16 可知,5 组试验中维生素C 含量随着时间的延长均呈现下降趋势,且处理组较对照组柑橘维生素C 下降更慢,0.500 g/L 灵菌红素复合涂膜处理组维生素C 下降最小。因此灵菌红素复合涂膜在柑橘保鲜过程中在一定程度上有利于减少柑橘中维生素C 的损失,有利于保鲜过程中柑橘风味的保存。
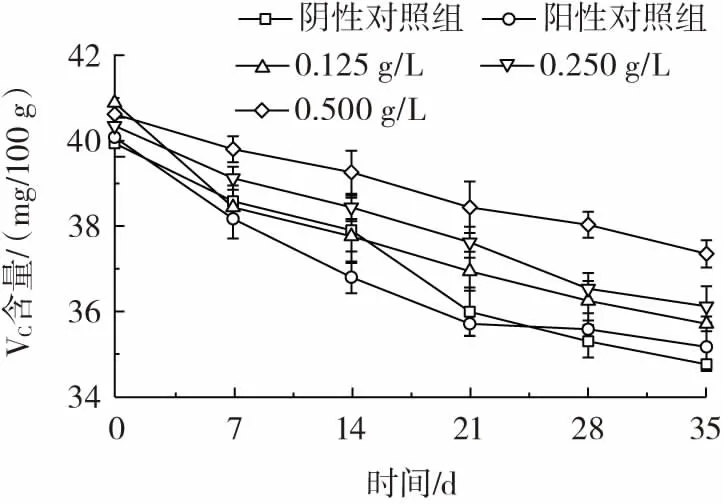
图16 柑橘保鲜过程中各组的维生素C 含量变化Fig.16 Vitamin C content changes of each group during citrus preservation
3 结论
灵菌红素的稳定性试验结果表明,高温和pH>7的碱性环境对灵菌红素的稳定性影响较大,光照对灵菌红素的影响极小,因此在柑橘保鲜过程中的一般条件下灵菌红素处于稳定状态,可维持较长作用时间。灵菌红素的抑菌试验结果表明灵菌红素对细菌以及真菌都有抑制作用,且对真菌指状青霉菌以及扩展青霉菌的抑制作用尤其显著,因此在柑橘保鲜中灵菌红素可对青霉菌起到抑制作用,其抑制作用机制为通过抑制青霉菌细胞膜上的甾醇合成进而影响细胞膜的正常生理功能,最终导致细胞死亡。灵菌红素的急性经口毒性实验结果显示,参照GB 15193.3—2104《食品安全国家标准急性经口毒性试验》毒性等级表灵菌红素属于实际无毒。保鲜实验中,灵菌红素复合保鲜涂膜对柑橘的保鲜作用有明显的效果。一般情况下,随着时间的延长,水分活度、维生素C 含量、可滴定酸含量和可溶性固形物含量会越来越低,呈现下降趋势,而失重量则会越来越高。灵菌红素复合涂膜处理组相较于阴性对照组和阳性对照组,柑橘的水分活度以及维生素C 含量的下降程度均有所缓减,失重也较小,因此灵菌红素在柑橘保鲜中具有防止水分流失、减少失重以及保持维生素C 含量的作用。本研究初步探究了灵菌红素在柑橘保鲜中的应用,同时对灵菌红素的稳定性、毒理性及抑菌作用进行了研究,基于本研究的结果,灵菌红素无毒、较稳定、对细菌和真菌的抑制作用广泛,为未来灵菌红素在食品领域或其他领域的应用及其作用机理提供参考,为拓宽灵菌红素的应用奠定基础。
