东海海参多糖酶解提取工艺优化及其抗氧化活性
2023-11-20徐仰丽刘温婷胡平霞苏来金
徐仰丽,刘温婷,胡平霞,苏来金*
(1.温州市农业科学研究院 温州市特色食品资源工程技术研究中心,浙江 温州 325006;2.温州大学生命与环境科学学院,浙江 温州 325035)
东海海参,又名东海乌参,学名白肛海地瓜(Acaudina leucoprocta),属于海参纲,尻参科,海地瓜属。东海海参除了富含蛋白质、微量元素等营养成分,还富含海参多糖、海参皂苷等功能活性成分。东海海参在我国沿海的储量为100 万t,是目前我国储量最大的低值海参资源[1-3],其价格低廉,与刺参相比,口感较差,加工困难[4];另外,由于东海海参生活在浅海淤泥中,其体表形成了一层致密坚硬的表皮,重金属含量易超标,去除较困难[5],导致东海海参没有得到很好的开发利用。近年来,海洋大陆架水质富营养化逐渐加剧[6],东海海参大量繁殖,已经对海洋核电等设施造成了潜在威胁,若不能对东海海参资源进行有效清除或开发利用,未来可能存在生态安全隐患或造成海洋资源的浪费。
研究表明,东海海参体壁中含有丰富的海参多糖[7],包含海参酸性黏多糖和海参岩藻多糖两大类[8-9],具有良好的抗氧化、抗肿瘤、抗病毒等活性[10-13]。因此,提取东海海参中的海参多糖是提高东海海参开发利用程度、保障安全的重要途径之一,然而目前东海海参多糖的提取率不高,部分功能还不明确,给产业化应用带来了困难。本研究以东海海参干品为原料,采用酶解技术对东海海参多糖的提取工艺进行优化,对其结构和抗氧化活性进行研究,为低值海参资源的利用提供参考,并为东海海参多糖在食品和药品等领域的应用提供技术支持。
1 材料与方法
1.1 材料与试剂
东海海参干品:温州冠佳食品有限公司。2021 年12 月捕捞于浙江沿海,清洗去内脏,海参体壁经冷风干燥制成干海参。
丙酮、无水乙醇、苯酚、七水合硫酸亚铁、30% 过氧化氢、葡萄糖、水杨酸、溴化钾(均为分析纯):国药集团化学试剂有限公司;硫酸(优级纯):浙江中星试剂有限公司;木瓜蛋白酶(80 万U/g)、风味蛋白酶(1.5 万U/g)、中性蛋白酶(20 万U/g)(均为食品级):北京索莱宝科技有限公司;D-葡萄糖标准品(纯度99.9%):美国Sigma 公司。
1.2 仪器与设备
DHG-9140A 恒温鼓风干燥箱:上海百典仪器设备有限公司;MKZA10-15JIV 超微粉碎机:日本増幸产业株式会社;FR124CN 电子分析天平(分度值0.000 1 g):上海书培实验设备有限公司;CT15RT 台式高速冷冻离心机:日本日立公司;HH-6 恒温水浴锅:苏州江东精密仪器有限公司;T6 紫外可见分光光度计:北京普析通用仪器有限责任公司;SpectraMax 190 全波长酶标仪:美国MD 公司;Vertex 70 傅立叶红外光谱仪:德国布鲁克公司。
1.3 试验方法
1.3.1 原料预处理
干东海海参试验前置于冰水中泡发24 h,体壁剪成小块,置于60 ℃烘箱中烘至恒重,粉碎,过80 目筛,制成东海海参体壁干粉,密封贮存于干燥器中备用。多糖提取前将海参干粉按照料液比1∶10(g/mL)置于95%丙酮溶液中,浸泡脱脂24 h ,自然晾干。
1.3.2 多糖含量测定
采用苯酚-硫酸法[14]测定不同条件下所得的东海海参多糖含量。
1.3.3 酶解法提取东海海参多糖工艺的优化
1.3.3.1 最适蛋白酶的筛选
以风味蛋白酶、中性蛋白酶和木瓜蛋白酶作为备选酶制剂,根据酶制剂说明书推荐条件略有改动,以5.00 g 东海海参干粉为原料,按照料液比1∶30(g/mL)加入去离子水,加底物质量0.8%的酶,于水浴锅中酶解6 h,酶解完成后,在100 ℃沸水中灭酶15 min,冷却后将酶解液离心(4 000 r/min,15 min),收集上清液于50 mL 容量瓶中定容,每个处理重复3 次,测定酶解液中多糖的含量,从而进一步确定后续试验所用的蛋白酶种类。
1.3.3.2 酶解法提取东海海参多糖的单因素试验
精确称取东海海参干粉5.00 g 为底物,考虑到东海海参多糖提取反应初始溶液为中性条件,木瓜蛋白酶最适pH 值为6~7,因此,本研究固定了pH7.0 进行单因素试验,以木瓜蛋白酶酶解过程中酶解温度、酶解时间、酶添加量和料液比为考察因素,每个因素选取5 个水平,每个处理重复3 次,测定酶解液中海参多糖含量,计算多糖提取率。
酶解温度:底物按照料液比1∶30(g/mL)加入去离子水,加底物质量0.8%的试验用酶,分别以酶解温度30、40、50、60、70 ℃,置于水浴锅中酶解6 h,考察酶解温度对多糖提取率的影响。
酶解时间:底物按照料液比1∶30(g/mL)加入去离子水,加底物质量0.8%的试验用酶,以50 ℃作为酶解温度,置于水浴锅中分别酶解2、4、6、8、10 h,考察酶解时间对多糖提取率的影响。
酶添加量:底物按照料液比1∶30(g/mL)加入去离子水、分别加入底物质量0.4%、0.6%、0.8%、1.0%、1.2%的试验用酶,置于50 ℃水浴锅中酶解6 h,考察酶添加量对多糖提取率的影响。
料液比:底物分别以1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)的料液比加入去离子水,加底物质量1.0%的试验用酶,置于50 ℃水浴锅中酶解6 h,考察料液比对多糖提取率的影响。
1.3.3.3 酶解法提取东海海参多糖的正交试验
在单因素试验的基础上,以东海海参多糖提取率为试验指标,选取酶解温度、酶解时间、酶添加量为影响因素,设计三因素三水平的正交试验,利用L9(33)正交试验表进行正交试验,正交试验因素与水平见表1,每个处理重复3 次。
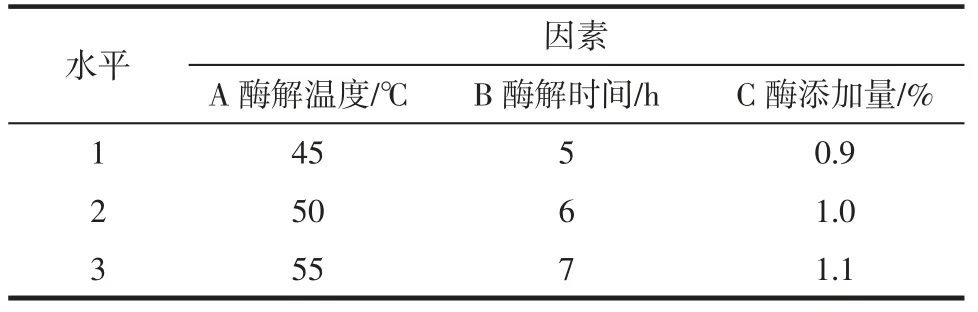
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.4 东海海参多糖的红外光谱分析
取干燥的试验提取多糖,参考文献[15]的方法,加入溴化钾后压片,在4 000~400 cm-1内扫描红外光谱。
1.5 东海海参多糖的抗氧化性测定
1.5.1 东海海参多糖对DPPH·的清除作用
DPPH·的清除能力参考马士超等[16]的测定方法。DPPH·清除率(X,%)计算公式如下。
式中:A1为多糖溶液的吸光度;A0为对照溶液的吸光度。
1.5.2 东海海参多糖对·OH 的清除作用测定
·OH 的清除能力参考Chen 等[17]的测定方法。·OH清除率(Y,%)计算公式如下。
式中:A1为空白对照的吸光度;Am为多糖溶液的吸光度;An为样品对照的吸光度。
1.6 数据处理
测定结果均作3 次平行处理,利用SPSS Statistics 21.0 和Excel 2016 对试验数据进行处理分析,结果以平均值±标准差表示,并利用Origin 2021 进行图表绘制,方差分析采用(one-way AVONA)进行显著性检验,p<0.05 表示差异显著。
2 结果与分析
2.1 葡萄糖标准曲线的制作
多糖含量在0~100 μg/mL 范围内与吸光度(λ=490 nm)呈现良好的线性关系,回归方程为Y=0.010 1X+0.003 4,r2=0.999 0,符合标准曲线的准确度要求。
2.2 蛋白酶种类对东海海参多糖提取率的影响
取相同量的东海海参干粉,对不同蛋白酶的酶解效果进行评定,以酶解液多糖提取率为指标,进行最适蛋白酶的筛选,结果见表2。
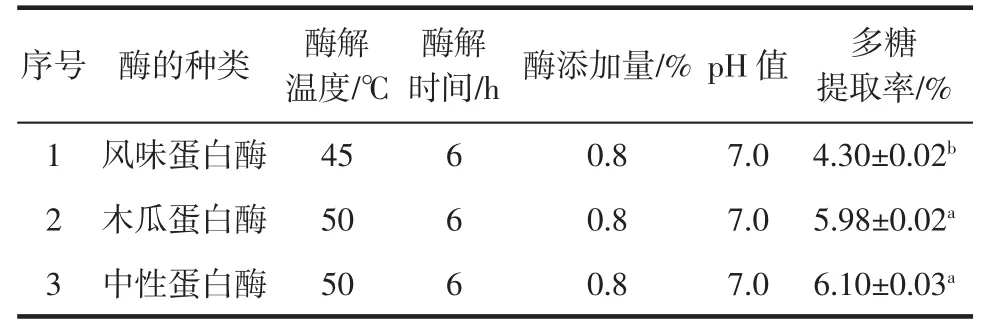
表2 最佳蛋白酶筛选结果Table 2 Results of optimal protease screening
海参多糖主要是蛋白多糖,其中的蛋白包括和多糖连接的核心蛋白以及游离蛋白,在多糖提取过程中,切断多糖与核心蛋白之间的糖肽键进而水解蛋白质,释放出多糖链[18-19]。由表2 可知,木瓜蛋白酶和中性蛋白酶的酶解液多糖提取率显著高于风味蛋白酶(p<0.05),而木瓜蛋白酶和中性蛋白酶酶解液的多糖提取率差异并不显著(p>0.05),故这两种酶的提取效果接近,但考虑到酶制剂的成本和应用,选取木瓜蛋白酶进行后续步骤的酶解工艺优化。
2.3 东海海参多糖提取的单因素试验结果
2.3.1 酶解温度对东海海参多糖提取率的影响
酶解温度对东海海参多糖提取率的影响见图1。
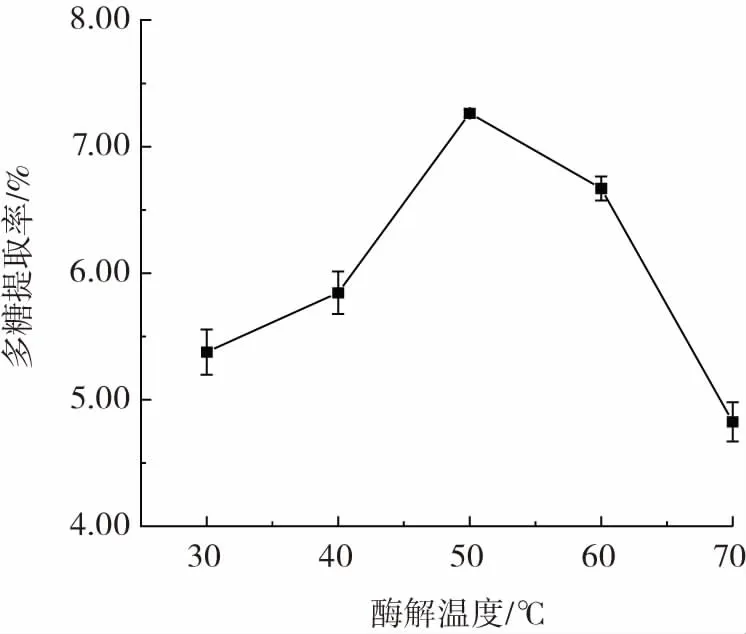
图1 酶解温度对多糖提取率的影响Fig.1 Effect of enzymolysis temperature on the yield of polysaccharides
从图1 可以看出,东海海参多糖的提取率随着酶解温度的提高呈现先上升后下降的趋势,在酶解温度为50 ℃时达到峰值。这可能是随着酶解温度升高,酶逐渐达到最适宜的温度,酶解效率升高,多糖分子加速运动,能够加快多糖的溶出;然而温度过高会导致酶分子的构象发生变化,致使蛋白酶活性变弱甚至消失,进而影响酶与底物的结合[20],导致多糖提取率下降,因此选取50 ℃为单因素最佳酶解温度,进行后续试验。
2.3.2 酶解时间对东海海参多糖提取率的影响
酶解时间对东海海参多糖提取率的影响见图2。
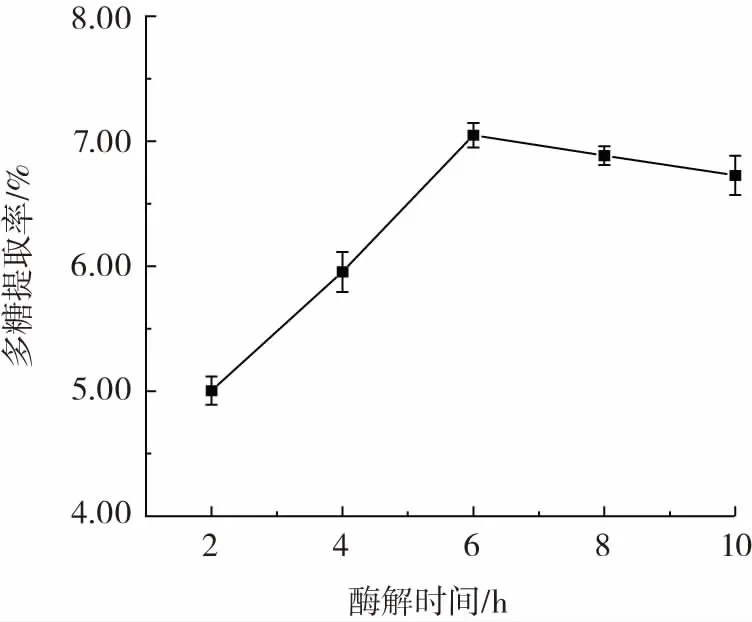
图2 酶解时间对多糖提取率的影响Fig.2 Effect of enzymolysis time on the yield of polysaccharides
从图2 可以看出,随着酶解时间的延长,东海海参多糖提取率逐渐提高,在6 h 达到峰值,之后提取率趋于平缓。这可能是由于酶解时间过短时,蛋白酶与底物不能够充分进行反应;延长酶解时间,随着反应的进行,酶和底物逐渐结合,东海海参中的蛋白质不断降解为肽和氨基酸,与糖链分离[21],多糖提取率随之增加。随着酶解反应的进行,底物减少,酶活力下降,产物也存在一定的抑制作用,因此酶解过程也会趋于平缓[22],在6 h 时多糖已基本提取完全,延长酶解时间提取率也不会明显上升,另外,酶解时间过长,可能会使酶解液腐败变质,形成安全隐患,因此选取6 h 为最优酶解时间进行后续试验。
2.3.3 酶添加量对东海海参多糖提取率的影响
酶添加量对东海海参多糖提取率的影响见图3。
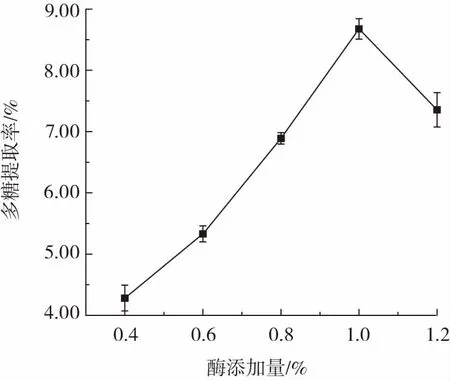
图3 酶添加量对多糖提取率的影响Fig.3 Effect of enzyme addition amount on the yield of polysaccharides
从图3 可以看出,随着酶添加量的增加,东海海参多糖提取率逐渐提高,这一阶段影响多糖提取率的主要因素是木瓜蛋白酶的用量,当酶添加量为1.0%时,多糖提取率达到最大,之后再增大酶的用量,多糖提取率反而有所降低。这可能是由于这一阶段影响东海海参多糖提取率的主要因素是底物的量[23-24],当酶与底物的量互相达到饱和状态,即使酶的用量上升,但没有足够的底物与之反应,提取率就不会提升,且考虑到酶促反应动力学,酶的浓度过高可能也会抑制自身酶解效果[25],因此选取1.0%为最优酶添加量进行后续试验。
2.3.4 料液比对东海海参多糖提取率的影响
料液比对东海海参多糖提取率的影响见图4。
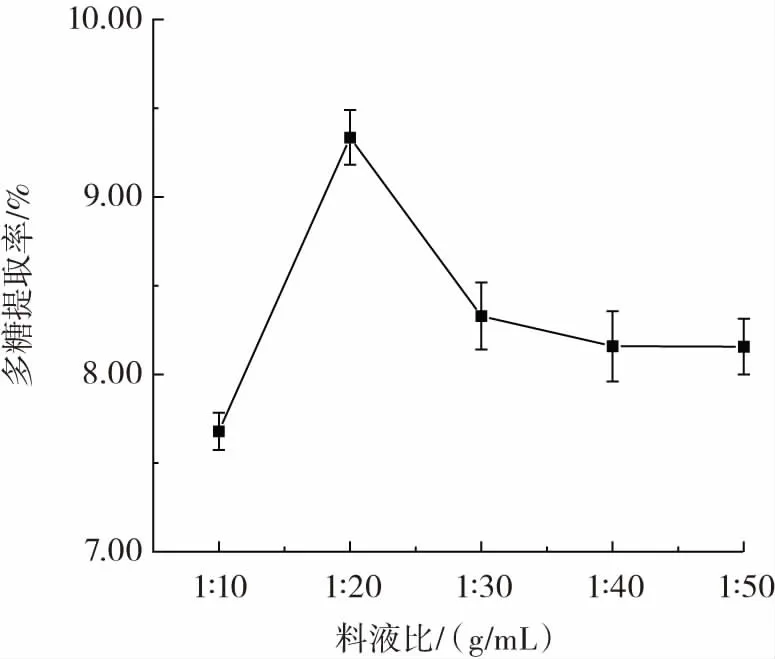
图4 料液比对多糖提取率的影响Fig.4 Effect of solid-to-liquid ratio on the yield of polysaccharides
从图4 可以看出,随着溶剂用量的增大,东海海参多糖提取率呈现先快速增加又逐渐降低的趋势,且在料液比为1∶20(g/mL)时达到最大值。这可能是由于溶剂量过大导致稀释效应,使得底物浓度降低,酶与物料接触的机会降低,使得酶解效果降低,不利于多糖物质溶出[26],并且溶剂用量过大会使后续多糖浓缩分离的成本增加,不利于实际工业化生产,因此,固定1∶20(g/mL)作为最佳酶解料液比,后续不进行正交试验。
2.4 东海海参多糖提取的正交试验结果
酶解法提取东海海参多糖正交试验结果见表3。
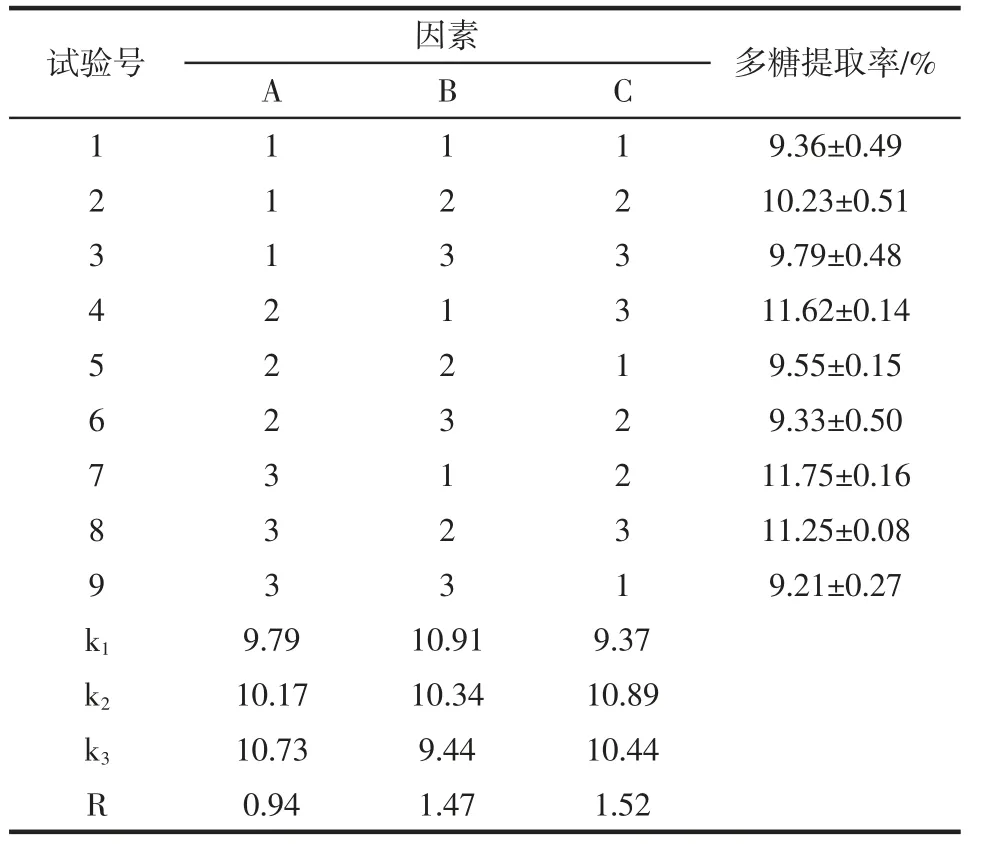
表3 正交试验方案设计及结果Table 3 Design and results of orthogonal test
由表3 可知,木瓜蛋白酶酶解提取东海海参多糖的最佳工艺为A3B1C2,即在料液比为1∶20(g/mL)的条件下,酶解条件为酶添加量1.0%,在55 ℃下酶解5 h;并且由极差R 值可以看出,在选取的3 个影响因素中,对东海海参多糖提取率的影响程度排序依次为C>B>A,即为酶添加量>酶解时间>酶解温度。
对正交试验进行多因素方差分析,结果见表4。
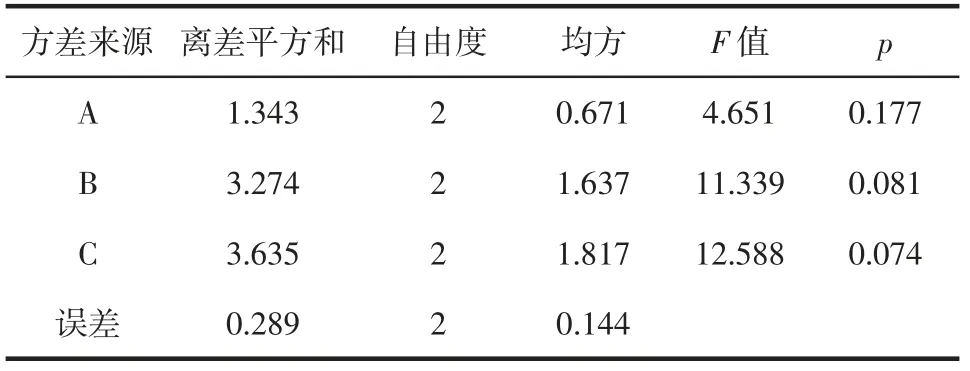
表4 正交试验结果方差分析Table 4 Analysis of variance of orthogonal test results
由表4 可知,酶添加量对多糖提取率的影响最为突出,酶解温度对多糖提取率的影响最小,根据F 值的大小,得到的各因素主次关系为酶添加量>酶解时间>酶解温度,这与极差分析所得结果一致。可能是由于设定的3 个温度水平均在该木瓜蛋白酶适宜作用温度范围,使得该次试验中酶解温度的影响效应最小,因此优化的提取工艺为料液比1∶20(g/mL)、酶解温度55 ℃、酶解时间5 h、酶添加量1.0%。
2.5 验证试验
为了检验所得最佳提取工艺的稳定性及可靠性,精确称取东海海参干粉5.00 g,以上述得到的最佳提取工艺进行试验验证。重复3 次平行,得到的东海海参多糖平均提取率为(11.85±0.27)%,大于正交试验方案中的最高值(11.75%±0.16)%,说明该工艺具有良好的稳定性和可靠性。
2.6 东海海参多糖的红外光谱分析
按照前述优化的提取工艺,对提取的东海海参多糖进行红外分析,结果见图5。
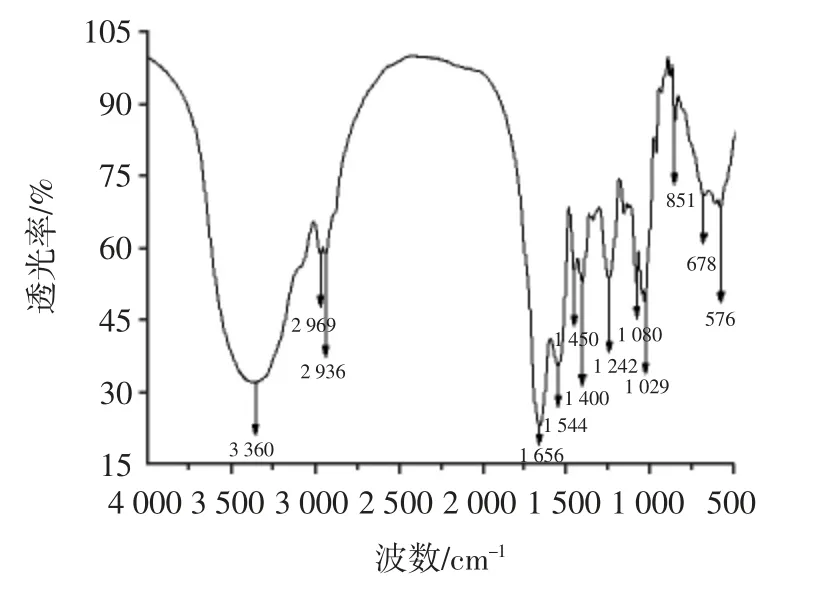
图5 东海海参多糖红外光谱扫描图Fig.5 IR spectrum of polysaccharides from Acaudina leucoprocta
从图5 可以看出,在3 360 cm-1处出现了1 个较强伸缩振动峰,这是由于O—H 的伸缩振动形成的,是多糖的特征吸收峰[27],表明样品中具有糖环羟基;而在2 969~2 936 cm-1处有1 个弱带,表明具有C-H 伸缩振动,这是多糖的次甲基C—H 振动吸收峰。另外在1 656 cm-1处的伸缩振动峰,与由C O 键的存在相关;而在1 242 cm-1的特征峰的产生则是与S O 键的存在有关,说明该多糖含有硫酸基。在850 cm-1处是C—O—S 的振动吸收峰,表明硫酸基在糖上的位置为C4 位。在1 080~1 029 cm-1和1 242~1 080 cm-1的特征峰,这是由醚键C—O—C 振动而产生的吸收峰表明多糖样品含有吡喃糖环。在890 cm-1处的吸收峰微弱,表明样品中含有少量β 型糖苷键,据此推断,该优化方法提取的东海海参多糖是一个典型的α-D-吡喃型多糖,这与Dong 等[28]从东海海参、黑乳参中提取的多糖的类型基本一致。
2.7 东海海参多糖的抗氧化性分析
2.7.1 东海海参多糖对DPPH·的清除能力分析
东海海参多糖对DPPH·的清除能力测定结果如图6 所示。
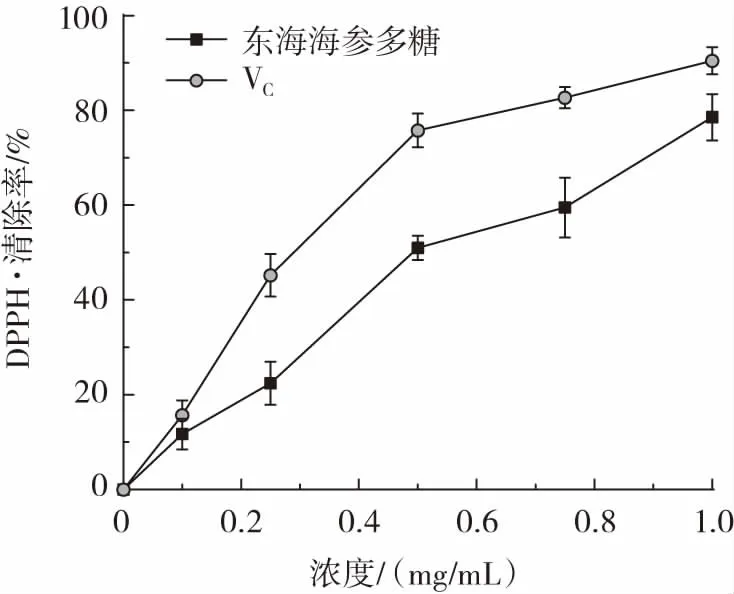
图6 东海海参多糖DPPH·清除率Fig.6 DPPH·scavenging rate of polysaccharides from Acaudina leucoprocta
DPPH·是一个比较稳定的基团,能够较好反映被测溶液的抗氧化活性,清除DPPH·的作用主要取决于抗氧化剂的供氢能力,被广泛用于抗氧化剂对自由基的清除活性的评价[29]。由图6 可以看出,在0~1.0 mg/mL浓度内,随着东海海参多糖浓度的增加,其清除DPPH·的效果逐渐增强,且具有明显的剂量关系,当多糖质量浓度提高到1.0 mg/mL 时,东海海参多糖对DPPH·的清除率达到(78.55±4.89)%,此时,阳性对照VC的DPPH·的清除率为(90.43±2.87)%,说明东海海参多糖具有较好的清除DPPH·能力。
2.7.2 东海海参多糖对·OH 的清除作用分析
东海海参多糖对·OH 的清除能力测定结果如图7所示。
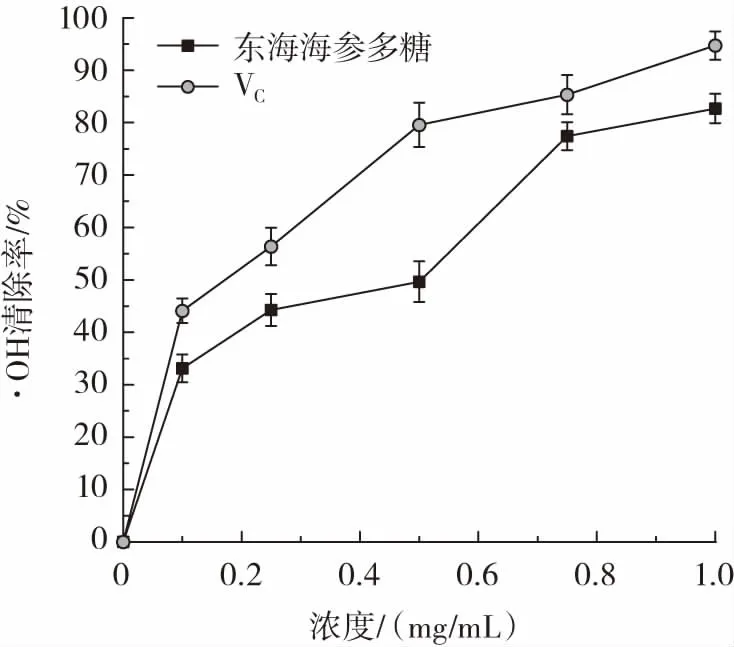
图7 东海海参多糖·OH 清除率Fig.7 Hydroxyl radical scavenging rate of polysaccharides from Acaudina leucoprocta
生物体内·OH 是最具代表的自由基,可能导致生物体内蛋白质、核酸、脂质、碳水化合物等大分子物质的破坏,从而加速生物体的老化[30]。由图7 可知,在多糖浓度为0.1~1.0 mg/mL 时,随着东海海参多糖质量浓度的增加,清除·OH 的效果逐渐增强,当质量浓度为1.0 mg/mL 时,清除率达到(82.71±2.81)%,阳性对照VC的·OH 清除率为(94.68±2.67)%,这表明东海海参多糖具有良好的·OH 清除活性。
海参多糖占干海参的6%以上,是海参的主要活性物质之一,其生物学活性主要取决于海参的结构,而海参的结构主要受到海参品种、分子量大小、提取方法等影响[31]。Mou 等[32]对墨西哥海参的研究表明,分支硫酸化模式为α-L-Fuc4S 的fCS-Am 抗氧化活性最强,经过降解后的低分子质量多糖的自由基清除能力比未降解多糖有所降低。本研究中东海海参多糖具有较好的抗氧化活性,这可能与本研究优化的酶解工艺有关系。
3 结论
采用木瓜蛋白酶酶解法提取东海海参多糖,得到最佳提取工艺为料液比1∶20(g/mL)、酶解温度55 ℃、酶解时间5 h、酶添加量1.0%,在此条件下东海海参多糖提取率为(11.85±0.27)%,且各因素对多糖提取率的影响程度为酶添加量>酶解时间>酶解温度。最优工艺提取的东海海参多糖具有典型的α-D-吡喃型多糖特征。东海海参多糖对DPPH·和·OH 的清除率均随多糖浓度升高而升高,具有明显的剂量关系且具有良好的抗氧化能力。本研究可为东海海参多糖的提取和功能成分的开发应用提供参考。
