慢性乙型肝炎和乙型肝炎肝硬化患者PBMCs 信号转导和转录激活因子3及血清可溶性CD30分子水平变化及其临床意义探讨*
2023-11-18邹涛,张敏,杨凡,王丽,喻峰
邹 涛,张 敏,杨 凡,王 丽,喻 峰
慢性乙型肝炎(chronic hepatitis B,CHB)是我国常见的病毒性肝炎,HBV长期感染导致肝纤维化,逐渐进展为肝硬化[1]。近年来研究发现,信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)[2-3]以及可溶性CD30分子(soluble CD30,sCD30)参与了肝纤维化的基因调控和信号转导,但它们的作用机制仍存在争议。在肝损伤早期阶段,STAT3可促进肝细胞再生,有利于肝细胞修复。随着肝脏免疫炎症反应加重,STAT3过度表达可促使肝纤维化病变的发生[4,5]。CD30是肿瘤坏死因子受体超家族成员,CD30与其配体结合可介导细胞增殖、活化、分化、凋亡,在肝纤维化的免疫炎症信号传导过程中具有关键的作用[6]。本研究检测了CHB和乙型肝炎肝硬化患者血清STAT3和sCD30水平,并分析了其与病情进展的关系,为临床诊治提供参考。
1 资料与方法
1.1 病例来源 2019年12月~2021年12月我院诊治的CHB患者45例(男35例,女10例,年龄25~58岁,平均年龄36.2±5.7岁,HBeAg阳性25例)和乙型肝炎肝硬化患者38例(男30例,女8例,年龄33~62岁,平均年龄45.0±7.6岁,失代偿期16例)。符合《慢性乙型肝炎防治指南(2015年版)》[7]和《肝硬化诊治指南(2019年版)》[8]诊断标准。纳入患者就诊3个月内未应用过α-干扰素或核苷(酸)类似物治疗。排除标准:(1)合并其他嗜肝病毒感染;(2)合并严重的心脑血管疾病、血液系统疾病、自身免疫性疾病、内分泌系统疾病、肾功能不全;(3)认知功能障碍或精神病。另选择同期在我院体检的健康人40例(男32例,女8例,年龄32~60岁,平均年龄为45.4±7.9岁)。本研究通过我院医学伦理委员批准实施,患者签署知情同意书。
1.2 外周血单个核细胞(PBMC)STAT3 mRNA水平检测 采集外周静脉血,采用淋巴细胞分离液分离出PBMCs,加入Trizol试剂提取细胞总RNA,加入氯仿0.2 ml,混匀30 s,冰浴静置3 min。然后,在4℃下,12000 r/m离心15 min。取上层水相移到新的EP管中,加入异丙醇0.5 ml,混匀,冰浴10 min。在4℃下,12000 r/m离心10 min。倾倒上层液体,用75%冰乙醇溶解下层沉淀物。在4℃下,12000 r/m 离心5 min。干燥下层沉淀物,加入DEPC处理水溶解RNA,-80℃保存。采用RT-PCR法扩增[试剂盒购自赛默飞世尔科技(中国)有限公司,Biometra TRobot II 384G实时荧光定量PCR扩增仪购自德国耶拿分析仪器有限公司]。试剂包括10×gDNA Eraser Buffer 1 μl,gDNA Eraser 0.5 μl,RNA Template1 10 pg~1 μg,加入RNase-Free水至10 μl。涡旋震荡混匀,短暂离心,使管壁上的溶液收集到管底。42℃孵育2 min。在反应结束后,短暂离心,置于冰上冷却。引物由Invitrogen公司合成,STAT3 mRNA上游引物:5’-GGTTAGAACCCTACACGAAG-3’,下游引物:5’-CTACAGA GCCCACTATCCG-3’。RT-PCR反应体系:2×SuperReal PreMix Plus 10 μl,上游引物(10 μM)0.6 μl,下游引物(10 μM)0.6 μl,cDNA100 ng,RNase Free ddH2O 20 μl。95℃ 15 min,95℃10 s,53~58℃ 30 s,72℃ 30 s,循环40次。以 GADPH为内参,采用2-△△CT法进行相对定量分析。
1.3 血清sCD30 采用ELISA法检测血清sCD30水平(德国IBL公司)。设置标准品孔和样本孔,在标准品孔各加不同浓度的标准品50 μl,在样本孔先加待测血清10 μl,再加样本稀释液40 μl,空白对照孔不加血清。除空白对照孔外,在标准品孔和样本孔中每孔加入辣根过氧化物酶标记的检测抗体100 μl,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min。弃去液体,使用洗板机重复洗板5次。每孔加入底物a、b各50 μl,37℃避光孵育 15 min。每孔加入终止液50 μl,15 min内在800TS酶标仪(美国BioTek公司)450 nm波长处测定各孔的吸光度OD值。以OD值为纵坐标(Y),以标准品浓度为横坐标(X对数坐标),绘制标准曲线,将待测血清样品的OD值代入回归方程,计算出其血清浓度。
1.4 治疗方法 给予两组患者恩替卡韦(安徽贝克生物制药有限公司,国药准字H20140037)0.5 mg口服,1次/d或富马酸替诺福韦二吡呋酯片(正大天晴药业集团,国药准字H20173303)300 mg口服,1次/d。给予乙型肝炎肝硬化患者综合治疗,除抗病毒药物外,给予复方甘草酸苷片(北京凯因科技股份有限公司,国药准字H20083001)2片口服,3次/d,安络化纤丸(森隆药业有限公司,国药准字Z20010098)6 g口服,2次/d。对于存在腹水的患者,给予利尿剂、白蛋白、腹腔穿刺放腹水等措施。

2 结果
2.1 三组有关指标比较 CHB患者血清ALT水平升高,肝硬化患者血清胆红素水平升高,而白蛋白水平降低;肝硬化患者PBMC STAT3 mRNA和血清sCD30水平显著高于CHB组或健康人(P<0.05,表1)。
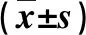
表1 三组有关指标比较
2.2 不同状态CHB和肝硬化PBMC STAT3 mRNA和血清sCD30水平比较 HBeAg阳性的CHB患者PBMC STAT3 mRNA和血清sCD30水平显著高于HBeAg阴性患者(P<0.05),失代偿期肝硬化患者STAT3 mRNA和sCD30水平显著高于代偿期患者(P<0.05,表2)。
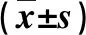
表2 不同状态CHB和肝硬化患者STAT3 mRNA和sCD30水平比较
2.3 治疗前后CHB和肝硬化患者PBMC STAT3 mRNA和血清sCD30水平比较 与治疗前比,在治疗3个月和6个月后,两组STAT3 mRNA和sCD30水平均显著下降(P<0.05,表3)。
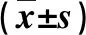
表3 两组治疗前后STAT3 mRNA和sCD30水平比较
3 讨论
肝纤维化是肝脏结缔组织异常增生的病理学过程。在肝纤维化早期,胶原、糖蛋白、蛋白多糖等细胞外基质生成和降解之间的不平衡是可逆的,但在HBV感染引起的免疫炎症反应反复刺激下,促纤维化细胞激活增殖,发生上皮间质转化反应[9],促使肝细胞和肝内胆管上皮细胞转化为成纤维细胞,肝纤维化加重,肝脏微细结构发生紊乱,肝细胞结节样再生,形成假小叶结构,逐步进展为肝硬化。此时,慢性肝病的病程已难以逆转[10,11]。STAT3是肝纤维化和肝细胞增殖与凋亡平衡的关键调节因子[12]。有研究[13]表明,在小鼠肝脏模型可检测到STAT3蛋白磷酸化。本研究也发现,CHB和乙型肝炎肝硬化患者PBMC STAT3 mRNA水平上调,显著高于健康人,给予抗病毒和抗炎护肝药物治疗后,STAT3 mRNA水平逐渐下降。血清HBeAg阳性、失代偿期肝硬化和发病期间STAT3 mRNA水平高于HBeAg阴性、代偿期肝硬化和治疗后病情稳定患者,也提示STAT3 mRNA水平与病情进展和预后密切相关。一般认为,STAT3在肝纤维化进展过程中具有双向调节作用。一方面,STAT3信号通路介导白细胞介素6(IL-6)相关的肝脏保护机制,抑制肝脏免疫炎症反应;另一方面,细胞因子信号转导抑制因子通过IL-6/ STAT3信号通路抑制促凋亡蛋白,拮抗γ干扰素,诱导抗凋亡蛋白,减轻肝纤维化[14]。不过,随着肝脏免疫炎症反应加重,STAT3过度表达经由非受体型酪氨酸蛋白激酶(JAK2)途径,使促纤维化细胞激活增殖,诱导肝纤维化[15,16]。有动物实验探讨了IL-6/ STAT3信号通路在肝纤维化发生过程中的作用,应用IL-6处理肝星状细胞,与未处理细胞相比,处理后的细胞STAT3磷酸化水平显著提高,提示STAT3过度表达可促进肝星状细胞增殖,促进肝纤维化[17]。利用外泌体作为递送导管特异性靶向STAT3,将成纤维细胞样间充质干细胞的外显子体工程化,携带靶向STAT3的siRNA,抑制了小鼠肝纤维化发展过程中STAT3表达和细胞外基质沉积,并显著改善了肝功能[18]。
CD30是肿瘤坏死因子受体超家族成员。本研究发现,CHB和乙型肝炎肝硬化患者血清sCD30水平显著高于健康人,而肝硬化患者血清水平有显著高于CHB患者,提示CD30表达上调可能与肝纤维化密切相关。随着治疗进步,血清sCD30水平也呈下降趋势。另外,HBeAg阳性的CHB患者血清sCD30水平显著高于HBeAg阴性者,失代偿期肝硬化患者sCD30水平也显著高于代偿期患者,说明sCD30水平与肝病活跃程度有关。CD30在Th1型细胞免疫应答过程中的活跃性降低,无法抑制HBV持续复制,肝细胞表面病毒抗原大量表达,刺激大量炎症因子生成,引起肝脏免疫炎症反应[19,20]。在Th2型细胞免疫应答过程中,CD30活跃度增加,辅助B细胞活化,发挥体液免疫反应作用,能有效抑制HBV复制,提高病毒清除效率,减轻肝细胞损伤。
综上所述,CHB和乙型肝炎肝硬化患者PBMC STAT3和血清sCD30水平上调,可能与病情进展和预后密切相关。