非酒精性脂肪性肝病患者肠道菌群及血清IL-17和INF-γ水平变化*
2023-11-18侯义林曹风华纪小燕
侯义林,曹风华,纪小燕,蔡 燕
非酒精性脂肪性肝病(nonalcoholic fatty liver diseases,NAFLD)是指除酒精和其他明确损肝因素以外所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,包括单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)及其相关的肝硬化等疾病[1]。当前,NAFLD已成为欧美等发达国家和我国富裕地区慢性肝病的重要病因之一。普通人群NAFLD患病率在10%~30%之间[2]。临床研究表明,NAFLD可直接导致失代偿期肝硬化和肝细胞癌,严重威胁患者生命健康[3]。NAFLD发病与胰岛素抵抗(IR)密切相关,后者通过影响脂肪分解和胰岛素分泌等导致脂代谢紊乱,进而引起肝细胞脂质蓄积[4]。此外,机体炎症反应能够加重肝细胞损伤。白细胞介素-17(interleukin-17,IL-17)作为促炎因子能够刺激免疫细胞释放炎症因子,加快脂质沉积和异常氧化反应[5]。γ-干扰素(gamma interferon,INF-γ)属于Th1细胞因子,参与多种肝脏炎症性疾病的发生和发展[6]。近年来,肝脏疾病肠道微生态研究是众多医学研究者关注的热点。肝脏疾病患者肝组织受损后可通过“肠-肝轴”引起肠道菌群的变化[7]。肠道微生态平衡是维持机体健康和阻止疾病进展的重要条件[8]。NAFLD患者粪便肠杆菌、肠球菌、双歧杆菌和拟杆菌均发生异常变化[9],而这些变化可能与机体炎症反应有关[10]。本研究检测了NAFLD患者肠道菌群及血清IL-17和INF-γ水平,现将结果报道如下。
1 资料与方法
1.1 一般资料 2019年1月~2022年1月我院收治的NAFLD患者102例,男62例,女40例;年龄为25~65岁,平均年龄为(46.5±9.4)岁。诊断符合2017年《亚太地区非酒精性脂肪性肝病指南简介》[11]的标准。NAFLD患者血清ALT水平大于正常值上限的2倍,持续时间大于4周者,诊断为非酒精性脂肪性肝炎(NASH)。排除标准:(1)自身免疫性肝病、病毒性肝炎等能导致脂肪肝的疾病;(2)胃肠道疾病;(3)心血管疾病;(4)肾功能障碍;(5)精神疾病;(6)血液系统疾病;(7)妊娠期或哺乳期女性;(8)恶性肿瘤;(9)近2周使用过微生态制剂和抗生素。另选择同期来院的健康体检者48例,男29例,女19例;年龄为24~66岁,平均年龄为(46.9±9.7)岁。两组年龄和性别资料可比(P>0.05)。本研究获得我院医学伦理委员会批准,患者签署知情同意书。
1.2 血清IL-17和INF-γ水平检测 采用ELISA法检测血清IL-17和INF-γ水平(武汉三鹰生物技术有限公司)。
1.3 粪便菌群检测 采集新鲜粪便1.5g,置于无菌管中,并于30 min内送至实验室。取粪便0.1 g,加入生理盐水9.9 mL稀释,充分震荡,制成稀释液,稀释梯度设置为1:102、1:103、1:104、1:105、1:106、1:107和1:108,选择1:104、1:105和1:1063个稀释梯度,分别吸取稀释液1 mL,加于培养皿中,每个稀释度做3个重复,将稀释液分别接种于培养双歧杆菌、乳杆菌、肠杆菌和肠球菌的选择培养基上,将培养双歧杆菌和乳杆菌的培养皿置于厌氧罐中,37℃恒温培养48~72 h。将培养肠杆菌和肠球菌的培养皿直接置于37℃恒温培养箱培养24~48 h,在培养完成后,计数平板菌落数,结果以每克新鲜粪便菌落形成单位的对数值表示,即lg CFU/g,lg CFU/g=菌落个数×稀释倍数×(标本质量+稀释量)/标本质量。计算B/E比值,即B/E比值=双歧杆菌数量/肠杆菌数量。

2 结果
2.1 NAFLD患者与健康体检者肠道菌群比较 NAFLD患者乳杆菌、双歧杆菌数量和B/E比值均显著小于健康体检者(P<0.05),而肠球菌和肠杆菌数量均显著大于健康体检者(P<0.05,表1)。
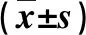
表1 两组粪便肠道菌群比较
2.2 NAFLD患者与健康体检者血清IL-17和INF-γ水平比较 NAFLD患者血清INF-γ水平显著低于健康体检者(P<0.05),而血清IL-17水平显著高于健康体检者(P<0.05,表2)。
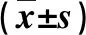
表2 两组血清IL-17和INF-γ水平比较
2.3 单纯性脂肪肝与NASH患者粪便肠道菌群比较 在本组NAFLD患者中,发现NASH患者38例,单纯性脂肪肝患者64例。NASH患者粪乳杆菌、双歧杆菌数量和B/E比值均显著小于单纯性脂肪肝患者(P<0.05),而肠球菌和肠杆菌数量均显著大于单纯性脂肪肝患者(P<0.05,表3)。
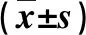
表3 单纯性脂肪肝与NASH患者粪便肠道菌群比较
2.4 单纯性脂肪肝与NASH患者血清IL-17和INF-γ水平比较 NASH患者血清IL-17水平显著高于单纯性脂肪肝患者,而血清INF-γ水平显著低于单纯性脂肪肝患者(P<0.05,表4)。
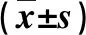
表4 单纯性脂肪肝与NASH患者血清IL-17和INF-γ水平比较
3 讨论
NAFLD发病原因复杂,与遗传、代谢、环境、应激等多种因素有关,其发病机制尚未完全明确[12,13]。有研究发现,肠道菌群失调在NAFLD发生发展过程中具有重要的作用[14]。机体肠道菌群包括有害菌和有益菌,健康机体肠道中有害菌和有益菌保持动态平衡,共同维持肠道微生态环境[15]。临床研究发现,当NAFLD患者肠道菌群紊乱后有害菌数量异常增加,有益菌数量明显下降,进而破坏肠道黏膜屏障,损害肝细胞,促进肝细胞凋亡和坏死[16]。部分研究认为,NAFLD患者肠道微生态失调能够引起肠杆菌等革兰氏阴性菌过度生长,细菌内毒素可以通过受损的肠黏膜屏障进入肝脏系统,进而刺激肝脏产生大量的炎症因子,加重NASH[17]。
本研究结果显示,NAFLD患者乳杆菌、双歧杆菌数量、B/E比值、血清INF-γ水平均低于健康体检者,而肠球菌、肠杆菌数量、血清IL-17水平均高于健康体检者,说明NAFLD患者肠道菌群及血清IL-17和INF-γ水平均发生异常变化。肠道菌群种类繁多,数量庞大,多种菌群形成复杂的肠道微生态系统,共同影响多种疾病的发生、发展[18]。乳杆菌、双歧杆菌均为有益菌,而肠球菌和肠杆菌均为中性菌,但在特定条件下,肠球菌和肠杆菌可以转为致病菌[19]。NAFLD患者肝脏病变使胆汁异常分泌,游离性胆汁酸对肠道内酸碱平衡调节失控,进而引起肠道菌群失调[20]。此外,肝脏病变后胃肠道蠕动减弱,影响胃肠道分泌功能,肠道清除能力降低,使得有害菌过度繁殖[21]。本研究在NAFLD患者中发现NASH患者38例,单纯性脂肪肝64例。NASH患者肠球菌、肠杆菌数量、血清IL-17水平均显著高于单纯性脂肪肝患者,而乳杆菌、双歧杆菌数量、B/E比值、血清INF-γ水平均低于单纯性脂肪肝患者。NAFLD患者肝功能受损导致肠道黏膜充血、水肿,肠道通透性增加,细菌及其内毒素可以通过损伤的肠道黏膜屏障进入肝脏系统,加重机体炎症反应,进而导致IL-17和INF-γ释放改变。动物实验研究发现,NASH小鼠肠道致病菌数量异常增加,有益菌数量明显减少,导致肠道菌群紊乱,影响菌群结构特征,导致细菌移位,引起肠道免疫屏障破坏,而肠道免疫系统应答被激活后分泌炎性细胞因子,可加重NASH[22]。辅助性T细胞是连接肠道菌群和肠道免疫屏障的关键细胞亚群,Th1细胞可产生大量的INF-γ,Th17细胞分泌产生IL-17。IL-17和INF-γ参与宿主感染、免疫、防御等病理学过程[23]。NAFLD患者肠道菌群失调,与NASH密切相关。然而,影响肠道菌群的因素较多,饮食、基因、环境等多种复杂因素均可影响肠道菌群变化。深入研究NAFLD患者肠道菌群及血清IL-17和INF-γ水平变化意义重大。
综上所述,NAFLD,尤其是NASH患者,肠道菌群及血清IL-17和INF-γ水平均发生异常变化。肠道菌群失调可能通过影响IL-17和INF-γ水平变化进而影响疾病发生和发展。临床上,可通过调整机体肠道菌群结构及血清IL-17和INF-γ水平变化,以改善肝功能损伤。