格卡瑞韦/哌仑他韦治疗HCV感染者和人类免疫缺陷病毒合并HCV感染者疗效及安全性研究*
2023-11-18曹汴川汤玲毓郭明贤袁天茹严一凯黄富礼黄永茂
曹汴川,刘 梅,丁 苹,汤玲毓,郭明贤,周 仙,袁天茹,严一凯,黄富礼,黄永茂
慢性丙型肝炎(chronic hepatitis C,CHC)是由丙型肝炎病毒(hepatitis C virus,HCV)感染导致的以肝脏损害为主的慢性传染病。HCV主要经静脉注射毒品、血液和性接触传播。凉山彝族自治州曾是外部毒品进入中国内陆地区的重要通道之一。据报道,该地区静脉注射毒品人群人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染率较高[1-3]。由于HCV和HIV有着共同的传播途径,因此HCV感染和HIV合并HCV感染也较为常见[4]。自2011年第一代直接抗病毒药物(direct antiviral agents,DAAs)问世以来,抗HCV治疗逐渐从以α-干扰素为基础的治疗方案转向全口服药物的治疗方案[5-7]。DAAs特异性靶向作用于HCV复制周期中的病毒蛋白,从而阻断病毒复制。DAAs主要包括非结构蛋白(non-structural,NS)3/4A蛋白酶抑制剂(proteinase inhibitor,PI)、NS5A抑制剂和NS5B聚合酶抑制剂等三大类药物[8]。目前,国内外各大指南均建议采用无干扰素的DAAs治疗方案为优先推荐的抗HCV治疗方案[8, 9]。格卡瑞韦/哌仑他韦属于一种泛基因型的NS3/4A蛋白酶抑制剂/NS5A抑制剂,在某些情况下,可将目前抗HCV治疗12周的时间缩短至8周[10]。本研究评估了应用格卡瑞韦/哌仑他韦治疗HCV感染和HIV合并HCV感染者疗效及安全性,现将结果报道如下。
1 资料与方法
1.1 研究对象 2021年4月~2021年12月凉山彝族自治州越西县第一人民医院诊治的HCV感染者25例,男性20例,女性5例,年龄为28~66岁,平均年龄为41.0±9.1岁,其中慢性丙型肝炎(CHC) 22例,代偿期肝硬化3例; HIV合并HCV感染者27例,男性19例,女性8例,年龄为13~55岁,平均年龄为36.4±7.8岁,其中CHC 25例,代偿期肝硬化2例。依据丙型肝炎防治指南(2019年版)的标准[5]诊断,纳入患者年龄≥12岁,体质量≥45 kg,均为初治患者。排除标准:(1)妊娠期、哺乳期或治疗期间有妊娠计划;(2)失代偿期肝硬化或既往有肝功能失代偿病史。
1.2 治疗方法 给予所有患者格卡瑞韦/哌仑他韦(由中国性病艾滋病防治协会捐赠)300 mg/120 mg口服,1次/d,治疗8周。对于非基因3型代偿期肝硬化患者,治疗12周;对于基因3型CHC患者,治疗12周;对于基因3型代偿期肝硬化患者,治疗16周;对于正在应用含奈韦拉平、依非韦伦或洛匹那韦/利托那韦方案抗HIV治疗者,将抗HIV治疗方案更换为艾考恩丙替片继续治疗,再联合抗HCV感染治疗。待抗HCV治疗结束后,再更换为原方案或继续艾考恩丙替片抗HIV治疗;对于合并HBV感染者,在抗HCV治疗的同时予以恩替卡韦或替诺福韦抗HBV治疗;在抗HCV治疗前,患者血清HBV DNA为阳性,则在抗HCV治疗结束后继续予以抗HBV治疗;在抗HCV治疗前,患者HBV DNA为阴性,则在抗HCV治疗结束3个月内停用抗HBV治疗。
1.3 检测与检查 使用上海力康公司提供的X960型PCR仪和采用实时荧光定量PCR法检测血清HCV RNA[复星诊断科技(上海)有限公司,最低检测下限为15 IU/mL];使用上海宏石医疗科技有限公司提供的SLAN96P荧光定量PCR仪和采用PCR-荧光探针法检测HCV 基因分型(湖南圣湘生物科技股份有限公司,该试剂所覆盖的HCV基因型为1型、1b型、2型、3型和6型);使用深圳迈瑞生物医疗电子股份有限公司提供的BC-6000血液分析仪检测血常规;常规检测血清肝肾功能指标;采用胶体金法检测血清HBV标志物[英科新创(厦门)科技股份有限公司];使用深圳迈瑞生物医疗电子股份有限公司提供的Resona 7彩色多普勒超声诊断仪检测肝脏超声。依据天冬氨酸氨基转移酶与血小板比值指数(APRI)>2或纤维化-4指数(FIB-4)> 3.25或肝脏超声诊断肝硬化。
1.4 随访 在抗HCV治疗期间,每4周随访1次。在抗HCV治疗结束后,每12周随访一次。
1.5 疗效及安全性评估 疗效评估是记录抗HCV治疗结束后 12周,血清HCV RNA载量低于检测下限所占的比例(SVR12);安全性评估是记录治疗过程中不良事件(adverse events,AEs)发生情况。

2 结果
2.1 一般资料 HCV感染和HIV合并HCV感染者一般资料见表1。
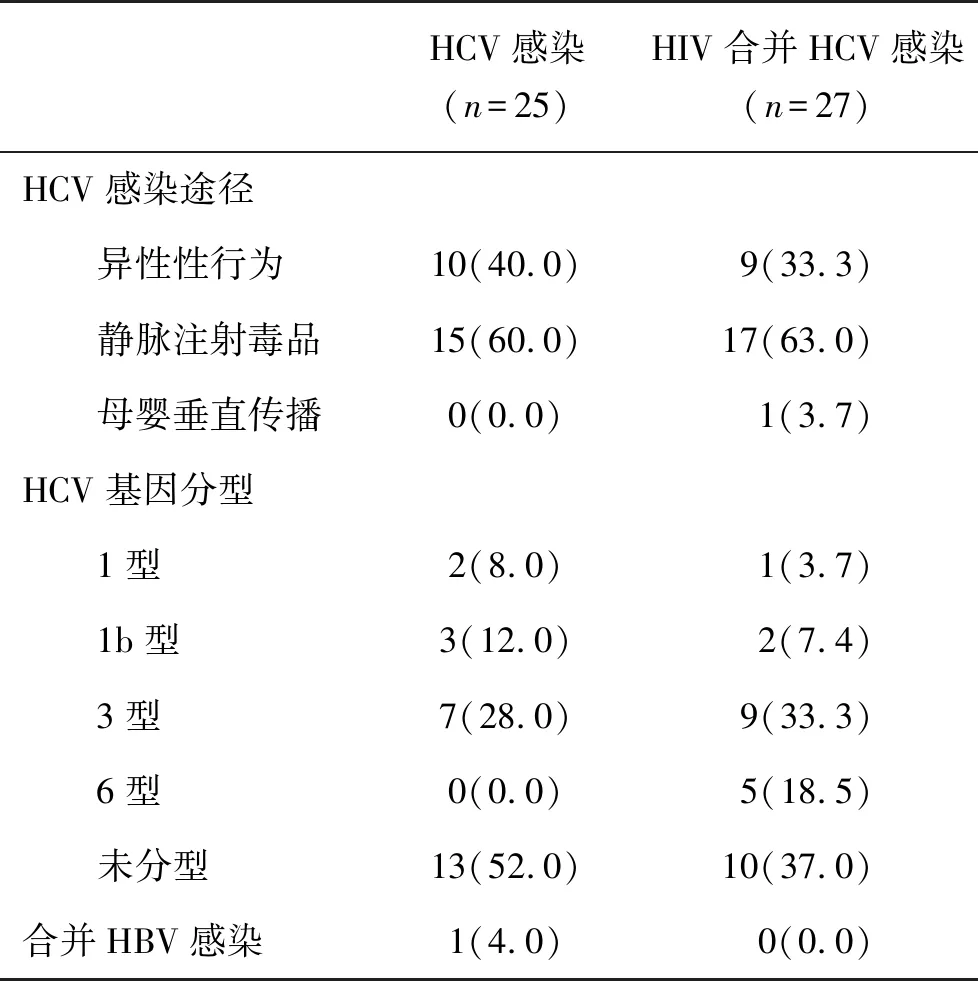
表1 两组一般资料(%)
2.2 基线临床特征 52例患者的基线临床特征中,HCV感染者的血红蛋白、总胆红素高于HIV合并HCV感染者,且差异具有统计学意义(P=0.031;P=0.001,表2)。
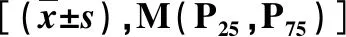
表2 两组基线临床指标
2.3 两组疗效与安全性情况 在治疗结束时,HCV感染者实现SVR12为92.0%,HIV合并HCV感染者实现SVR12为88.9%,但两组间差异无统计学意义(P=1.000);不同年龄、HCV感染途径、HCV基因型、合并HBV感染和存在代偿期肝硬化患者SVR12见表3。应用格卡瑞韦/哌仑他韦的主要不良反应为头痛、疲劳、恶心和腹泻等。在本研究,所有患者对该药物耐受性良好,均未发生不良事件导致的治疗方案调整或中止。

表3 两组SVR12(%)比较
3 讨论
HCV感染是世界范围内面临的一个重大公共卫生问题,每年影响7100多万人,造成约40万人死亡[9],而我国 CHC 患者约为950万左右,数量庞大[11, 12]。丙型肝炎起病大多隐匿,出现症状时大部分都伴有肝功能损害,甚至部分进展为肝硬化或肝癌。抗HCV治疗可清除HCV感染,阻止病变进展为肝硬化、肝衰竭,甚至肝癌[13]。自DAAs问世以来,治疗HCV 感染经历了一场革命。在 DAAs上市前,大部分患者接受的基于α-干扰素联合利巴韦林的治疗方案,仅有约50%患者可获得SVR[14]。由于部分患者对上述药物耐受性差或存在禁忌证,导致CHC患者的总体治疗效果不甚理想。应用DAAs方案治疗的患者有超过90%以上实现了病毒学治愈,且患者对DAAs的耐受性更好[8]。因此,世界卫生组织启动了一项计划,旨在2030年前消除病毒性肝炎[15]。同样,中国也在实现该计划。本研究以格卡瑞韦/哌仑他韦为基础治疗HCV感染,这是第一次应用格卡瑞韦/哌仑他韦治疗本地区HCV感染和HIV合并HCV感染患者的初步研究,结果显示具有良好的疗效和安全性。
HCV属于黄病毒科的单股正链RNA病毒。由于HCV具有显著异源性和高度可变性,而且同一基因组不同部分的变异程度差异很大。目前,HCV可分为6种基因型和多种亚型[16, 17]。HCV基因型的分布与患者的感染途径和区域位置有关。在世界范围内,美国、中国和日本,感染HCV基因型以1型为主,2a型主要分布在亚洲国家,3型主要分布在南亚,4型和5型常见于中东和非洲,6型主要见于我国香港和澳门。目前,我国主要流行的HCV基因型为1型、2型、3型和6型,其中以1b型(66%)和2a型(14%)为主[18,19]。在本研究,我们发现在成功进行了HCV基因分型的患者中,HCV基因型以3型为主。目前,采用泛基因型 DAAs方案治疗后,HCV感染者获得SVR可达到 90% 以上。格卡瑞韦/哌仑他韦作为一种泛基因型的抗HCV药物,治疗8周时,在基因1型、2型、3型和6型感染患者SVR 12 分别为99.8%、99%、97%和100%;在治疗12周,在基因1型、2型和6型感染患者 SVR 12为 99%、100%和100%;治疗16周,在基因3型感染患者SVR 12为96%[8, 20]。在本研究,我们同样发现在HCV感染和HIV合并HCV感染者,可以获得总体良好的SVR12。同时,所有患者对该药物耐受性良好,均未发生不良事件导致的治疗方案调整或中止。本研究结果表明了格卡瑞韦/哌仑他韦治疗HCV感染和HIV合并HCV感染者均具有较好的疗效和较高的安全性。
本研究仍存在一定的局限性。首先,本研究为单中心研究,且样本量较小。同时,由于格卡瑞韦/哌仑他韦禁用于肝功能损害较重的患者,在纳入研究对象时可能低估了当地合并中度至重度肝功能损害患者的数量;其次,本研究中所采用的HCV基因分型检测试剂只能针对HCV基因1型、1b型、2型、3型和6型,无法排除4型、5型以及混合基因型感染的可能,因而导致本研究中HCV基因未分型的比例较高;最后,研究对象在入组时,未完全排除其它病因导致的肝功能损害,如自身免疫性肝病、药物性肝损害或其它嗜肝病毒感染。然而,本研究结果仍然补充了格卡瑞韦/哌仑他韦治疗本地区HCV感染和HIV合并HCV感染者的疗效及安全性的稀缺资料。进一步研究将包括更多病例和更为复杂的真实世界病例,以揭示DAA类药物的长期疗效。
综上所述,应用格卡瑞韦/哌仑他韦治疗HCV感染和HIV合并HCV感染者具有较好的近期疗效和较高的安全性。