维生素A和乙酸交互作用对奶牛乳腺上皮细胞中乳成分合成相关基因表达的影响
2023-11-18郭咏梅刘阳武汭闫素梅赵艳丽郭晓宇
郭咏梅,刘阳,武汭,闫素梅,赵艳丽,郭晓宇
维生素A和乙酸交互作用对奶牛乳腺上皮细胞中乳成分合成相关基因表达的影响
郭咏梅,刘阳,武汭,闫素梅,赵艳丽,郭晓宇
内蒙古农业大学动物科学学院/内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018
【目的】在前期研究发现维生素A(VA)对奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)内乳脂和乳蛋白合成相关基因表达具有显著促进效果的基础上,以奶牛乳腺上皮细胞为研究对象,添加乳脂肪合成前体物乙酸(acetic acid,AA),旨在探究VA和AA二者在乳成分合成相关基因表达上是否存在互作关系,借此更系统地了解VA参与乳脂、乳蛋白合成的调控机制,为奶牛饲料中合理添加VA及改善乳品质提供科学依据。【方法】采用胶原酶消化法培养细胞,将第三代BMECs分为6个处理组,分别加入不同浓度的VA和AA混合工作液, 6个处理组依次命名为对照组(0 mg·mL-1VA+0 mol·L-1AA)、AA处理1组(0 mg·mL-1VA+0 .006 mol·L-1AA)、AA处理2组(0 mg·mL-1VA+0.01 mol·L-1AA)、VA处理组(0.001 mg·mL-1VA+0 mol·L-1AA)、VAAA1组(0.001 mg·mL-1VA+0.006 mol·L-1AA)和VAAA2组(0.001 mg·mL-1VA+0.01 mol·L-1AA)。培养结束后收集细胞和培养液样品,采用MTT法测定细胞增殖率;采用试剂盒法测定甘油三酯含量、乳脂和乳蛋白合成关键酶的活性;采用实时定量PCR技术测定并计算乳脂和乳蛋白合成相关基因的相对表达量。【结果】添加VA后显著提高了细胞增殖率(<0.001),但添加AA、VA与AA的组合效应均对细胞增殖率无显著影响(>0.05)。VA和AA在乳脂合成方面存在互作效应,AA能提高BMECs内的甘油三酯(TG)含量(=0.01),同步添加VA则对TG的合成产生明显的抑制作用(=0.01);AA能提高细胞内脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶(ACACA)的活性及过氧化物酶体增殖物激活受体γ()基因的表达(<0.05;<0.05;<0.001),同时添加VA则极显著地抑制(<0.001;=0.01;<0.01);AA显著提高了BMECs内哺乳动物雷帕霉素靶蛋白(mTOR)含量(=0.05)、p70核糖体蛋白S6激酶1(S6K1)酶活性(<0.001),并上调了κ-酪蛋白()的基因表达(<0.001),与β-酪蛋白()的基因表达受到两者互作效应的影响(=0.02),同时添加VA与AA时会减弱单独添加VA或AA后对与的基因表达的下调作用。【结论】AA处理组2对乳脂合成的促进效果较好,VAAA2组较弱;AA处理1组对乳蛋白合成促进作用较好,VAAA1组较弱。因此,单独添加0.01 mol·L-1的AA对促进乳脂合成较好,0.006 mol·L-1的AA则更利于乳蛋白的合成。
维生素A;乙酸;互作;奶牛乳腺上皮细胞;乳成分
0 引言
【研究意义】2022年中央一号文件提出要把重点放在粮食生产和重要农产品供给上,加快奶业生产规模,保证“菜篮子”产品供给。在乳品消费方面,由于我国人民生活水平的提高,消费者的需求不断增加,且消费者更青睐使用国内新鲜奶源加工而成的乳制品。奶业作为农业现代化的重要标志之一,同时为满足消费内需和初级农产品的有效供给,我们国家的奶业急需加强内功和核心竞争力[1]。乳脂肪和乳蛋白是乳中的主要成分,也是衡量乳品品质的重要营养指标。根据目前我们国家的奶业生产的饲料资源和生产环境等状况,促进乳蛋白合成和改善乳品质在提高我国奶业核心竞争力方面属于重中之重[2]。乳品质直接影响奶牛养殖场及乳品厂的经济效益,改善牛奶成分,生产高质量的鲜奶是提升奶牛生产经济效益的关键。因此,如何通过营养调控措施来提高和改善牛奶质量,增加其营养价值,尤其是提高牛奶乳脂肪和乳蛋白的含量,优化牛奶组分是国际牛奶产业研究的热点问题。【前人研究进展】维生素A(VA)作为机体重要营养素之一,参与调节体内脂质代谢。有大量研究证明,饲料中添加维生素A会影响动物机体内脂类分解代谢,大剂量的视黄醇灌服会导致大鼠肝脏中脂滴的累积[3],还会增加不同亚型大鼠肝脏内的胆固醇、脂肪酸及TG含量。VA通过影响脂质分解代谢改善反刍动物的生产性能,从分娩前60 d至产后42 d,给奶牛饲喂17 000 IU/d的VA,其产奶量显著高于饲喂50 000 IU/d的VA[4],同时还促进了乳脂和乳蛋白等乳成分的合成。课题组前期的研究发现体外添加VA在不同程度上提高了BMECs细胞增殖率及TG含量、乳脂乳蛋白合成相关酶活性和基因表达,且0.001 mg·mL-1的浓度促进效果最好。牛乳中的脂肪酸主要来源于两个部分,一部分是日粮经过水解形成的脂肪酸,另一部分是瘤胃发酵产生的脂肪酸,主要包括乙酸(acetic acid, AA)和丁酸,为乳腺内脂肪酸的合成提供了碳源,其在血液中的浓度直接影响了乳脂和乳蛋白的合成。有研究显示,AA的浓度与乳腺组织合成乳脂的能力呈正向相关,同时对乳蛋白的合成也有一定调节作用,但浓度过高时脂肪组织利用较多。Purdie等[5]研究指出,奶牛阴外动脉灌注AA显著增加了乳蛋白率,乳脂率也有增加的趋势;塔娜等[6]研究结果表明,培养液中添加12 mmol·L-1的乙酸钠能显著上调奶牛乳腺上皮细胞(bovine mammary epithelial cells, BMECs)中脂肪合成相关基因脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶(ACACA)、二酰甘油酰基转移酶和过氧化物酶体增殖物激活受体γ(peroxisome proliferative activated receptor gamma, PPARG)的表达,并且显著提高细胞内甘油三酯(TG)含量。在此之前,本课题组也进行了AA对BMECs内乳脂合成相关基因表达及TG含量影响的探索,研究发现BMECs内PPARG、瘦素[7]及ACACA、FASN的基因表达[8]均受到AA的正向调控,且最佳作用浓度均在8—12 mmol·L-1;生冉[9]研究表明,添加6 mmol·L-1的AA会下调BMECs中酪蛋白s1-酪蛋白(CSN1S1)mRNA的相对表达量;可以上调β-酪蛋白(CSN2)、κ-酪蛋白(CSN3)mRNA的相对表达量以及CSN2的蛋白表达水平。关于乳腺内乳蛋白合成调控最受人们关注的是Janus激酶-信号转导与转录激活因子(JAK-STAT)信号转导途径和调节蛋白质翻译的哺乳动物雷帕霉素靶蛋白(mTOR)信号途径,AA对mTOR信号通路相关基因与JAK2、的表达也有一定的促进作用,由此可以得出,AA作为乳脂合成的前体物同时影响着乳脂和乳蛋白的合成。【本研究切入点】乳脂、乳蛋白以及乳产量等都是反映奶牛产奶性能的重要指标,在不同影响因素的作用下,乳脂合成的前体物AA不仅影响乳脂合成而且乳蛋白合成也受其影响,但VA对乳脂和乳蛋白合成的影响效果是否会被AA浓度变化改变,目前尚不得知。【拟解决的关键问题】鉴于此,本试验旨在探究在添加不同浓度AA后,VA对BMECs内乳脂乳蛋白合成的调控作用是否改变,探讨二者之间是否存在互作关系,以便更系统地了解VA参与乳脂、乳蛋白合成的调控机制,为奶牛生产中VA的合理添加以及改善乳成分的合成提供依据。
1 材料与方法
1.1 试验材料
主要试剂包括:视黄酸(Sigma,货号:R2625)、乙酸钠(Sigma,货号:S5636-500G)、培养基DMEM/F12(Gibco,货号:12400-024)、PrimeScriptTM RT Master Mix(TaKaRa,货号:DRR036A)、SYBR Premix Ex TaqTM Ⅱ(TaKaRa,货号:DRR820A)、RNAiso Plus(TaKaRa,货号:D9109B)。
1.2 试剂配制
VA贮备液的配制:将100 mg视黄酸RA溶于5 mL的DMSO溶液中,配制成20 mg·mL-1的VA母液,按照试验要求将其稀释成浓度分别为0、1.0 mg·mL-1的VA贮备液。
AA贮备液的配制:将乙酸钠溶于基础培养基中配制成浓度为2.4 mol·L-1的母液,进一步添加基础培养基分别稀释配制成浓度为0.6、1.0 mol·L-1贮备液。
VA+AA工作液:经基础培养基稀释,将上述贮备液分别配制成VA工作液(浓度为0、0.001 mg·mL-1)和AA工作液(浓度为0、0.006、0.01 mol·L-1),以制备符合各细胞组处理要求的工作液。工作液经0.22 µm滤器过滤后低温避光保存。
1.3 BMECs的制备
BMECs的培养参照王新朋等[10]研究中所用的胶原酶消化法。于内蒙古呼和浩特市北亚清真冷库采集奶牛乳腺组织样,除去外层组织样,按照3×双抗的PBS、医用酒精(75%,30 s)、含1×双抗的PBS的顺序依次清洗内层组织块。去掉上述组织表层后,于腺泡丰富处剪取1 mm3大小的小组织块装入离心管,剪成糊状后加入等体积的II型胶原酶(0.5%)放入37 ℃培养箱中消化1 h,每20 min轻晃一次确保组织块充分消化。然后用80目细胞滤网过滤,将滤液离心后弃上清。用PBS溶液清洗细胞沉淀后重新悬浮离心后弃上清,使细胞再次悬浮,接种到25 cm2的培养瓶中,放入培养箱(37 ℃、5% CO2)培养。原代细胞贴壁生长至80%—90%时,弃培养液,经PBS溶液清洗和经胰蛋白酶(0.05%)作用后,差速法纯化细胞。终止消化后并传代得到第三代BMECs。
1.4 试验设计
本试验在内蒙古自治区高校动物营养与饲料科学重点实验室进行。采用二因素完全随机试验设计,将第三代BMECs随机分为6个处理组,每组6个重复。6个处理组依次命名为对照组、AA处理组1、AA处理组2、VA处理组、VAAA组1和VAAA组2。试验设计详见表1。培养结束后采集样本,并按照测定指标的要求进行检测。其中,VA和AA的浓度的确定基于课题组前期研究结果,分别为0.001 mg·mL-1和0.006、0.01 mol·L-1。
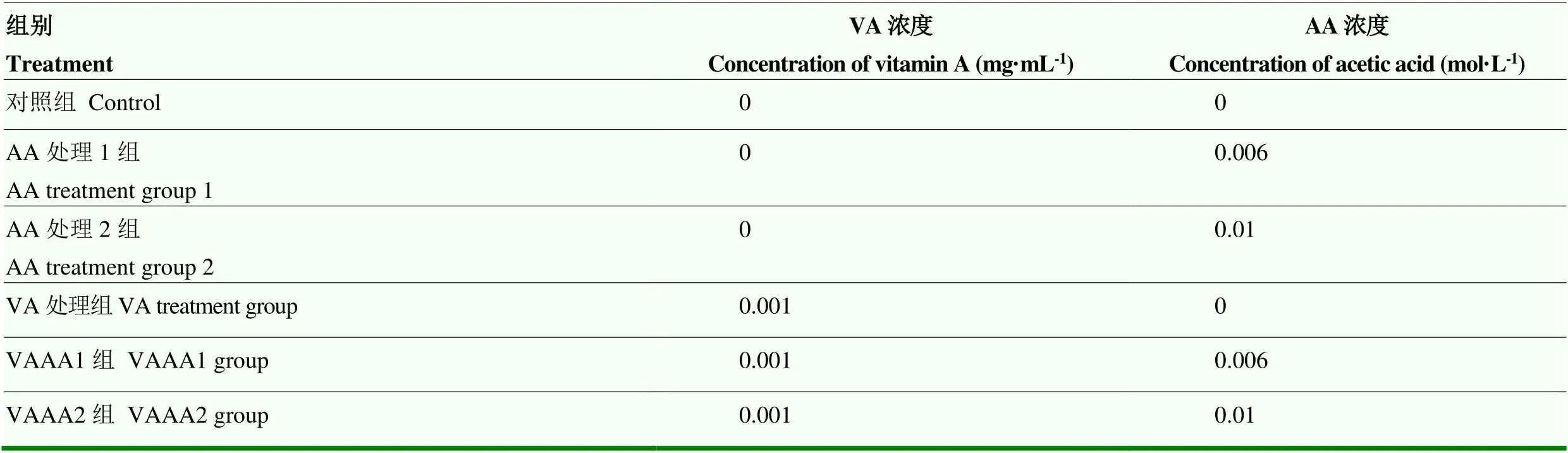
表1 试验设计
1.5 测定指标与方法
1.5.1 细胞增殖率 采用MTT法测定细胞增殖率。在无血清培养基中培养BMECs,饥饿培养24 h,根据上述试验设计进行后续试验。每孔加入20 µL的MTT(5 mg·mL-1),置于37℃培养箱培养4 h后弃上清,并甩板拍干液体。每个培养孔中加入100 µLDMSO,用全自动酶标仪(Synergy4, BioTek)振荡10 min后于490 nm波长处测吸光值(OD490)。细胞存活率=试验组OD490/对照组OD490×100%。
1.5.2 细胞内甘油三酯含量 培养结束经PBS溶液清洗细胞去除甘油,接着加入裂解液(200 mL/孔)作用10 min后离心5 min(12 000 r/min),于70 ℃加热上清液10 min,离心5 min(2 000 r/min)后取上清,按照细胞甘油三酯酶法测定甘油三酯含量。
1.5.3 乳脂、乳蛋白合成关键酶的活性 培养完成后加PBS溶液清洗细胞后添加动物细胞裂解液(600 µL,含1%PMSF),冰浴30 min,收集细胞和裂解液后离心10 min(4 ℃,12 000 r/min),收集上清液低温冷冻保存。测定指标包括BMECs内乳脂肪合成相关酶FAS、ACC、脂蛋白酯酶(lipoprteinlipase, LPL)、脂酰辅酶A去饱和酶(Stearoyl-CoA desaturase, SCD)的活性,乳蛋白合成相关酶p70核糖体蛋白S6激酶1(p70 ribosomal protein S6 kinase, S6K1)的活性以及mTOR的含量。测定方法按照ELISA试剂盒的操作说明书进行。
1.5.4 细胞内乳脂、乳蛋白合成相关基因的相对表达量 使用Trizol法提取细胞总RNA,并进行RNA纯度、浓度及总RNA完整性的测定。根据PrimeScript RT Master Mix试剂盒的方法进行反转录,用SYBR Premix Ex TaqTMⅡ试剂盒对得到的cDNA进行荧光定量PCR(qRT PCR)分析,反应体系为20 μL。以作为内参基因,对乳脂合成相关基因[、、、、脂肪酸结合蛋白3()、固醇调节元件结合蛋白1()、]及乳蛋白合成相关基因[、、、真核起始因子4E结合蛋白1()、、、]的相对表达量进行测定,上述基因的引物序列及qRT-PCR反应程序参见文献[11]。
1.6 数据处理
试验数据使用EXCEL进行初步统计整理,并用SAS 9.0软件中2×3二因子设计的MIXED程序进行分析,混合模型包括主效应VA、AA及VA与AA交互作用。<0.05表示差异显著。
2 结果
2.1 细胞增殖率和甘油三酯含量
添加VA后显著提高了细胞增殖率(表2,<0.001),但添加AA、VA与AA的组合效应均对细胞增殖率无显著影响。BMECs内TG含量受到VA及AA浓度的显著影响(0.01),0.001 mg·mL-1VA组TG含量显著低于0 mg·mL-1VA组;0.006、0.01 mol·L-1AA组TG含量均显著高于0 mol·L-1AA组(<0.05),且两组间并无显著差异;VA与AA的互作效应对TG含量有极显著影响(<0.01),VA添加量为0时,添加0.006、0.01 mol·L-1AA后TG含量较高,尤以10 mol·L-1AA组最高,显著高于其他各组(<0.05);VAAA2组与对照组较低,且与其余各组无显著差异。
2.2 细胞内乳脂合成关键酶活性及乳脂合成相关基因的表达
BMECs内ACC、FAS的活性在添加VA后显著降低(表3,<0.001,=0.01),同时受到VA与AA互作效应的极显著影响(<0.001,<0.01)。ACC活性以AA处理1组、AA处理2组较高,且显著高于其他各处理组(<0.05);以VAAA2组最低。AA处理1组的FAS活性最高,其次是AA处理2组和VAAA1组,但三组之间没有显著差异,VAAA2组最低,显著低于其他所有处理(<0.05)。添加VA和AA有提高SCD活性的趋势(=0.06,=0.06),0.006 mol·L-1AA组高于0 mol·L-1AA组;VA和AA的交互作用对SCD活性有明显影响(=0.05),VAAA2组最高,明显高于其他组合,其次是AA处理1组和VAAA1组,而其他组无显著差异。VA与AA交互作用显著影响了LPL活性(=0.01),以AA处理1组最高,且显著高于对照组和AA处理2组(<0.05),VA处理组、VAAA1组、VAAA2组三组次之,与AA处理1组之间差异不显著。
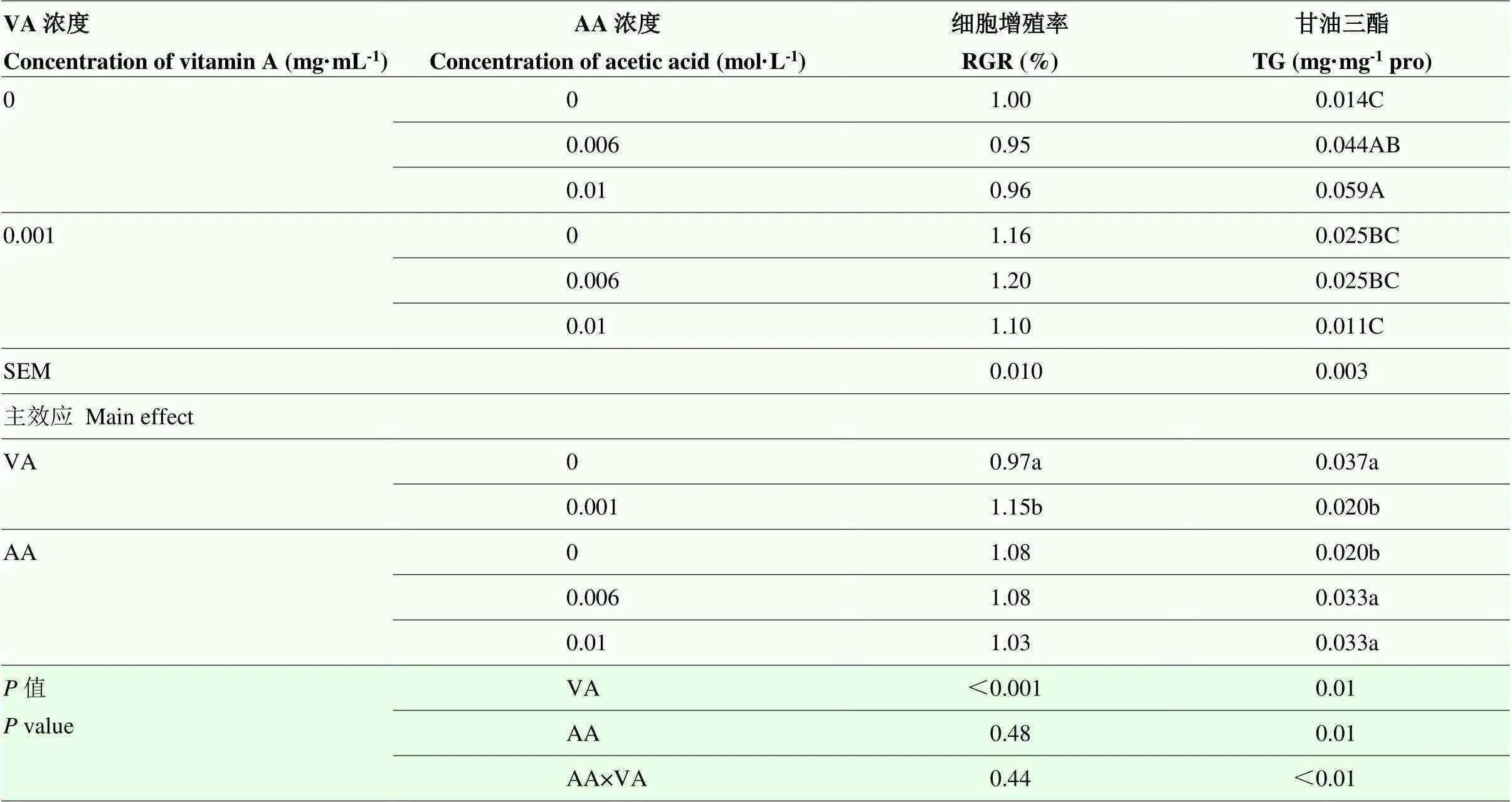
表2 VA和AA对BMECs细胞增殖率和甘油三酯含量的影响
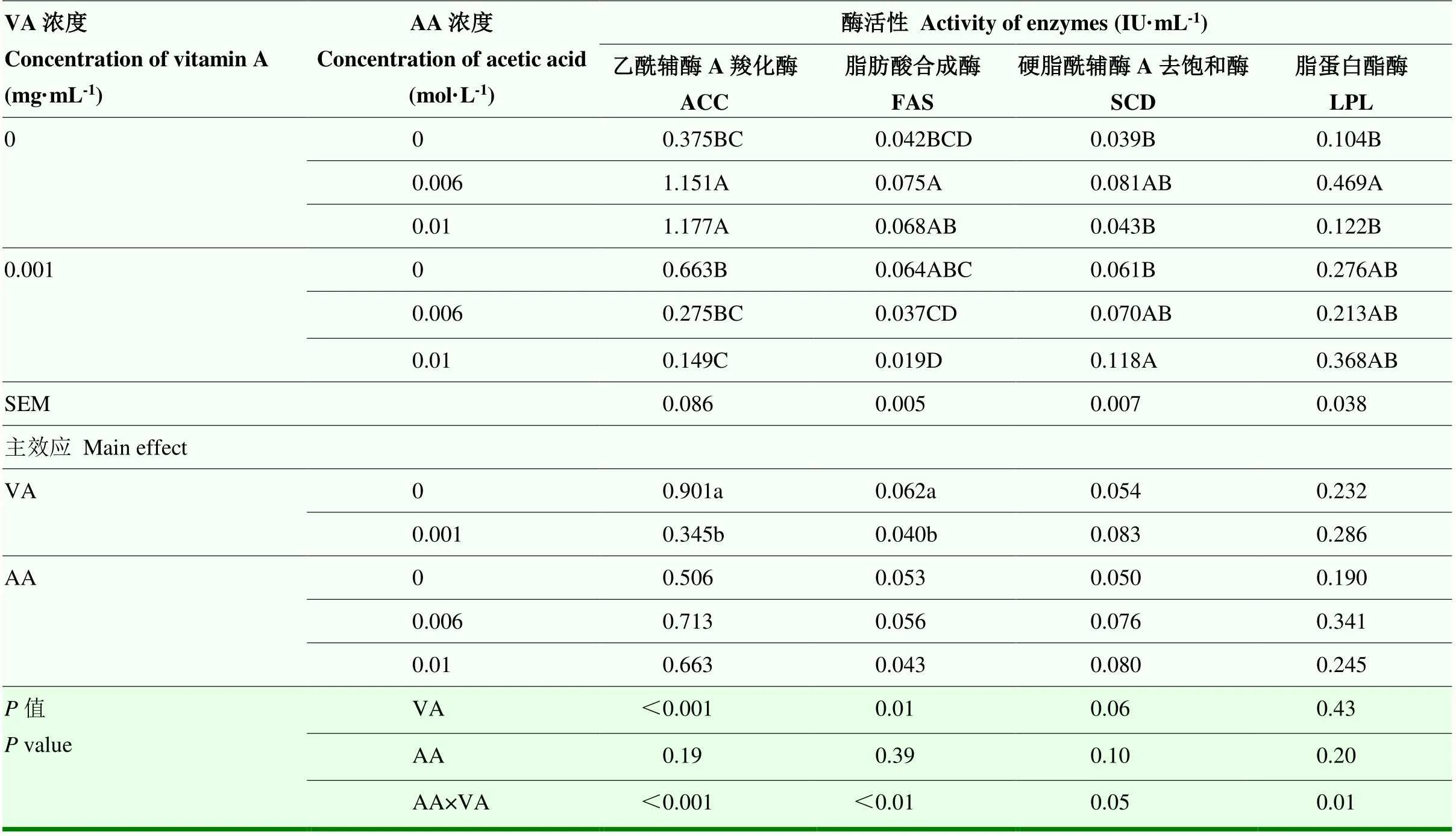
表3 VA和AA对BMECs内乳脂合成关键酶活性的影响
由图1可知,VA显著降低了基因和的表达量(<0.01;0.03;<0.01)。添加0.01 mol·L-1AA后,PPARG基因表达量增加,并明显高于0和0.006 mol·L-1AA组,而0 mol·L-1AA组则明显高于0.006 mol·L-1AA组(<0.001)。0.006、0.01 mol·L-1AA组ACACA的基因表达量趋向高于0 mol·L-1AA组(=0.10)。VA与AA共同作用时对表达有显著影响(=0.03),以AA处理2组效果最好且显著高于其他组(<0.05),VAAA1组效果最弱。LPL的基因表达受到AA浓度的显著影响(0.01),0.01 mol·L-1AA组显著高于0、0.006 mol·L-1AA组(<0.05);VA与AA互作也显著影响了基因的表达(<0.05),其中AA处理2组、VA处理组和VAAA2组显著提高(0.03),且三组间差异不显著。与0 mg·mL-1VA处理组相比,0.001 mg·mL-1VA处理组基因的表达显著增加(<0.001),表达还受到VA和AA互作效应的显著影响(0.02),促进作用以VAAA2组最佳,VAAA1组、VA处理组稍低,AA处理1组和AA处理2组与对照组差异不显著(图1)。SREBP1的基因表达未受到VA与AA的影响。FABP3的基因表达量随AA浓度的增加显著增加(<0.05),其中0、0.006 mol·L-1AA组之间差异不显著。
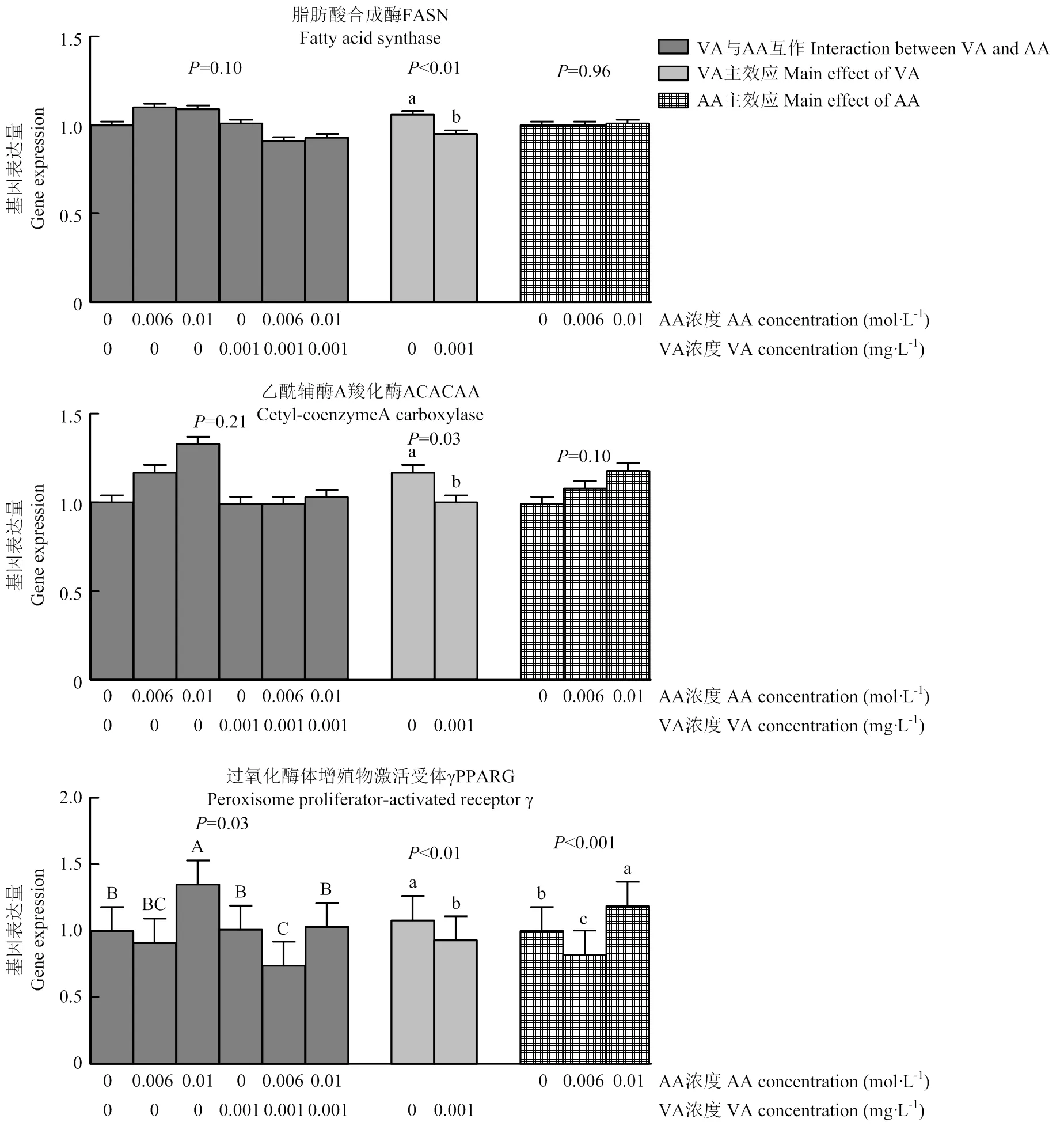
2.3 细胞内乳蛋白合成关键酶活性及乳蛋白合成相关基因的表达
添加VA显著降低mTOR活性(=0.02);而AA的添加可以使mTOR活性显著提高(=0.05),0 mol·L-1AA组显著低于0.01 mol·L-1AA组(<0.05),0.006 mol·L-1AA组分别与0、0.01 mol·L-1AA组的mTOR活性无显著组间差异;同时添加VA和AA对mTOR活性影响不显著。VA的添加会降低S6K1活性(<0.001),AA的添加则显著提高其活性(<0.001),0 mol·L-1AA组效果显著低于0.006、0.01 mol·L-1AA组(<0.05),且这两组间差异不显著;VA和AA同时补加对S6K1活性影响不显著(=0.19,表4)。
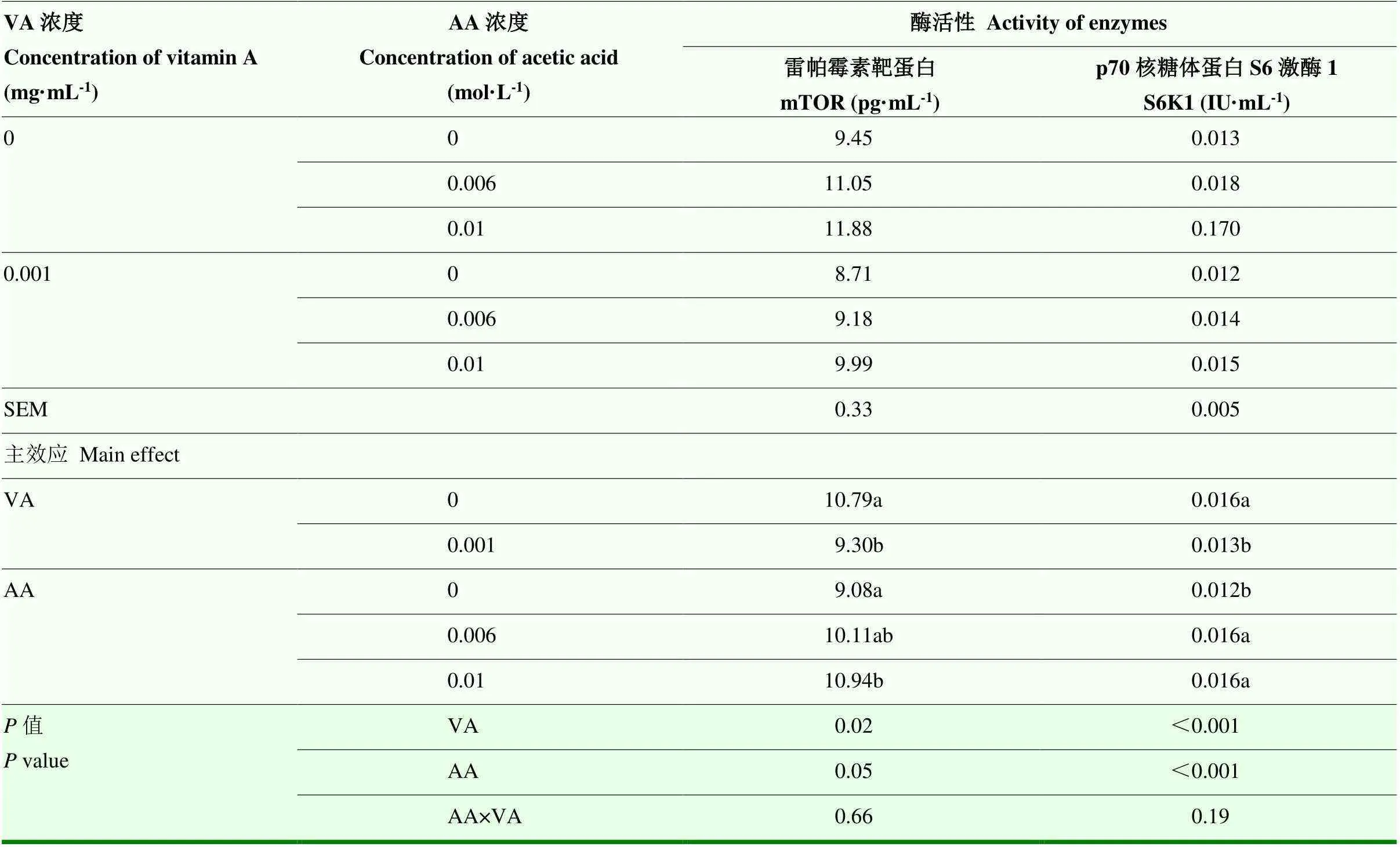
表4 VA和AA对BMECs内乳蛋白合成关键酶活性的影响
如图2所示,VA和AA浓度都能显著影响BMECs内的相对表达,0.001 mg·mL-1VA组显著高于0 mg·mL-1VA组(<0.01),0.006、0.01 mol·L-1AA组显著低于0 mol·L-1AA组(<0.05)。表达受到VA浓度的显著影响,其中0.001 mg·mL-1VA组显著低于0 mg·mL-1VA组(0.04),同时补充VA和AA时表达显著降低(0.02),其中VAAA1组和VAAA2组下降最明显。0.001 mg·mL-1VA组表达显著高于0 mg·mL-1VA组(<0.01)。的基因表达也随AA添加浓度的增加显著提高,0.01 mol·L-1AA组>0.006 mol·L-1AA组>0 mol·L-1AA组(<0.001)。VA与AA互作效应显著影响的表达,各种组合的处理组相比对照组表达均降低(0.02)。AA浓度显著影响的表达,0.006 mol·L-1AA组显著高于0、0.01 mol·L-1AA组(<0.01)。VA和AA浓度均显著影响表达(<0.05),0.001 mg·L-1VA组和0.01 mol·L-1AA组的表达分别依次高于0 mg·mL-1VA组(<0.001)和0、0.006 mol·L-1AA组(<0.001)。AA浓度显著影响表达,0.01 mol·L-1AA组显著高于0、0.006 mol·L-1AA组(<0.001)。AA的添加量还显著影响表达,0.006 mol·L-1AA组显著高于0 mol·L-1AA组,0 mol·L-1AA组显著高于0.01 mol·L-1AA组(<0.001)。
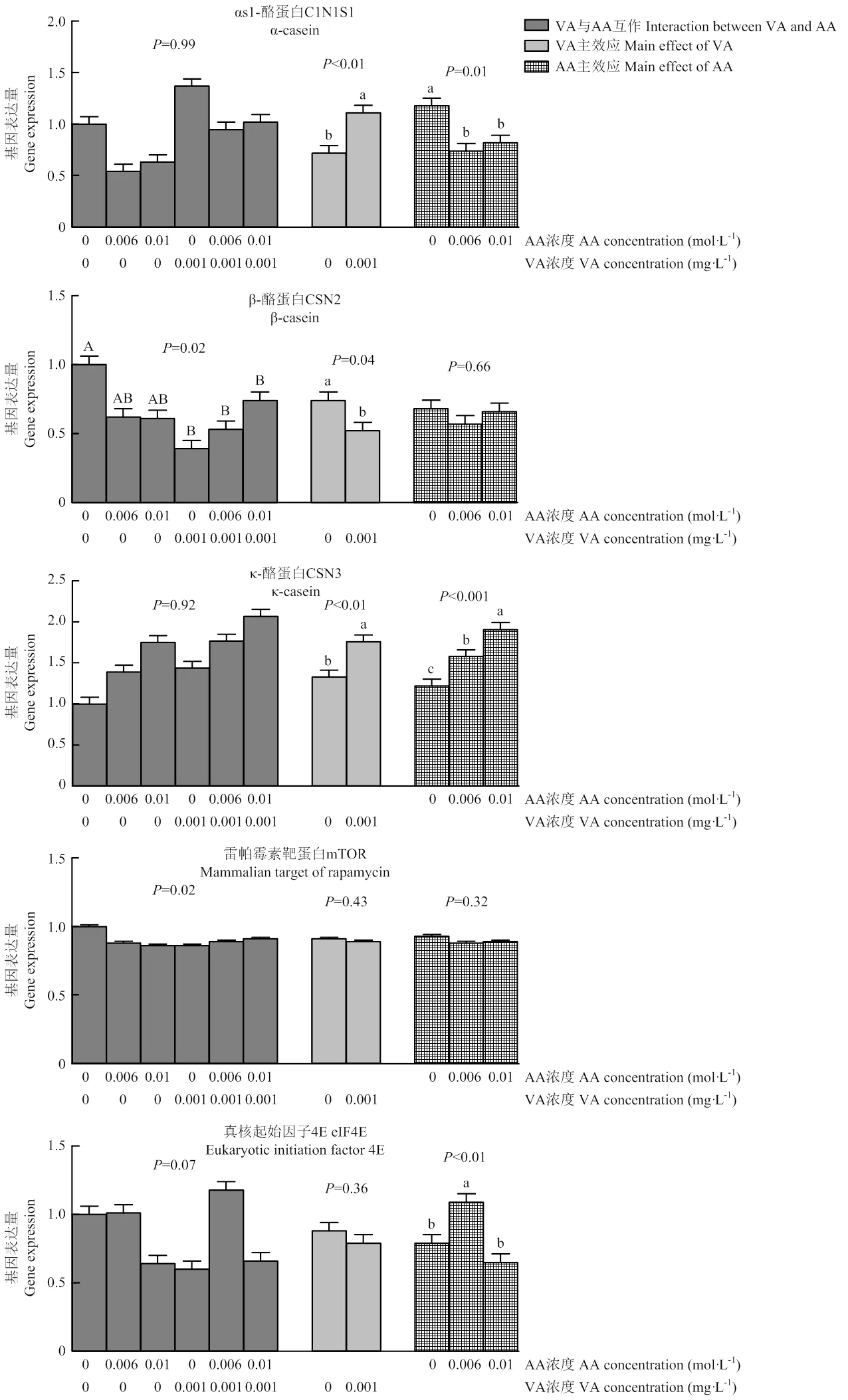
3 讨论
3.1 对细胞增殖率及甘油三酯含量的影响
VA是机体重要营养素之一,在细胞增殖分化、胚胎发育等生物过程中发挥着至关重要的作用[12]。视黄酸受体(RAR)和类视黄醇X受体(RXR)是介导VA调控的两种核受体家族,全反式视黄酸和9-顺式视黄酸与受体结合后对上皮细胞增殖分化起到调控作用。细胞膜上的糖基视黄醇磷酸可能与膜的接触抑制、分化识别环境等功能有关,因此VA可能与膜糖蛋白的合成有关[13]。本研究发现VA的添加对BMECs的细胞增殖率有显著的促进作用,这与苏芮等[11]的研究结果相似。齐利枝等[7]研究发现,添加AA的浓度与BMECs的细胞增殖率呈现二次曲线剂量依赖关系,因此低剂量的AA可以提高BMECs的细胞增殖率,但是剂量过高则会抑制细胞的增殖。然而,本试验中并未发现添加AA对细胞增殖率的影响,目前关于AA对细胞增殖率影响的研究较少,原因尚待进一步研究。尽管共同添加VA和AA时差异不显著,但VA处理组和VAAA1组在细胞增殖率的数值上比VAAA2组高,证明AA对VA的促细胞增殖作用有一定负面影响,添加VA的基础上加入0.01 mol·L-1AA会抑制BMECs细胞增殖率,AA浓度相同时,加入VA组细胞增殖率要高于未添加组,证明VA能减轻AA对细胞增殖率的抑制作用。
TG是乳脂肪的主要组成形式,由95%的脂肪酸及1%的磷酸与甘油结合而成,于内质网上融合成脂滴分泌到乳汁中[14],因此BMECs中TG含量可以作为细胞分泌乳脂肪能力的评定指标,这与奶牛的乳脂产量、牛奶的乳脂率息息相关。来自血液中的游离脂肪酸或在BMECs内重新合成的脂肪酸在甘油分子的羟基上发生酯化。研究发现,AA的浓度关系着细胞乳脂合成的能力,它是脂肪酸从头合成的重要前体物,添加0.016 mol·L-1的AA对BMECs内TG的分泌有显著促进作用[15];齐利枝等[7]及生冉[9]也得到相似的研究结果,发现AA对BMECs内TG的积累以及脂滴的形成的具有促进作用,且这种作用随AA浓度的增加呈线性或二次曲线增强。研究结果中发现AA添加使BMECs内TG含量显著增加,这进一步验证了其对乳脂合成的促进作用,mTOR/eIF4E信号通路在AA对乳脂合成的调节中起着不可或缺的作用[16]。本试验中,VA添加的抑制了TG的合成,且同时添加VA与AA也显著影响TG含量,这表明VA对TG的抑制作用与AA之间存在一定相关性。与单独添加VA组相比,VA与AA共同添加后TG含量在数值上明显降低,且互作效应使TG含量显著低于单独添加相同剂量的AA组,这表明VA和AA的互作效应对AA促进BMECs乳脂合成有抑制作用,VAAA1组TG数值高于VAAA2组,说明AA浓度的高低会影响VA和AA对乳脂合成的互作效应,高浓度AA添加会导致VA抑制BMECs乳脂的合成;而单独添加适宜剂量的VA会促进乳脂的合成。
3.2 对乳脂合成相关基因表达及酶活性的影响
乳脂合成中所需的脂肪酸大部分由乳腺上皮细胞从头合成,因此从头合成的原料乙酸和丁酸对泌乳期奶牛格外重要,有效的瘤胃发酵是供给挥发性脂肪酸充足的保证[17]。瘤胃发酵生成的挥发性脂肪酸包括AA、丙酸、丁酸等。瘤胃上皮细胞将丁酸转化生成β-羟丁酸,AA与β-羟丁酸是脂肪酸从头合成的主要前体物,当ATP柠檬酸裂解酶缺乏时,由于不能直接利用葡萄糖导致脂肪酸无法合成[18]。二者进入乳腺细胞后,在ACACA、FASN的共同作用下进行脂肪酸的从头合成,脂肪酸结合蛋白(FABP)与脂肪酸转移蛋白的分化抗原簇36协同作用,将脂肪酸转移至BMECs的TG结合位,使其进一步延伸去饱和[19]。ACACA作为一种限制性酶,催化乙酰辅酶A向丙二酸单酰辅酶A的羧化,而FASN在饱和脂肪酸、中链脂肪酸的合成中起着重要作用,两者都是脂肪酸合成中的关键酶[20]。本试验中,添加VA使BMECs内FASN、ACACA的基因表达和酶活显著降低,AA则对其无显著影响,二者共同添加对FASN、ACACA的酶活有显著影响,同时趋于显著地影响了FASN的基因表达,表明VA与AA的互作影响BMECs内TG含量可能与其调控脂肪酸的从头合成相关。与对照组相比,分别添加0.006和0.01mol·L-1的AA,可以明显促进BMECs中ACACA和FASN的活性,这表明AA的补充增加了ACACA和FASN蛋白的表达,从而促进了脂肪酸的从头合成,增加了BMECs的TG含量。前人的研究得出了相似的结果,AA的添加可以促进BMECs内ACACA和FASN的基因表达[6,8]。本研究中虽未发现ACACA和FASN的基因表达显著改变,但在数值上有增加的趋势。然而,VAAA1组和VAAA2组的ACACA、FASN酶活性相比AA处理1组和AA处理2组显著降低,这与细胞内TG含量的变化规律一致,表明AA与VA共同作用抑制BMECs内ACACA和FASN的酶活性,可能导致脂肪酸从头合成减少,降低TG含量。SCD作为产生单不饱和脂肪酸的限速酶在BMECs内的TG合成起关键作用,其催化产物同时可作为底物产生多不饱和脂肪酸[21]。分娩后,奶牛乳腺中的SCD基因表达和酶活性会立刻上调,泌乳期相比分娩前可上调40多倍,同时SCD的高表达与ACACA、FASN有关,因此SCD与脂肪酸的从头合成有直接关系。JACOBS等[22]发现0.005 mol·L-1乙酸钠能显著上调SCD1的基因表达,生冉[9]的研究表明这种调控作用随AA浓度增加而呈现先促进后抑制的趋势。本试验中VA的添加可以上调SCD的基因表达,但这种调控作用在AA添加后未被发现。同时VA与AA的互作效应也显著影响基因SCD的相对表达,与VA处理组、VAAA1组相比,VAAA2组SCD表达显著提高,表明VA和AA可能协同促进SCD基因表达,其具体机制仍需深入探讨研究;VA和AA相互作用对SCD活性的影响较大,其变化与其基因表达一致。LPL和FABP3对BMEC中长链脂肪酸的转运非常重要,LPL决定脂肪细胞的大小和TG积累的程度,FABP3在泌乳期的基因表达最高[2]。前人研究发现,AA的添加促进了BMECs内FABP3的基因表达[7,9],而不同浓度AA对LPL的基因表达无显著影响[9]。本试验得出相似结果,高浓度AA对FABP3基因表达有显著促进作用,AA处理2组和VAAA2组的FABP3基因表达均显著上调,但VA与AA互作对其并无显著影响,表明添加VA并没有明显影响AA促进的作用;LPL基因表达和酶活性也受到VA和AA之间相互作用的明显影响,两者的最佳组合是没有添加AA的组。然而,这一效果仍然没有明确的规律。PPARG和SREBP1是脂肪酸合成的重要转录调节因子,有多个下游靶基因调节脂肪酸的摄取、转运、合成和去饱和,PPARG可以调节SCD、LPL、SREBP1的表达,SREBP1可以调节ACACA、FASN、FABP的表达[23-24]。研究报道表明AA能上调BMECs中和的表达,这与AA调节和等基因表达的证据相一致[16]。本试验中VA使表达降低,AA以及VA与AA的互作也均对表达产生显著影响;VA浓度不变,0.006 mol·L-1AA组显著低于0、0.01 mol·L-1AA组,AA浓度为0.01 mol·L-1时,未添加VA组显著高于添加组,表明VA不仅自身下调表达,而且会与AA协同作用下调的表达。虽然AA及其与VA的互作效应对SREBP1基因表达没有产生显著影响,但单独添加AA时SREBP1基因表达量在数值上要高于同浓度添加VA组,这和BMECs内ACACA、FASN基因表达在VA和AA的互作效应下降低的结果类似,表明VA和AA协同可能是通过抑制PPARG、SREBP1基因表达来下调脂肪酸从头合成基因,进一步降低细胞内的TG含量。
3.3 对乳蛋白合成相关基因及酶活性的影响
乳蛋白是衡量牛奶质量的一个重要指标,酪蛋白含量在牛奶蛋白中的占比高达80%,其中CSN1占总酪蛋白的45%—55%,且主要为CSN1S1,CSN1S2占少部分,CSN2和CSN3分别占总酪蛋白的25%—35%和8%—15%[25];免疫球蛋白、α-乳白蛋白、β-乳球蛋白、血清白蛋白以及具有特定生物活性的乳过氧化物酶和乳铁蛋白等都是乳清蛋白的主要成分[26]。已有研究表明AA可以抑制S1的合成,但促进和的合成[27]。塔娜等[6]的研究中0.012 mol·L-1乙酸钠能显著提高BMECs内和的基因表达,并且降低了S1表达,但0.006 mol·L-1AA促进S1表达。在本试验中,VA添加的主效应显著增加了S1和的表达,降低了的表达;AA添加显著增加了BMECs中的表达,降低了的表达;VA和AA相互作用显著影响了的表达;VA和AA互作明显影响了的表达,在没有VA的情况下随AA浓度的增加而减少,但在有VA的情况下随AA浓度的增加而增加,说明VA只在有AA的情况下削弱了CSN2基因表达的下调作用。这可能是由于VA对的下调作用。
乳腺组织中乳蛋白的合成受到不同信号通路的调控,目前主要集中在JAK-STAT和mTOR两条信号转导通路,两者与细胞凋亡、增殖等多种生理过程有关。JAK-STAT主要在催乳素等激素作用下在基因转录水平起调控作用[28],在催乳素-乳蛋白信号途径起重要作用,是乳腺中特异表达的转录因子,上游信号JAK2可对其活化,激活后入核实现对靶基因的调控。已有研究显示,的过表达能够促进BMECs内、、和β-酪蛋白的mRNA水平的表达量[29]。mTOR通路主要在蛋白质翻译水平来发挥生乳和维乳作用[30]。BMECs中mTOR通路的上游信号分子主要由蛋白激酶B、磷脂酰肌醇3-激酶组成,通过磷酸化其下游的eIF4E、4EBP1和S6K1进而调控蛋白质的合成[31-32]。mTOR受到抑制时,PPARG蛋白表达水平下降,未磷酸化的4EBP1会与eIF4E结合形成复合体,进而抑制蛋白的翻译起始及合成[33]。本试验结果显示,VA可显著提高4EBP1基因的表达,补充AA可使S6K1、4EBP1基因表达显著提高,且0.01 mol·L-1AA有显著促进作用,0.006 mol·L-1无显著影响,说明S6K1、4EBP1的基因表达与AA浓度有关,高浓度AA更能促进其表达;VA与AA互作效应对、的表达无显著影响,说明VA的添加没有改变AA的这种促进作用。此外,结果显示补充AA显著增加S6K1活性,但补充VA则相反,且二者交互作用对其活性无显著影响,这与基因表达的结果一致,表明VA不会影响AA的作用结果。本试验还发现0.006 mol·L-1AA能促进表达,而0.01 mol·L-1AA可能会产生抑制作用,表明高浓度AA抑制的表达,但本试验没有涉及AA或VA对下游基因的影响,仍需进一步探究。生冉[9]的结果还表明不同浓度AA均会使BMECs内eIF4E、4EBP1、S6K1基因表达量升高,本试验中添加AA也显著影响表达,但0.01 mol·L-1AA组显著低于0.006 mol·L-1AA组,在数值上也低于0 mol·L-1AA组,提示高浓度AA可能抑制的表达。目前,尚未有太多关于AA或者VA对酪蛋白合成调控以及对乳蛋白合成影响的研究,体内灌注乙酸钠对乳蛋白影响的试验结果也不尽一致。综合本研究及前人研究结果,AA可能通过调控mTOR信号通路影响BMECs中酪蛋白的基因表达,但不同AA浓度对信号通路中不同基因的影响机制还有待于进一步探讨。结果也表明,VA与AA协同对mTOR基因表达有一定影响,相比主效应VA或主效应AA时一定程度上对mTOR的表达有促进作用,这可能与CSN2基因表达的互作效应有关,需要进一步深入研究。
本试验通过VA和AA的互作效应,初步探讨了BMECs乳成分合成相关基因表达的影响,但由于其复杂的合成调控因素,很多问题仍需深入研究。在细胞内发挥生物学作用时,VA及其与AA的交互作用可能密切关系着核视黄酸受体及细胞视黄酸结合蛋白(cRABP),VA在调节基因表达的同时是否会对cRABP浓度产生影响,AA的受体调节作用是否受VA与AA的互作效应影响,这些仍需进一步探讨研究。
4 结论
维生素A(VA)和乙酸(AA)在调控乳脂和乳蛋白合成方面存在互作效应:AA能提高奶牛乳腺上皮细胞内甘油三酯含量、乙酰辅酶A羧化酶活性、脂肪酸合成酶活性及的表达,VA同步添加则会抑制上述指标的合成或表达;AA显著提高了S6K1酶活性,并上调了基因及的表达;同时,VA与AA同步添加会减弱单独添加时对基因与表达的下调作用。综合以上结果,单独添加0.01 mol·L-1的AA对促进乳脂合成较好,单独添加0.006 mol·L-1的AA则更利于乳蛋白的合成。
[1] 实施九大任务提振奶业发展: “十四五”奶业竞争力如何提升有了行动方案. 北方牧业, 2022(6): 13-14.
Implementing nine tasks to boost the development of dairy industry-how to improve the competitiveness of dairy industry in the 14 th Five-Year Plan has an action plan. BeiFang MuYe, 2022(6): 13-14. (in Chinese)
[2] 刘阳. 维生素A和乙酸对奶牛乳腺上皮细胞乳脂乳蛋白合成相关基因表达的影响[D]. 呼和浩特: 内蒙古农业大学, 2017.
LIU Y. Effects of vitamin A and acetic acid on gene expression related to milk fat and protein synthesis in bovine mammary epithelial cells[D]. Hohhot: Inner Mongolia Agricultural University, 2017. (in Chinese)
[3] LETTINGA K D, GUTTER W, VAN NOORDEN C J, SCHELLENS J P, FREDERIKS W M. Early effects of high doses of retinol (vitamin A) on thecellular metabolism in rat liver. Liver, 1996, 16(1): 1-11.
[4] OLDHAM E R, EBERHART R J, MULLER L D. Effects of supplemental vitamin A or β-carotene during the dry period and early lactation on udder health. Journal of Dairy Science, 1991, 74(11): 3775-3781.
[5] PURDIE N G, TROUT D R, POPPI D P, CANT J P. Milk synthetic response of the bovine mammary gland to an increase in the local concentration of amino acids and acetate. Journal of Dairy Science, 2008, 91(1): 218-228.
[6] 塔娜, 李红磊, 侯先志, 考桂兰, 高民, 李大彪. 乙酸钠和β-羟丁酸钠对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响. 动物营养学报, 2014, 26(6): 1527-1534.
TANA, LI H L, HOU X Z, KAO G L, GAO M, LI D B. Effects of sodium acetate and sodium β-hydroxybutyrate on expressions of genes involved in milk fat and protein synthesis in bovine mammary epithelial cells. Chinese Journal of Animal Nutrition, 2014, 26(6): 1527-1534. (in Chinese)
[7] 齐利枝, 生冉, 闫素梅, 赵艳丽. 乙酸浓度对奶牛乳腺上皮细胞甘油三酯含量及瘦素和过氧化物酶增殖物激活受体γ基因表达量的影响. 动物营养学报, 2013, 25(7): 1519-1525.
QI L Z, SHENG R, YAN S M, ZHAO Y L. Effects of acetate concentration on triacylglycerol content and expression levels of lept in and PPARγ genes in bovine mammary epithelial cells. Chinese Journal of Animal Nutrition, 2013, 25(7): 1519-1525. (in Chinese)
[8] 韩慧娜, 闫素梅, 齐利枝, 生冉, 赵艳丽. 乙酸对奶牛乳腺上皮细胞乳脂肪酸从头合成相关基因表达量的影响. 动物营养学报, 2015, 27(3): 926-931.
HAN H N, YAN S M, QI L Z, SHENG R, ZHAO Y L. Effects of acetic acid on expression levels of genes involved in milk fatty acidssynthesis in bovine mammary epithelial cells. Chinese Journal of Animal Nutrition, 2015, 27(3): 926-931. (in Chinese)
[9] 生冉. 乙酸参与奶牛乳腺上皮细胞内乳脂肪与乳蛋白合成的调控机理研究[D]. 呼和浩特: 内蒙古农业大学, 2015.
SHENG R. Regulation mechanism of acetate involved in milk fat and milk protein synthesis in the bovine mammary epithelial cells[D]. Hohhot: Inner Mongolia Agricultural University, 2015. (in Chinese)
[10] 王新朋, 闫素梅, 齐利枝, 生冉, 赵艳丽. β-羟丁酸浓度对奶牛乳腺上皮细胞内乳蛋白合成相关基因表达量的影响. 动物营养学报, 2014, 26(12): 3836-3842.
WANG X P, YAN S M, QI L Z, SHENG R, ZHAO Y L. Effects of β-hydroxybutyric acid on expressions of genes involved in milk protein synthesis in bovine mammary epithelial cells. Chinese Journal of Animal Nutrition, 2014, 26(12): 3836-3842. (in Chinese)
[11] 苏芮, 刘阳, 闫素梅, 史彬林, 赵艳丽, 石惠宇. 维生素A对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响. 动物营养学报, 2018, 30(8): 3151-3158.
SU R, LIU Y, YAN S M, SHI B L, ZHAO Y L, SHI H Y. Effects of vitamin A on gene expressions related to milk fat and protein synthesis in bovine mammary epithelial cells. Chinese Journal of Animal Nutrition, 2018, 30(8): 3151-3158. (in Chinese)
[12] TIMONEDA J, RODRÍGUEZ-FERNÁNDEZ L, ZARAGOZÁ R, MARÍN M P, CABEZUELO M T, TORRES L, VIÑA J R, BARBER T. Vitamin A deficiency and the lung. Nutrients, 2018, 10(9): 1132.
[13] 方桂红, 程莉. 维生素A的生理功能及毒性研究进展. 轻工科技, 2012, 28(8): 10-11, 15.
FANG G H, CHENG L. Research progress on physiological function and toxicity of vitamin A. Light Industry Science and Technology, 2012, 28(8): 10-11, 15. (in Chinese)
[14] 哈斯额尔敦, 白晨, 萨茹丽, 敖长金. 牛奶甘油三酯脂肪酸酯化位置结构特点及其在乳腺中合成代谢的研究进展. 动物营养学报, 2021, 33(6): 3036-3042.
KHAS-ERDENE, BAI C, SA R L, AO C J. A review of properties of fatty acid esterification structure in bovine milk triglycerides and its biosynthesis in mammary gland. Chinese Journal of Animal Nutrition, 2021, 33(6): 3036-3042. (in Chinese)
[15] 孔庆洋. 乙酸钠和丁酸钠对奶牛乳腺上皮细胞及腺泡乳脂合成相关基因表达的影响[D]. 哈尔滨: 东北农业大学, 2012.
KONG Q Y. Effect of sodium acetate and sodium butyrate on expression of genes related to milk fat synthesis of dairy cow mammary epithelial cells and acinus[D]. Harbin: Northeast Agricultural University, 2012. (in Chinese)
[16] ZHAO Y L, GUO X Y, YAN S M, SHI B L, SHENG R. Acetate regulates milk fat synthesis through the mammalian target of rapamycin/eukaryotic initiation factor 4E signaling pathway in bovine mammary epithelial cells. Journal of Dairy Science, 2021, 104(1): 337-345.
[17] MATAMOROS C, HAO F, TIAN Y, PATTERSON A D, HARVATINE K J. Interaction of sodium acetate supplementation and dietary fiber level on feeding behavior, digestibility, milk synthesis, and plasma metabolites. Journal of Dairy Science, 2022, 105(11): 8824-8838.
[18] 郭冬生, 彭小兰, 夏维福. 乳的合成过程及其在生产中的应用技术. 乳业科学与技术, 2007, 30(4): 195-196, 194.
GUO D S, PENG X L, XIA W F. The synthesis process of milk and the application in production. Journal of Dairy Science and Technology, 2007, 30(4): 195-196, 194. (in Chinese)
[19] BAUMAN D E, MATHER I H, WALL R J, LOCK A L. Major advances associated with the biosynthesis of milk. Journal of Dairy Science, 2006, 89(4): 1235-1243.
[20] 王丽芳, 张兴夫. 黄花蒿醇提物对奶牛乳腺细胞中共轭亚油酸合成相关酶基因表达的作用. 中国农业科学, 2019, 52(18): 3271-3278.
WANG L F, ZHANG X F. Effects ofextracts on CLA synthesis and mechanism. Scientia Agricultura Sinica, 2019, 52(18): 3271-3278. (in Chinese)
[21] LI Z P, LU S Y, CUI K Q, SHAFIQUE L, REHMAN S U, LUO C, WANG Z Q, RUAN J, QIAN Q, LIU Q Y. Fatty acid biosynthesis and transcriptional regulation of Stearoyl-CoA Desaturase 1 (SCD1) in buffalo milk. BMC Genetics, 2020, 21(1): 23.
[22] JACOBS A A A, DIJKSTRA J, LIESMAN J S, VANDEHAAR M J, LOCK A L, VAN VUUREN A M, HENDRIKS W H, VAN BAAL J. Effects of short- and long-chain fatty acids on the expression of stearoyl-CoA desaturase and other lipogenic genes in bovine mammary epithelial cells. Animal, 2013, 7(9): 1508-1516.
[23] MA N, ABAKER J A, WEI G, CHEN H, SHEN X, CHANG G. A high-concentrate diet induces an inflammatory response and oxidative stress and depresses milk fat synthesis in the mammary gland of dairy cows. Journal of Dairy Science, 2022, 105(6): 5493-5505.
[24] 王红芳, 刘红云, 杨维仁, 刘建新, 杨在宾. 外源反-10, 顺-12共轭亚油酸对体外培养牛乳腺上皮细胞SREBP-1基因表达和蛋白质合成的影响. 中国农业科学, 2011, 44(23): 4892-4901.
WANG H F, LIU H Y, YANG W R, LIU J X, YANG Z B. Effects of exogenetic trans-10,-12 CLA on genes expression and protein synthesis of SREBP-1 gene in bovine mammary epithelial cells. Scientia Agricultura Sinica, 2011, 44(23): 4892-4901. (in Chinese)
[25] 王俊锋, 黄静龙, 梁国义. 泌乳反刍动物乳蛋白的合成机理及调控途径的研究. 饲料工业, 2005, 26(7): 13-17.
WANG J F, HUANG J L, LIANG G Y. Study on synthesis mechanism and regulation of milk protein in lactating ruminants. Feed Industry, 2005, 26(7): 13-17. (in Chinese)
[26] 庞孝飞, 汪超. 牛乳乳清蛋白的主要组成及其营养特点. 畜牧与饲料科学, 2016, 37(3): 52-54.
PANG X F, WANG C. A review on major components and nutritional properties of cow milk whey protein. Animal Husbandry and Feed Science, 2016, 37(3): 52-54. (in Chinese)
[27] ZHAO Y L, YAN S M, CHEN L, SHI B L, GUO X Y. Effect of interaction between leucine and acetate on the milk protein synthesis in bovine mammary epithelial cells. Animal Science Journal, 2019, 90(1): 81-89.
[28] BROCKMAN J L, SCHROEDER M D, SCHULER L A. PRL activates the cyclin D1 promoter via the Jak2/stat pathway. Molecular Endocrinology, 2002, 16(4): 774-784.
[29] 王立娜. 氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D]. 哈尔滨: 东北农业大学, 2014.
WANG L N. Effect of interaction between amino acids and STAT5A on lactation of dairy cow mammary epithelial cells and its mechanism[D]. Harbin: Northeast Agricultural University, 2014. (in Chinese)
[30] RIUS A G, APPUHAMY J A D R N, CYRIAC J, KIROVSKI D, BECVAR O, ESCOBAR J, MCGILLIARD M L, BEQUETTE B J, AKERS R M, HANIGAN M D. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids. Journal of Dairy Science, 2010, 93(7): 3114-3127.
[31] ANDERSON S M, RUDOLPH M C, MCMANAMAN J L, NEVILLE M C. Key stages in mammary gland development. Secretory activation in the mammary gland: it’s not just about milk protein synthesis!. Breast Cancer Research, 2007, 9(1): 204.
[32] LUYIMBAZI D, AKCAKANAT A, MCAULIFFE P F, ZHANG L, SINGH G, GONZALEZ-ANGULO A M, CHEN H Q, DO K A, ZHENG Y H, HUNG M C, et al. Rapamycin regulates stearoyl CoA desaturase 1 expression in breast cancer. Molecular Cancer Therapeutics, 2010, 9(10): 2770-2784.
[33] 曹洋, 艾阳, 张源淑. 乳蛋白合成的信号通路与营养调控. 畜牧与兽医, 2014, 46(6): 133-136.
CAO Y, AI Y, ZHANG Y S. Signal pathway of milk protein synthesis and nutritional regulation. Animal Husbandry & Veterinary Medicine, 2014, 46(6): 133-136. (in Chinese)
Effect of Interaction Between Vitamin A and Acetic Acid on the Expression of Genes Related to Milk Composition Synthesis in Bovine Mammary Epithelial Cells
GUO YongMei, LIU Yang, WU Rui, YAN SuMei, ZHAO YanLi, GUO XiaoYu
College of Animal Science, Inner Mongolia Agricultural University/Key Laboratory of Animal Nutrition and Feed Science at Universities of Inner Mongolia Autonomous Region, Hohhot 010018
【Objective】Our previous research found that vitamin A (VA) has a significant effect on promoting the expression of genes related to milk fat and milk protein synthesis in bovine mammary epithelial cells (BMECs). Based on this, this experiment was conducted by adding acetic acid (AA) to explore whether there is an interaction between VA and AA in the expression of genes related to milk composition synthesis, then gaining a more systematic understanding of the regulatory mechanism of VA involvement in milk fat and protein synthesis, this study would provide scientific basis for the rational addition of VA to feed for dairy cows and the improvement of milk quality.【Method】In this experiment, cells were cultured using digestive method of collagenase. Two factor completely randomized trial design was used in this study. The third generation BMECs was randomly divided into 6 treatment groups, with 6 replicates in each group. After starvation treatment of serum-free medium for 24 hours, medium with VA and AA at different concentrations was added, respectively. The six treatment groups were sequentially named as control group (0 mg·mL-1VA+0 mol·L-1AA), AA treatment group 1 (0 mg·mL-1VA+0.006 mol·L-1AA), AA treatment group 2(0 mg·mL-1VA+0.01 mol·L-1AA), VA treatment group(0.001 mg·mL-1VA+0 mol·L-1AA), VAAA1 group(0.001 mg·mL-1VA+0.006 mol·L-1AA), and VAAA2 group(0.001 mg·mL-1VA+0.01 mol·L-1AA). After 24 hours of continuous culture, the cells and culture medium were collected as required, and the cell proliferation rate was measured using MTT method; the content of triglycerides and the activities of key enzymes in milk fat and protein synthesis were measured using kits. The relative expression of genes related to milk fat and milk protein synthesis was measured and calculated by real-time quantitative PCR. 【Result】 The results showed that adding VA significantly increased the cell proliferation rate (<0.001), but no significant effect on the cell proliferation rate was found followed by addition of AA or VA and AA (>0.05). There was an interaction effect between VA and AA on milk fat synthesis. AA increased the triglyceride (TG) content in BMECs (=0.01), but the addition of VA inhibited TG synthesis in the meantime (=0.01). AA up-regulated the activities of fatty acid synthase () and acetyl CoA carboxylase () as well as peroxisome proliferator-activated receptor γ () gene expression in BMECs (<0.05;<0.05;<0.001), while significant inhibitory effect of VA was observed (<0.001;=0.01;<0.01). AA significantly increased the content of mammalian rapamycin target protein (mTOR) (=0.05), ribosome S6 protein kinase (S6K1) enzyme activity (<0.001), and the gene expression of=0.02). VA and AA had an interaction effect on the gene expression ofand, because the simultaneous addition of VA and AA attenuated the down-regulatory effect onandgene expression after addition of VA or AA alone. 【Conclusion】 To sum up, AA treatment group 2 had a better promoting effect on milk fat synthesis, while VAAA2 group had a weaker effect; AA treatment group 1 had a better promoting effect on milk protein synthesis, while VAAA1 group had a weaker effect. Therefore, 0.01 mol·L-1of AA alone is better for promoting milk fat synthesis, while 0.006 mol·L-1of AA is more conducive to milk protein synthesis.
vitamin A; acetic acid; interaction; bovine mammary epithelial cells; milk composition

2023-01-31;
2023-05-25
国家自然科学基金(31160466)、内蒙古农业大学高层次人才科研启动项目(NDYB2020-4)、内蒙古农业大学基本科研业务费专项资金(BR220142)、内蒙古自治区本级事业单位引进优秀人才科研基金
郭咏梅,E-mail:ymguo2015@163.com。通信作者闫素梅,E-mail:yansmimau@163.com
(责任编辑 林鉴非)
