枸橼C-05 CmPR4A上游转录因子CmWRKY75的筛选及其抗溃疡病功能分析
2023-11-18颜培涵罗健铭郝晨星孙紫青叶蓉春李益刘恋盛玲马先锋邓子牛
颜培涵,罗健铭,郝晨星,孙紫青,叶蓉春,李益,刘恋,盛玲,马先锋,邓子牛
枸橼C-05上游转录因子CmWRKY75的筛选及其抗溃疡病功能分析
颜培涵,罗健铭,郝晨星,孙紫青,叶蓉春,李益,刘恋,盛玲,马先锋,邓子牛
湖南农业大学园艺学院/园艺作物种质创新与新品种选育教育部工程研究中心/国家柑橘改良中心长沙分中心,长沙 410128
【背景】柑橘溃疡病(Citrus canker)是由黄单胞杆菌柑橘致病变种(subsp.)引起的危害严重的柑橘病害之一,目前尚无根治方法,而现有栽培品种中很少有对柑橘溃疡病存在显著抗性的品种,因此,抗病品种的选育对根治该病害尤其重要,而抗性基因的发掘又非常利于抗病育种。【目的】以枸橼C-05的抗溃疡病相关基因为诱饵,筛选其上游转录因子,探究转录因子参与调控枸橼C-05抗溃疡病的功能作用,为选育柑橘抗病品种提供基因信息。【方法】基于前期冰糖橙和枸橼C-05叶片接种的转录组测序结果,结合实时荧光定量PCR分析在抗病和感病种质中的表达差异,使用PlantCARE对枸橼C-05(抗病)和冰糖橙(感病)启动子序列进行差异分析,利用酵母单杂交筛选上游转录因子,并使用酵母回转验证、双荧光素酶验证和候选转录因子的互作关系。在8种抗病和感病柑橘种质中,人工接种后,于0、2、4、6和8 d时取注射点附近的叶片,对转录因子的表达水平进行分析,验证其与抗病的关系。通过农杆菌介导瞬时转化法,将带有35S启动子的转录因子载体在枸橼C-05和冰糖橙叶片中瞬时过表达,使用qRT-PCR对转录因子和表达水平进行分析,并在瞬时过表达24 h后接种,进行菌定量和症状观察。【结果】接种的枸橼C-05和冰糖橙的转录组分析及定量PCR表达结果显示,在接种4、6和8 d时,抗病种质枸橼C-05中的表达量显著高于感病的冰糖橙。枸橼C-05和冰糖橙的启动子在-236 bp处存在顺式作用元件W-box的差异,以此为依据进行启动子短截并构建诱饵载体。依据自激活结果,在200 ng·mL-1的金担子素(AbA)浓度下,以为诱饵,在枸橼C-05受诱导下的酵母文库中进行酵母单杂交筛选,表明CmWRKY75可以与互作,双荧光素酶报告系统也证实二者的互作关系,且CmWRKY75正调控的表达。在8种柑橘种质叶片接种后进行的表达模式分析表明,表达量在抗病种质枸橼C-05、美国枸橼AV、矮果香橼中显著上调,在感病种质冰糖橙、沙田柚及柠檬、南川香橼和丹娜香橼中只出现微量上调。在枸橼C-05和冰糖橙叶片中瞬时过表达WRKY75,发现的表达量在接种4 d时显著上调且能增强叶片对的抗性。【结论】CmWRKY75可以结合到启动子的W-box上,并正调控的表达,增强叶片对的抗性。同时的表达受诱导,在抗病种质中呈显著上调表达,与在抗病感种质中的表达变化趋势一致,可能是上游调控因子WRKY75在不同抗病和感病柑橘种质中表达差异导致,从而使其在枸橼C-05抗溃疡病过程中起作用。
柑橘溃疡病;枸橼C-05;;转录因子;WRKY75
0 引言
【研究意义】柑橘溃疡病是一种世界性的检疫性病害,是柑橘植株所面临的最为严重的细菌性病害之一,对柑橘的生产栽培造成了严重的危害[1]。柑橘溃疡病由柑橘黄单胞杆菌柑橘亚种(subsp.,)所引起[2],主要从伤口、气孔等处侵入植物叶片、新梢和幼果,形成火山口状典型病斑,严重时会导致落叶、落果,使果实产量、品质下降,甚至失去商业价值[3]。目前,柑橘溃疡病尚无根治方法,生产中主要采取预防为主、综合防治的策略[4]。因此,挖掘抗性基因、选育抗病品种具有重要意义。现有栽培种中很少对柑橘溃疡病有显著抗性的品种,而笔者课题组经过十余年的筛选,获得了能够稳定抗柑橘溃疡病的柑橘属种质——枸橼C-05[5],并鉴定到与枸橼C-05抗性相关的调控基因[6]。因此,明确枸橼C-05中存在的抗病调控基因,阐明调控柑橘抗溃疡病的作用机理,对选育抗病柑橘种质具有重要意义。【前人研究进展】植物在生长发育的过程中总是受到各种病原微生物(如细菌、真菌和病毒等)的侵害,因此进化出复杂的抗性机制。植物的免疫应答调控机制分为两种,一种是通过模式识别受体(pattern recognition receptors,PRRs)识别病原菌相关分子模式(pathogen-associated molecular pattern,PAMP)后进行跨膜信号传导的PTI(pattern-triggered immunity)反应;另一种依靠R基因编码的具有多态性的NB-LRR蛋白识别病原菌效应子(effector)而触发的ETI(effector-triggered immunity)反应[7-8]。植物病程相关(pathogenesis related,PR)基因编码的病程相关蛋白(pathogenesis-related proteins,PRs)在体外试验中具有抑制病原菌生理活性的潜在作用,并且在响应生物胁迫或非生物胁迫过程中,其编码的病程相关蛋白的积累和植株抗性存在紧密关系[9]。各种病原菌都可以引起的生成,而且不仅在受感染的组织中表达,还在其他未受感染的组织中逐渐积累。这些基因能够在相当长的时间内有效地抵抗该病原菌或其他病原体的入侵,从而使整个植株具备了系统性获得抗性(systemic acquired resistance,SAR)[10-11]。PR蛋白根据来源植物、氨基酸序列特征、酶活性等分为17个家族[12-13],其中,PR4基因家族编码几丁质酶,能够通过降解真菌细胞壁中的几丁质来增强对真菌的抵抗力[14-15],同时也能够对细菌性病害产生防御反应[16]。有研究表明,毛花猕猴桃PR2蛋白对由丁香假单胞杆菌猕猴桃致病变种引起的猕猴桃溃疡病菌具有一定的抗性[17];在甘蔗白条黄单胞菌的侵染下显著提高[18];柑橘溃疡病作为一种由柑橘黄单胞杆菌引起的严重细菌性病害,在侵染柑橘叶片后会引起、、、、和的显著上调表达[6]。这些均说明PR蛋白作为植物抗病性的标志,在植株抵御细菌性病害中起到重要作用。PR4家族根据其是否有几丁质结合域(chitin-binding domain,CBD)分为两大类:I类PR4蛋白含有CBD,如拟南芥PR4蛋白[19];II类PR蛋白不含有CBD,只含有Barwin结构域,如烟草PR4蛋白[20]和辣椒PR4蛋白[21]。已有研究表明,VpPR4-1与中国野生葡萄抵御白粉病相关[22],MdPR4与苹果对再植病害病原的识别和抗性反应相关[23]。笔者课题组前期研究发现,抗病种质枸橼C-05叶片中表达量显著高于感病种质,且PR4A蛋白可以抑制柑橘溃疡病菌生长[6]。植物免疫反应中信号通路的有序传导与转录因子的调节密不可分,其中,WRKY转录因子起着重要的作用,它能够特异性地识别并结合W-box(TTGACC/T)DNA顺式作用元件[24],因此,可以通过分析目标基因启动子是否含有W-box元件来筛选WRKY转录因子。WRKYs转录因子在植物先天免疫系统的两个分支(PTI和ETI)中发挥着重要作用,可以正向或负向调节不同病原菌侵染的抗性反应[25-28]。在水稻中,WRKY62过表达和敲除株系呈现出对白叶枯病抗感性的相反趋势,过表达植株更易感病,而敲除植株抗病性更强[28]。将在葡萄中筛选得到的抗性基因转入拟南芥可以增强转基因植株对白粉病的抗性,却降低了对灰霉病的抗性[29]。苹果MdWRKY75能够与启动子中的W-box结合,导致根系木质素积累从而增强苹果对腐皮镰孢菌的抗性[30]。此外,WRKY转录因子可以与其家族中的其他蛋白质相互作用,共同调节植物对病原体的抗性。OsWRKY13能够与的启动子结合,增强表达,从而增强水稻对白叶枯病的抗性反应[31]。因此,作为植物特有的转录调节因子,WRKY转录因子在植物的抗病调控过程中起重要作用。【本研究切入点】笔者课题组前期发表的转录组数据分析表明,在抗病种质枸橼C-05中上调表达,且显著高于感病种质冰糖橙。但是如何参与柑橘抵御溃疡病菌的机制仍未有研究。【拟解决的关键问题】本研究以启动子为诱饵,通过酵母单杂交筛选其上游转录因子,进一步解析参与枸橼C-05抵御溃疡病菌侵染的分子机制。
1 材料与方法
试验于2020年10月至2023年2月在国家柑橘改良中心长沙分中心进行。
1.1 植物材料
植物材料为抗溃疡病种质枸橼C-05、美国枸橼AV、矮果香橼和感溃疡病种质冰糖橙、沙田柚、柠檬、南川香橼和丹娜香橼,均为2年生枳砧嫁接苗。于湖南农业大学国家柑橘改良中心长沙分中心植物病理温室培育,培养条件为温度28 ℃,相对湿度80%,16 h光照/ 8 h黑暗。本氏烟()播种至营养土中,4 ℃冰箱放置2 d后,于植物人工气候室培养,培养条件为温度22 ℃、相对湿度70%、8 h光照/16 h黑暗。
1.2 溃疡病菌系
柑橘溃疡病菌(subsp,)为湖南农业大学国家柑橘改良中心长沙分中心分离纯化的DL509菌株(亚洲A系),保存于-80 ℃冰箱。挑取活化的单菌落在液体LB培养基中28 ℃培养至OD600=0.6,用无菌水稀释10 000倍至浓度为105cfu/mL备用。
1.3 Xcc接种
选择上述8个柑橘种质均完全展开但尚未转为深绿色的叶片,从叶背注射接种105cfu/mL的,在温室正常生长条件下培养,取0、2、4、6和8 d时接种口周围叶片,用液氮速冻储存于-80 ℃冰箱用于后续RNA提取。
1.4 诱饵表达载体的构建
根据甜橙基因组数据库(http://citrus.hzau.edu.cn/)查找和启动子序列,并使用Plant CARE(https://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)预测和的顺式作用元件,根据W-box差异位点对启动子进行短截,设计引物进行扩增(表1)。同时,使用I/I酶切载体pAbAi,按ClonExepress II-C112(Vazyme)说明书进行同源重组连接,采用化学转化法将连接产物转入大肠杆菌DH10B感受态,并涂布于含羧苄青霉素的LB平板筛选。经PCR阳性克隆鉴定单菌落后摇菌,提取质粒并送至北京擎科生物科技有限公司(长沙)进行测序,正确质粒命名为-pAbAi和-pAbAi。
1.5 诱饵表达载体自激活检测
采用PEG/LiAc法将诱饵载体- pAbAi和-pAbAi转化至Y1H Gold感受态细胞中,阳性鉴定后保存诱饵酵母菌株。同时,使用金担子素(AbA)进行诱饵载体酵母菌株的自激活检测,根据菌落生长情况确定能抑制诱饵载体自激活最低AbA浓度。阳性对照为-AbAi和pGADT7-53的共转酵母菌株Y1H Gold,阴性对照为-AbAi与pGADT7-T的共转酵母菌株Y1H Gold。
1.6 CmPR4A上游转录因子筛选
供试酵母cDNA文库为笔者实验室构建的抗病种质枸橼C-05受诱导的cDNA文库。将已转化至Y1H Gold感受态细胞的-pAbAi酵母菌株在YPDA平板上于30 ℃划线活化培养3 d后,加入文库质粒,使用PEG/LiAc法进行转化,最后用6 mL 0.9% NaCl重悬菌液,涂布于SD/-leu+AbA200平板上。30 ℃倒置培养3—5 d后,挑取筛选培养基上单菌落进行阳性克隆鉴定,将>500 bp的PCR产物送测序。
1.7 回转验证
将已转化的酵母菌株-pAbAi划线摇菌,制备感受态细胞,采用PEG/LiAc法将构建好的候选转录因子pGADT7载体质粒转化进制备好的感受态细胞中,依次点板于SD/-leu、SD/-leu+AbA200的平板上,根据菌落生长情况确定-pAbAi与候选转录因子是否互作。
1.8 双荧光素酶验证proCmPR4A与CmWRKY75互作关系
将构建至植物表达载体pCambia1300- YFP,构建至pGreenII0800-LUC,将构建好的载体阳性克隆提取质粒转化入GV3101(引物序列见表1)。通过农杆菌介导在烟草叶片中按照转录因子﹕启动子=10﹕1的比例进行注射,3 d后取注射孔附近的叶片进行测定。双荧光素酶活性的测定采用Dual-Luciferase Reporter Assay System试剂盒。
1.9 WRKY转录因子家族在接种Xcc的冰糖橙和枸橼C-05中表达模式分析
通过PlantTFDB(http://planttfdb.gao-lab.org/index. php)对WRKY家族转录因子进行检索查询,并结合甜橙网(http://citrus.hzau.edu.cn/)进行序列比对,将得到的WRKY转录因子在冰糖橙和枸橼C-05对响应的转录组数据中查找,使用TBtools软件进行基因表达矩阵热图分析,得到在冰糖橙和枸橼C-05中存在明显差异表达的基因进行后续验证。
1.10 转录因子CmWRKY75瞬时过表达分析
将含有质粒和pCambia 1300原始质粒(空载体对照)的农杆菌EHA105菌液用MgCl2缓冲液(10 mmol·L-1MgCl2+10 mmol·L-1MES+100 μmol·L-1AS)重悬至OD600=0.6,静置2 h后注射至枸橼C-05和冰糖橙完全展开但尚未完全转为绿色的功能叶上。采集处理2、4 d后的叶片,用液氮速冻储存于-80 ℃冰箱用于后续RNA提取,用于瞬时表达WRKY75后的表达分析。注射瞬时过表达菌液24 h后在相同位置注射105cfu/mL,收集接种3 d后的叶片用于单位叶面积含量测定,保留3个重复叶片进行后续的症状观察,用于瞬时过表达WRKY75后叶片对的抗性分析。
1.11 Xcc定量分析
使用直径为0.5 cm的打孔器,取接种叶片非注射孔的部位3个叶圆片,将叶圆片置于含有500 µL无菌水和3颗灭菌钢珠的2 mL离心管中研磨至匀浆状,研磨液作为100,梯度稀释10-1、10-2、10-3后,取10 µL菌液滴于LB平板上,每个梯度重复3次。在28 ℃条件下培养2 d,直至能够观察到黄绿色单菌落。统计单菌落数量,并计算单位面积(cm2)叶片上菌落数量。
1.12 总RNA提取及实时荧光定量PCR分析
利用艾科瑞公司的总RNA提取试剂盒SteadyPure Plant RNA Extraction Kit(Code No. AG21019)进行总RNA提取,然后使用艾科瑞公司的5×Evo M-MLV RT Master Mix试剂盒(A4A1436)反转录合成cDNA。利用NCBI在线分析工具Primer-BLAST(https://www. ncbi.nlm.nih.gov/tools/primer-blast/)设计检测引物(表1),以为内参基因。使用2×ChamQ Universal SYBR®qPCR Master Mix(Q711-02)(Vazyme,中国)作为荧光染料,反应总体积10 µL(其中cDNA(100 ng·µL-1)1 µL、上/下游引物(10 μmol·L-1)各0.2 µL、2×qPCR Master Mix 5 µL、ddH2O补充至10 µL)。反应条件为:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 30 s,40个循环。计算基因相对表达量用2-∆∆CT法,通过IBM SPSS Statistics 26软件的单因素方差分析法进行差异显著性分析。

表1 本研究所用引物
2 结果
2.1 Xcc诱导下抗病和感病柑橘种质PR4A的表达
枸橼C-05和冰糖橙响应接种的转录组数据对比分析发现,在接种后第4、6和8天,枸橼C-05中的表达量显著高于冰糖橙(图1-A)。此外,qPCR验证表明,在接种后第4、6和8天的枸橼C-05中,表达量受溃疡病菌诱导上调表达,且显著高于对照(图1-B)。表明很可能参与了枸橼C-05抗溃疡病过程。
2.2 枸橼C-05 CmPR4A诱饵载体构建和自激活检测
通过比对分析抗病种质枸橼C-05和感病种质冰糖橙的启动子序列,发现与WRKY转录因子结合的顺式作用元件W-box在-236 bp处存在差异,以此为依据对启动子进行短截(图2-A)。以枸橼C-05 DNA为模板,扩增得到(0—-516 bp)片段(图2-B)。AbA浓度筛选结果显示1 000 ng·mL-1AbA无法抑制-pAbAi的生长(图2-C)。因此,继续短截启动子至-317 bp处,AbA筛选结果显示200 ng·mL-1AbA可以抑制-pAbAi的生长,可用于后续文库筛选(图2-D)。
2.3 酵母单杂交筛选CmPR4A上游转录因子
在200 ng·mL-1AbA下,以-pAbAi为诱饵,在枸橼C-05受柑橘溃疡病菌诱导的酵母文库中进行单杂交筛选,共得到8个转录因子(表2)。为了验证-pAbAi与其潜在上游转录因子的互作关系,将8个转录因子构建至pGADT7载体上获得重组质粒,进行酵母单杂交回转验证。结果显示,只有-pGADT7和-pAbAi共转化的酵母可以在含有200 ng·mL-1AbA的缺陷型培养基上生长(图3),表明CmWRKY75可以与-pAbAi互作。

A:枸橼C-05和冰糖橙转录组中PR4A的表达量;B:枸橼C-05和冰糖橙接种Xcc后PR4A的qRT-PCR检测。*表示差异显著(P<0.05)。下同

A:枸橼C-05 CmPR4A启动子短截示意图;B:CmPR4A短截启动子克隆;M:DNA Marker;C:proCmPR4A-1-pAbAi(0— -516 bp)诱饵载体自激活验证;D:proCmPR4A-2-pAbAi(0—-317 bp)诱饵载体自激活验证
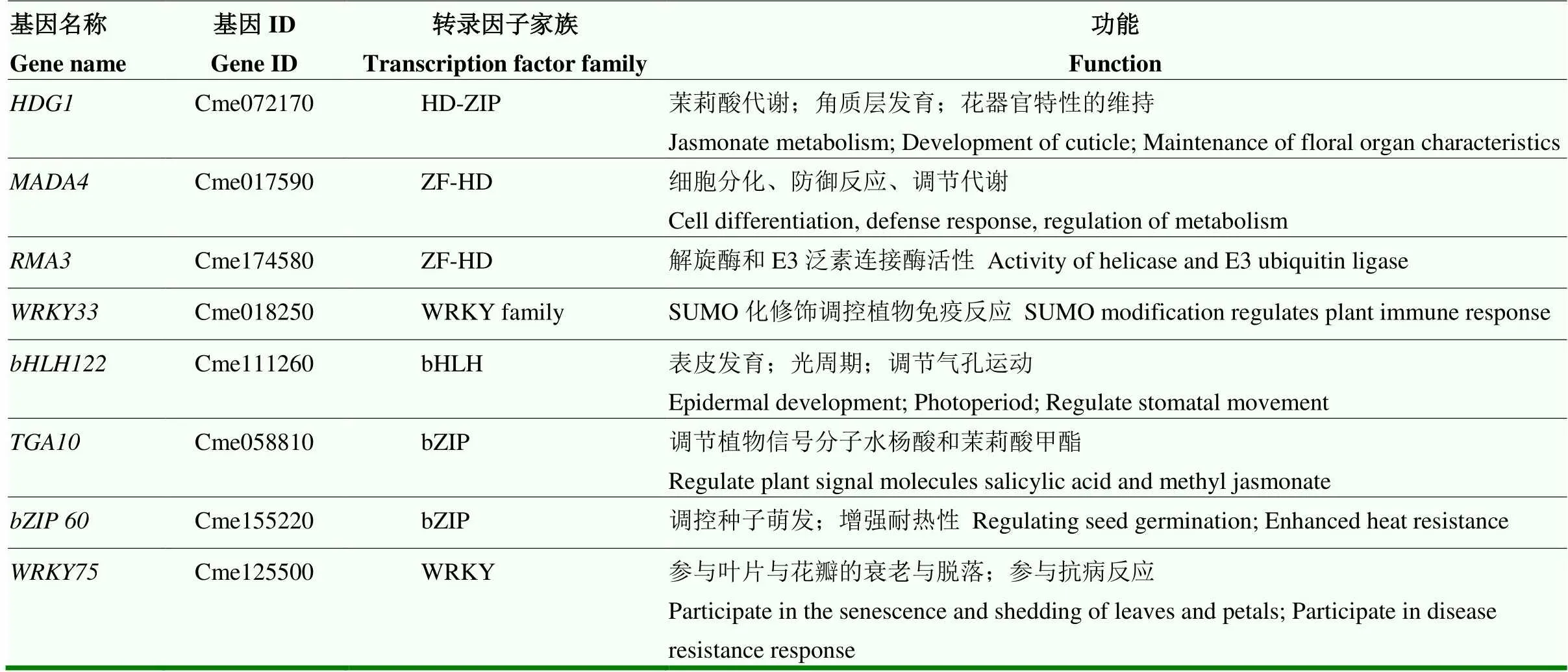
表2 CmPR4A上游转录因子在Xcc诱导的枸橼C-05酵母文库中的筛库结果

阳性对照为p53-AbAi和pGADT7-53互作;阴性对照为p53-AbAi与pGADT7-T互作
2.4 CmWRKY75与proCmPR4A互作关系验证
为了进一步验证CmWRKY75和互作关系,在300 ng·mL-1AbA下,以- pAbAi+pGADT7和pAbAi+CmWRKY75-pGADT7为阴性对照,进行回转验证。结果表明,CmWRKY75与在酵母中存在互作(图4-A)。进一步用烟草瞬时表达体系进行双荧光素酶试验验证二者在植物体内的互作,结果显示,瞬时过表达CmWRKY75可以提高报告基因的活性(图4-B),表明CmWRKY75与启动子存在互作并能够增强启动子转录激活活性。
2.5 受Xcc诱导的柑橘WRKY转录因子家族表达分析及其与CmPR4A互作验证
为了探究是否存在其他受诱导的WRKY转录因子能直接调控的表达,通过分析枸橼C-05和冰糖橙受诱导的转录组,筛选在枸橼C-05和冰糖橙中存在表达变化差异的WRKY转录因子。热图分析发现,有9个WRKY转录因子的表达量在冰糖橙和枸橼C-05中差异明显,分别为、、、、、、、和(图5-A)。在枸橼C-05中将这9个转录因子构建至pGADT7载体上获得重组质粒,进行酵母单杂交回转验证。结果显示,只有()可以与-pAbAi结合,在酵母中互作(图5-B)。
2.6 Xcc诱导下不同柑橘种质WRKY75的表达
为了进一步验证是否参与柑橘种质对溃疡病的抗性反应,在抗病种质枸橼C-05、美国枸橼AV、矮果香橼和感病种质南川香橼、丹娜香橼及冰糖橙、沙田柚和柠檬叶片接种后进行的表达模式分析。结果显示,在所有种质中,的表达量自接种4 d后开始有不同程度的上升,但在抗病种质枸橼C-05、美国枸橼AV、矮果香橼中显著上调,在感病种质中只出现微量上调(图6)。表明的表达受诱导在抗病种质中呈现显著上调表达,其很可能参与了枸橼C-05抗溃疡病过程。
2.7 枸橼C-05和冰糖橙叶片瞬时表达WRKY75增强PR4A的表达
为了进一步验证在柑橘中的表达量是否受WRKY75的影响,在枸橼C-05和冰糖橙叶片中瞬时过表达CmWRKY75,以p1300农杆菌(EV)为对照,定量PCR检测和的表达量变化。结果显示,瞬时过表达CmWRKY75和CsWRKY75后,接种2和4 d的材料中表达量均上调,且显著高于对照(图7-A、图7-C)。而且在接种2和4 d时也出现上调表达,但是只在接种4 d时显著高于对照(图7-B、图7-D)。表明在枸橼C-05和冰糖橙中瞬时过表达WRKY75能够增强的表达。
2.8 枸橼C-05和冰糖橙叶片瞬时过表达WRKY75对Xcc抗性的影响
为了进一步探究瞬时过表达WRKY75对抗性的影响,在枸橼C-05和冰糖橙叶片中瞬时过表达WRKY75农杆菌24 h后,在相同位置注射。接种3 d时,单位叶面积菌定量结果显示,在枸橼C-05叶片上过表达WRKY75后,含量显著低于空载体对照(EV);而在冰糖橙叶片上过表达WRKY75后,含量与EV相比略微减少,但差异不显著(图8-A、图8-C)。症状观察结果显示,接种15 d时枸橼C-05瞬时过表达WRKY75后的叶片部位比EV有更少的细小水渍状病斑(图8-B)。接种15 d时冰糖橙瞬时过表达WRKY75后的叶片部位比EV叶片上单位面积形成水渍状和灰白色愈伤状病斑的数量更少,病斑也更小(图8-D)。菌定量和症状观察表明,在枸橼C-05和冰糖橙叶片中瞬时表达WRKY75能增强叶片对的抗性。

A:WRKY家族基因在冰糖橙和枸橼C-05中受Xcc诱导的表达热图;B:9个差异表达的WRKY家族基因与proCmPR4A-2-pAbAi酵母互作验证。红色箭头表示枸橼C-05和冰糖橙受Xcc诱导表达变化差异的WRKY转录因子
3 讨论
3.1 PR4增强植物抗病性
作为植物响应生物胁迫的重要环节,在模式植物上对PR蛋白的研究比较深入,但关于PR4蛋白在柑橘抗溃疡病中的作用相对研究较少。本研究通过对感病种质冰糖橙和抗病种质枸橼C-05注射接种柑橘溃疡病菌的转录组和定量结果进行分析,发现在枸橼C-05中的表达量出现明显上调,且显著高于冰糖橙,说明很可能参与了枸橼C-05抗溃疡病过程。有研究表明,辣椒与LRR1相互作用,抑制引发的辣椒细胞死亡和防御反应[16];在葡萄上已有研究表明,与中国野生葡萄‘留坝-8’抵抗霜霉病相关[32],与中国野生葡萄抵御白粉病相关[22];与苹果对再植病害病原的识别和抗性反应相关[23]。综上,可以增强植物抗病性,与本研究得出的增强柑橘溃疡病抗性结果相一致。而植物表面的受体可以感知到生物或非生物胁迫等环境信号,通过一系列复杂的信号传导途径激活转录因子;同时,相关基因启动子上的顺式作用元件为这些转录因子的结合提供附着位点,从而调控下游基因如的表达[33]。因此,要了解转录调控表达模式需要对该基因的启动子序列特征进行分析,并以此为依据筛选上游调控因子,从而揭示该基因的调控机制。

Citron C-05:枸橼C-05;MGJY:美国枸橼American citron;AGXY:矮果香橼Aiguo citron;Bingtang Sweet orange:冰糖橙;STY:沙田柚 Shatian Yu pummelo;NM:柠檬Lemon;NCXY:南川香橼Nanchuan citron;DNXY:丹娜香橼Danna citron。红色系为抗病种质;蓝色系为感病种质The red series represents resistant genotypes, while the blue series represents susceptible genotypes

图7 在枸橼C-05和冰糖橙叶片中瞬时表达WRKY75后WRKY75和PR4A的表达量

A、B:枸橼C-05;C、D:冰糖橙 A, B:Citron C-05; C, D: Bingtang Sweet orange
3.2 WRKY转录因子参与植物抗病反应
分析启动子在抗病和感病种质上的W-box差异后,以启动子为诱饵,通过酵母单杂交筛选其上游转录因子WRKY75。WRKY转录因子作为植物转录因子中重要的家族之一,广泛参与植物对多种抗病信号的调节。在苹果中过表达增强植株抗病性[34];拟南芥中过表达,也显著提高其对轮纹病的抗性[35]。在柑橘中,Qin等[36]研究表明甜橙WRKY22通过调控的表达来调节对溃疡病的易感性;响应外源SA诱导,在抑制柑橘采后绿霉病发生的过程中具有显著效果[37]。转录因子WRKY75在模式植物拟南芥以及园艺植物柑橘、葡萄和草莓等中研究广泛,在调节植株生长发育以及抗逆反应中均起到重要作用。Guo等[38]研究发现在拟南芥叶片衰老过程中,WRKY75、SA和ROS的表达水平在正反馈循环的驱动下逐渐升高。卢婷等[39]对柠檬、甜橙、金橘等进行胁迫处理发现,受低温、干旱和高盐等非生物胁迫诱导表达。本研究筛选到的WRKY75转录因子是否也在柑橘叶片衰老,以及逆境胁迫下发生表达变化,后续还要进一步探究。在WRKY75调控抗病反应方面,拟南芥WRKY75可能与ET信号或其他防御相关蛋白的成分复合,最后调节对坏死性病原体的防御反应[26]。近期,张娜[40]利用拟南芥突变体和转基因葡萄愈伤组织验证了WRKY75参与抗葡萄霜霉病的功能。本研究结果表明WRKY75转录因子在抗病种质中显著上调,在感病种质中只出现微量上调,且在瞬时过表达后能增强冰糖橙和枸橼C-05对的抗性,表明其很可能参与了枸橼C-05抗溃疡病过程。但是由于瞬时表达的不稳定性,后续还将通过转基因过表达和敲除来进行详细的功能验证。
3.3 WRKY转录因子与PR结合,调控植物抗病反应
W-box是WRKY转录因子特异的结合元件[41]。通过对拟南芥的启动子分析,发现在同一个启动子中平均会出现4.3个W-box,说明WRKY转录因子在响应抗病反应中起重要作用[42]。在烟草中,VvWRKY2通过与上的W-box结合从而激活其表达,进而调节转基因烟草对灰葡萄孢菌的抗性[43]。苹果MdWRKY75能够与MdRF114启动子中的W-box结合,导致根系木质素积累从而增强苹果对腐皮镰孢菌的抗性[30]。中国野生葡萄中VpWRKY75调控下游靶基因的表达[40];WRKY40和WRKY75可以结合到启动子上,从而增强对霜霉病的抗性[44]。为了探明WRKY转录因子在参与枸橼C-05抗溃疡病的分子机制,本研究以WRKY转录因子能够特异性地识别并结合DNA顺式作用元件W-box为依据,对抗/感种质的启动子序列进行分析,发现抗病种质枸橼C-05和感病种质冰糖橙的启动子上的W-box在-236 bp处存在差异,因此,以含有差异位点的枸橼C-05启动子区域为诱饵,筛选发现CmWRKY75可以通过W-box结合到的启动子上,且CmWRKY75正调控的表达,这与张娜[40]和刘兵等[44]在葡萄中得到的结果一致,说明WRKY转录因子可以与结合,调控植物的抗病反应。同时定量结果发现,的表达受诱导在抗病种质中呈现显著上调表达,这与在抗病感种质中的变化趋势一致,表明在抗病种质出现上调表达可能是上游调控因子在不同抗病和感病种质中表达量的差异所导致。但枸橼C-05受到侵染后,是通过何种通路引起的表达上调,后续还需继续探究的上游调控因子,进行关键基因的挖掘及稳定遗传转化,进一步揭示枸橼C-05抗柑橘溃疡病的分子机制,为柑橘产业发展提供理论支持。
4 结论
枸橼C-05转录因子CmWRKY75与启动子互作,正调控的表达。瞬时过表达WRKY75后能增强冰糖橙和枸橼C-05对的抗性,而且在抗病种质中受到诱导后显著上调表达,这与在抗病和感病种质中的变化趋势一致。枸橼C-05 CmWRKY75与互作调控参与抗病反应,进一步揭示了枸橼C-05抗溃疡病的分子机制。
[1] SUDYOUNG N, TOKUYAMA S, KRAJANGSANG S, PRINGSULAKA O, SARAWANEEYARUK S. Bacterial antagonists and their cell-free cultures efficiently suppress canker disease in citrus lime. Journal of Plant Diseases and Protection, 2020, 127(2): 173-181.
[2] BEHLAU F, GOCHEZ A M, JONES J B. Diversity and copper resistance ofaffecting citrus. Tropical Plant Pathology, 2020, 45(3): 200-212.
[3] GOCHEZ A M, BEHLAU F, SINGH R, ONG K, WHILBY L, JONES J B. Panorama of citrus canker in the United States. Tropical Plant Pathology, 2020, 45(3): 192-199.
[4] FERENCE CHRISTOPHER M, GOCHEZ ALBERTO M, FRANKLIN B, NIAN W, GRAHAM JAMES H, JONES JEFFREY B. Recent advances in the understanding ofssp.pathogenesis and citrus canker disease management. Molecular Plant Pathology, 2018, 19(6): 1302-1318.
[5] DENG Z N, XU L, LI D Z, LONG G Y, LIU L P, FANG F, SHU G P. Screening citrus genotypes for resistance to canker disease (pv.). Plant Breeding, 2009, 129(3): 341-345.
[6] 郝晨星. 响应柑橘溃疡病菌侵染的枸橼C-05抗性基因PR4A的鉴定[D]. 长沙: 湖南农业大学, 2019.
HAO C X. Identification ofC-05 resistance genein response toulcer infection [D]. Changsha: Hunan Agricultural University, 2019. (in Chinese)
[7] DANGL J L, JONES J D G. Plant pathogens and integrated defence responses to infection. Nature, 2001, 411(6839): 826-833.
[8] YUAN M H, NGOU B P M, DING P T, XIN X F. PTI-ETI crosstalk: An integrative view of plant immunity. Current Opinion in Plant Biology, 2021, 62: 102030.
[9] SELS J, MATHYS J, DE CONINCK B M A, CAMMUE B P A, DE BOLLE M F C. Plant pathogenesis-related (PR) proteins: A focus on PR peptides. Plant Physiology and Biochemistry, 2008, 46(11): 941-950.
[10] 刘红霞, 赵晨辉, 刘洋, 李增海, 梁英海, 张冰冰. 植物系统获得抗病性及其信号调控. 吉林农业科学, 2012, 37(2): 38-41, 51.
LIU H X, ZHAO C H, LIU Y, LI Z H, LIANG Y H, ZHANG B B. Systematic acquired resistance (SAR) of plant and its signal regulation. Journal of Jilin Agricultural Sciences, 2012, 37(2): 38-41, 51. (in Chinese)
[11] 张玉, 杨爱国, 冯全福, 蒋彩虹, 耿锐梅, 罗成刚. 植物病程相关蛋白及其在烟草中的研究进展. 生物技术通报, 2012(5): 20-24.
ZHANG Y, YANG A G, FENG Q F, JIANG C H, GENG R M, LUO C G. Plant pathogenesis-related proteins and research progress in tobacco. Biotechnology Bulletin, 2012(5): 20-24. (in Chinese)
[12] ALEXANDER D, GOODMAN R M, GUT-RELLA M, GLASCOCK C, WEYMANN K, FRIEDRICH L, MADDOX D, AHL-GOY P, LUNTZ T, WARD E. Increased tolerance to two oomycete pathogens in transgenic tobacco expressing pathogenesis-related protein 1a. Proceedings of the National Academy of Sciences of the United States of America 1993, 90(15): 7327-7331.
[13] MUTHUKRISHNAN S, LIANG G H, TRICK H N, GILL B S. Pathogenesis-related proteins and their genes in cereals. Plant Cell, Tissue and Organ Culture, 2001, 64(2): 93-114.
[14] AWADE A, DE TAPIA M, DIDIERJEAN L, BURKARD G. Biological function of bean pathogenesis-related (PR 3 and PR 4) proteins. Plant Science, 1989, 63(2): 121-130.
[15] KIM Y J, LEE H J, JANG M G, KWON W S, KIM S Y, YANG D C. Cloning and characterization of pathogenesis-related protein 4 gene from. Russian Journal of Plant Physiology, 2014, 61(5): 664-671.
[16] HWANG I S, CHOI D S, KIM N H, KIM D S, HWANG B K. Pathogenesis-related protein 4b interacts with leucine-rich repeat protein1 to suppress PR4b-triggered cell death and defense response in pepper. The Plant Journal, 2014, 77(4): 521-533.
[17] REGLINSKI T, VANNESTE J L, SCHIPPER M M, CORNISH D A, YU J, OLDHAM J M, FEHLMANN C, PARRY F, HEDDERLEY D. Postharvest application of acibenzolar-S-methyl activates salicylic acid pathway genes in kiwifruit vines. Plants, 2023, 12(4): 833.
[18] ZHAO J Y, CHEN J, SHI Y, FU H Y, HUANG M T, ROTT P C, GAO S J. Sugarcane responses to two strains ofdiffering in pathogenicity through a differential modulation of salicylic acid and reactive oxygen species. Frontiers in Plant Science, 2022, 13: 1087525.
[19] SEO P J, LEE A K, XIANG F N, PARK C M. Molecular and functional profiling ofpathogenesis-related genes: Insights into their roles in salt response of seed germination. Plant and Cell Physiology, 2008, 49(3): 334-344.
[20] PONSTEIN A S, BRES-VLOEMANS S A, SELA-BUURLAGE M B, VAN DEN ELZEN P J, MELCHERS L S, CORNELISSEN B J. A novel pathogen- and wound-inducible tobacco () protein with antifungal activity. Plant Physiology, 1994, 104(1): 109-118.
[21] GUEVARA-MORATO M Á, GARCÍA DE LACOBA M, GARCÍA- LUQUE I, SERRA M T. Characterization of a pathogenesis-related protein 4 (PR-4) induced inL3 plants with dual RNase and DNase activities. Journal of Experimental Botany, 2010, 61(12): 3259-3271.
[22] DAI L M, WANG D, XIE X Q, ZHANG C H, WANG X P, XU Y, WANG Y J, ZHANG J X. The novel gene VpPR4-1 fromincreases powdery mildew resistance in transgenicL. Frontiers in Plant Science, 2016, 7: 695.
[23] ZHOU Z, ZHU Y M, TIAN Y, YAO J L, BIAN S X, ZHANG H T, ZHANG R P, GAO Q M, YAN Z L. MdPR4, a pathogenesis-related protein in apple, is involved in chitin recognition and resistance response to apple replant disease pathogens. Journal of Plant Physiology, 2021, 260: 153390.
[24] RUSHTON P J, SOMSSICH I E, RINGLER P, SHEN Q J. WRKY transcription factors. Trends in Plant Science, 2010, 15(5): 247-258.
[25] ZHANG L P, CHEN L G, YU D Q. Transcription factor WRKY75 interacts with DELLA proteins to affect flowering. Plant Physiology, 2018, 176(1): 790-803.
[26] CHEN L G, ZHANG L P, XIANG S Y, CHEN Y L, ZHANG H Y, YU D Q. The transcription factor WRKY75 positively regulates jasmonate-mediated plant defense to necrotrophic fungal pathogens. Journal of Experimental Botany, 2021, 72(4): 1473-1489.
[27] ZHANG H Y, ZHANG L P, JI Y R, JING Y F, LI L X, CHEN Y L, WANG R L, ZHANG H M, YU D Q, CHEN L G.factor binding protein1(sib1) and sib2 inhibit wrky75 function in abscisic acid-mediated leaf senescence and seed germination. Journal of Experimental Botany, 2022, 73(1): 182-196.
[28] LIU J Q, CHEN X J, LIANG X X, ZHOU X G, YANG F, LIU J, HE S Y, GUO Z J. Alternative splicing of rice WRKY62 and WRKY76 transcription factor genes in pathogen defense. Plant Physiology, 2016, 171(2): 1427-1442.
[29] WANG X H, GUO R R, TU M X, WANG D J, GUO C L, WAN R, LI Z, WANG X P. Ectopic expression of the wild grape WRKY transcription factor VqWRKY52 inenhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen. Frontiers in Plant Science, 2017, 8: 97-110.
[30] LIU Y S, LIU Q W, LI X W, ZHANG Z J, AI S K, LIU C, MA F W, LI C. MdERF114 enhances the resistance of apple roots toby regulating the transcription of MdPRX63. Plant Physiology, 2023, 192(3): 2015-2029.
[31] QIU D Y, XIAO J, XIE W B, CHENG H T, LI X H, WANG S P. Exploring transcriptional signalling mediated by OsWRKY13, a potential regulator of multiple physiological processes in rice. BMC Plant Biology, 2009, 9: 74.
[32] LI M Y, JIAO Y T, WANG Y T, ZHANG N, WANG B B, LIU R Q, YIN X, XU Y, LIU G T. CRISPR/Cas9-mediated VvPR4b editing decreases downy mildew resistance in grapevine (L.). Horticulture Research, 2020, 7(1): 149-160.
[33] YANG T, WANG Y. Research progress of plant pathogenesis related protein PR-10. Plant Physiology Journal, 2017, 53: 2057-2068.
[34] 张远嬿. 苹果MdWRKY33基因的克隆与功能分析[D]. 沈阳: 沈阳农业大学, 2018.
ZHANG Y Y. Cloning and functional analysis of apple MdWRKY33 gene [D]. Shenyang: Shenyang Agricultural University, 2018. (in Chinese)
[35] 周茜茜, 邱化荣, 何晓文, 王宪璞, 刘秀霞, 李保华, 吴树敬, 陈学森.介导提高苹果与拟南芥对轮纹病菌的免疫抗性. 中国农业科学, 2018, 51(21): 4052-4064. doi: 10.3864/j.issn.0578- 1752.2018.21.005.
ZHOU Q Q, QIU H R, HE X W, WANG X P, LIU X X, LI B H, WU S J, CHEN X S.mediated improvement of the immune resistance of apple andto. Scientia Agricultura Sinica, 2018, 51(21): 4052-4064. doi: 10.3864/j.issn.0578-1752.2018.21.005. (in Chinese)
[36] LONG Q, DU M X, LONG J H, XIE Y, ZHANG J Y, XU L Z, HE Y R, LI Q, CHEN S C, ZOU X P. Transcription factor WRKY22 regulates canker susceptibility in sweet orange (Osbeck) by enhancing cell enlargement andexpression. Horticulture Research, 2021, 8(1): 50-65.
[37] DENG B, WANG W J, RUAN C Q, DENG L L, YAO S X, ZENG K F. Involvement of. Horticulture Research, 2020, 7: 157.
[38] GUO P R, LI Z H, HUANG P X, LI B S, FANG S, CHU J F, GUO H W. A tripartite amplification loop involving the transcription factor WRKY75, salicylic acid, and reactive oxygen species accelerates leaf senescence. The Plant Cell, 2017, 29(11): 2854-2870.
[39] 卢婷, 杨莉, 胡威, 匡柳青, 郭文芳, 沈丹, 刘德春, 刘勇. 柑橘抗逆基因的克隆与表达分析. 江西农业大学学报(自然科学版), 2021, 43(1): 82-93.
LU T, YANG L, HU W, KUANG L Q, GUO W F, SHEN D, LIU D C, LIU Y. Cloning and expression analysis ofgenes in response to abiotic stresses. Acta Agriculturae Universitatis Jiangxiensis (Natural Sciences Edition), 2021, 43(1): 82-93. (in Chinese)
[40] 张娜. 中国野生葡萄VpWRKY75调控下游靶基因抗霜霉病的功能研究[D]. 杨凌: 西北农林科技大学, 2021.
ZHANG N. Study on the function of China wild grape VpWRKY75 in regulating downstream target genes to resist downy mildew [D]. Yangling: Northwest A & F University, 2021. (in Chinese)
[41] TAN X L, FAN Z Q, LI L L, WU Y, KUANG J F, LU W J, CHEN J Y. Molecular characterization of a leaf senescence-related transcription factor BrWRKY75 of Chinese flowering cabbage. Horticultural Plant Journal, 2016, 2(5): 272-278.
[42] MALECK K, LEVINE A, EULGEM T, MORGAN A, SCHMID J, LAWTON K A, DANGL J L, DIETRICH R A. The transcriptome ofduring systemic acquired resistance. Nature Genetics, 2000, 26(4): 403-410.
[43] MZID R, MARCHIVE C, BLANCARD D, DELUC L, BARRIEU F, CORIO-COSTET M, DRIRA N, HAMDI S, LAUVERGEAT V. Overexpression of VvWRKY2 in tobacco enhances broad resistance to necrotrophic fungal pathogens. Physiologia Plantarum, 2007, 131(3): 434-447.
[44] 刘兵, 李梦媛, 张娜, 尚博兴, 刘国甜, 徐炎. 中国野生葡萄抗霜霉病相关基因及其启动子的克隆和功能分析. 园艺学报, 2021, 48(2): 265-275.
LIU B, LI M Y, ZHANG N, SHANG B X, LIU G T, XU Y. Cloning and functional analysis of the CDS and promoter ofgene response to downy mildew in Chinese wild grape. Acta Horticulturae Sinica, 2021, 48(2): 265-275. (in Chinese)
Identification of the Transcription Factor WRKY75 ofin Citron C-05 and Its Function Analysis in Resistance to Citrus Canker Disease
YAN PeiHan, LUO JianMing, HAO ChenXing, SUN ZiQing, YE RongChun, LI Yi, LIU Lian, SHENG Ling, MA XianFeng, DENG ZiNiu
College of Horticulture, Hunan Agricultural University/Engineering Research Center for Horticultural Crop Germplasm Creation and New Variety Breeding, Ministry of Education/National Center for Citrus Improvement (Changsha), Changsha 410128
【Background】Citrus canker is one of the serious citrus diseases caused bysubsp.(). There is currently no radical cure method for it, and few of the existing cultivars have sufficient resistance to citrus canker. Therefore, the breeding for resistant varieties is crucial for the radical cure of the disease, and the identification of resistant genes is beneficial to disease-resistant cultivar breeding.【Objective】The aim of this study was to use the resistance related geneto screen its upstream transcription factors, and to explore the role of transcription factors in resistance to, which could provide genetic information for the breeding of citrus disease resistant varieties.【Method】Based on the transcriptome results of Citron C-05 (resistant) and Bingtang Sweet orange (susceptible) after inoculated with, and combined with the results of qRT-PCR,was differentially expressed in resistant and susceptible genotypes. Differential analysis onpromoter sequence of Citron C-05 and Bingtang Sweet orange was performed using PlantCARE. Yeast one hybrid was used to screen the upstream transcription factors ofFurtherinteraction betweenand candidate transcription factors was verified by yeast gyration test and dual-Luciferase. The expression of candidate transcription factors was detected among 8 resistant and susceptible citrus genotypes after inoculation withat 0, 2, 4, 6, and 8 days to verify their relationship with disease resistance. By transient overexpression of candidate transcription factors in Citron C-05 and Bingtang sweet orange leaves, the expression of transcription factors andwere analyzed using qRT-PCR.bacterial quantification and symptom observation were executed in transgenic leaves after 24 h inoculated with.【Result】The expression ofwas significantly higher in resistant Citron C-05 than that in the susceptible Bingtang sweet orange at 4, 6, and 8 dpi after inoculated with. There was a difference in the cis acting element W-box inpromoter between Citron C-05 and Bingtang sweet orange at -236 bp location. Therefore, thepromoter was truncated and the bait vector was constructed. Yeast one hybrid screening was conducted using Citron C-05 yeast library induced by, resulting in CmWRKY75 could interact with proCmPR4A-2. Further dual Luciferase reporting system also confirmed that the interaction between CmWRKY75 and, and CmWRKY75 was positive regulating the expression of. Additionally, the expression ofwas significantly upregulated in resistant genotypes Citron C-05, American citron and Aiguo citron after inoculation with, while it was only slight upregulation in susceptible genotypes Bingtang Sweet orange, Shatian Yu pummelo, lemon, Nanchuan and Danna citron. Transient overexpressionCitron C-05 and Bingtang Sweet orange leaves revealed a significant upregulation expression ofat 4 dpi ofand enhanced leaf resistance to.【Conclusion】CmWRKY75 could bind to the W-box inpromoter and positively regulate the expression of, resulting in enhancing leaf resistance to. Moreover, the expression ofwas induced byand showed significant upregulation in disease-resistant genotypes, which was consistent with the expression pattern of. These results indicated that the differential expression ofgenotypes influenced the expression of, which made it play a role in the resistance of Citron C-05 to canker disease.
citrus canker disease; Citron C-05;; transcription factor; WRKY75

2023-04-06;
2023-06-09
国家重点研发计划(2022YFD1200503)、湖南省研究生科研创新项目(CX20210671)
颜培涵,E-mail:yanpeihan7279@163.com。通信作者邓子牛,E-mail:deng7009@163.com
(责任编辑 赵伶俐)
