代谢综合征患者血脂、血糖、血压及炎症介质与血清胰岛素生长因子-1的相关性*
2023-11-18时黛顾雯李晓英段小平张航赵伟穆旭王霄霄秦嘉恒
时黛,顾雯,李晓英,段小平,张航,赵伟,穆旭,王霄霄,秦嘉恒
(1.贵州中医药大学第二附属医院 内分泌科,贵州 贵阳 550003; 2.贵州中医药大学 第二临床医学院,贵州 贵阳 550025; 3.贵州医科大学附属医院 门诊部,贵州 贵阳 550004)
代谢综合征(metabolic syndrome,MS)是一种全身慢性炎症轻度诱导的状态,是肥胖、胰岛素抵抗、高血压和高脂血症等多种症候群的累积,该人群罹患心血管疾病及糖尿病的风险性增加[1]。中国老年人MS的Meta分析结果显示,老年人MS的合并患病率为23.9%,女性MS的合并患病率高于男性[2]。MS症候群的发病症结是脂肪组织堆积和组织功能障碍,从而导致胰岛素抵抗[3],并以炎症细胞因子活性增加为特征[4]。研究显示,炎症因子在MS的发生发展中起着不可或缺的主导作用,这些炎症因子包括白细胞介素-1β(interleukin 1 beta,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor,TNF-α)等,因此炎症介质可以作为MS有价值的预测因子[5]。胰岛素生长因子-1(insulin-like growth factors,IGF-1)是MS病理生理学中的关键激素,涉及碳水化合物和脂类的代谢[6],IGF-1的缺乏与MS的发生和导致动脉粥样硬化的血管功能紊乱的形成密切相关[7],IGF-1会因炎症、氧化应激等因素而减少[8]。本研究通过分析IGF-1及炎症介质与MS的相关性,为早期预判MS、降低心脑血管发病率,预防2型糖尿病及心血管疾病的发生提供新思路。
1 对象与方法
1.1 研究对象
选取2021年5月—2021年7月确诊MS患者40例作为MS组,年龄31~67岁;同期确诊为单纯血压升高、不伴有其他代谢异常的高血压患者40例作为HT组,年龄22~79岁;同期健康体检者40例作为NS组,年龄22~60岁。MS的诊断参照中华医学会糖尿病学分会(CDS)[9]提出的我国MS诊断标准:(1)超重和(或)肥胖,即体质量指数(body mass index,BMI)≥25.0 kg/m2;(2)高血糖,空腹血糖(fasting blood glucose,FBG)≥6.1 mmol/L及(或)糖负荷后2 h血糖(2 h postprandial blood glucose,2 hPBG)≥7.8 mmo/L,和(或)已确诊为糖尿病并治疗者;(3)高血压,收缩压/舒张压 ≥140/90 mmHg、及(或)明确诊断为高血压并治疗者;(4)血脂紊乱,甘油三酯(triglyceride,TG)≥1.7 mmol/L、及(或)高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)男性<0.9 mmol/L、女性<1.0 mmol/L;符合上述3项或以上即可诊断为MS。排除标准:(1)排除患有严重心脑血管疾病者;(2)发热及感染者;(3)近1个月内出现糖尿病酮症酸中毒等急性代谢紊乱;(4)继发性高血压;(5)严重肝肾功能不全、危重病、恶性肿瘤患者及妊娠和哺乳期妇女。
1.2 研究方法
1.2.1一般临床资料 收集3组受试者的一般临床资料,包括性别、年龄、身高、血压、体质量及BMI。
1.2.2血糖、血脂指标测定 采用鱼跃血糖仪测定3组受试者FBG及2 hPBG;采集3组受试者晨起空腹状态下肘静脉血5 mL,3 000 r/min离心15 min,取上层血清,应用全自动生化分析仪检测TG、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、HDL-C、糖化血红蛋白(glycosylated hemoglobin,type A1C,HbA1c)。
1.2.3血清炎症介质检测 抽取3组受试者空腹肘静脉血2 mL,3 000 r/min离心15 min,收集上层血清备用。采用酶联免疫吸附试验测定法(enzyme-linked immunoadsordent assay,ELISA)测定3组患者血清IL-1β、IL-6、TNF-α、IGF-1的水平,试剂盒由武汉伊莱瑞特生物科技股份有限公司生产。
1.3 统计学方法
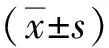
2 结果
2.1 一般临床资料
3组受试者的身高、性别比较,差异无统计学意义(P>0.05);MS组患者的年龄、体质量、BMI高于HT组和NS组(P<0.05);MS组收缩压、舒张压均高于NS组(P<0.05)。见表1。
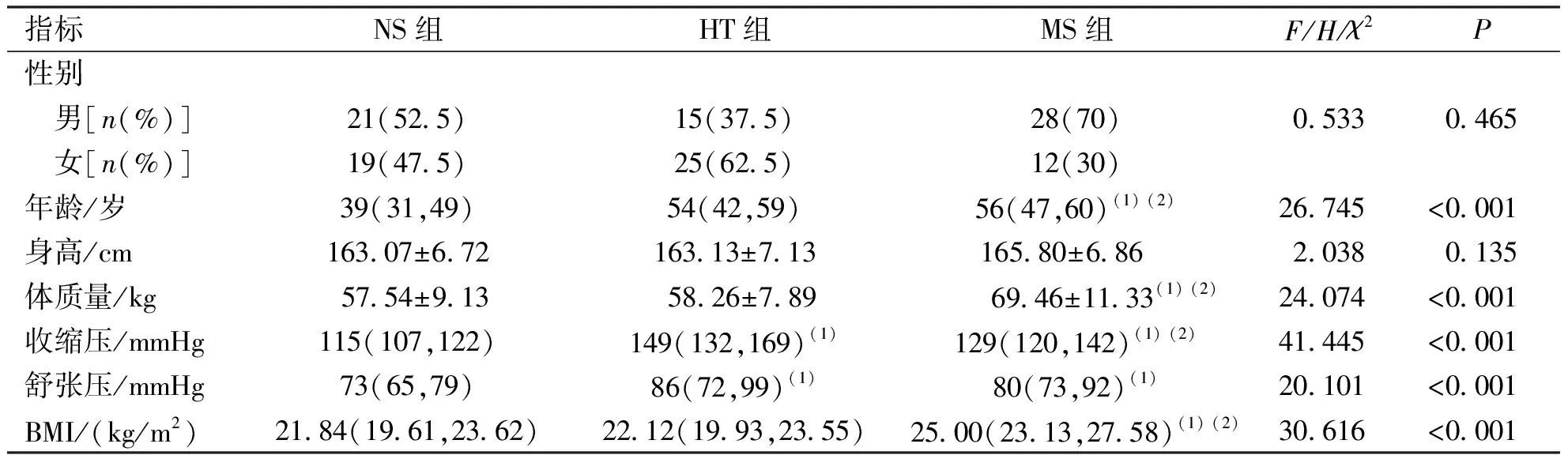
表1 各组被检者一般临床资料比较
2.2 血糖及血脂水平
MS组患者的FPG、2 hPBG、HbA1c、TG均高于HT组和NS组(P<0.05),MS组患者的LDL-C高于HT组(P>0.05);MS组患者的HDL-C低于HT组和NS组(P<0.05)。见表2。
2.3 血清炎症介质水平
MS组患者的IL-1β水平高于NS组和HT组(P<0.05);MS组和HT组患者的TNF-α水平均高于NS组(P<0.05);MS组IL-6水平低于HT组(P<0.05),HT组IL-6水平高于NS组(P<0.05);MS组患者的IGF-1水平低于HT组(P<0.05),HT组IGF-1水平高于NS组(P<0.05)。见表3。

表3 各组被检者血清炎症介质比较
2.4 MS组TG、HDL-C、LDL-C、2 hPBG、HbA1c、舒张压及收缩压与IGF-1的相关性分析
结果表明,MS组的TG、LDL-C、HDL-C与IGF-1无相关性(P>0.05),2 hPBG、HbA1c 与IGF-1呈负相关(r=-0.235、-0.195,P<0.05),收缩压、舒张压与IGF-1呈正相关(r=0.124、0.208,P<0.05)。见表4。
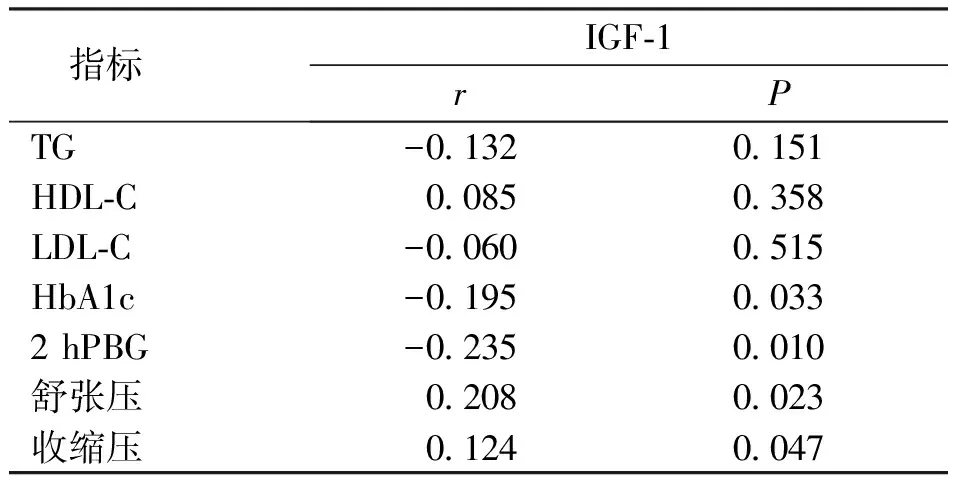
表4 TG、HDL-C、LDL-C、2 hPBG、HbA1c、舒张压、收缩压与IGF-1的相关性分析
3 讨论
MS是多种代谢风险因素的聚集,增加2型糖尿病和心血管疾病的患病率[10]。MS发病机制至今尚未阐明,与胰岛素抵抗、脂肪组织功能障碍、慢性低度炎症、氧化应激、失眠、肠道微生物群、遗传因素等密切相关[11]。慢性炎症是一种潜在的病理状态,长期的暴饮暴食及缺乏运动导致肥胖时,炎性细胞渗入及积聚脂肪及其他组织,分泌过量的促炎介质,促进动脉硬化的发生发展,诱发血管病变[12]。脂肪衍生的炎症细胞因子和非酯化脂肪酸在中心性肥胖胰岛素抵抗、炎症和动脉粥样硬化形成之间建立了联系[13]。肥胖导会致脂肪细胞尺寸增大,释放过量的游离脂肪酸、活性氧、促炎细胞因子,如单核细胞趋化蛋白-1、TNF-α、IL-1β、IL-6等炎性介质[14],导致慢性低度全身炎症和胰岛素抵抗,从而导致代谢失调。研究显示,炎性介质与MS密切相关,一项探索416名45~60岁女性MS患者肿瘤坏死因子α基因多态性与促炎细胞因子关系研究显示,MS组的IL-1β、IL-6、TNF-α、CRP炎性因子明显高于非MS组,提示炎症介质在MS的发病机制中起重要作用[15]。一项横断面研究显示,MS组的血清TNF-α和IL-6水平明显高于健康对照组,与对照组比较,MS组具有更高的腰围、血压、血清甘油三酯、葡萄糖和胰岛素水平,观察到IL-6与TNF-α和胰岛素抵抗显著相关,为预防胰岛素抵抗引起的代谢紊乱提供新的治疗靶点[16]。本研究有相似发现,MS组患者的体质量、BMI、FPG、2hPBG、HbA1c、TG、LDL-C水平均高于HT组和NS组;观察到MS组患者的IL-1β、TNF-α炎症介质均高于NS组,与HT组比较,IL-1β水平进一步升高;HT组IL-6水平高于MS组和NS组,证实慢性炎症因子参与MS的发生发展,说明炎症介质与MS密切相关。因此及时检测炎症因子有助于MS患者的预测。
炎症易引发神经内分泌系统的反应,其反应的特征是下丘脑生长激素抵抗和IGF-1水平的降低[17]。痴呆症、糖尿病、血管疾病、骨质疏松、死亡率与IGF-1之间呈现U形关系,IGF-1的高水平和低水平都可能是有害的[18]。IGF-1与MS具有一定的关联,低水平的IGF-1可导致MS,IGF-1浓度与MS及其单个组分呈负相关[19],IGF-1在维持内皮屏障功能中起重要作用,其缺失下调会降低抗氧化能力、增加内皮通透性,促进动脉粥样硬化的发展,增加心血管疾病和2型糖尿病的风险[20]。本研究显示,HT组、NS组、MS组血浆IGF-1水平逐渐降低,证明IGF-1与MS密切相关,与国内外研究一致,本研究中MS组的炎症水平表达相对较高,但IGF-1水平表达低,证实了低水平的IGF-1可导致MS,炎症易引起IGF-1的水平的降低。本研究应用相关性分析发现2hPG、HbA1c 与IGF-1呈负相关,血压与IGF-1呈正相关关系,IGF-1与TG、HDL-C、LDL-C无显著相关性。有研究观察到低剂量的IGF-1替代疗法具有逆转胰岛素抵抗、改善脂质代谢,并减少氧化损伤[21]。因此,提早对血清IGF-1进行检测,有助于预判MS的进展,有助于减少MS患者发生2型糖尿病及心脑血管疾病的不良后果及风险。
综上,血清IGF-1和炎症因子IL-1β、IL-6、TNF-α表达水平均能影响MS疾病的进展,血清IGF-1与MS的HbA1c、2hPBG呈负相关,与血压呈正相关,证实了炎症介质、IGF-1与MS具有相关性,认为低水平的IGF-1可导致MS,炎症易引发IGF-1的水平的降低,因此检测炎症指标及IGF-1水平对预判MS具有指导意义,有助于对2型糖尿病、心血管疾病的防治。
