血流向量成像技术评价房颤患者在心动周期中左心室能量损失特征及相关因素*
2023-11-18王星黄富琴袁瑶张蓓
王星,黄富琴,袁瑶,张蓓
(1.贵州医科大学附属医院 超声医学科,贵州 贵阳 550004; 2.贵州医科大学 医学影像学院,贵州 贵阳 550004)
心房颤动(atrial fibrillation,AF)是临床上最常见的心律失常之一[1]。正常的心内血流模式促进血液流入心室,限制能量耗散,保持动量,并使血液重新定向流出[2]。缺血性心脏病和瓣膜性心脏病干扰正常血流模式,从而增加耗散能量损失(energy loss,EL)并影响疾病结果[3]。血流向量成像(vector flow mapping,VFM)是一种新的超声心动图技术,其原理是使用彩色多普勒和斑点追踪测量来可视化心内血流速度矢量,并量化血流EL[4]。目前关于超声评估AF患者左心房的结构和功能的研究比较多见,但是对AF患者中左心室的结构和功能的研究少见,对左心室血流动力学变化的研究更为少见。本研究采用VFM评价AF患者的左心室EL,探讨AF患者左心室血流模式的变化,评价其在AF患者中的应用价值。
1 资料与方法
1.1 研究对象
选取2021年8月—2022年3月确诊的AF患者60例作为AF组,其中男29例、女31例,平均年龄(63.9±13.17)岁。纳入标准:符合2020年欧洲心脏病协会AF管理指南[5]中AF的诊断标准。排除标准:(1)超声透声窗不良及其他导致声学图像质量差者;(2)高血压控制不良(血压>140/90 mmHg);(3)糖尿病血糖控制不良(空腹血糖≥7.0 mmol/L);(4)合并瓣膜病及其他器质性心脏病;(5)合并甲状腺功能亢进症、严重肺部疾病、肿瘤性疾病的患者;(6)未签署知情同意书者。选取同期年龄及性别匹配的健康体检志愿者60例作为对照组,其中男39例、女21例,年龄平均(62.0±12.5)岁。
1.2 研究方法
1.2.1一般资料 记录2组受试者性别、年龄、体质量、身高、体质量指数(body mass index,BMI)等一般资料。
1.2.2图像采集 采用日立880彩色多普勒超声诊断仪和相控单晶体探头S121,探头频率为10~50 MHz,所有受试者均连接心电图,左侧卧位进行检查,以获得心尖四腔视图;调整图像深度以显示整个左室流入道(left ventricular inflow tract,LVIT)、整个左室腔和左 室流出道(left ventricular outflow tract,LVOT),设置每个彩色多普勒图像的脉冲频率以避免混叠,在一幅动态图像中捕捉到三个连续的心动周期,每个受试者至少记录3张动态图像。
1.2.3二维超声方法 参考美国超声心动图协会制定的成人超声心动图指南[6],获取2组受试者心脏左房内径(left atrial diameter,LAD)、左室舒张末期内径(left ventricle end-diastolic dimension,LVEDD),使用双平面Simpson法计算左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)及左室射血分数(left ventricular ejection fraction,LVEF)。在心尖四腔心切面,将脉冲多普勒放在二尖瓣尖,使取样线平行于血流,测量二尖瓣口舒张早期血流速度峰值E,以及二尖瓣环侧壁舒张早期二尖瓣运动峰值速度e′,进而计算 E/e′。
1.2.4EL分析 将所采集心尖四腔心图像导入DAS-RSI图像处理工作站,对心尖四腔心切面左室二维彩色血流动态图像进行分析,手动描记左室心内膜边界,自动追踪其余帧频心内膜边界,根据时间-血流曲线、瓣膜开放情况,以及结合体表心电图,将一个完整心动周期分为等容收缩期(isovolumic contraction period,IC)、收缩早期(early systolic phase,ES)、收缩晚期(late systolic phase,LS)、等容舒张期(isovolumic relaxation phase,IVRT)、舒张早期(early diastole phase,ED)和舒张晚期(late diastole phase,LD),手动描绘6个时相的每个节段为感兴趣区域(region of interest,ROI),工作站自动显示ROI的EL,测量3次,取平均值。
1.3 统计学分析
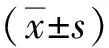
2 结果
2.1 一般资料
两组受试者年龄、性别、身高、体质量、BMI比较,差异无统计学意义(P>0.05)。见表1。
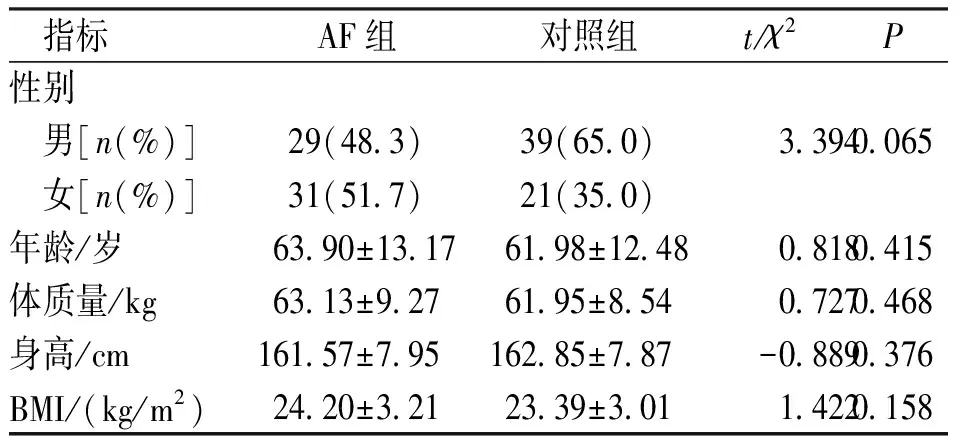
表1 2组被检者一般资料比较
2.2 常规超声心动图结果
与对照组比较,AF组患者LAD、LVEDD、LVEDV、LVESV、E/e′均升高,差异有统计学意义(P<0.05);而e′小于对照组,差异有统计学意义(P<0.05);两组间E、LVEF比较,差异无统计学意义(P>0.05)。见表2。
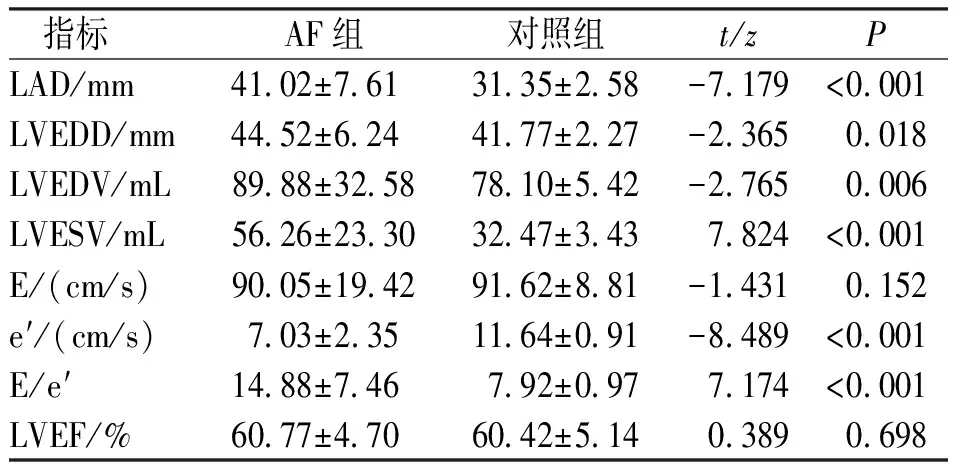
表2 房颤组与对照组常规超声心动图指标比较
2.3 EL
与对照组比较,AF组在ES、LS、ED、LD的EL升高,差异有统计学意义(P<0.05),其他时相比较差异无统计学意义(P>0.05)。见表3。
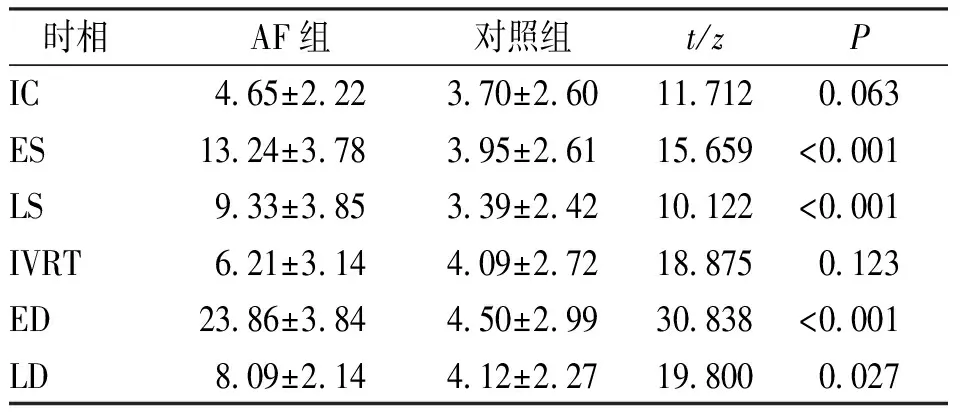
表3 2组被检者各时相EL对比[(J/s·m2)]
2.4 相关性分析
Pearson相关性分析结果表明,AF组左室LS-EL与LVEDD呈明显正相关(r=0.93,P<0.000 1),左室ED-EL与LVEDV、E、E/e′呈明显正相关(r=0.93、0.98、0.95,P<0.000 1)、与e′呈明显负相关(r=-0.93,P<0.000 1),LVEDV与E、E/e′呈明显正相关(r=0.93、0.97,P<0.000 1)、与e′呈明显负相关(r=-0.83,P<0.000 1);E与e′呈明显负相关(r=-0.88,P<0.000 1)、与E/e′呈明显正相关(r=0.98,P<0.000 1),e′与E/e′呈明显负相关(r=-0.84,P<0.000 1)。见图1。
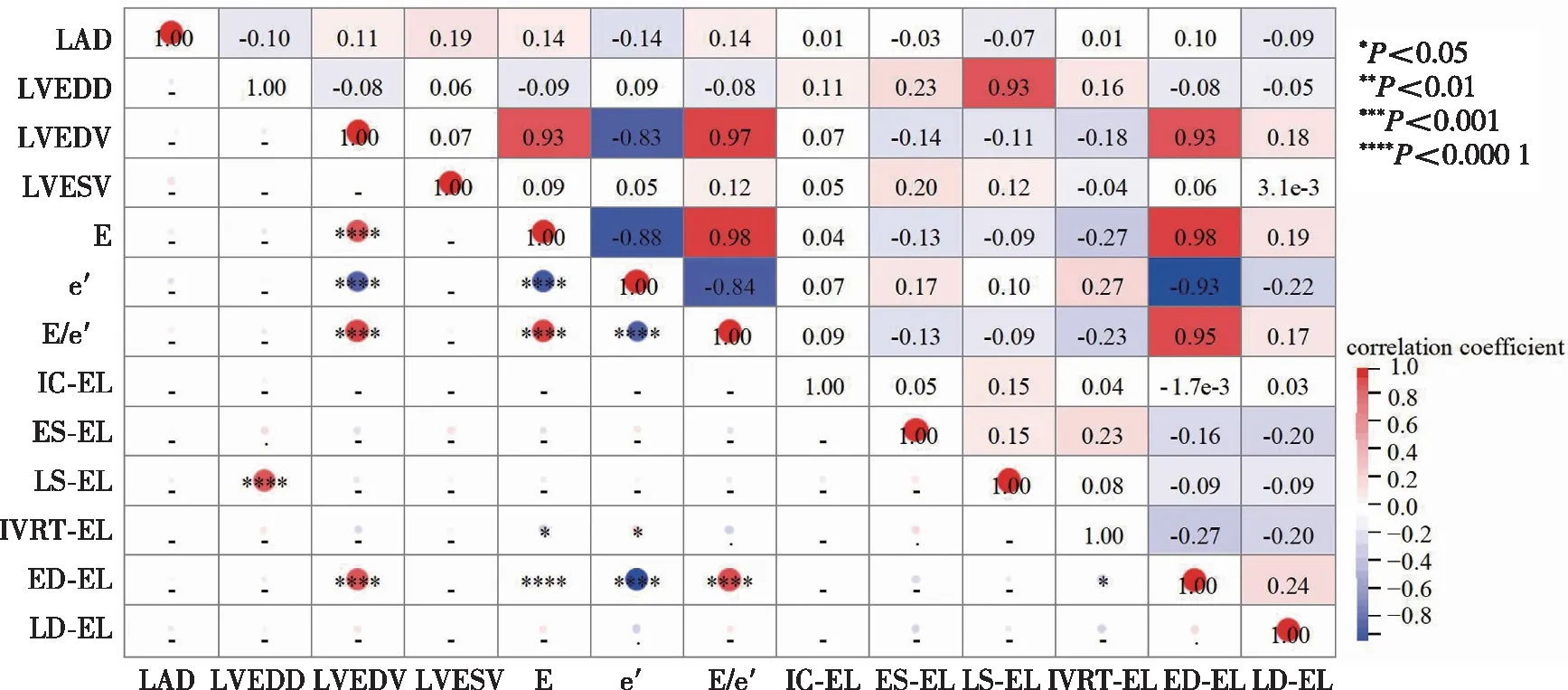
图1 AF患者超声心动图各参数间的相关系数热力图
3 讨论
EL是一种评价心功能的新血流动力学指标[4],它是由于血液黏性导致流动的血液与壁剪切流动产生摩擦[5],将动能转化为热量而引起的。当血流和壁之间的速度越高或剪切角越大,EL值越高[1],此时心脏中的血流模式被不对称地重新定向,以通过限制血流分离和不稳定性来避免过多的能量耗散[6],因此只产生很少的EL[7]。湍流引起的能量损失被认为会增加心脏负荷。EL基本上是由于黏度驱动摩擦而转化为热能的动能。在生理条件下,与动能相比,EL较低(约10%)[8],其作用尚未确定。然而,在病理情况下,这一比例会增加,反映出心室内血流模式的不利变化,进而可能影响心脏组织,最终导致从局部心室壁到整个心室的心脏适应性—不适应性重塑[9]。之前有研究证实,对于一个健康成年人,在一个心动周期内会出现三个EL峰值:快速射血期、快速充盈期以及心房收缩期[10]。
AF是由心房主导折返环引起许多小折返导致的房律紊乱,此时心房激动次数可高达300~600次/min,心跳频率快而且不规则,导致心房各部分心肌纤维呈现出速度极快的不协调和不规则的收缩颤动,造成心房有效机械功能基本丧失,同时造成的快速而不规律的心室收缩也将引起心室泵血功能的下降[11]。AF可引起左房重构,包括电重构、结构重构及功能重构[12]。左房收缩功能受损时,左室充盈量减少,每搏量逐渐降低引起心动过速,可诱导心肌细胞凋亡、坏死或纤维化[13]。有研究发现20%~30%的AF患者患有收缩性左心室功能障碍。此外,AF被认为与心脏猝死的风险增加有关,可能与心衰相关的并发症有关。当左心室几何结构变形,左心室舒张功能和左心房压力受损时,左心室血流模式将受到不利影响[14]。之前的临床研究表明,在心室率正常的情况下,AF可能会促使左心室功能恶化[15-17]。先前的临床研究数据显示,与心房纤维化相比,动物模型中起搏诱导的AF对左心室纤维化的影响较小或没有影响。并且在起搏诱发AF的狗模型中研究发现,左心室纤维化的增加是由AF的心动过速成分介导的[18]。
本研究发现,AF组患者LVEDD、LVEDV、LVESV、E/e′均高于对照组(P<0.05),而e′低于对照组(P<0.05),提示AF组左心室容积明显扩大,舒张功能显著降低,原因可能在于AF患者存在心律不规则、房室同步性丧失和心动过速,导致左心室充盈压增高、顺应性下降,与Zhu等[7]的研究结果一致。
本研究中,AF组患者ES、LS、ED、LD的EL较对照组均明显升高(P<0.05),并且在ES、ED时各可见一峰值,之前有研究发现收缩期的EL(IC、ES、LS)主要受喷射流的高速所影响[7,19]。在本研究中,LS-EL主要受左室舒张末期内径影响,并与其呈正相关,左室舒张末期内径越大,左室内血流越多,在左室收缩晚期时,高速血流流向主动脉,左室内丰富的血流之间形成碰撞以及血液与室壁之间的碰撞导致左室收缩晚期的高EL。之前有研究发现,在正常人中,舒张期的EL比收缩期的高[8,10],与本研究一致,说明即使在AF患者中,该规律也保持不变,这可能与左心室流入需要在心室中部和心尖部进行“U形转弯”有关。较高的左心室充盈速度会导致更多的湍流与左心室中的血液碰撞,从而导致更多的EL[19-20]。舒张期左心室EL主要受左心室舒张功能的影响。二尖瓣打开后,由于左心房和左心室之间的压力梯度以及左心室心肌的主动松弛,有高速血流进入左心室腔,促进涡流形成。然而,AF患者的左心室舒张功能障碍明显影响涡流形成[19,21],导致左心室舒张期高EL[20,22]。此外,ED-EL也显著增加,可能在于左心室舒张功能受损时,心室壁松弛度和顺应性下降,导致血流与室壁冲撞增多,使EL增加。之前有研究发现EL与E/e′、E呈正比[7,22],本研究在AF患者中也发现左室ED-EL与E、E/e′呈正相关。至于LD-EL,主要受左心房收缩能力的影响。心房收缩将有助于形成晚期心内涡流,促进左心室动能并降低EL耗散[23]。AF患者心房收缩功能受损,形成不稳定的涡流,使血液间的碰撞以及血液和室壁间的碰撞增加,导致EL增高。同时IVRT和ED左室充盈血流增加,LD时进入左心室的血流与ED的血流碰撞进一步增加,导致LD的EL增加。之前有报告将左心室舒张功能障碍描述为房颤消融术后房颤复发的独立预测因素[24-25],进一步证实了左心室舒张功能在治疗AF中的重要性。
虽然VFM技术具有无创、便捷、成本低等优点,可准确定量定性分析心腔内血流动力学,更加敏感地评价心功能,但本研究也有其局限性,比如目前研究的样本量较少,需要扩大样本量,减少混杂偏倚;其次心腔内血流是三维立体空间结构,而VFM是基于二维平面分析;最后当心腔内血流流速较快时,VFM无法校正混叠导致低估流速。
综上所述,AF患者左室血流动力学已经发生紊乱,引起收缩期和舒张期EL增高,其中以ED的EL增高较为明显,可作为评估AF患者左室血流动力学变化的潜在指标,为未来AF患者的研究提供一种新的方法和思路。
