依达拉奉对帕金森病模型PC12细胞和秀丽隐杆线虫氧化应激、自噬水平及α-突触核蛋白表达的影响*
2023-11-18秦思源屠秋霞郑乾翟素珍焦玲张春林
秦思源,屠秋霞,郑乾,翟素珍,焦玲,张春林*
(贵州医科大学 基础医学院,贵州 贵阳 550025)
帕金森病(Parkinson's disease,PD)是一种常见的中枢神经系统退行性疾病,常见于中老年人群,在我国拥有庞大的患病群体[1]。有研究显示,中国城市中65岁以上人群PD 发病率约为1.7%[2]。PD临床表现主要包括静止性震颤、运动迟缓、肌强直、姿势步态异常等运动症状以及其他非运动症状,典型病理学特征为中脑黑质致密带(substantia nigra zona compact,SNc)多巴胺 (dopamine,DA)能神经元进行性、不可逆性的丢失,残留的神经元胞质内出现以α-突触核蛋白 (α-synuclein,α-syn)为主要成分的路易小体(lewy body,LB)[3]。PD发病机制复杂,涉及α-syn异常聚集、氧化应激(oxidative stress,OS)、神经炎症、内质网应激及线粒体功能障碍等致病因素,其中α-syn异常聚集与OS是PD药物治疗的主要靶点[4]。依达拉奉(edaravone,Eda)是一种临床上用于急性缺血性脑血管病的治疗药物,近年来,作为一种强效的自由基清除剂在神经系统疾病治疗中备受关注[5]。Eda不仅对急性缺血性脑血管病具有保护作用,而且对多发性硬化、癫痫及阿尔茨海默病等神经系统疾病具有潜在治疗作用[6-8];除此之外,Eda在PD动物疾病模型与临床治疗的研究中所发挥的作用也愈发引人关注,如Eda可通过抗氧化对抗细胞凋亡[9],还可通过抑制核苷酸寡聚化结构域样受体热蛋白结构域蛋白3[NOD (nucleotide-binding oligomerization domain)-like receptor thermal protein domain associated protein 3,NLPR3]炎症小体的激活和调节Ⅰ型/Ⅱ型小胶质细胞(microglia 1/2,M1/M2)极化来改善PD大鼠的神经行为功能达到抗炎作用[10],还能通过影响线粒体融合和分裂蛋白对线粒体进行调节从而治疗PD[11]。目前有关Eda对α-syn表达的调节以及对PD的作用机制尚不清楚,因此本研究拟以Eda为活性氧(reactive oxygen species,ROS)清除剂,探讨其对α-syn表达和自噬的作用,以期为Eda“旧药新用”于PD的修饰治疗提供前期研究基础。
1 材料与方法
1.1 实验材料
1.1.1细胞株、虫株及菌株来源 大鼠肾上腺嗜铬细胞瘤细胞株PC12细胞(高分化型)购自中国科学院典型培养物保藏委员会昆明细胞库;秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)转基因虫株BZ555[Pdat-1::绿色荧光蛋白(green fluorescent protein,GFP)]、NL5901[Punc-54::α-synuclein::黄色荧光蛋白 (yellow fluorescent protein,YFP)+unc-119]及DA2123[Plgg-1::GFP::lgg-1+rol-6 (su1006)];菌株大肠埃希氏杆菌 (Escherichiacoli,E.coli) OP50(尿嘧啶渗漏突变型)均购自美国线虫遗传中心(CaenorhabditisGenetics Center,CGC)。
1.1.2主要药物及试剂 6-羟基DA(6-hydroxydopamine,6-OHDA)、抗坏血酸及Eda(美国Sigma),杜氏改良Eagle 培养基(dulbecco's modified eagle medium,DMEM)高糖培养基、胰蛋白酶、青-链霉素及谷氨酰胺(美国Hyclone),四季青胎牛血清(fetal bovine serum,FBS;天杭生物),噻唑蓝(methylthiazolyl-diphenyl-tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、丙二醛(malonaldehyde,MDA)含量检测试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(索莱宝生物),ROS及二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(碧云天生物),自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA;美国MCE),α-syn 抗体(美国Abcam),微管相关蛋白1轻链3B(microtubule associated protein 1 light chain 3 beta,LC3B)抗体(美国CST),泛素结合蛋白p62(sequestosome-1,p62/SQSTM1)抗体(日本MBL),Tubulin抗体(博奥森生物),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(康成生物),Alexa Fluor 488二抗(美国Thermo Fisher),近红外染料(infrared dye,IRDye)680RD 免疫球蛋白G(immunoglobulin G,IgG)、IRDye 800CW IgG二抗(美国Li-cor),其余试剂均为国产分析纯。
1.1.3主要仪器 生物安全柜和CO2细胞培养箱(美国Thermo Fisher),超微量微孔板紫外分光光度计、垂直电泳槽、电泳仪电源及蛋白转印系统(美国Bio-Rad),近红外双色激光成像系统(美国Li-cor),倒置荧光显微镜(日本Nikon),激光共聚焦显微镜(日本Olympus)。
1.2 研究方法
1.2.1细胞培养 PC12细胞培养于含有10%胎牛血清、1%青-链霉素、1%谷氨酰胺的DMEM高糖培养基,置于含有5%CO2的37 ℃细胞培养箱中培养,每隔24 h换液处理,待单层细胞汇合至80%~90%,0.25%胰蛋白酶消化、传代,取对数生长期的细胞进行后续实验。
1.2.2细胞活力检测 采用MTT比色法检测6-OHDA对细胞活力的影响,以确定其最适造模浓度。取“1.2.1”项下对数生长期PC12细胞以1.5×108个/L的密度接种于96孔板,分别使用50~800 μmol/L 6-OHDA 处理24 h,吸弃上清,加0.5 g/L MTT,孵育4 h,加DMSO溶解沉淀,室温振荡10 min,使用超微量微孔板分光光度计测量其在490 nm处吸光度值。同样方法使用10~200 μmol/L Eda预处理“1.2.1”项下对数生长期的PC12细胞3 h,再用200 μmol/L 6-OHDA(后续实验选择此浓度为最适造模浓度)处理细胞24 h,最后检测吸光度,计算各组细胞存活率。
1.2.3荧光探针法、微量法及可见分光光度法检测细胞的OS水平 取“1.2.1”项下对数生长期的PC12细胞,以2×108个/L的密度接种于6孔板,分为对照组(不做任何处理)、模型组(6-OHDA处理)及 Eda组(Eda+6-OHDA)。给药干预后使用磷酸盐缓冲液(phosphate buffer saline,PBS)洗去药物,加10 μmol/L 2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针,孵育30 min,无血清培养基清洗3次,倒置荧光显微镜观察荧光;使用细胞裂解液处理各组细胞,1 200 r/min离心 20 min,收集上清,按照MDA和SOD试剂盒配制反应体系,使用酶标仪检测吸光度值,计算MDA含量和SOD活性。
1.2.4免疫荧光法检测细胞中α-syn的表达 取“1.2.1”项下对数生长期的细胞接种至细胞爬片,分为对照组(不做任何处理)、模型组(6-OHDA处理)及 Eda组(Eda+6-OHDA),药物处理后、用PBS洗去药物,依次进行4%多聚甲醛固定、0.2% Triton X-100透膜、3% 牛血清白蛋白(bovine albumin,BSA)封闭、一抗二抗孵育,含4′,6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)的封片胶水封片,于激光共聚焦显微镜下观察并拍摄α-syn免疫荧光的表达。
1.2.5Western blot检测细胞α-syn和自噬相关蛋白的表达 提取“1.2.1”项下对数生长期的细胞,分为对照组(不做任何处理)、模型组(6-OHDA处理)及 Eda组(Eda+6-OHDA),提取各组蛋白进行定量以及变性处理,聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分离,转印至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,3% BSA封闭1 h,α-syn(1∶1 000)、LC3(1∶1 000)、p62(1∶1 000)、Tubulin(1∶5 000)及GAPDH抗体(1∶5 000)一抗4 ℃孵育过夜,次日TBST清洗3次,加IRDye 680RD IgG、IRDye 800CW IgG二抗,避光孵育1 h,清洗,使用Li-cor Odyssey CLx系统进行成像,结果使用Image J软件分析。
1.2.6线虫的培养和同期化 配制标准线虫生长培养基(nematode growth medium,NGM),以E.coliOP50作为食物,置于20 ℃人工气候箱中培养。使用M9缓冲液冲洗收集产卵期线虫,置于裂解液中裂解3~6 min,收集虫卵,M9缓冲液清洗2~3次,置于铺有E.coliOP50的NGM平板上,20 ℃人工气候箱中培养20 h,得到同期化的第一阶段幼虫(larva 1,L1)。以上均按照国际化标准程序进行培养。
1.2.7线虫PD模型建立及实验分组 取“1.2.6”项下发育至L3阶段的BZ555虫株,使用M9缓冲液收集至离心管,2 000 r/min离心2 min,M9缓冲液重复洗涤3次、缓冲液1 mL重悬;上述虫液分为2份,分别转移至含有10 mmol/L抗坏血酸配制的6-OHDA(浓度50 mmol/L)离心管和只含有等浓度抗坏血酸的离心管中,后者作为对照组,2管均处理1 h,每隔10 min轻柔摇晃。将暴露于6-OHDA的L3线虫洗净后分为4份,1份转移至均匀涂有OP50菌液的NGM培养板中记为模型组,其余3份分别转移至含有50、200 及400 μmol/L Eda的培养板中,分别记为低、中及高浓度Eda组。将仅使用抗坏血酸处理的对照组洗净后转移至涂有E.coliOP50菌液的空白NGM培养板中,20 ℃恒温气候箱培养24 h。NL5901、DA2123虫株以相同方法进行处理分为对照组、模型组和中浓度Eda组后,额外设置中浓度Eda+3-MA组,即将模型组线虫转移至含有200 μmol/L Eda+100 μmol/L 3-MA的培养板中进行培养。
1.2.8线虫的DA依赖行为学检测 分别取“1.2.7”项下发育至L4时期的对照组、模型组、低、中、高浓度Eda组BZ555虫株40只,置于空白NGM板,使其自由运动以脱去附在身上的E.coliOP50菌液。(1)基础减缓行为:将线虫分别放在涂有OP50(B+)和未涂有OP50(B-)的培养板中,适应5 min,计数30 s内线虫的身体弯曲数。(2)乙醇趋避行为:将培养板划分为4个象限,取对角2个象限均匀加入75%乙醇50 μL,使线虫处于平板中央,自由活动30 min,清点各象限线虫的数量,计算偏好指数[preference index,PI;PI=(空白象限线虫数量-乙醇象限线虫数量)/线虫总数]。
1.2.9荧光显微成像法检测线虫DA能神经元的损伤与修复 分别取“1.2.7”项下发育至L3~L4时期对照组、模型组及中浓度Eda组BZ555虫株10只,利用2%琼脂制备琼脂薄片,使用盐酸左旋咪唑作为麻醉剂固定线虫;使用中性树胶封片,置于倒置荧光显微镜下观察DA能神经元。
1.2.10荧光显微成像法检测线虫体内ROS水平 分别取“1.2.7”项下对照组、模型组、中浓度Eda组发育至L3~L4时期的BZ555虫株10只,收集至离心管,转移至含有50 μmol/L DCFH-DA的NGM板中,避光培养2 h,观察各组线虫的ROS变化。
1.2.11Western blot法检测线虫体内α-syn蛋白的表达 分别取“1.2.7”项下对照组、模型组、中浓度Eda组发育至L3~L4时期的NL5901虫株10只,观察线虫体壁上α-syn蛋白的荧光变化;同时各组各取10个长满L4时期线虫的培养板,离心收集裂解,将提取的线虫蛋白进行定量及变性处理,SDS-PAGE凝胶电泳分离,转印至PVDF膜,3% BSA封闭1 h,加α-syn抗体(1∶1 000),Tubulin抗体(1∶5 000),置于4 ℃孵育过夜;次日TBST清洁3次,加IRDye 680RD IgG、IRDye 800CW IgG二抗,避光孵育1 h,清洗,使用Li-cor Odyssey CLx 系统进行成像,结果使用Image J软件分析。
1.2.12荧光显微成像法检测自噬抑制剂处理前后线虫自噬小体和α-syn的表达 分别取“1.2.7”项下对照组、模型组、中浓度Eda组以及中浓度Eda+3-MA组发育至L3~L4时期的NL5901和DA2123虫株各10只,观察DA2123线虫体内绿色荧光蛋白标记的自噬小体数量和NL5901线虫体壁上α-syn蛋白的荧光表达。
1.3 统计学分析
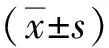
2 结果
2.1 细胞活力
MTT结果表明,在50~800 μmol/L 6-OHDA范围内PC12细胞存活率随着6-OHDA的浓度升高而降低(P<0.01或P<0.000 1或P<0.001);当6-OHDA浓度为200 μmol/L时,PC12细胞存活率约为60%,较符合PD模型的情况,故选择该浓度为造模浓度。与模型组比较,100 μmol/L Eda组PC12细胞存活率增加(P<0.05),此时PC12细胞存活率恢复至80%,故将此浓度确定为Eda的保护浓度。见图1。
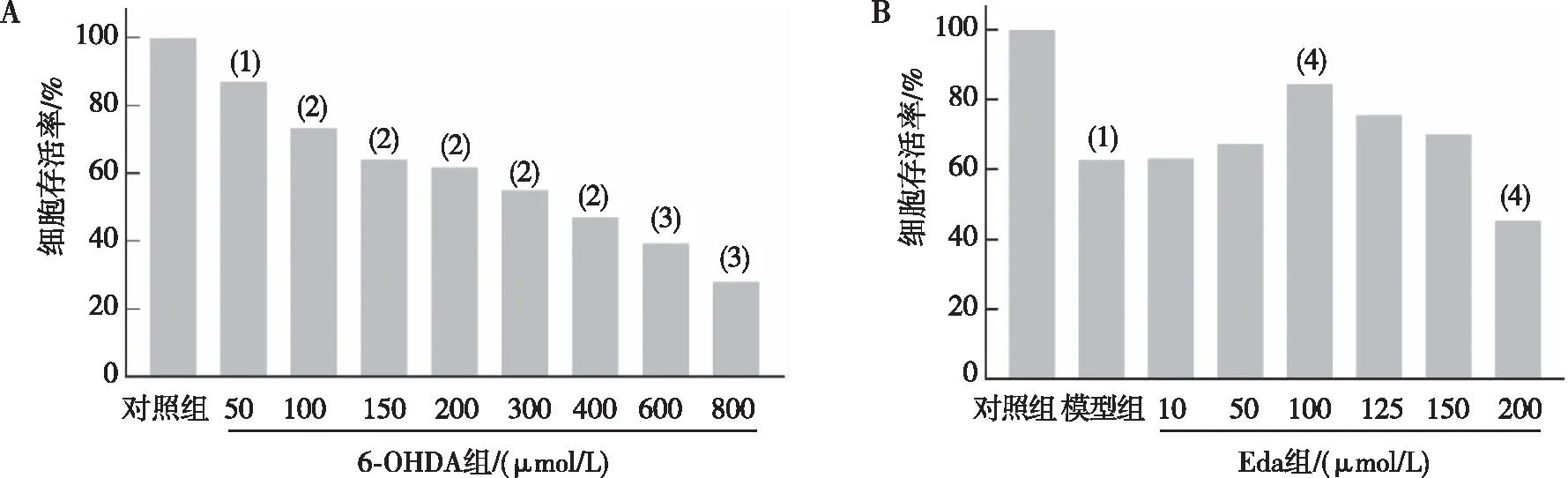
注:A、B分别为不同浓度6-OHDA和Eda处理后的细胞存活率;与对照组比较,(1)P<0.01,(2)P<0.000 1,(3)P<0.001;(4)与模型组比较,P<0.05。
2.2 线虫的 DA依赖行为学和DA能神经元形态
基础减缓行为检测实验结果显示(图2A),模型组BZ555线虫身体弯曲数相较于对照组明显减少(P<0.000 1),低、中、高浓度Eda组线虫身体弯曲数相较于模型组均有不同程度的增多(P<0.05或P<0.01);乙醇趋避实验结果显示(图2B),模型组BZ555线虫的乙醇PI明显低于对照组(P<0.000 1),低、中、高浓度Eda组线虫高于模型组(P<0.000 1)。荧光显微成像结果显示(图2C),与对照组相比,模型组BZ555线虫DA能神经元胞体出现不对称收缩、GFP减弱且突起处出现大量异常空泡,不同浓度Eda组线虫DA能神经元胞体异常收缩现象有减少的趋势、GFP表达恢复正常且异常空泡显著减少。
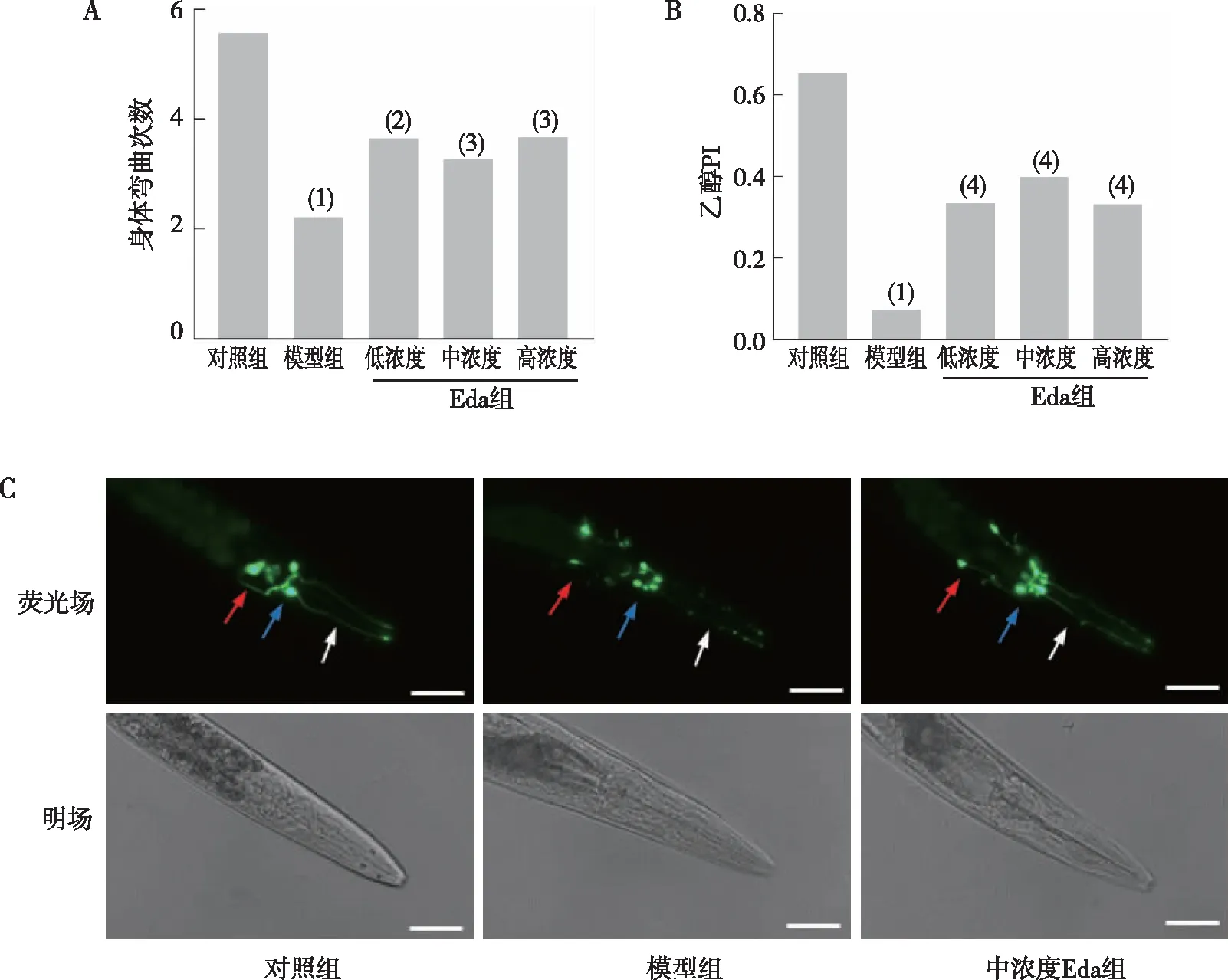
注:A为身体弯曲次数,B为乙醇PI,C为DA能神经元GFP表达 (200×) ;红、蓝及白色箭头分别表示咽部神经元(anterior deirids,ADEs)、头部神经元(cephalic sensilla,CEPs)及CEPs的细胞突起;(1)与对照组比较,P<0.000 1;与模型组比较,(2) P<0.01,(3) P<0.05,(4) P<0.000 1。
2.3 细胞和线虫的ROS水平
使用DCFH-DA探针检测PC12细胞和BZ555线虫体内的ROS,结果显示,与对照组比较,模型组PC12细胞和线虫体内ROS含量明显增加,差异有统计学意义(P<0.01或P<0.001);与模型组比较,Eda组细胞和中浓度Eda组线虫体内ROS含量减少,差异有统计学意义(P<0.05或P<0.01)。见图3。

注:A、B分别为细胞和线虫中ROS表达,C、D分别为细胞和线虫ROS定量结果;A、B中绿色萤光表示ROS含量;与对照组比较,(1) P<0.01,(3) P<0.001;与模型组比较,(2) P<0.05,(4) P<0.01。
2.4 细胞的MDA及SOD水平
使用试剂盒检测PC12细胞MDA,结果显示,模型组PC12细胞MDA含量较对照组明显增加(P<0.000 1),Eda组细胞MDA含量较于模型组明显减少(P<0.001);使用试剂盒检测细胞SOD活力,结果显示,模型组细胞SOD活力较对照组下降(P<0.01),Eda组细胞SOD活力较模型组升高(P<0.01)。见图4。

注:A、B分别为MDA相对含量和SOD活力;与对照组比较,(1) P<0.000 1,(3) P<0.01;与模型组比较,(2) P<0.001,(4) P<0.01。
2.5 细胞和线虫的α-syn蛋白表达
Western blot和细胞免疫荧光法结果表明(图5),模型组PC12细胞中α-syn蛋白表达较对照组明显升高(P<0.01或P<0.001),Eda组细胞内α-syn表达较模型组降低(P<0.05或P<0.01);Western blot和荧光显微成像法结果表明(图6),模型组线虫α-syn蛋白表达较于对照组升高(P<0.01),中浓度Eda组线虫体α-syn蛋白表达较模型组降低(P<0.05)。
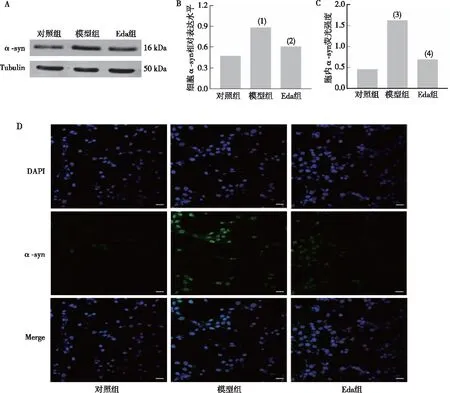
注:A、B为Western blot检测结果及相对表达定量结果,C、D为细胞免疫荧光法检测结果和平均荧光强度定量结果(蓝色荧光表示DAPI染色的细胞核,绿色荧光表示Alexa Fluor 488染色的α-syn);与对照组比较,(1)P<0.01,(3)P<0.001;与模型组比较,(2)P<0.05,(4)P<0.01。

注:A、B为Western blot检测结果及相对表达定量结果;C、D为荧光显微成像法检测结果和定量结果(绿色荧光表示线虫体壁的α-syn);(1)与对照组比较,P<0.01;(2)与模型组比较,P<0.05。
2.6 细胞和线虫的自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、p62、α-syn表达
Western blot实验结果表明(图7),与对照组相比,模型组PC12细胞中LC3-Ⅱ/LC3-Ⅰ比值降低、p62表达升高(P<0.01);与模型组比较,Eda组PC12细胞LC3-Ⅱ/LC3-Ⅰ比值升高、p62表达降低(P<0.05);与Eda组比较,Eda+3-MA组PC12细胞内LC3-Ⅱ/LC3-Ⅰ比值降低、α-syn表达升高(P<0.05)。Western blot实验结果表明(图8),模型组DA2123线虫自噬小体数量较对照组明显减少(P<0.001),中浓度Eda组DA2123线虫体内自噬小体较模型组增加(P<0.01),中浓度Eda+3-MA组DA2123线虫较中浓度Eda组减少(P<0.05);模型组NL5901线虫体内α-syn蛋白表达较对照组升高(P<0.001),中浓度Eda组NL5901线虫较模型组下降(P<0.01),中浓度Eda+3-MA组NL5901线虫较中浓度Eda 组增加(P<0.05)。
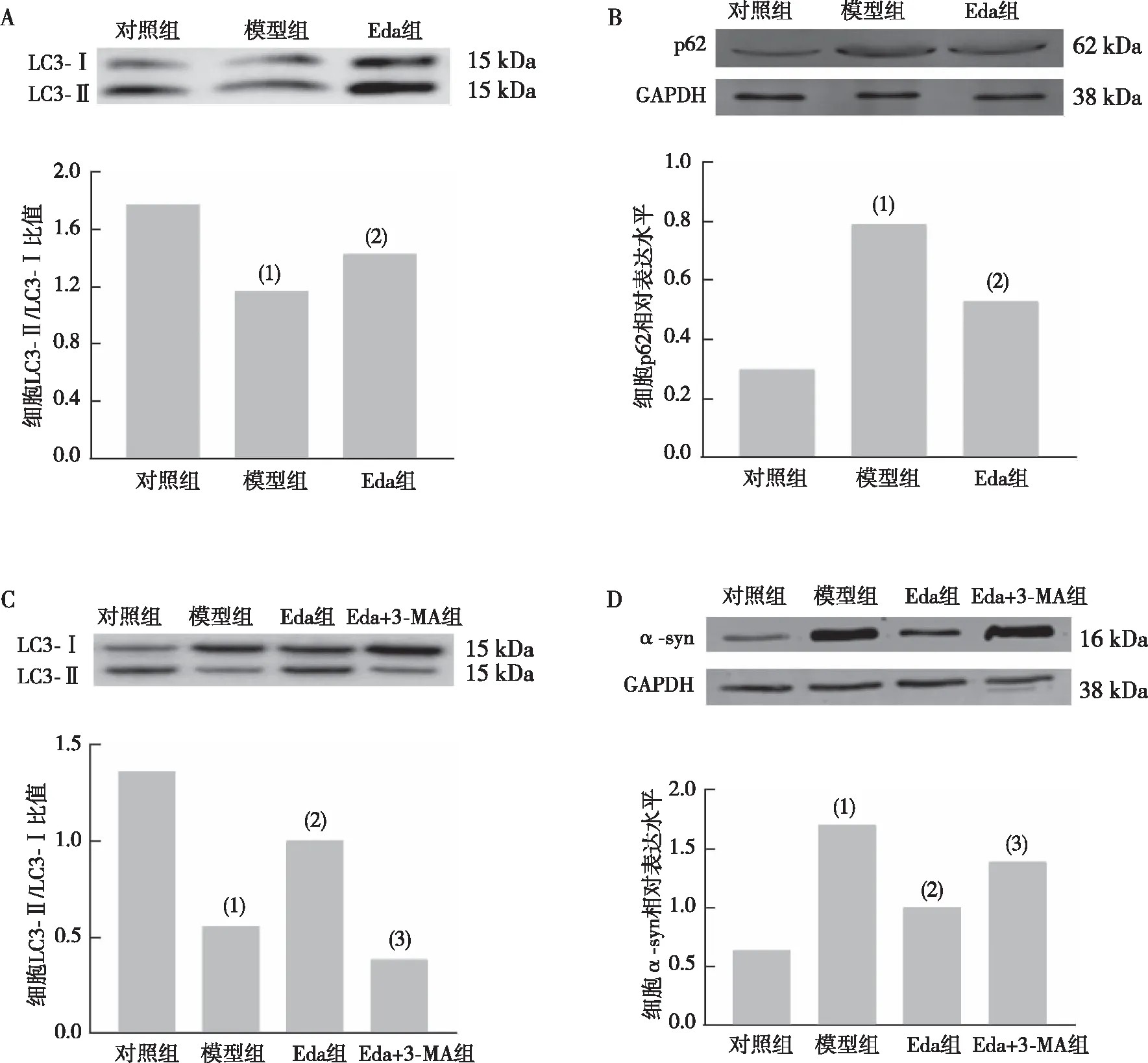
注:A为LC3的Western blot检测结果及相对表达定量结果,B为p62的Western blot检测结果及相对表达定量结果,C为使用自噬抑制剂后LC3-Ⅱ/LC3-Ⅰ的Western blot检测结果及相对表达定量结果,D为使用自噬抑制剂后α-syn的Western blot检测结果及相对表达定量结果;(1)与对照组比较,P<0.01;(2)与模型组比较,P<0.05;(3)与Eda组比较,P<0.05。

注:A为DA2123虫株中自噬小体的荧光显微成像(绿色荧光代表DA2123线虫体内的自噬小体,白色方框表示自噬小体聚集典型区域),B为NL5901虫株中α-syn蛋白的荧光显微成像(100×,绿色荧光表示NL5901线虫体壁的α-syn,白色方框表示α-syn蛋白聚集典型区域),C、D分别为DA2123虫株中自噬小体和NL5901虫株中α-syn蛋白的平均荧光强度; (1)与对照组比较,P<0.001; (2)与模型组比较,P<0.01;(3)与Eda组比较,P<0.05。
3 讨论
PD是一种以黑质DA能神经元选择性死亡和变性为特征的神经退行性疾病[12]。DA能神经元的丢失导致运动症状的出现,如运动迟缓、静止性震颤、僵硬和姿势不稳定,以及非运动症状,如睡眠障碍、抑郁及认知缺陷等[13]。PD现有治疗主要以药物DA替代治疗为主,虽然有治疗效果,但不能很好地延缓病程,且随着疾病的进展,药物疗效减弱,故寻求一种有效的、针对病因的治疗非常重要[14]。
除了OS,α-syn也受到自噬的调节。自噬是真核细胞清除蛋白质等物质的主要通路[25],PD中α-syn的寡聚体和多聚体形式主要是通过自噬途径进行降解[26]。在自噬缺失的小鼠体内,发生了DA能神经元死亡,在存活的神经元中出现了LB和α-syn内源性聚集[27],提示阻断自噬通路会加剧α-syn异常聚集,从而产生细胞毒性;当使用自噬增强剂时,由α-syn介导的大鼠运动不对称行为和黑质中DA能神经元退行性变等现象明显减轻[28],提示上调自噬水平可以降解α-syn,从而达到治疗PD的作用。因此,对自噬的调节是降解α-syn聚集的关键靶标。
本研究选择的造模药物6-OHDA是PD相关神经递质DA的羟基化类似物,可以被DA转运体摄取进入细胞内,迅速引发非酶促氧化反应,抑制膜转运蛋白功能,导致大量氧化物质与神经递质蓄积,进而抑制线粒体呼吸复合物Ⅰ的相关功能[29],造成细胞发生OS,最终导致DA能神经元坏死、缺失,使机体神经系统出现退行性现象[30]。因此,6-OHDA常用于制作氧化损伤的PD模型。线虫作为小型模式生物,具有繁殖周期短、易于饲养观察、遗传背景清晰且易于实验操作等优点[31]。通过对线虫基因组的分析,发现其离子通道和神经递质合成酶、受体以及转运体与哺乳动物结构功能相似,同时60%~80% 基因与人类同源,已成为研究神经退行性疾病机制的理想模型[32]。其中通过在不同细胞人为导入突触核蛋白α(synuclein alpha,SNCA)基因使线虫体内过表达α-syn,以及采用6-OHDA等毒性药物造成线虫发生OS或运动功能障碍,以构建PD线虫模型进而给药干预,是利用线虫进行PD治疗研究常用的手段。
Eda是目前常用的氧自由基清除剂和抗氧化剂,能够抑制细胞膜性结构的脂质过氧化反应,以及氧自由基介导的蛋白质和核酸损伤,减轻细胞毒性作用[33]。Bandookwala 等[34]研究显示,Eda可单独使用或与其他抗氧化剂联用达到减轻OS水平的作用,从而对PD相关的体外模型产生明显的保护作用。另外,有临床证据表明,Eda能够减轻血管源性PD患者的病情严重程度,并改善患者的预后[35]。这些证据都提示,Eda对于PD的基础研究与临床治疗具有一定的潜力。
综上所述,Eda不仅能作为抗氧化剂减缓氧化应激损伤,同时能通过激活自噬通路降解异常聚集的α-syn发挥神经保护作用,但更深入的机制还需要进一步研究和证实。
