二氧化钛用于硅负极材料表面包覆改性的研究
2023-11-17王仕伟孟伟巍
王仕伟,郑 浩,孟伟巍
(攀钢集团研究院有限公司钒技术研究所,钒钛资源综合利用国家重点实验室,四川 攀枝花 617000)
0 引言
近年来,混合动力电动汽车和便携式电子设备等众多技术应用领域对寿命更长、能量密度更高的锂离子电池(LIB)的需求不断增长。因此,开发具有高容量的负极材料以取代仅具有372 mAh/g 理论容量的传统石墨材料正变得越发迫切[1]。在众多材料中,硅基负极材料理论比容量可达3 572 mAh/g(以Li15Si4的形式),远高于石墨负极材料的理论容量,已被视为最有前途的候选材料之一[2]。但硅的实际应用也面临着严重挑战。首先是硅的本征电导率低,这限制了高电流密度下Li+的传输[3]。另一个更为严重的问题是硅在嵌锂过程中会出现极大的体积膨胀(膨胀率≈400%),这导致了许多严重后果,如结构粉碎、不稳定的固体电解质界面(SEI)膜的连续产生以及循环稳定性差,使得硅负极材料的容量急剧下滑[4]。
针对上述问题,研究人员主要采取包覆策略来努力解决。在诸多材料中,二氧化钛(TiO2)因其较好的机械强度(大约是无定型碳的5 倍),脱嵌锂时可忽略不计的体积膨胀率(<4%),以及可以在其表面上形成稳定的SEI 膜等优点在锂离子电池硅负极材料的改性方面具有巨大潜力[5]。例如,Wang Kai等[6]用纳米硅作硅源、原硅酸四乙酯为二氧化硅源、钛酸四丁酯为钛源(TBOT)、盐酸多巴胺为碳源,通过溶胶凝胶法并经热处理得到C@TiO2@SiO2@Si材料,再经HF 刻蚀合成中空结构的C@TiO2@Si(CTS)纳米复合材料,该复合材料在100 mA/g 电流密度下循环50 次后的容量为747 mAh/g。Lu Bing等[7]以钛酸四丁酯为钛源合成了机械坚固的二氧化钛(TiO2)壳和均匀碳层修饰的中空Si 纳米球,中空Si@TiO2@C 纳米球表现出优异的电化学性能,其初始放电容量为2 557.1 mAh/g,库仑效率为86.06%,在1 A/g 条件下进行250 次循环后的大回收放电容量为1 270.3 mAh/g,平均库仑效率为99.53%。Jiao Xiangwei 等[8]以正硅酸乙酯为硅源,通过镁热还原得到空心Si 纳米球(HN-Si),再以钛酸异丙酯为钛源,利用溶胶-凝胶法制备了HN-Si@TiO2,复合材料在1 A/g 的电流密度下100 次循环后放电容量为1 196.3 mAh/g。然而,目前关于二氧化钛包覆硅负极材料以改善硅材料性能的研究主要集中在使用钛酸四丁酯、钛酸异丙酯等有机钛源,在无机钛源,如TiCl4方面的研究报道较少。因此,笔者以攀钢氯化法钛白工艺中间产物精制四氯化钛TiCl4作为钛源,采用水解法合成具有坚固二氧化钛外壳的Si@TiO2纳米复合材料,研究结果表明,采用TiCl4为钛源,能够制得二氧化钛均匀包覆的Si@TiO2纳米复合材料,其充放电性能相比原始纳米硅明显得到提高。
1 试验部分
1.1 材料的制备
取0.45 g 100 nm 高纯硅粉(纯度99.99%,鑫铁金属材料有限公司)置于烧杯中,倒入50 mL 无水乙醇,超声20 min,加入20 mL 去离子水,再滴入1.0 mL 氨水(25%~28%),磁力搅拌30 min,得到悬浊液A。用胶头滴管取0.25 mL 四氯化钛(攀钢氯化法钛白工艺中间产物精制四氯化钛,纯度≥99.99%)逐滴加入到10 mL 0 ℃的去离子水中配成四氯化钛水溶液,再次进行30 min 的磁力搅拌。在50 ℃水浴加搅拌条件下,用胶头滴管将上述四氯化钛水溶液缓慢滴加到混合液A 中,继续搅拌至溶液蒸干。取蒸干后的物料放入管式气氛炉,在氩气气氛、500 ℃条件下对物料进行热处理,时间30 min,随炉冷却至室温,然后取出磨细,即为Si@TiO2纳米复合材料。
1.2 材料的表征
采用X 射线衍射仪(XRD)(Co 靶,电压35 kV,电流50 mA)、透射电子显微镜(TEM)和扫描电子显微镜(SEM)对样品的物相及微观结构进行分析和表征。
1.3 材料的电化学性能测试
分别称取活性材料、乙炔黑和海藻酸钠,质量比为7∶2∶1,加入适量去离子水混合均匀后涂布在Cu 箔上,将获得的电极放入真空烘箱中干燥12 h,温度设定为80 ℃,冲压成Ø12 mm 的电极片备用。使用锂箔、PP 隔膜和电解质(1.0 M LiPF6溶液,溶剂体积比为EC(碳酸乙烯酯)∶DMC(碳酸二甲酯)∶EMC(碳酸甲乙酯)=1∶1∶1,在填充有Ar(O2,H2O<0.000 01%)的手套箱中组装纽扣电池(CR2016)。电池组装后静置8 h 以上。使用普林斯顿电化学工作站(VersaSTAT3)对电池进行循环伏安测试,采用两电极体系,测试电位为0.01~2.50 V,扫描速率设定为0.5 mV/s。采用蓝电测试仪(CT2001A)进行电极材料储锂性能测试,测试电位为0.01~2.50 V。
2 结果与讨论
2.1 XRD 分析
图1 为未经处理的纳米硅和Si@TiO2纳米复合材料的XRD 谱。从图1 可以看出,Si@TiO2纳米复合材料在33.1°、55.5°、66.2°、91.8°和107.6°处有明显的衍射峰,与晶体硅(JCPDS :03-065-1060)的特征峰相一致,表明复合材料中硅的晶体结构是稳定的。此外,还可以观察到锐钛型二氧化钛的衍射峰(29.5°),衍射峰较宽,且强度较低,说明复合材料中二氧化钛的结晶性不好。

图1 Si 和Si@TiO2 纳米复合材料的XRD 谱Fig.1 XRD diffraction patterns of Si and Si@TiO2 nanocomposites
2.2 SEM 和TEM 分析
图2(a)、(b)为未经处理的纳米硅和Si@TiO2纳米复合材料的形貌。如图2(a)所示,Si 颗粒易于团聚,颗粒大体呈球形,它的表面较为光滑,粒径分布在 100 nm 左右;从图2(b)可以观察到,Si@TiO2纳米复合材料表面比较粗糙,颗粒形状为近球形,颗粒粒径在110~120 nm。图2(c)、(d)为纳米硅和Si@TiO2纳米复合材料的TEM 形貌。从图2(d)可以看出复合材料样品内部为晶体Si 纳米颗粒,表面包覆着一层无定型的TiO2壳,二氧化钛壳层厚度为10~20 nm,增加了硅颗粒的尺寸。二氧化钛具有较高的机械强度,它作包覆层能在一定程度上抑制硅核在锂化过程中的膨胀。此外无定形TiO2外壳还能起到保护层的作用,避免硅颗粒和电解液直接接触,确保复合材料的结构稳定性。该复合材料应当具有不错的电化学性能。

图2 (a) Si 的SEM 形貌;(b) Si@TiO2 的SEM 形貌;(c)Si 的TEM 形貌;(d) Si@TiO2 的TEM 形貌Fig.2 (a) SEM image of Si;(b) SEM image of Si@TiO2;(c) TEM image of Si;(d) TEM image of Si@TiO2
图3 为Si@TiO2复合材料的的元素分布。从图3 可以直接观察到,样品中存在Si、Ti、O 三种元素,其分布状况进一步印证了包覆结构。
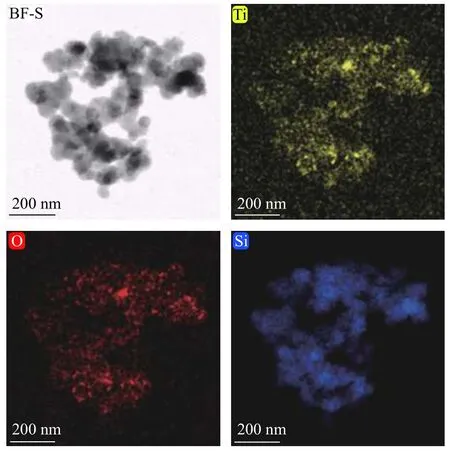
图3 Si@TiO2 纳米复合材料的元素分布Fig.3 EDS analysis of Si@TiO2 nanocomposites
2.3 Si@TiO2 复合纳米材料的电化学性能研究
图4(a)为Si@TiO2的循环伏安曲线,电压测试范围为0.01~2.5 V,扫描速率设定为0.5 mV/s。如图4 所示,在首次阴极扫描过程中,在1.2 V 左右处处出现了较宽的还原峰,这可能是有机电解质发生分解以及在活性材料表面上形成SEI 层造成的[9]。峰值在后续的循环中消失,这意味着形成了稳定的SEI 层[10]。随着循环的继续,在约0.19 V 处出现一个还原峰,归因于晶态Si 锂化形成LixSi 合金[11]。由于LixSi 脱锂形成非晶Si,在约0.38 V 处观察到不明显的氧化峰,在0.59 V 处观察到强烈的氧化峰[8],且电流峰值不断增大,表明Si 电极不断被激活,直到电流峰值不再增加,Si 电极完成活化。值得注意的是,每个峰的位置几乎保持不变,这意味着硅和锂离子之间的反应是高度可逆的。此外,还可以从图中观察到锐钛矿TiO2的氧化还原峰。在第一个循环中,1.66 V 的还原峰和2.13 V 的氧化峰分别对应于锐钛矿TiO2中的Li+的嵌入和脱出。在后续循环中还原峰移动到1.72 V,氧化峰基本保持不变。一般认为在Li+嵌入过程中TiO2从四方锐钛矿到正交Li0.5TiO2结构的双相转变是还原峰移动的原因[12]。这种现象是锐钛矿型TiO2的典型特征[13]。

图4 Si 和Si@TiO2 纳米复合材料的电化学性能Fig.4 Electrochemical properties of Si and Si@TiO2 nanocomposites
图4 (b)为 Si@TiO2在电流密度200 mA/g、电压0.01~2.5 V(vs Li+/Li)条件下的前三次充放电曲线。纳米复合材料在0.15 V 下显示出一个长的平坦平台,代表了硅锂化的典型特征。在后续的循环过程中,锂化平台从0.1 V 移动到0.3 V,这与晶体硅向非晶硅的转化有关[8]。在充电过程中,0.55 V下出现的脱锂平台表示LixSi 向非晶硅的转变。
图4(c)为Si 和Si@TiO2的倍率性能曲线。以200、400、800、1 600、2000 mA/g 的电流密度下测试Si@TiO2的倍率性能,其对应放电比容量分别为1 810.7、1 550、1 135.7、614.3、1 457.1 mAh/g。与之相比,未经处理的Si 的放电比容量分别为3 140.8、1 843.3、288.3、3.3 和1 385 mAh/g。显然,Si@TiO2纳米复合材料的倍率性能和结构稳定性远胜于未经处理的Si。这归因于TiO2涂层改善了硅材料的电子传导性和结构稳定性。图4(d)为Si 和Si@TiO2纳米复合材料在500 mA/g 电流密度下的循环性能曲线。从图4 可以看出,在最初的几个循环里,Si和Si@TiO2纳米复合材料的比容量都发生了明显的衰减,这是由于SEI 膜的生长和电极材料的不可逆反应造成的[7]。Si@TiO2在500 mA/g 电流密度下的首次放电比容量为1 691.4 mAh/g,循环100 次后仍有877 mAh/g 的放电比容量,容量保持率为51.8%。与之相比,未经处理的Si 在500 mA/g 电流密度下循环100 次后放电比容量为4 mAh/g。从上述结果可以看出,二氧化钛的包覆会降低硅负极材料的首次放电容量,但TiO2包覆层能通过提供机械支撑和形成稳定的SEI 膜,起到稳定电极的作用,避免硅负极材料结构发生变化,从而提高复合材料的循环稳定性。
为了进一步评估采用无机钛源制备的Si@TiO2复合材料的储锂性能,选择了部分文献报道的采用有机钛源制备的硅基复合材料作比较,如表1 所示。从表1 可以看出,Si@TiO2表现出良好的储锂性能。与本文以水作TiCl4的反应溶剂相比,有机钛源一般采用乙醇等有机溶剂作为反应溶剂,反应过程要更为复杂,制备难度更大,且成本更高。因此,研究利用TiCl4这类无机钛源来制备硅基复合材料具有重要意义。
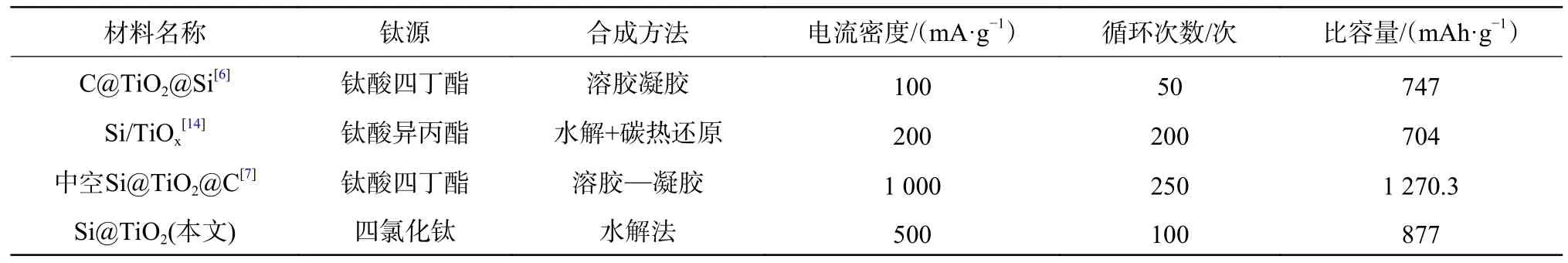
表1 不同钛源制备的硅基复合材料储锂性能比较Table 1 Comparison of lithium storage performance of composite materials prepared from different titanium sources
3 结论
以攀钢氯化法钛白工艺中间产物精制四氯化钛TiCl4作为无机钛源,采用水解法成功合成了具有二氧化钛包覆层的Si@TiO2纳米复合材料。合成的Si@TiO2材料在1 600 mAh/g 的大电流密度下的放电比容量为614.3 mAh/g。电流密度500 mA/g,循环100 次后仍有877 mAh/g 的放电比容量,容量保持率为51.8%,这说明TiO2外壳凭借其较好的机械性能在充放电过程中极大地缓解了硅的体积膨胀,同时也改善了材料的电子传导性,使得 Si@TiO2具有较为优异的电化学性能。Si@TiO2纳米复合材料采用TiCl4作为无机钛源,相比钛酸四丁酯等有机钛源,TiCl4原料价格更为低廉,且水解法工艺也较为简单,易于工业化大规模生产。
