活体生物发光肺癌骨转移模型构建及其生物学特性
2023-11-16刘雁萍王仲怡张小兰顾力行周经姣
田 禹, 杨 文, 杨 程, 刘雁萍, 王仲怡,张小兰, 顾力行, 周 俊, 周经姣
(武汉科技大学生命科学与健康学院,武汉 430065)
据WHO国际癌症研究机构(IARC)发布的全球最新癌症数据显示,2020年全球肺癌发病人数220.6万例,占全部癌症新增病例的11.4%;死亡人数高达179.6万例,占比18.0%[1-2].由于具有“高复发”和“易转移”的特点,中国肺癌患者五年生存率仅为19.8%.在进行手术切除后,40%诊断为早期的患者以及超过50%诊断为中晚期的患者在术后五年内经历了复发和转移[3].
肺癌尤其是小细胞肺癌 (small cell lung cancer,SCLC)和分化差的非小细胞肺癌 (non-small cell lung cancer,NSCLC),是常见的发生骨转移的恶性肿瘤之一.肺癌骨转移好发部位在胸部、脊柱、骨盆、肢体、颅骨等,转移前期症状不明显,但发展迅速[4].骨转移过程中发生溶骨性骨质破坏,会引发剧烈疼痛.重度疼痛是肺癌骨转移后常见的临床表现,可加重患者病情,降低生活质量,晚期肺癌骨转移疼痛控制问题一直是恶性肿瘤防治的难点[5].
肺癌的骨转移机制尚不明确,相关的动物模型建立困难、敏感性低.生物发光活体成像可以多时间点、动态监测到体积为0.5 mm3的微小肿瘤转移灶[6].结合生物发光活体成像技术建立肺癌骨转移动物模型是研究肺癌骨转移的重要工具,有助于深入研究肺癌骨转移的发生机制以及探索高效的治疗药物和预后评价策略.
本研究应用Luciferase和GFP双标记肺腺上皮癌细胞A549,在BALB/c nu/nu小鼠体内建立肺癌骨转移模型.应用小鼠成像技术、组织切片和HE染色等分析显示,该小鼠肺癌骨转移模型的生物学特性,与人体肺癌骨转移具有高度相似性.成功构建的肺癌骨转移模型有利于癌症骨转移的分子病理机制研究,特别是癌细胞在骨中停滞、存活、增殖以及癌症骨病的相关研究,可用于筛选和评价高效的癌症治疗药物.
1 材料和方法
1.1 材料
1.1.1 菌株和细胞株 293T细胞和A549细胞购买自中国科学院上海细胞库,由本实验室保存及培养.DH-5a感受态细胞购自Tiangen公司.
1.1.2 主要试剂 胰酶消化液 (Biosharp, BL501A)、RPMI-1640培养基(Sigma, R8758)、DMEM高糖培养基 (Procell, PM150210)、嘌呤霉素(Aladdin, P113126),PEI 40K(Yeasen, 40816ES02),Polybrene (Solarbio, H8761),异氟烷(RWD, R510-22-10),D-Luciferin potassium(Ark, L120798),Trizol(Absin, abs9331)、Reverse transcription Kit (Abclonal, RK20403)、Quantity PCR mix (Abclonal, RK21203).
1.1.3 主要仪器 恒温摇床(上海一恒),CO2培养箱(Biobase), 高速离心机(Beckman),Nanodrop (Thermo Scientific),倒置荧光显微镜(Olympus),Spectral instruments imaging(LLC),VonFrey纤维丝测痛仪(Stoelting),荧光定量PCR仪(Bio-Rad).
1.1.4 实验动物 6 w龄左右BALB/c nu/nu小鼠购自江苏集萃药康生物科技公司,每组16只饲养于武汉科技大学SPF级动物房,饲养条件:温度18~22 ℃,湿度50%~60%,12 h昼夜更替.所有动物相关操作均按照武汉科技大学实验动物伦理委员会的规定执行(实验动物伦理批准号#202047).
1.2 方法
1.2.1 A549-Luc-GFP-Puro稳转细胞系的构建 胰酶消化293T细胞传入10 cm培养皿中.第2天细胞在培养皿中密度达到70%~80%时,采用脂质体PEI 40K转染法将VSV-G质粒、Gag/pol/rev慢病毒包装质粒和Luc-GFP-Puro质粒15 μg共转染293T 细胞.转染48~72 h后,将含有病毒液的培养基转移到15 mL离心管中,4 ℃,4 000 r·min-1,离心30 min去除细胞碎片,收集病毒上清.将病毒上清用0.22 μm滤器过滤至高速离心管中,4 ℃,30 000×g,离心2.5 h浓缩获得Luc-GFP-Puro慢病毒.
A549细胞接种于6孔板,37 ℃培养过夜.第2天细胞融合度为70%~80%时感染Luc-GFP-Puro慢病毒.病毒感染48 h后,荧光倒置显微镜下可见部分A549细胞表达绿色荧光蛋白GFP.病毒感染后48~72 h开始puromycin筛选,向新鲜培养基中添加puromycin,终浓度为2 μg·mL-1.药筛会杀死没有感染Luc-GFP-Puro慢病毒的A549细胞,2~3天换液一次,并添加相应浓度的puromycin.药筛持续1周左右,筛选出稳定表达Luciferase和GFP的双标A549细胞(A549-Luc-GFP-Puro细胞).
1.2.2 肺癌骨转移小鼠模型的构建 在A549-Luc-GFP-Puro细胞融合度在80%~90%时消化细胞,将细胞吹打成均匀的细胞悬液,立即转移到15 mL离心管,300×g离心5 min.弃上清液加入1 mL预冷的PBS重悬细胞,血球计数板进行计数.稀释A549-Luc-GFP-Puro细胞至每毫升1×107个.
选择6~8 w龄的雌性 BALB/c nu/nu小鼠,实验前将小鼠进行麻醉,麻醉维持时间约为30~35 min.小鼠进入麻醉状态之后,擦拭消毒并用食指和拇指轻轻地抓住外踝、内踝和胫骨下半部分,然后曲腿90°.用70%的酒精湿润皮肤,增加胫骨韧带下方的可见度,胫骨韧带可见一条明显的、粗的白线.在抓紧小鼠腿的同时,将针插入胫骨下方,穿过韧带中部,进入胫骨顶部髁间前区.将A549-Luc-GFP-Puro细胞80 μL接种于 BALB/Cnu/nu小鼠的左后肢胫骨.对照组注射PBS 80 μL.
1.2.3 肺癌骨转移小鼠模型的生物发光成像和X-ray成像 小鼠腹腔注射D-luciferin底物,小鼠吸入异氟烷进行麻醉.将麻醉后的小鼠放入spectral instruments imaging成像仪,进行活体生物成像.每间隔7天对小鼠进行成像,对肿瘤细胞在小鼠胫骨内的生长以及对胫骨的破坏情况进行监测.同时进行X-ray拍照,观测小鼠骨关节滑膜、软骨、骨赘大小以及生长板厚度.
1.2.4 肺癌骨转移引起骨疼痛的分析与评价 在A549-Luc-GFP-Puro细胞植入小鼠胫骨腔后第0、7、10、14、17、21、24、28天,测试小鼠骨持续疼痛(自发的防护和退缩)和机械性触诱发痛(触诊引起的防护和触诊引起的畏缩):将小鼠放在具有金属丝网地板的透明塑料观察箱中,先使其适应10 min.1)在2 min的观察期内,记录自发退缩的次数和防护的时间(代表伤害感受行为);2)用Von Frey纤维丝测痛仪垂直刺激小鼠左后肢的足底中部,使之稍成S形,持续时间不超过4 s,出现抬足或舔足行为视为阳性反应,否则为阴性反应.刺激力度从1.3 g开始,当该力度的刺激不能引起阳性反应时,则给予相邻大一级力度的刺激,如出现阳性反应时,则给予相邻小一级力度的刺激,如此连续进行,每次间隔15 s.然后应用Chaplan等[7]报道的方法计算出50%缩足阈值.
1.2.5 骨关节组织切片和病理学分析 A549-Luc-GFP-Puro细胞植入后第28天取膝关节和胫骨组织固定48 h,脱钙处理、更换脱钙液数次,再脱水、透明、浸蜡包埋.骨组织切片、脱蜡、复水,Harris苏木精染色10 min;盐酸酒精分化、水洗待核变蓝后1%伊红染色3~5 min;各级酒精脱水、二甲苯透明、树胶封固,显微镜下观察膝关节和胫骨的形态、癌组织的分布及浸润情况等.
1.2.6 荧光定量RT-PCR检测骨肿瘤转移相关基因表达 从胫骨腔取出肿瘤组织,用剪刀剪碎至1 mm3小块,每个样品加入1 mL Trizol溶液.组织研磨后离心收集上清,提取RNA,用Reverse transcription Kit逆转录出cDNA.荧光定量PCR检测骨肿瘤转移相关基因Mta1、Mta2、Mta3、Lasp1 等的表达情况.β-actin作为内参, 计算2-ΔΔCt比较基因表达差异.
1.2.7 统计学分析 数据经Excel 2020、GraphPad Prism 8.0、 Aura Idl进行录入与统计分析,数据采用均数±标准差表示.采用方差分析,p≤0.05表明具有统计学差异.
2 实验结果
2.1 成功构建Luc-GFP-Puro阳性的稳转A549细胞系
VSV-G、Gag/pol/rev和Luc-GFP-Puro质粒用PEI转染293T细胞包装慢病毒,病毒上清超速离心浓缩,得到高浓度Luc-GFP-Puro病毒(5×107pfu·mL-1).用Luc-GFP-Puro病毒感染A549细胞后48 h,加入2 μg·mL-1puromycin 进行筛选,筛选一周后获得阳性稳转A549-Luc-GFP-Puro细胞(图1).在荧光倒置显微镜450~490 nm蓝光激发下,检测到90%以上的A549细胞高表达GFP蛋白发绿色荧光(图2).结果显示带有Luc-GFP-Puro的双标记的稳转A549细胞系构建成功.

图1 Luc-GFP-Puro慢病毒包装和Luc-GFP-Puro双标记A549细胞筛选示意图Fig.1 Modeling of Luc-GFP-Puro lentivirus package and screening of A549-Luc-GFP-Puro cells
2.2 肺癌骨转移模型生物发光成像
在小鼠胫骨注射A549-Luc-GFP-Puro细胞的过程中,确保注射器针头垂直于胫骨平台进针,使用平稳的力量旋转进针,避免过度用力引起小鼠骨组织的损伤(图3).A549-Luc-GFP-Puro细胞接种小鼠胫骨后,每周对小鼠体内肿瘤的生长情况进行生物发光成像.首先小鼠腹腔注射D-luciferin(浓度15 mg·mL-1),随后对小鼠进行麻醉,将麻醉后的小鼠放入小动物成像仪进行成像.在A549-Luc-GFP-Puro细胞接种第7天,检测到小鼠膝关节和胫骨有明显的生物发光信号,而对侧腿则呈现阴性.随着时间的推移,第14、21、28天生物发光信号逐渐增强,显示肿瘤细胞在小鼠的胫骨腔存活并且稳定地增殖(图4a~4d).随荧光信号逐渐增强,小鼠开始表现出消瘦,体重下降、肤色变暗,出现晚期癌症患者的恶液质现象.
图3 A549-Luc-GFP-Puro细胞接种方式和位置(箭头所示)Fig.3 Injection of A549-Luc-GFP-Puro cells into tibia

图4 A549-Luc-GFP-Puro细胞接种小鼠第7、14、21、28天(a~d)活体生物发光成像Fig.4 In vivo bioluminescence imaging at day 7, 14, 21, 28 (a-d) post A549-Luc-GFP-Puro injection
2.3 肺癌骨转移模型X-ray成像分析
左侧胫骨为肿瘤细胞接种侧,右侧为健康侧.X-ray成像显示,在接种肿瘤细胞第14天,接种侧胫骨隐约可见骨质密度下降;接种第21天,接种侧胫骨骨质明显不均一,且骨边界模糊不清,胫骨骨质破坏严重,骨密度明显降低,骨膜边界不清,呈弥散状,部分骨骼组织消失.在整个实验过程中,小鼠健康侧的膝关节和胫骨骨质均无明显变化(图5a~5d).

图5 A549-Luc-GFP-Puro细胞接种小鼠第7、14、21、28天(a~d)的X-ray成像 Fig. 5 X-ray imaging at day 7, 14, 21, 28 (a-d) post A549-Luc-GFP-Puro injection
2.4 肺癌骨转移小鼠持续性疼痛和触觉疼痛的评价
在2 min的观察期内,记录小鼠自发退缩和防护的时间.PBS对照组在术后7天有抬足行为,但10天左右基本消失.A549-Luc-GFP-Puro细胞接种组,在第10天左右自发抬足行为明显,且抬足时间在观察期内逐渐延长,在14、17、21、24、28天分别为8.7±2.7 s, 15.0±2.8 s, 18.7±5.0 s, 27.3±3.5 s, 38.3±4.3 s.与PBS对照组比较,差异有统计学意义(p<0.01)(图6a).
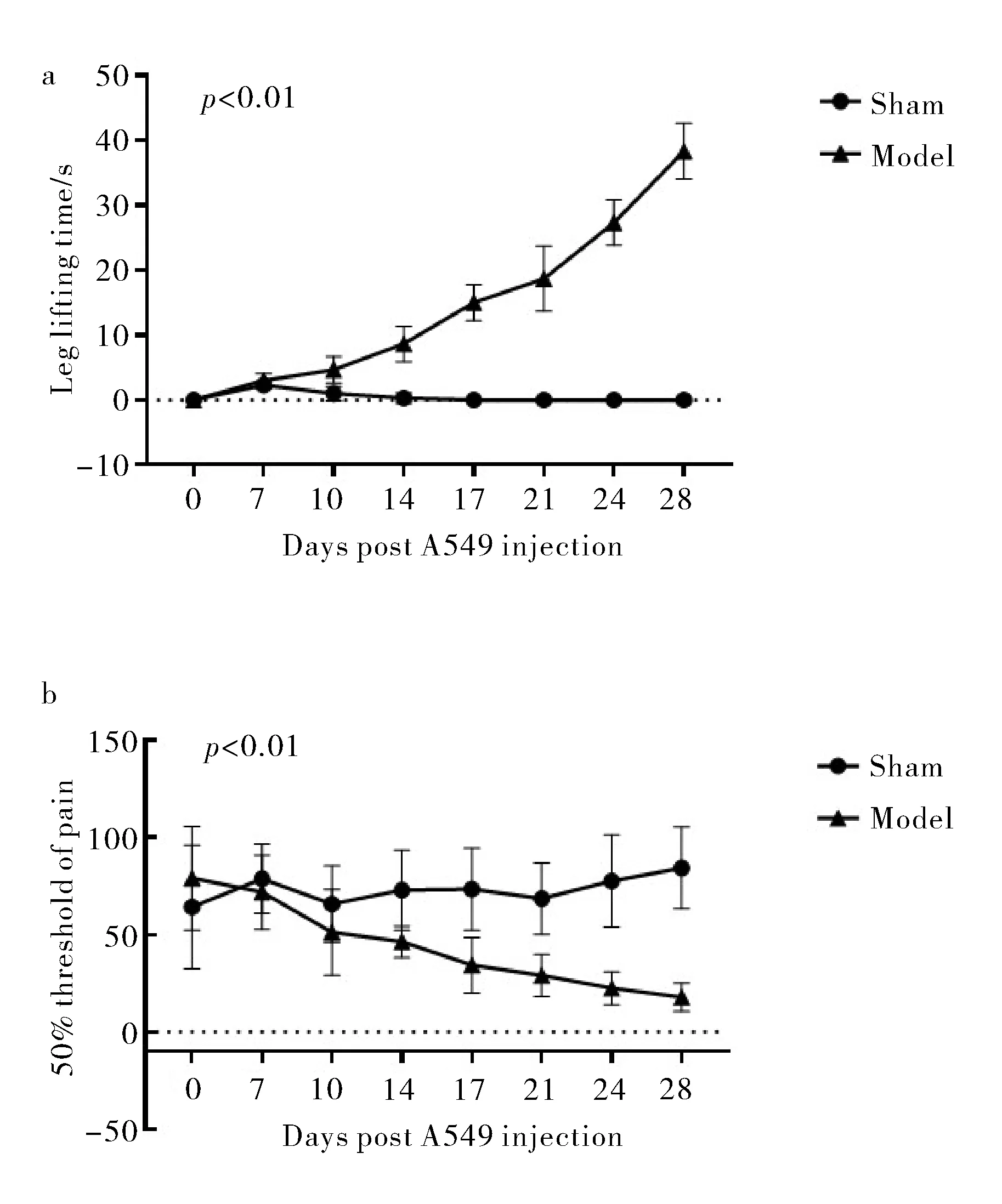
a. 小鼠抬足时间分析; b. 50%疼痛阈值分析图6 肺癌骨转移小鼠疼痛分析Fig.6 Evaluation and analysis of bone pain in mice with bone metastasis of lung cancer
PBS对照组无明显触诱发痛表现,观察期间各时间点的50%缩足阈值趋于稳定.A549-Luc-GFP-Puro细胞接种组在第10天左右出现明显触诱发痛,在观察期间接种组左后腿50%缩足阈值明显逐渐下降.与PBS对照组小鼠比较,A549-Luc-GFP-Puro细胞接种组左后腿50%疼痛阈值具有显著性差异(p<0.01)(图6b).
2.5 肺癌骨转移模型病理学分析
在A549-Luc-GFP-Puro细胞接种的第21天,观测到骨肿瘤已经开始影响小鼠的行走,注射肿瘤细胞的左后肢在小鼠行动时出现拖拽的现象.在细胞接种第28天,对小鼠进行解剖,将膝关节和胫骨截取进行组织切片进行病理学分析.图7右侧图片为没有接种肿瘤细胞的健康膝关节和胫骨,图7左侧为接种肿瘤组的膝关节和胫骨.可以观察到左侧肿瘤组骨髓腔内肿瘤细胞生长活跃,骨髓腔内及骨小梁间被大量肿瘤细胞填充,骨髓腔和骨质结构破坏严重.健康胫骨骨髓腔内见各种正常的骨髓细胞,骨结构无异常改变.

a. 对照组:椭圆标示处显示骨髓腔结构完整,骨小梁数量较多,骨质密集;b. 肿瘤组:椭圆标示处显示骨质结构被破坏严重,骨髓腔边缘骨小梁结构较少,骨质疏松,腔内骨质流失图7 小鼠膝关节和胫骨组织切片HE染色结果(标尺: 100 μm) Fig.7 HE staining of mouse knee and tibia cavity (scale bar: 100 μm)
2.6 检测骨肿瘤组织中转移相关基因的表达情况
取出胫骨肿瘤组织,提取RNA逆转录出cDNA,荧光定量PCR检测肿瘤转移相关基因Mta1、Mta2、Mta3、Lasp1等.从图8可以看出,Mta2、Lasf1基因表达有增高趋势,但与对照组比较没有统计学差异(p>0.05).Mta3基因特别是Mta1增高显著,差异具有统计学意义(p<0.05).

注:*表示p<0.05,NS表示无统计学差异.图8 骨肿瘤组织中转移相关基因的表达分析 Fig.8 Analysis of the expression of metastasis related genes in bone tumor tissues
3 讨论
肺癌潜在骨转移机制尚不明确,开发肺癌骨转移动物模型是研究其转移机制和开发抗肿瘤药物的重要工具.理想的动物模型应能模拟疾病发生的病理生理过程,具有可重复性,便于观测研究.研究表明,肿瘤细胞小鼠心内注射形成骨转移率低;尾静脉注射可发生肿瘤肺转移、肝转移和骨转移,但形成肿瘤转移灶差异大、可重复性低.与心内注射和静脉注射方法相比,骨髓腔注射构建骨转移模型肿瘤生长迅速、成瘤率高,且实验期间不会发生其他器脏、组织转移,可重复性高[8-9].
本研究中采用Luc-GFP-Puro病毒感染A549细胞,puromycin筛选得到Luc-GFP-Puro阳性A549细胞接种小鼠胫骨,在接种部位可以稳定的表达荧光素酶.接种第7天,腹腔注射底物D-荧光素检测到肿瘤信号,可反映肿瘤在小鼠胫骨内生长情况.此活体动物模型非常灵敏和高效,在骨肿瘤极早期即可进行观察、量化体内肿瘤细胞的生长、观测抗肿瘤药物的作用.另外这种生物发光成像对机体无损伤,可以多时间点、动态对活体肿瘤病灶的生长情况进行直观检测,并具有极高的检测灵敏度、实验费用也大大降低.
石蜡切片和HE染色是小鼠肺癌骨转移的诊断金标准.光镜下可以观察到肺癌骨转移灶的形态、分布及浸润情况,常与X-ray等影像学技术联合使用用于模型的评价[10-11].本研究应用A549-Luc-GFP-Puro细胞构建的肺癌骨转移模型,接种第21天,接种侧胫骨骨质明显不均一,骨膜边界不清呈弥散状,部分骨骼组织消失.A549-Luc-GFP-Puro接种第28天,取膝关节和胫骨制备组织切片和HE染色,结果显示骨髓腔内及骨小梁间被大量肿瘤细胞填充,骨质结构被破坏严重,骨髓腔内肿瘤细胞生长活跃.这些结果表明,此模型能模拟肿瘤细胞在骨组织的增殖及转移过程,并且具有与肺癌骨转移发生相似的生物学特性及病理学表现,具有很高的应用价值.
肺癌转移至骨组织后常引发溶骨性骨破坏,导致顽固性骨痛、病理性骨折甚至瘫痪等并发症,严重影响患者的生存及生活质量[5,12].本研究应用A549-Luc-GFP-Puro细胞构建的骨转移模型,X-ray成像可以观测到肿瘤对膝关节和小鼠胫骨组织的损害,接种侧持续性疼痛指标,如抬足时间逐渐延长;50%疼痛阈值下降,持续性疼痛和触诊疼痛强度与肿瘤骨组织浸润、骨组织损伤程度一致.随着肿瘤在小鼠胫骨组织中的生长,接种第21天后出现明显行走异常、肿瘤晚期恶液质现象.
取出胫骨肿瘤组织提取RNA,进行荧光定量RT-PCR检测发现Mta1和Mta3肿瘤转移相关基因高表达,结果提示胫骨中破骨细胞、成骨细胞等微环境表达的分子与肿瘤的生长和转移相关.同时,本模型胫骨组织中大量的肿瘤细胞可以通过胰酶消化法分离出骨组织中的肿瘤原代细胞,原代细胞更多保留了体内原始骨组织中的生物学特征,保持其原有的遗传特征,可更好地反映肿瘤细胞在体内的生长状态,从而获得与体内生理功能更接近的数据,可用于药物测试、细胞分化和转化等实验研究.
此外,此模型可用于研究肿瘤细胞与骨组织之间的相互作用,也可用于肿瘤细胞骨转移后药物对肿瘤生长及对骨组织破坏影响的相关研究,为进一步肺癌骨转移的骨应力改变及防治的研究奠定重要的基础.
