多发性骨髓瘤患者PHF19基因表达水平及其与预后的关系
2023-11-15董慧娟程杨燕李春艳颜静秀
董慧娟,程杨燕,郑 林,李春艳,颜静秀
(上饶市人民医院血液科,江西 上饶 334000)
多发性骨髓瘤(multiple myeloma,MM)是骨髓浆细胞的恶性肿瘤,发病率呈逐年上升趋势,占血液系统恶性肿瘤的第2位。随着蛋白酶体抑制剂、免疫调节药物、单抗以及造血干细胞移植的临床应用,MM患者的预后得到了很大的改善,仍有部分患者终将走向难治复发[1]。肿瘤患者中大多存在表观遗传学异常,而且表观遗传学修饰与肿瘤的发生发展密切相关,多发性骨髓瘤也不例外。多梳蛋白家族是一类重要的表观遗传调控因子,PHD锌指蛋白19(PHF19)作为多梳蛋白家族的成员之一,发挥着转录抑制因子的作用,既往研究发现PHF19在多种实体瘤细胞中过度表达,可能参与着肿瘤的发生发展过程[2]。关于PHF19在多发性骨髓瘤研究的报道并不多,有研究[3]发现PHF19过度表达与多发性骨髓瘤细胞的增殖及耐药产生相关,但关于PHF19基因表达与多发性骨髓瘤临床特征及疗效预后关系鲜有报道。本研究旨在通过实时荧光定量PCR技术检测初治、难治复发患者PHF19表达水平,结合患者的临床资料,分析PHF19与患者预后、疾病进程的关系,拟为多发性骨髓瘤的治疗提供新的靶点。
1 对象与方法
1.1 研究对象
2018年2月至2021年12月上饶市人民医院确诊为初诊MM患者69例(男39例,女30例,年龄27~86岁,IgAκ7例、IgGκ24例、IgAλ12例、IgGλ16例、IgDλ1例、轻链型9例),随访过程中20例患者出现难治复发,同时收取15例正常人骨髓标本(营养性贫血等)作为对照。初诊患者诱导及巩固化疗方案采用蛋白酶体抑制剂、免疫调节剂为主的方案。中位随访22个月,患者出现死亡或进行造血干细胞移植,则随访中止。
1.2 RNA提取及cDNA合成
骨髓标本EDTA抗凝,Ficoll淋巴细胞分离液分离单个核细胞,Trizol溶解提取的单个核细胞,经氯仿抽提、异丙醇沉淀、75%乙醇清洗,提取细胞总RNA。cDNA合成使用TAKARA公司PrimeScriptTMRT逆转录试剂盒进行,合成过程37℃ 15min,85℃ 5sec反应后-20℃保存备用。
1.3 引物合成
本研究中所用的PHF19及内参GAPDH引物均由金维智生物科技公司设计合成,引物序列:PHF19上游引物5’-CTACCTCGGGAAGATCAAGAG-3’,下游引物5’-CTAGGCAGATGTTGCACTTGG-3’;GAPDH上游引物5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-GAAGATGGTGATGGGATTTC-3’。
1.4 荧光定量PCR
实时荧光定量PCR反应按照TAKARA公司SYBR Premix Ex Taq试剂盒进行,ABI PRISM 7500 Fast Real-Tmie PCR System上95℃预变性30sec,95℃ 5sec,60℃ 34sec,40个循环,反应结束后软件自动得出mRNA的拷贝数。最终计算结果采用2-△CT值(△CT=△CT PHF19-△CT GAPDH)作为基因的表达水平。
1.5 统计学方法

2 结果
2.1 多发性骨髓瘤患者PHF19基因表达情况比较
69例初诊患者PHF19基因中位表达水平为0.0206(0.0002~0.9424),15例正常对照组PHF19基因表中位水平为0.0008(0.0001~0.3214),初诊患者PHF19基因表达水平显著高于正常对照组(Z=-3.767,P=0.000)。同时分析20例进展为难治复发患者PHF19基因表达情况,见表1,中位表达水平为0.0798(0.0013~0.9616),统计结果显示复发难治状态患者PHF19基因表达水平较初治组显著升高(Z=-2.290,P=0.022)。

表1 正常对照、初诊及难治复发MM患者PHF19基因表达情况比较
2.2 初治患者两组临床特征差异比较
对不同免疫球蛋白亚型初诊患者进行PHF19基因表达分析,结果显示,不同免疫球蛋白亚型患者PHF19基因表达无统计学差异(χ2=3.991,P<0.05);PHF19基因低表达组初诊患者中位年龄为66岁,高表达组为68岁,两组统计无差异(Z=-0.384,P<0.05);39例男性及30例女性患者PHF19基因表达中位水平分别为0.1121(0.0000~0.7241)、0.3514(0.0001~0.9424),PHF基因表达情况在男女分布中无统计学差异(Z=-1.005,P<0.05)。
2.3 初诊患者两组疾病负荷、预后分期比较
根据患者初诊时临床实验室数据对患者进行疾病负荷及预后评估,统计数据显示,69例患者贫血程度、LDH水平以及β2微球水平在不同PHF基因表达组无统计学差异,见表2,且肾功能损伤、是否合并高钙血症以及骨质破坏情况PHF基因表达也未见统计学差异(P>0.05)。
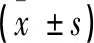
表2 初诊患者两组血红蛋白、LDH、β2微球水平比较
对不同DS、ISS分期组患者PHF19基因表达情况进行统计分析,结果显示5例DS II期患者PHF19基因中位表达水平为0.0444(0.0004~0.9424),64例患者DS分期为III期中位表达水平为0.0229(0.0000~0.7241),两组对比无统计学差异(P>0.05);69例患者ISS分期3例I期、26例II期、40例III期,三组患者PHF19基因表达水平无统计学差异(χ2=0.791,P>0.05)。
2.4 初诊患者PHF基因表达水平与疗效的关系
69例初诊患者经诱导方案治疗后60例患者达到VGPR及以上疗效,中位随访22个月。PHF19基因高表达组的OS率为76.5%,而低表达组的OS率为94.3%,低表达组优于高表达组(χ2=4.468,P=0.035);高表达组患者PFS率为52.9%,低表达组PFS率为74.3%,高表达组初诊患者的PFS率显著低于低表达组(χ2=4.244,P<0.05)。
3 讨论
多发性骨髓瘤是起源于浆细胞的恶性肿瘤,尽管诊治手段不断改善,目前仍不可治愈,部分患者难治且易复发。深入探讨多发性骨髓瘤发展及耐药机制,为其治疗提供新靶点有待进一步研究[4]。表观遗传学与肿瘤的发生发展密切相关,其机制主要是通过DNA甲基化、组蛋白修饰、非编码RNA调控和染色质结构重构等方式进行调控,进而影响肿瘤的进展,多发性骨髓瘤也不例外[5]。
多梳蛋白家族是一类重要的表观遗传调控因子,多见的有PRC1和PRC2,它能从染色质水平上通过表观遗传修饰作用调控靶基因,在细胞的增殖分化中发挥重要作用。PHD锌指蛋白19(PHF19)是PRC2的成员之一,位于人类染色体9q33.2,发挥着转录抑制因子的作用[6]。既往研究发现,PHF19在多种肿瘤细胞中过度表达,且与肿瘤的侵袭性有密切关系,可能参与肿瘤的发生发展过程[7, 8]。目前国内外关于PHF19在多发性骨髓瘤中表达情况的研究不多,2020年Mike J Mason等[9]人组织了一项名为“Multiple Myeloma DREAM Challenge”的众包测试,结果显示PHF19是多发性骨髓瘤预后不良的分子标志,联合患者的MMSET基因表达、年龄以及ISS分期情况,有望进一步完善多发性骨髓瘤的危险分层系统。体内外研究发现,PHF19过表达与多发性骨髓瘤细胞的增殖及耐药相关,但相关机制并不明确[10]。
本研究采用实时荧光定量PCR检测69例初诊、20例难治复发MM患者以及15例正常人骨髓PHF19基因表达情况,结果显示MM患者PHF19基因表达水平显著高于正常对照组,且在患者出现疾病进展后PHF19基因表达水平显著提高,提示PHF19在MM发生发展中起到一定的作用。对初治患者发病时临床特征及疾病负荷进行统计学分析,发现初诊患者PHF19基因表达水平与患者年龄、性别、免疫球蛋白亚型无相关;对患者疾病符合和预后分层分析显示,不同DS、ISS及R-ISS分期患者PHF19基因表达水平无统计学差异。本研究结果还显示PHF19基因低表达组患者OS率及PFS率明显优于高表达组,提示PHF19基因表达和多发性骨髓瘤患者疗效和预后存在一定的相关性,PHF19高表达患者预后不良。
本研究结果提示PHF19基因表达水平和MM患者疗效和预后存在一定的关系,PHF19基因高表达提示预后较差。今后仍需扩大样本量以及延长随访时间,以期进一步了解PHF19基因在多发性骨髓发展及耐药中的作用,为其治疗提供新的靶点。
