CYP2C19基因多态性与急性缺血性脑卒中氯吡格雷抵抗相关性研究
2023-11-15刘立雄张姗姗江晓敏
刘立雄,张姗姗,马 培,江晓敏,杨 欣
( 1.广州医科大学附属第五医院神经内科,广东 广州 510700;2.广州医科大学附属第二医院康复科,广东 广州 510280;3.广州医科大学附属第五医院康复科 ,广东 广州 510700;4.广州医科大学附属第五医院药剂科,广东 广州 510700)
急性缺血性脑卒中是一种以局灶性神经功能缺失为主要特征的脑血管病变,可出现运动、语言等功能障碍,甚至导致患者死亡。目前抗血小板治疗是急性缺血性脑卒中二级预防的重要策略,可有效降低复发率,改善患者预后,其中氯吡格雷是常用抗血小板药物之一,具有良好的抗血小板聚集作用,但长期临床实践证实,在氯吡格雷给药过程中,约有4%~30%的患者在常规剂量治疗中达不到预期疗效,甚至出现氯吡格雷抵抗(clopidogrel resistance,CR)现象而诱发严重缺血性事件[1]。CR确切的发生机制目前仍不十分清楚,多数学者考虑主要与基因多态性、年龄、高血压等多种因素密切相关,其中与药物代谢相关的基因多态性与CR发生的相关性研究受到国内外研究学者的广泛关注。CYP2C19基因位于染色体区10q24.2上,其编码酶具有完全活性,在人体内呈多态性表达。目前,多项研究证实,CYP2C19基因多态性与氯吡格雷抵抗的机制密切相关,通过检测CYP2C19基因,可判断患者代谢速率类型[2-4]。因此,本研究选取200例急性缺血性脑卒中患者为研究对象,旨在从基因多态性分布、主要临床终点事件发生情况两个方面来探讨氯吡格雷抗血小板疗效与其基因多态性之间的相关性,现报道如下。
1 资料与方法
1.1 一般资料
本研究经医院伦理委员会审批,选取2020年10月至2022年10月广州医科大学附属第五医院神经内科住院治疗的200例急性缺血性卒中患者为研究对象,其中男115例,女85例;年龄43~75(60.21±4.17)岁。(1)纳入标准:①均符合《中国急性缺血性脑卒中诊治指南2018》[5]诊断标准;②首次发病,且临床资料完整;③取得患者或家属书面知情同意。(2)排除标准:①小脑肿瘤、脑萎缩等其他疾病引起的神经功能缺损患者;②合并慢性消耗性疾病、严重心肝肾功能损害者;③合并恶性肿瘤者;④既往1个月内应用质子泵抑制剂或对氯吡格雷过敏者;⑤严重外伤史或合并出血性疾病者;⑥合并精神疾病,依从性差者;⑦不能定期门诊随诊者或中途因自身原因退出研究者。
1.2 方法
1.2.1 分组标准:纳入的200例患者按随机1:1的原则分成A组和B组。未接受基因检测的急性缺血性脑卒中/TIA患者100例设为A组,服用常规剂量氯吡格雷(75mg,qd)。接受CYP2C19基因检测患者为B组,将只携带CYP2C19*1/*1,CYP2C19*1*17定义为快代谢型(*1/*1、*1/*17), 携带一种无功能等位基因的被定义为中间代谢型(*1/*2、*1/*3),而携带两种无功能等位基因的被定义为慢代谢型(*2/*2、*3/*3、*2/*3)。其中,快代谢型患者为B1组,服用常规剂量氯吡格雷(75mg,qd);中间代谢型患者为B2组,提高氯吡格雷剂量至150mg;慢代谢型患者为B3组,服用阿司匹林(100mg,qd),对阿司匹林有禁忌者给予替格瑞洛(90mg,bid)。
1.2.2 基因多态性测定:荧光原位杂交技术(fluorescence in situ hybridization, FISH)以利用荧光标记的特异寡聚核苷酸片段作为探针,并通过检测荧光信号对基因型进行判读并给出基因型结果显示。具体检测方法:所有入组对象均在入组后次日(在开始用药治疗之前)抽取3~5mL肘静脉血(不需要空腹),乙二胺四乙酸(ethylene diaminetetraacetic acid,EDTA)抗凝,使用德国Merck公司提供的CYP2C19基因检测试剂盒提取DNA,操作过程严格按照说明书进行,自动完成CYP2C19、PON1和 ABCB1基因染色体核型分析和基因序列测定,确定基因型。
1.2.3 血小板抑制率测定:采集所有受检者空腹静脉血3mL,按照9:1比例加入枸橼酸抗凝剂混合摇匀,以离心半径10cm,转速3000r/min,离心10min,分离血清,于-20℃保存;采用DRNX-Ⅲ型血栓弹力图分析仪(重庆鼎润)及配套软件计算血小板抑制率,其中血小板抑制率≤40%即为氯吡格雷抵抗。
1.2.4 临床随访和终点事件:每个患者至少随访90d,排除改变抗栓药物方案患者,详细记录服药情况、终点事件以及发生时间。临床终点事件包括各种脑血管事件(复发性缺血性脑卒中、短暂性脑缺血发作)和出血事件(颅内出血、皮肤黏膜出血、消化道出血)等。
1.3 统计学方法

2 结果
2.1 两组一般资料比较
两组患者性别、吸烟史、饮酒史、合并高血压、合并糖尿病、合并高脂血症、年龄、BMI、TC、TG、LDL-C、HDL-C、ALT及AST等资料比较,差异均无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
2.2 CYP2C19基因不同代谢型血小板抑制率及CR情况比较
B1组血小板抑制率高于B2组和B3组,差异有统计学意义(P<0.05);B1组CR率为30.30%低于B2组54.35%和B3组66.67%,差异有统计学意义(P<0.05),见表2。

表2 CYP2C19基因不同代谢型血小板抑制率及CR情况比较
2.3 CYP2C19基因不同代谢型不良事件发生率比较
B3组不良事件发生率为28.57%,高于B2组8.70%和B1组6.06%,差异有统计学意义(P<0.05),见表3。
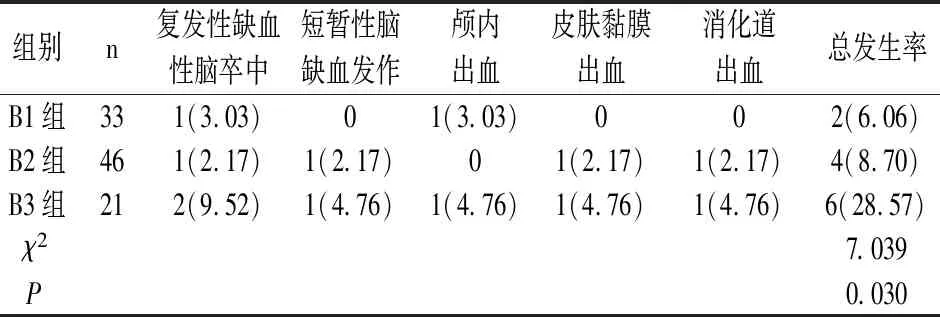
表3 CYP2C19基因不同代谢型不良事件发生率比较[n(%)]
3 讨论
急性缺血性脑卒中是临床常见病、多发病,近年来,随着我国人口老龄化的加剧及脑血管病危险因素的持续增多,其发病率呈明显上升趋势,若不能及时得到有效救治,可引发一系列神经功能缺损症状,甚至出现呼吸、循环等多系统功能障碍[6]。动脉粥样硬化血栓形成是缺血性脑卒中发生的关键因素,因此采取有效的抗血小板治疗对改善患者预后具有重要临床指导意义。
氯吡格雷是一种前体药物,口服后经肝脏P450酶(CYP2C19、CYP2B6、PON1等)活化代谢,进而发挥抑制血小板聚集的作用,但部分患者会出现CR,而CYP2C19又是氯吡格雷氧化代谢的关键酶之一。相关研究表明,CYP2C19基因多态性与氯吡格雷抵抗的机制密切相关,其中等位基因CYP2C19*2和CYP2C19*3的存在可在一定程度上削弱氯吡格雷的抑制血小板聚集作用,从而增加CR及缺血性事件的发生风险[7,8]。董婧等[9]研究指出,CYP2C19快代谢型患者血小板抑制率为(86.0±10.1)%显著高于慢代谢型患者(66.4±23.0)%,差异有显著性(P<0.05)。本研究结果显示,B1组血小板抑制率高于B2组和B3组;B1组CR率为30.30%低于B2组54.35%和B3组66.67%(P<0.05),与上述研究结果部分相符。进一步说明CYP2C19等位基因是决定CR的重要遗传变异基因,其中携带慢代谢型CYP2C19基因型的急性缺血性脑卒中患者CR发生风险较高。
目前,多项研究表明,药物代谢酶CYP2C19基因多态性与氯吡格雷抵抗发生机制密切相关。如:Tomek A等[10]研究表明,在接受氯吡格雷治疗的缺血性中风患者中,CYP2C19*2功能缺失等位基因携带者发生重大临床不良事件的风险是正常人的3倍。一项关于CYP2C19基因型对氯吡格雷预防中风有效性的回顾性队列研究中[11],经过3年对628种氯吡格雷启动剂的跟踪随访发现,氯吡格雷不良代谢状态与缺血性中风的高风险相关,其中缺血性脑卒中和心肌梗死复合结局的风险较高,分别为(HR=3.32,95%CI:1.35~8.17;P=0.009)、(HR=2.86,95%CI:1.16~7.06;P=0.02),得出结论,纯合子CYP2C19功能等位基因缺失的患者服用氯吡格雷可能增加缺血性卒中、心肌梗死的风险。本研究结果显示,B3组不良事件发生率为28.57%,高于B2组8.70%和B1组6.06%(P<0.05)。提示携带CYP2C19*2/*2、*3/*3、*2/*3突变基因患者发生不良事件的风险更高。因此,建议临床应用氯吡格雷治疗时,应根据患者CYP2C19基因多态性分布考虑调整氯吡格雷用药剂量或联合应用其他药物。
综上所述,急性缺血性脑卒中患者CYP2C19基因多态性与CR具有相关性,其中携带CYP2C19*2/*2、*3/*3、*2/*3突变基因患者更易发生CR,通过检测CYP2C19基因型有助于指导临床中抗血小板药物的应用。
