肿瘤坏死因子-α对糖尿病大鼠钠潴留的调控
2023-11-15张冬瑞韦青清邓佳豪隋洪玉
张冬瑞,韦青清,刘 佳,薛 嵩,邓佳豪,张 杨,隋洪玉
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
糖尿病是一种复杂的慢性代谢紊乱性疾病,由多因素导致胰岛素分泌不足和/或利用障碍而引起,临床特征主要表现为高血糖和多种并发症。其中,糖尿病肾脏疾病(diabetic kidney disease, DKD)是糖尿病最常见和最严重的并发症之一[1],而钠潴留被认为是DKD早期肾功能改变的重要指标,其发病机制涉及诸多因素,如糖基化终末产物沉积、血流动力学改变、炎性细胞因子、氧化应激及某些特异基因表达异常等,其中炎性细胞因子发挥重要作用[2]。大量研究表明,促炎因子TNF-α与糖尿病的发病过程密切相关,但它是否参与了DKD中钠潴留的形成鲜有报道。本研究旨在探讨TNF-α对糖尿病肾脏疾病大鼠钠潴留的影响,以期为探索DKD的发病机制及早期防治提供新的研究思路和作用靶点。
1 材料与方法
1.1 实验动物
健康雄性SD (sprague-dawley)大鼠180~220g,购于佳木斯大学实验动物中心。
1.2 实验材料
Actin抗体购于Affinity公司,TNF-α抗体及CLCNK抗体均购于Abcam公司,链脲佐菌素(streptozotocin, STZ)购于Sigma公司。
1.3 实验方法
1.3.1 实验分组
40只雄性SD大鼠适应性喂养1周,随机分成4组,分别为:正常对照组(NC,n=10)、糖尿病模型组(DM,n=10)、正常+TNF-α阻断剂组(NC+TNFR:Fc,n=10、糖尿病+TNF-α阻断剂组(DM+TNFR:Fc,n=10)。
NC组腹腔注射与DM组等量的柠檬酸缓冲液;DM组按60mg/kg剂量腹腔注射STZ制备糖尿病模型;NC+TNFR:Fc组腹腔注射与DM组等量的柠檬酸缓冲液,并在注射前一天按2mg/kg剂量皮下注射TNFR:Fc,依2次/周的方式连续注射至3周;DM+TNFR:Fc组按60mg/kg剂量腹腔注射STZ,并在注射前一天按2mg/kg剂量皮下注射TNFR:Fc,依2次/周的方式连续注射至3周。
1.3.2 蛋白免疫印迹技术
采用聚丙烯酰胺凝胶电泳进行蛋白分离,首先取50μg蛋白样品上样后进行电泳,电泳结束后选用PVDF膜进行转印,然后将转印膜置于5%脱脂奶粉溶液中室温下封闭1h,随后加入相应特异抗体进行一抗孵育并4℃过夜,洗膜后室温下二抗孵育1h,洗膜后使用ECL发光液显影并进行凝胶成像分析。
1.3.3 单通道膜片钳技术
使用Multiclamp700B放大器记录TAL管周膜氯通道电流,通道活动度用NPo表示,是通道开放概率(Po)与通道开放数(N)的乘积,NPo=∑(1t1+2t2+……+iti),ti为通道开放时间。
1.4 统计学方法
2 结果
2.1 空腹血糖
在实验第72 h和3周时检测大鼠空腹血糖。结果显示:与NC组相比,DM组空腹血糖明显升高(表1,n=8,P<0.01)。结果表明糖尿病模型制备成功。

表1 两组大鼠空腹血糖的变化
2.2 TAL组织中TNF-α蛋白表达
应用蛋白免疫印迹法检测TAL组织中TNF-α的蛋白表达(图1)。结果显示:与NC组相比,DM组TNF-α的蛋白表达明显升高(n=3,P<0.01)。
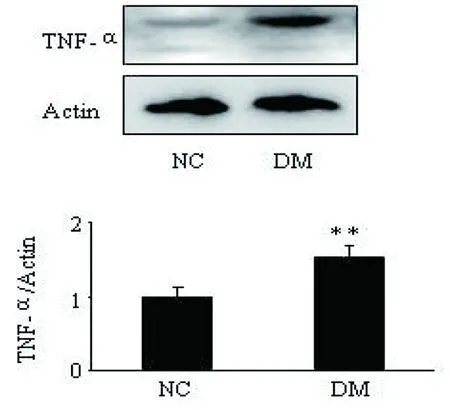
图1 TAL组织中TNF-α的蛋白表达(与NC组比较,**P<0.01)
2.3 24h钠平衡指数
利用“钠平衡=钠摄入量-钠排出量”测定3周时各组大鼠24h钠平衡指数,以判断钠潴留情况(表2)。结果显示:与NC组相比,DM组钠平衡指数升高(n=8,P<0.05);与DM组相比,DM+TNFR:Fc组钠平衡指数下降(n=8,P<0.05)。
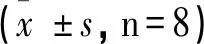
表2 各组大鼠24h钠平衡指数的变化
2.4 TAL管周膜氯通道蛋白表达
应用蛋白免疫印迹法检测TAL管周膜氯通道的蛋白表达(图2)。结果显示:与NC组相比,DM组CLCNK蛋白表达明显升高(n=3,P<0.01);与DM组相比,DM+TNFR:Fc组CLCNK蛋白表达下降(n=3,P<0.05)。

图2 TNF-α对TAL管周膜氯通道蛋白表达的影响(**P<0.01,##P<0.01)
2.5 TAL管周膜氯通道NPo
应用细胞贴附式膜片钳技术高阻封接TAL管周膜后记录氯通道电流,2~3min后向浴槽内加入10nM的TNF-α,观察记录氯通道电流NPo的变化。结果显示:与NC组相比,DM组氯通道电流NPo明显升高(图3,n=5,P<0.01)。
图3 TNF-α对TAL管周膜氯通道NPo的影响(**P<0.01)
3 讨论
糖尿病是全球常见的代谢性疾病之一,具有“发病率高、致残率高、死亡率高”的典型特征,严重威胁着当代人类的健康和生活质量。据国际糖尿病联合会预测,全世界糖尿病患者人数至2035年将达到5.52亿,而中国已成为糖尿病人口第一大国[3],由此可见,深入开展疾病的相关研究已迫在眉睫。而DKD是诱发终末期肾病最常见的原因,亦是导致人类死亡的主要病因之一,因此,其已成为不可忽视的社会公共卫生问题[4]。
DKD的发病原因较为复杂,尚未完全阐明。越来越多的证据表明DKD患者存在着明显的微炎性反应状态,表现为单核巨噬系统激活后引发全身循环持续、低水平的炎性因子升高,如TNF-α、IL-6、TGF-β等,因这种炎症有别于传统的病原微生物感染所致的炎症,故而被称为“微炎症”[5,6]。其中,TNF-α是一种主要由活化单核巨噬细胞产生的多效性炎性细胞因子,参与机体多种生理免疫过程,包括糖尿病肾脏疾病形成的病理过程。大量研究表明,TNF-α作为一种细胞毒性因子能够对肾脏造成直接损伤,诱导细胞凋亡和细胞坏死、导致肾脏血流动力失衡;还可诱导活性氧类系统的激活,破坏肾小球滤过膜的通透性,产生蛋白尿[7],但是否参与到DKD钠潴留的形成中尚不十分明确。目前,一般认为钠潴留的发生主要是由肾远端小管介导的,而肾远端小管对钠的重吸收又主要发生在髓袢升支粗段,生理情况下,小管液中20%~25%的NaCl可经TAL管腔膜Na+-K+-2Cl-(NKCC2)同向转运体进入肾上皮细胞,再经管周膜上的钠泵和氯通道转运至组织间液。由于Cl-浓度升高使细胞超极化,其扩散电位增大,促进Cl-出胞的同时亦驱动了NKCC2的转运,进而增加Na+的重吸收[8],因此,管周膜氯通道活性的大小可以调控小管液中Na+的重吸收。本实验采用蛋白免疫印迹和膜片钳等技术观察了糖尿病大鼠模型肾组织中TNF-α的蛋白表达、TNF-α对钠平衡指数及TAL管周膜氯通道活性的影响,结果显示,DKD大鼠肾组织TNF-α蛋白水平显著上升;钠平衡指数及TAL管周膜氯通道蛋白表达水平显著上升,给予其阻断剂后二者均下降;在体外TAL组织中给予TNF-α后,氯通道开放率明显增加。说明TNF-α可能是通过增加TAL管周膜氯通道活性而促进了糖尿病大鼠钠潴留的形成,但TNF-α增加氯通道活性是通过哪条信号转导通路实现的尚不清楚,在今后的实验研究中将进一步探索。本研究为探寻TNF-α对糖尿病性钠潴留的形成过程提供了新的理论依据,亦为DKD的靶向治疗指出了新的方向。
