半夏组织培养一步成苗技术初步研究
2023-11-15程搏幸罗夫来李冀青王洪亮李开阳
程搏幸, 罗夫来, 李冀青, 王洪亮, 李开阳, 周 丹
(1.贵州师范学院生物科学学院, 贵阳 550018; 2.贵州大学农学院, 贵阳 550025;3.贵州省农业科技发展中心, 贵阳 550001;4.赫章县山地高效农业科技有限公司, 贵州 毕节 553200)
半夏[Pinelliaternate(Thunb.)Breit.]是天南星科草本植物,以干燥块茎入药,被历版《中华人民共和国药典》收载[1],具有燥湿化痰、降逆止呕、消痞散结等功效[2],是常用的化痰止咳平喘药材[3]。随着半夏药材需求量逐步增加,野生资源大幅衰减,市场上半夏药材主要依靠人工种植[4]。目前,主要以块茎作为种茎,用无性繁殖方式进行种植,繁殖系数小、种茎成本高、种植效益低,严重影响半夏产业可持续发展[5-6]。利用组织培养技术,实行半夏工厂化育苗是提高繁殖系数、降低种茎成本、提升种植效益的有效途径,但是传统组培技术需经过多次接种和培养,才能完成诱导、分化、生根、壮苗的过程,育苗环节多、步骤繁琐、周期长[7]。一步成苗组织培养育苗法是在同一培养基上完成脱分化、再分化等过程,减少人工操作环节,降低污染风险,有效提高了育苗效率、缩短了育苗周期,为进一步提高种苗大规模生产提供有力保障。近年来,石斛[8]、丹参[9]、白芨[10]、栝楼[11]等药用植物均已初步完成了一步成苗的相关研究,从理论上简化了种苗生产操作流程,缩短育苗周期。然而关于半夏一步成苗的研究相对较少,目前主要以三叶半夏[12]、荆半夏[13]等作为研究对象,对其培养基成分优化。本研究以半夏为材料,研究其一步成苗的适宜外植体、培养基配方、炼苗方法、移栽炼苗基质,以期简化半夏组织培养种苗生产流程,缩短培育周期,初步建立半夏一步成苗技术,为半夏种苗组培快繁提供技术支持。
1 材料与方法
1.1 材 料
试验用半夏块茎来源于贵阳市花溪区大将山半夏种植基地,经贵州大学赵才副教授鉴定为天南星科植物半夏(Pinelliaternata)。
1.2 方 法
1.2.1半夏无菌叶柄、叶片的培养
选取健康半夏块茎通过组织培养得到半夏组培幼苗,将组培幼苗作为外植体来源,其叶柄和叶片作为外植体,叶柄切成1 cm小段、叶片切成0.5~1.0 cm见方小块。
1.2.2外植体及培养基配方筛选
以MS培养基(含0.1%活性炭)为基本培养基,采用二因素三水平完全随机设计(表1),考察生长调节剂对半夏组培苗生长的影响,将外植体接种到相应培养基上,放入培养室培养。培养条件为25 ℃、2 000~2 500 lx,每天光照12 h,培养周期为60 d。记录愈伤数、芽分化数、根分化数以及每颗外植体长出的幼苗数,并计算愈伤诱导率、芽分化率、根分化率等。

表1 半夏一步成苗的生长调节剂因素及水平
愈伤诱导率/%=(分化愈伤组织外植体数/接种外植体数)×100%;
芽分化率/%=(具芽的外植体数/接种外植体数)×100%;
根分化率/%=(具根的外植体数/接种外植体数)×100%;
平均每个外植体分化的幼苗数=分化出的幼苗总数/分化出幼苗的外植体数;
增殖系数=分化出的幼苗总数/接种株数。
1.2.3炼苗方法筛选
将生长健壮,长势一致的组培苗与培养瓶一起转移至炼苗室,进行闭瓶炼苗(0 d、2 d、5 d)和开瓶炼苗(3 d)处理,考察炼苗方式和时间对半夏幼苗成活率及幼苗长势的影响,各处理200瓶。炼苗环境:温度25 ℃、湿度40%~50%、光照2 000~2 500 lx,适当浇水。
移栽成活率/%=(成活株数/移栽株数)×100%。
1.2.4移栽炼苗基质筛选
以表2中河沙、腐殖土、蛭石三种物质比例配制移栽基质,经高压灭菌锅121 ℃灭菌20 min后,取出,置于烘箱中105 ℃烘干10 h以上,至恒重。在炼苗盘中装入厚约5 cm的基质,在基质上按5 cm × 5 cm距离用木棍打孔。将上述通过炼苗且长势良好的幼苗取出,分割成一芽三根的单棵植株(芽高3 cm以上,根平均长2 cm)栽入小孔内,每个处理移栽40颗小苗,3次重复。移栽炼苗环境:温度25 ℃、湿度40%~50%、光照2 000~2 500 lx,每天光照12 h,适量补水,20 d后观察组培苗移栽成活率及幼苗生长情况。

表2 移栽基质的配比设计
1.2.5移栽基质含水量筛选
以腐殖土+河砂作为移栽基质,根据上述实验方法配制移栽基质及移栽半夏组培苗,20 d后观察成活率及幼苗生长情况。
计算最大持水量:用环刀取基质,在环刀下垫一张滤纸,用皮筋固定在环刀上,防止基质散出。之后将环刀放在盘子里,盘中倒水,没过滤纸即可,隔天将环刀中的基质取出,放在已知重量的铝盒中称重,得到最大持水量时的土壤质量(W1);之后将铝盒放在烘箱中105 ℃烘至恒重(约10 h以上),称重得到干土质量(W2)。
最大持水量(质量含水量)=(W1-W2)/W2。
1.3 数据处理
试验数据分析采用Excel软件进行,方差分析采用IBM SPSS Statistics24软件进行,利用邓肯新复极差法进行多重比较。
2 结果与分析
2.1 不同培养基配方对半夏叶柄一步成苗的影响
由表3可知,以半夏无菌苗叶柄为外植体时,处理8愈伤组织诱导率最高,达100%,但愈伤组织能分化为幼苗的比例仅达到一半。处理7愈伤组织诱导率达81.48%,愈伤组织的成苗率也接近100%,但该处理中根系相对较少,每棵具苗外植体产出幼苗数为4.88株。处理2和处理5愈伤组织诱导率分别为77.78%和86.42%,愈伤组织的成苗率接近100%,且根系发达,每颗具苗外植体能产出8株幼苗,为本组实验中的最高值,且处理5的增殖系数显著高于其他处理(表4)。因此,处理5最适宜作为半夏无菌苗叶柄作为外植体时一步成苗的培养基。
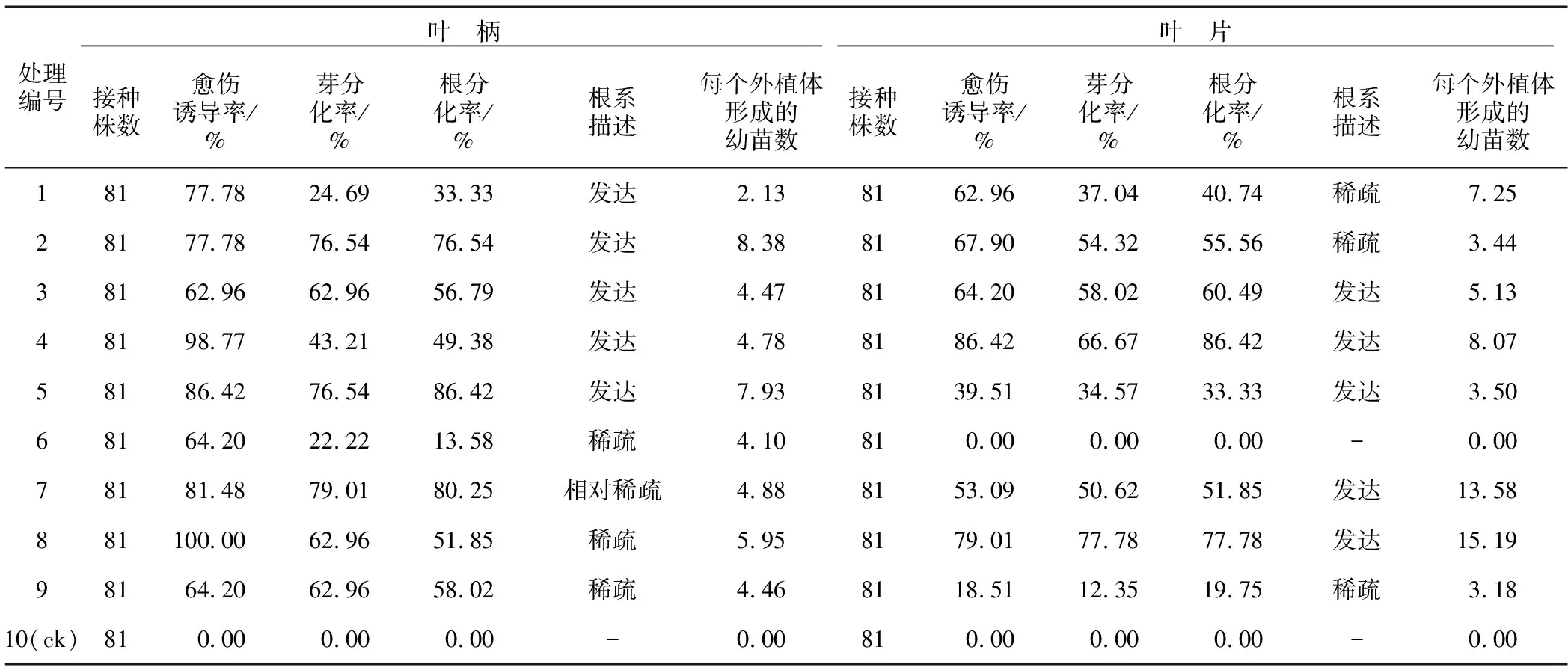
表3 生长调节剂对半夏一步成苗的影响
2.2 不同培养基配方对无菌叶片一步成苗的影响
如表3所示,以半夏无菌苗叶片为外植体时,处理4愈伤组织诱导率为86.42%,为该组实验最高值,愈伤组织分化成苗率接近100%,根系发达,每颗具苗外植体能分化幼苗数为8.07株。处理7和处理8的愈伤组织分化成苗率也接近100%,根系发达,每颗具苗外植体能分化幼苗数分别为13.58株和15.19株,然而处理7的愈伤组织诱导率为53.09%,低于处理8(79.01%),且处理8的增殖系数显著高于处理7(表4)。因此,处理8最适宜作为半夏无菌苗叶片为外植体时一步成苗的培养基。
综合上述两组试验数据,半夏无菌苗叶片作为外植体时处理8的愈伤组织诱导率、芽分化率、根分化率等数据与叶柄作为外植体时处理2和处理5的相似,叶片作为外植体时处理8的成苗率、增殖系数均高于叶柄为外植体的。因此,半夏无菌苗一步成苗体系中应以叶片作为外植体,并以处理8的生长调节剂浓度配比作为培养基配方。
2.3 炼苗时间对半夏组培苗生长的影响
如表5所示,闭瓶炼苗时间对半夏组培苗成活率影响显著且苗情差异较大。在炼苗阶段,直接开瓶炼苗时半夏组培苗成活率为56%,成活的幼苗长势不佳,不宜移栽。当闭瓶炼苗2 d、5 d再开瓶炼苗时,成活率均达到100%,且幼苗长势均良好。

表5 炼苗时间对半夏组培苗成活率及苗情的影响
2.4 移栽炼苗基质对半夏组培苗生长的影响
移栽基质的选择影响半夏组培苗移栽成活率和苗情(表6)。3种移栽基质对幼苗成活率和叶宽的影响无显著差异,腐殖土+河砂作为移栽基质时幼苗叶绿素相对含量和叶长显著低于其他处理,株高显著低于腐殖土+蛭石处理组。腐殖土+蛭石处理组与腐殖土处理组的成活率、叶长、叶宽、叶绿素相对含量等指标差异不显著,腐殖土+蛭石处理组的株高显著高于腐殖土处理组。因此,腐殖土+蛭石处理组较适合作为半夏组培苗移栽基质。

表6 移栽基质对半夏组培苗成活率及苗情的影响
2.5 移栽炼苗基质含水量对半夏组培苗生长的影响
随着移栽基质含水量增加,半夏组培苗移栽成活率呈升高趋势,幼苗长势逐渐强壮(表7)。移栽基质含水量为80%时,成活率显著高于其他处理,虽然该处理中半夏组培苗株高显著低于含水量为70%的处理,但叶长、叶宽、叶绿素相对含量等指标均高于其他处理。因此,移栽基质含水量为80%有利于半夏组培苗的生长。

表7 基质含水量对半夏组培苗成活率及苗情的影响
3 讨 论
激素是植物组织培养基的核心组成部分,作为植物生长调节剂在诱导愈伤组织、不定芽分化、苗的生长、生根等组培苗生长各阶段均起着关键作用。细胞分裂素6-BA促进芽的分化和生长,并对愈伤组织的形成具有促进作用,生长素NAA以促进苗的生长和诱导不定根的形成为主[14],在一步苗体系中细胞分裂素与生长素共同影响组培苗的生长与分化[15-16]。本研究中,综合考虑愈伤组织诱导率、芽分化率、根分化率、每个外植体形成的幼苗数及增殖系数等指标,以叶片作为外植体并在培养基中加入1.5 mg/L NAA和1 mg/L 6-BA时半夏组培一步成苗的效率优于其他处理。在该培养基处理下,愈伤组织诱导率虽然仅有79.01%,而芽分化率和根分化率均近100%,增殖系数达44.22。由此可见,本处理提高了半夏一步成苗的繁殖效率[12]。在该激素浓度配比中1 mg/L 6-BA的浓度相对较低,与杨璐等[17]、刘福平等[18]的研究结果一致,原因是过高浓度的细胞分裂素会抑制植物正常的生长、发育。本研究中,高浓度NAA促进愈伤组织诱导不定根形成,NAA浓度达到1.5 mg/L时不定根的诱导率接近100%,与李娟娟等[19]的研究结果一致。
MS培养基具有植物生长所需的丰富营养,能加快愈伤组织的形成和幼苗的生长,是植物组织培养最常用的基础培养基之一。半夏组织培养各阶段或一步成苗的大多数研究均以MS作为基础培养基,均能达到较为理想效果,本研究也使用MS作为半夏一步成苗的基础培养基。活性碳已广泛应用于石斛、蝴蝶兰、蓝莓等植物组织培养,作为培养基添加剂可有效防止外植体的褐化、吸附植物代谢的有害物质、促进幼苗根系的生长[20]。喻娜[21]研究认为,添加适量活性炭有利于组织培养中半夏幼苗根系的生长,同时根据本实验室前期实验经验,本研究在MS中添加了0.1%活性炭作为基础培养基。
炼苗和移栽是植物组培幼苗一步成苗体系中最后一个环节[22],炼苗时间、移栽基质和移栽基质含水量对半夏组培幼苗移栽的成活率及长势具有显著影响。在本研究中,未经开瓶炼苗的半夏组培幼苗成活率及长势显著低于经开瓶炼苗处理的,这可能是组培苗长期在无菌环境中长大,如直接移栽适应性较差,无法适应自然环境[23]。此外,组培苗的移栽基质应具备丰富营养、疏松透气、水分充足等特点[24],在本研究中,具有上述特征的腐殖土+蛭石(含水量为80%)更有利于半夏组培苗的移栽。
