油莎豆茎豆萌发过程中内源激素含量的变化
2023-11-15张向歌宋万献朱雅婧于美琴宋雯栩王树峰李居政王会伟
张向歌, 宋万献, 朱雅婧, 于美琴, 宋雯栩, 王树峰, 李居政, 王会伟
(河南省农业科学院经济作物研究所, 郑州 450002)
油莎豆(CyperusesculentusL.)又名虎坚果、油莎草和铁荸荠等,是一年生块茎类植物,其地下茎块呈圆形或椭圆形豆状,可称之为茎豆,富含油脂、淀粉、糖、蛋白质、膳食纤维以及多种维生素,应用于粮、油、牧、饲等多个方面,开发潜力巨大[1-3]。目前,油莎豆主要依赖于茎豆进行无性繁殖,其茎豆即为油莎豆繁育的种源。因而,保证油莎豆茎豆发芽率对油莎豆大面积推广种植十分关键,开展油莎豆茎豆休眠与萌发相关的研究具有重要意义。
在种子的休眠与萌发过程中,植物内源激素起着非常重要的调控作用[4]。目前,内源激素脱落酸(ABA)和赤霉素(GAs)在种子休眠与萌发中的作用得到充分研究[5-6]。ABA和GAs作为主要的内源调控因子,以拮抗的方式调控种子的休眠和萌发;其中,ABA促进种子休眠并抑制萌发,而GAs则解除种子休眠并触发萌发[7-8]。此外,近年来很多研究发现,其他内源激素如生长素、细胞分裂素、乙烯等对植物种子休眠与萌发均至关重要[9-11]。同样,在无性繁殖植物中(如马铃薯、山药等),其块茎的休眠与萌发也受到各种内源激素的调控[12-13]。植物种子或茎豆从休眠到萌发的转变过程不只是单一激素影响的结果,而与多种激素的共同作用密切相关。
种子萌发是指种子从吸胀作用开始的一系列有序的生理过程和形态发生过程。吸胀是种子萌发过程中极其重要的阶段,随着种子充分吸水,休眠性逐渐解除,其内源激素的含量也随之呈现动态变化[14-15]。了解油莎豆茎豆在充分吸水前后内源激素含量的变化规律,有助于提高对油莎豆茎豆休眠与萌发的认识。本研究对油莎豆茎豆萌发过程中干茎豆、吸胀茎豆、初发芽茎豆进行内源激素GAs(GA1、GA3和GA4)、ABA、IAA、玉米素核苷(ZR)、水杨酸(SA)和茉莉酸(JA)含量的测定,以明确油莎豆茎豆萌发过程中激素含量的变化规律,为油莎豆茎豆休眠与萌发调控机制的研究提供参考。
1 材料与方法
1.1 试验材料
供试材料为河南省油莎豆认定品种(2020年):圆粒型豫油莎2号,由河南省农业科学院经济作物研究所选育。
1.2 萌发试验
选取大小均匀一致的茎豆,用10%次氯酸钠溶液消毒5 min,放入无菌水中进行浸种(3 d),每天更换一次无菌水。3 d后将吸胀的茎豆转移至沙土育苗盘中进行发芽,设置3个重复,每个重复100粒,每天喷洒一次足量的无菌水。观察茎豆萌发情况,统计茎豆发芽率。以上试验均于河南省农业科学院人工气候室进行,培养条件为光照14 h,30 ℃;黑暗10 h,28 ℃。
1.3 内源激素含量测定
选取干茎豆、浸种3 d茎豆、初发芽茎豆(芽长约0.5 cm),以芽眼为中心切取茎豆块(约0.5 cm×0.5 cm×0.5 cm),设置3个重复,利用高效液相色谱法分别检测以上各样品中GAs、ABA、IAA、ZR、SA及JA等内源激素的含量。
内源激素的提取和纯化参照相关研究并适当进行调整[16-17]。将样品在液氮中研磨成粉末后准确称取0.2 g(精确至0.001 g)于10 mL离心管中,加入2 mL经4 ℃预冷的80%(体积比)甲醇提取液(含0.5%甲酸),超声萃取30 min,静止过夜;在4 ℃条件下,12 000 r/min离心15 min,吸取上清液;再向残渣中加入2 mL甲醇提取液,超声萃取30 min,重复提取2次,合并3次上清液;在38 ℃恒温水浴中旋转减压蒸发至水相,置-20 ℃冰箱中冷冻30 min;随后取出解冻,4 ℃ 12 000 r/min离心10 min,取上清液于净化管,剧烈振荡30 s,4 000 r/min离心5 min,取上清液,用氮吹仪浓缩至干燥,加入1.0 mL乙腈溶液复溶,超声30 s,0.22 μm微孔滤膜过滤,滤液用于高效液相色谱仪检测。以1%甲酸-甲醇为流动相溶剂系统,设定上样量为10 μL,流速为0.5 mL/min,柱温为30 ℃,依照梯度洗脱程序(表1)进行以上内源激素含量的测定。
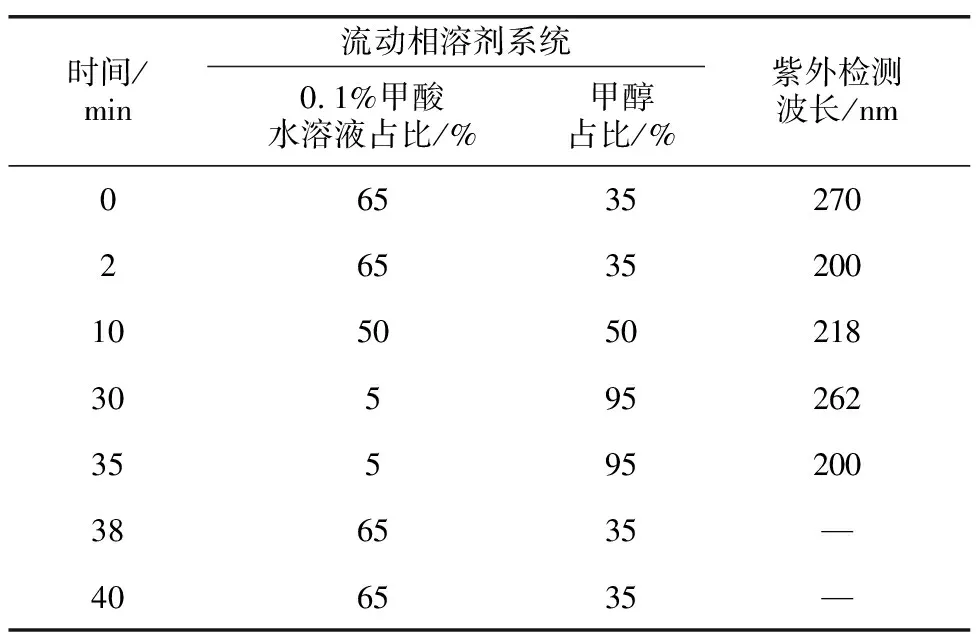
表1 高效液相色谱梯度洗脱程序
1.4 外源激素处理
依据内源激素含量测定结果,选择一些油莎豆茎豆萌发过程中出现明显变化的激素,进行外源激素处理,以检验其对茎豆萌发的影响。将茎豆分别放入不同外源激素及对照(水)处理中浸种3 d,激素浓度参照萌发过程中最高检测含量,每天更换一次相应的处理溶液;3 d后,将吸胀的茎豆转移至沙土育苗盘中进行发芽,每个处理设3次重复,每个重复100粒,从茎豆发芽破土开始,每天观察各处理中茎豆发芽情况,统计茎豆发芽个数并计算发芽率。
发芽率/%=(发芽个数/总茎豆数)×100%。
2 结果与分析
2.1 油莎豆茎豆萌发观察及发芽率统计分析
油莎豆干茎豆浸种3 d后,茎豆充分吸水膨胀。将吸胀的茎豆放入沙土培养3 d后,茎豆开始逐渐发芽;沙土培养7 d后,几乎所有茎豆发芽完成,而发芽较早的茎豆产生许多根系,叶片即将展开(图1A)。通过统计分析,沙培7 d时茎豆的发芽率高达98.33%(图1B),表明豫油莎2号茎豆芽点的活力较高,适合用于油莎豆茎豆萌发过程中内源激素含量的变化分析。
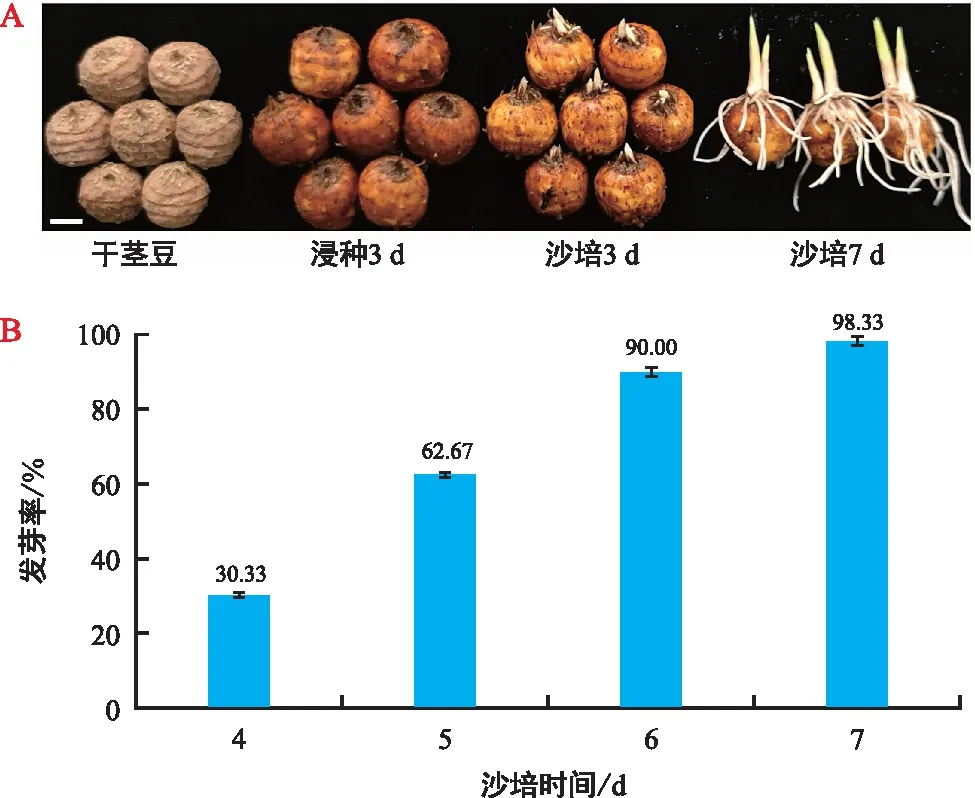
图1 油莎豆茎豆萌发情况
2.2 内源激素GAs和ABA含量变化分析
在植物中,最常见的有生物活性的GAs是GA1、GA3和GA4。油莎豆茎豆萌发过程中(干茎豆-浸种3 d茎豆-初发芽茎豆)内源激素GA1、GA3和GA4的含量均出现了明显变化,其中,GA1和GA4呈现逐渐上升,而GA3呈先上升后下降的变化趋势(图2)。在干茎豆中,GAs的含量均较低,GA1、GA3、GA4的含量分别为11.84 ng/g,3.87 ng/g,2.34 ng/g;在浸种3 d茎豆中,GAs的含量明显上升,尤其是GA3的含量急剧上升至564.31 ng/g(约上升245倍);在初发芽茎豆中,GA1的含量进一步小幅度上升,而GA4的含量大幅度上升,达到169.70 ng/g;相反,GA3的含量急剧下降(图2),表明GAs(尤其是GA3)的含量与油莎豆茎豆萌发呈密切正相关,而GA4可能在发芽后的生理变化中发挥着重要作用。相比之下,ABA的含量在休眠干茎豆中较高(364.59 ng/g),浸种3 d后急剧下降(11.72 ng/g),而在初发芽茎豆中又小幅度上升,即在茎豆萌发过程中呈先降后升的变化趋势(图2),与GA3恰好相反,表明ABA和GA3拮抗调控油莎豆茎豆的休眠和萌发进程。
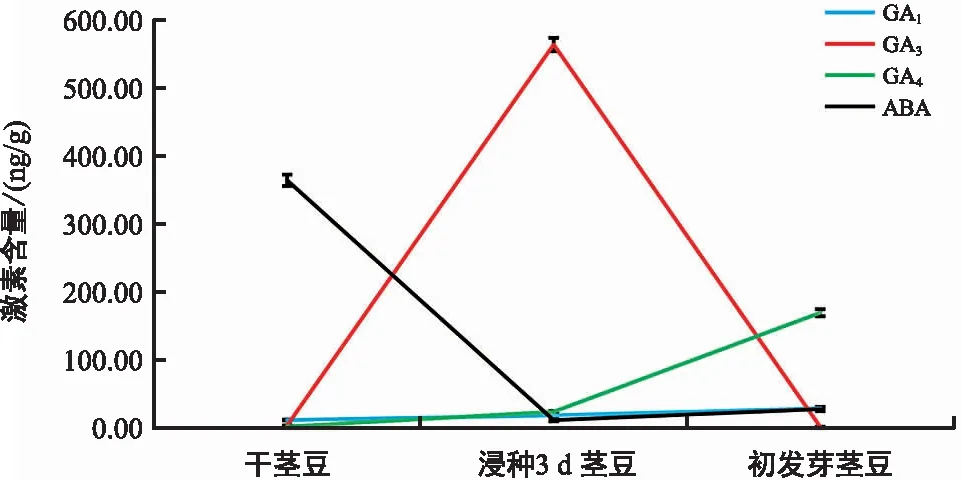
图2 油莎豆茎豆萌发过程中内源激素GAs和ABA含量的变化
2.3 内源激素IAA、ZR、SA和JA含量变化分析
IAA、ZR、SA和JA均是植物体内普遍存在的内源激素,参与多种生理过程调控。在油莎豆茎豆萌发过程中,IAA和JA的含量均呈先降后升的变化趋势(图3),与ABA的含量相似,在休眠的干茎豆中处于较高水平(分别为208.41 ng/g和332.40 ng/g),吸胀后急剧下降,茎豆解除休眠而开启萌发进程;相反,ZR的含量则呈先急剧上升而后下降的趋势(图3),与GA3的一致,在干茎豆吸胀后达高水平状态(218.04 ng/g),促进萌发进程;而SA的含量虽然呈逐渐下降的变化趋势,但整体变化幅度较小且整体水平较低(图3),可能不参与油莎豆茎豆萌发的调控。
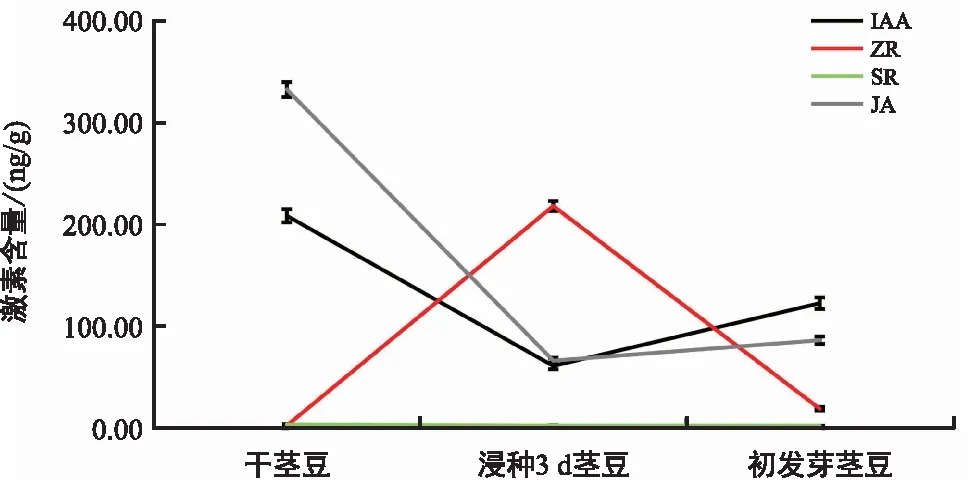
图3 油莎豆茎豆萌发过程中内源激素IAA、ZR、SA和JA含量的变化
2.4 外源激素处理对油莎豆茎豆萌发的影响
由上述分析可知,在油莎豆茎豆萌发过程中,从干茎豆到浸种3 d茎豆,GA3、ABA、IAA、ZR和JA的含量出现急剧变化。设置此5种激素浓度,GA3(564.31 ng/g)、ABA(364.59 ng/g)、IAA(208.41 ng/g)、ZR(218.04 ng/g)、JA(332.40 ng/g),对豫油莎2号茎豆进行外源激素处理,以检验其对茎豆萌发的影响。沙培4 d时,部分茎豆芽开始破土,ck处理条件下茎豆的发芽率为30.33%;相比之下,GA3和ZR处理条件下其发芽率增加,分别为41.33%和35.67%;而ABA、IAA和JA处理条件下其发芽率降低,分别为12.67%和16.67%(图4)。同样,沙培5 d时,与ck相比,GA3和ZR处理条件下发芽率增加而ABA、IAA和JA处理条件下发芽率降低(图4)。沙培6 d时,GA3、ZR处理条件下所有茎豆发芽完成,发芽率达100%,ck达92.33%,而ABA、IAA和JA处理条件下茎豆发芽率分别为79.33%和80.00%(图4)。由此表明,GA3和ZR能够加快油莎豆茎豆的萌发速度,具有促进作用;而ABA、IAA和JA则相反,具有抑制作用。
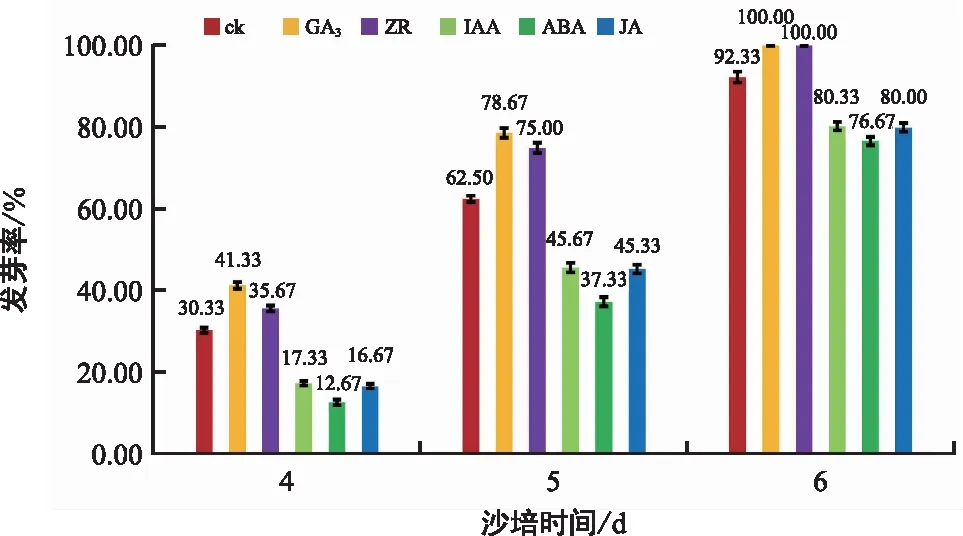
图4 外源激素处理下油莎豆茎豆发芽率的变化
3 结论与讨论
植物种子或块茎经过吸胀作用后,内源激素含量呈不同的变化趋势,协同调控种子或块茎的萌发与生长。大量研究表明,ABA和GAs是调控休眠与萌发的主导内源激素[5-8]。本研究发现,油莎豆干茎豆中ABA的含量较高,而GAs的含量较低;随着茎豆充分吸水,ABA的含量急剧下降,而GA3的含量急剧上升;随后,茎豆逐渐开始发芽,在初发芽茎豆中,ABA的含量出现小幅度上升,GA3的含量出现下降。可以看出,在油莎豆茎豆萌发过程中ABA和GA3出现了相反的变化趋势,而且ABA含量的下降和GA3含量的上升促进了茎豆萌发。同时,外源激素处理结果显示,GA3能够加快油莎豆茎豆的萌发速度,而ABA则恰好相反。因此,与众多研究一致,ABA和GA3以拮抗的方式分别抑制和促进油莎豆茎豆的萌发。另外,与GA3相比,GA1和GA4的含量同样在油莎豆茎豆萌发过程中出现上升的趋势,但GA1在干茎豆中的含量相对较高且在整个过程中呈现小幅度的变化,可能主要作用是维持茎豆的生命活力;而GA4在初发芽茎豆中的含量急剧上升,可能主要参与茎豆发芽后的生理变化调控。
本研究中,除了ABA和GAs之外,IAA、ZR、SA、JA含量也出现了变化。其中,IAA和JA含量的变化与ABA的一致,呈先降低后上升的趋势。有研究发现,高浓度的IAA对种子的萌发具有抑制作用[18-20],而JA通过干扰过氧化酶的β氧化过程来抑制种子萌发[21-22]。另外,Liu等[23]发现,IAA通过激活ABA信号途径促进拟南芥种子休眠而抑制萌发;Wang等[24]发现,ABA通过促进JA的生物合成来协同抑制水稻种子萌发。因而,可以看出IAA、JA和ABA一起协同抑制油莎豆茎豆的萌发。ZR是植物体内天然存在活性最强的细胞分裂素,能促进植物细胞分裂,保持细胞活力。Wang等[25]发现,细胞分裂素能够下调ABA信号途径中ABI5因子的基因表达,减弱ABA的抑制作用,从而使GA能够促进拟南芥种子的萌发。本研究发现,ZR含量的变化与GA3的一致,呈先上升后降低的趋势,表明ZR和GA3一起协同促进油莎豆茎豆的萌发。另外,SA是一种调节植物渗透能力的应激性激素,可以诱导植物抵抗生物和非生物胁迫[26-27]。大量研究发现,SA对盐胁迫条件下草本植物种子萌发具有一定促进作用[28]。本研究中,SA含量较小,并且在整个茎豆萌发过程中出现小幅度下降的趋势,表明SA对茎豆萌发过程影响较小。因而,在正常条件下,SA可能没有参与萌发调控;而在一些胁迫条件下,SA可能被大量诱导合成,进而促进植物种子或块茎的萌发。
综上所述,油莎豆茎豆的萌发主要是ABA、GA3、IAA、ZR、JA等多种激素共同调控的结果,其中IAA、JA和ABA可以被称为萌发抑制类激素,协同抑制茎豆萌发;而GA3和ZR可以被称为萌发促进类激素,协同促进茎豆萌发。两类激素之间的动态平衡,决定了茎豆的休眠与萌发,进一步深入探讨各种激素之间的具体协同途径,将有助于油莎豆茎豆休眠与萌发的调控机制解析。
