丝素蛋白-明胶-壳聚糖-羟基磷灰石多孔支架的制备及性能评估
2023-11-14谷明西王常成田丰德郝瑞胡
谷明西, 王常成, 田丰德, 郝瑞胡, 安 宁, 郭 林
(1.北京大学深圳医院 内科,深圳 518000; 2.大连理工大学 医学部,大连 116081; 3.大连大学附属中山医院 膝关节与骨肿瘤科,大连 116001)
关节软骨主要由嵌有软骨细胞的细胞外基质(Extracellular Matrix,ECM)组成,具有承载和缓冲作用,覆盖和保护骨骼免受数倍于身体质量的承重力的影响[1]。与大多数其他组织不同,软骨组织结构特殊,由于缺乏血管化和神经支配,软骨细胞少、增殖能力低,导致软骨损伤后的自我修复能力差,当损伤从软骨表层延伸到软骨下骨时,即发生全层软骨缺损(Full-Thickness Cartilage Defect,FTAC)[2]。组织工程(Tissue Engineering,TE)是一种结合了工程学和细胞生物学的跨学科方法,旨在恢复、改善和维持组织功能[3],已成为软骨组织再生和重建最常用的方法之一。种子细胞、支架材料及生长因子是制约软骨组织工程的三个关键性制约因素,其中作为组织形成模板的支架材料在TE中起着最重要的作用[4]。
丝素蛋白(Silk Fibroin,SF)是一种具有出色机械性能、生物降解性、生物相容性和生物可吸收性的天然蛋白质[5]。壳聚糖(Chitosan,CS)是唯一带正电荷的天然多糖,与ECM中发现的葡糖胺聚糖(Glycosaminoglycan,GAGs)相似,不仅能够与带负电的GAG发生静电相互作用,而且还能促进软骨特异性蛋白表达[6]。明胶(Gelatin,Gel)是胶原蛋白的水解产物,具有高度的亲水性和出色的生物相容性,这有助于支架中的营养输送和细胞黏附[7]。羟基磷灰石(Hydroxyapatite,Hap)是天然骨骼的矿物质成分,具有骨传导特性、骨诱导特性、骨结合能力和原位降解缓慢等优势,已成功应用于临床骨修复[8]。然而由单一成分制成的支架在水和生理条件下的稳定性差,因此,可以将两种或多种聚合物混合以获得新材料[9-10]。
本研究为了构建理想的组织工程支架,充分恢复关节软骨的原始成分、结构、力学和生物功能,以明胶、壳聚糖、丝素蛋白和羟基磷灰石为基础材料,通过真空冷冻干燥和化学交联开发一种能够满足骨软骨ECM和成骨成软骨双向分化要求的三维多孔支架,探索其用于修复软骨缺损的可行性。
1 方 法
1.1 材 料
蚕茧(西北养蚕工业基地);甲苯胺蓝染色液、透析袋(北京索莱宝科技有限公司);脱乙酰度≥95%的壳聚糖、明胶、溴化锂、N-羟基琥珀酰亚胺、碳酰二亚酸盐(上海麦克林生化科技有限公司);DMEM/F12培养基(海克隆Hyclone生物科技公司);澳洲胎牛血清(美国赛默飞公司Gibco胎牛血清);CCK-8细胞增殖试剂盒、活死细胞染色试剂盒(Abbkine亚科因生物技术有限公司);碳酸氢钠(国药集团药业有限公司),II型胶原酶(百普赛斯Bioshap生物科技公司)
1.2 主要实验溶液的配制
1.2.1 壳聚糖溶液
称取3 g壳聚糖(脱乙酰度≥95%)粉末溶解于100 mL 1%醋酸溶液中,磁力搅拌4 h直至完全溶解,然后过滤溶液以除去杂质。
1.2.2 明胶溶液
称取3 g生物明胶溶解于50 ℃ 100 mL超纯水中,水浴加热并持续搅拌至完全溶解。
1.2.3 丝素蛋白溶液
1) 脱胶:挑选优质干净的蚕茧,将切好的茧块加入沸腾的0.5% Na2CO3溶液中,煮沸60 min,然后用蒸馏水浸泡洗涤10 min,重复2~3次后烘干。2) 溶解:按照1︰6的比例将脱胶蚕丝在60 ℃条件下溶解于9.3 mol/L LiBr溶液中。3) 过滤离心:冷却至室温,使用不锈钢过滤网过滤去除较大颗粒杂质,以9 000 r/min速度离心10 min。4) 透析:将离心后的丝素蛋白溶液转移至截留相对分子质量12 000±2 000的透析袋中,超纯水持续透析3 d,直至透析袋内水位不再变化。5) 浓缩:将含丝素蛋白溶液的透析袋放入质量分数10%的聚乙二醇溶液中进行浓缩12 h,保存于4 ℃冰箱中备用。
1.3 SF-CS-Gel-nHap支架的制备
将质量分数为3%的SF溶液、CS溶液、Gel溶液分别以1︰1︰1体积比混合均匀,调整Hap的量,根据Hap在混合溶液质量分数的不同,SF-CS-Gel-nHap复合溶液分为5组(Hap-1%、Hap-2%、Hap-3%、Hap-4%、Hap-5%),磁力搅拌60 min混合均匀,然后以每孔1 mL转移至48孔板内。在-20 ℃预冻过夜,放入-80 ℃冰箱中继续冷冻24 h,然后真空冷冻干燥48 h,经第一次塑形得到规则、圆柱状的冷冻干燥支架。冷冻干燥后每孔中加入2 mL交联剂,交联剂各成分分别为碳化二亚胺盐50 mmol/L和N-羟基琥珀酰亚胺25 mmol/L。在4 ℃条件下充分交联过夜,然后用75%乙醇和去离子水清洗数次,加入75%乙醇溶液浸泡24 h,1 mol/L NaOH溶液浸泡中和6 h,去离子水洗净。再次放于-20 ℃冷冻过夜,-80 ℃冷冻24 h后行真空干燥48 h,进行第二次塑形。干燥完成后,将支架收集密封,置于4 ℃冰箱,保存备用。
1.4 物理性能表征
1.4.1 大体外观
将不同类型的3D支架从48孔板中取出进行拍照观察。
1.4.2 扫描电镜观察
使用手术刀片将每个支架样品切成合适厚度,常规涂覆金膜后,通过Regulus 8100扫描电子显微镜(日本日立公司)对支架的内部结构和形貌进行分析;采用ImageJ图像可视化软件对样品进行孔径分析,平均孔径是通过测量在样品中心部分至少随机选择的20个孔的最大和最小直径来获得。
1.4.3 X射线衍射(XRD)分析
将支架研磨成粉末,使用D8 advance全自动X射线衍射仪(美国布鲁克海文仪器公司)对粉末样品进行表征,X射线衍射仪在35 kV和10 mA的条件下用Cukα辐射(λ=1.542)记录样品的衍射图,扫描2θ角范围为5°~60°,扫描速率为5°/min。
1.4.4 溶胀率
用常规重量法测定各组支架的吸水溶胀率。将冷冻干燥后的支架后称重记为M1,然后浸泡于PBS缓冲液(pH 7.4)中24 h后,取出样品,用纱布吸去支架表面多余的水分,称重记为M2。每组实验进行3次。吸水溶胀率S计算如下式所示:
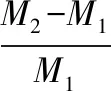
(1)
1.4.5 孔隙率
采用比重瓶法测定各组复合支架的孔隙率。用手术刀片将各支架切成统一大小的样品,以无水乙醇为液体介质,称量充满无水乙醇的比重瓶,质量记为M1,将干重M0的支架浸入无水乙醇中,真空脱泡30 min,直至支架完全被无水乙醇所饱和,加入乙醇直至比重瓶充满相同刻度,再次称重,记为M2。取出充盈乙醇的样品,称量剩余的液体与比重瓶质量,记为M3。支架孔隙率ε计算如下式所示:
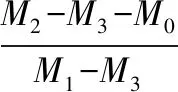
(2)
1.4.6 生物降解率
支架的体外酶降解实验根据支架在含酶的磷酸盐缓冲液中孵育后的残留量百分比来评价支架的降解行为。真空干燥后的支架质量记录为M1,然后用含10 mg/mL溶菌酶的PBS缓冲液(pH 7.4)37 ℃浸泡4周。在规定的时间间隔(7、14、21、28 d)取出样品,真空干燥24 h,称重记为Mt。生物降解率δ计算如下式所示:
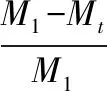
(3)
1.4.7 机械性能
使用ETM系列通用万能试验机(深圳万测试验设备有限公司)进行压缩机械测试。在每次测试之前测量样品大小,支架样品为直径约10 mm、高15~18 mm的圆柱体,水平头速度设定为2 mm/min,当压缩位移达到10 mm时停止加压。然后绘制应力-应变曲线以评估支架的机械性,应力-应变曲线初始线性阶段的斜率为弹性模量,每组3个平行样。
1.5 生物性能表征
1.5.1 软骨细胞的提取和鉴定
本研究经大连大学附属中山医院伦理委员会批准(伦理审查批件2021073-1),并获得所有研究对象的知情同意。纳入2021年11月因骨关节炎行全膝关节置换术的患者1例(年龄52岁,职业木工)。收集膝关节置换术中切除的股骨髁软骨,无菌条件下转移至在超净工作台,使用含无菌PBS缓冲液连续漂洗2~3次,分离出光滑透亮的透明软骨组织薄片,切成2 mm大小的组织块,之后使用5倍体积的0.2% Ⅱ型胶原酶消化过夜(37 ℃和5% CO2恒温培养箱)。消化结束后使用100 μm细胞滤器过滤,然后终止消化,将获得的细胞悬液在室温下以1 500 r/min的速度离心5 min,收集细胞沉淀,重悬后接种到T 25 cm2培养瓶,在37 ℃和5% CO2的细胞孵箱中培养,24 h后更换一次培养液以去除未贴壁的细胞。此后每3 d换液一次,建立原代培养,当贴壁细胞达到90%汇合时,用无菌PBS缓冲液洗涤后使用胰蛋白酶(含EDTA)进行消化处理并将细胞以1︰2的传代比例重新接种以进行传代培养,直到细胞达到第2代,使用甲苯胺蓝染色对软骨细胞进行鉴定。
1.5.2 支架接种前的处理
将支架样品切成直径10 mm、厚度1~2 mm的薄片,在紫外光下用75%酒精消毒过夜,然后用无菌PBS缓冲液彻底冲洗3次。在细胞培养之前,通过在37 ℃的培养箱中浸入DMEM中2 h将支架预润湿。
1.5.3 黏附率
取传代培养至第2代的软骨细胞悬液,将含有105个/mL细胞(A0)的细胞悬液100 μL接种在预先润湿的支架上,然后添加培养基至300 μL,并在接种2、4、6 h后测量黏附率。从孔中取出支架,用细胞计数板(A1)计数细胞数,去除所有培养基溶液后,消化并计算黏附在孔壁上的细胞(A2)。细胞黏附率θ计算如下式所示:
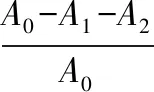
(4)
每组进行3次实验,得到平均黏附率。
1.5.4 增殖率
使用CCK-8法检测支架上软骨细胞的增殖,将软骨细胞接种在支架上(每个支架104个细胞),48孔板每孔添加培养基至300 μL。每3天更换一次培养基,经过1、4、7、10 d培养后,30 μL CCK-8的反应溶液加入到每个孔中,并在37 ℃温育4 h。然后将100 μL含有CCK-8反应液的培养基转移到96孔细胞培养板中,使用Biotek 800TS酶标仪(美国伯腾仪器有限公司)在450 nm处读取吸光度,绘制生长曲线,所有实验一式三份进行。
1.5.5 活死细胞染色
细胞接种3 d后使用Live/Dead试剂盒进行染色,观察细胞在支架样品上的分布。该试剂盒分别用碘化丙啶和Calcein AM对死细胞、活细胞进行染色,并在细胞培养箱中孵育30 min后,使用TXM-500C荧光显微镜(上海天省光学仪器有限公司)观察。
1.6 统计分析
多组样本间的比较使用SPSS 20.0软件进行ANOVA单因素方差分析,然后进行Tukey’s检验,以确定组间测量数据的差异。独立样本数据的比较使用t检验,重复测量数据使用球形检验,认为p<0.05具有统计学意义。置信度记号标为:*表示p<0.05,** 表示p<0.01,*** 表示p<0.001)。
2 结果和分析
2.1 物理性能
2.1.1 大体外观
5组SF-CS-Gel-nHap多孔支架均为直径10 mm左右的白色圆柱体,随着支架内Hap质量分数的增加,支架底部可见少量沉积的羟基磷灰石,质量分数越高沉积越多,如图1所示。

图1 SF-CS-Gel-nHap多孔支架大体外观
2.1.2 扫描电镜观察
各组支架扫描电镜图像如图2所示。由图2可见,Hap-1%支架、Hap-2%支架、Hap-3%支架、Hap-4%支架具有多孔结构,Hap-1%支架的平均孔径最大,为(225.14±53.63) μm;Hap-2%支架、Hap-3%支架、Hap-4%支架的孔径分别为(212.89±62.22) μm、(171.30±31.87) μm、(169.73±26.19) μm;Hap-5%支架的平均孔径最小,为(136.11±20.46) μm。当支架内Hap的质量分数在1%~4%变化时,支架能保持高度多孔的网络结构和良好的孔间联通性,随着Hap在支架中质量分数的增加,多孔材料的孔径有所减小,支架的联通性下降;当Hap的质量分数达到5%及以上时,可以明显看到过量的羟基磷灰石沉积在多孔支架的孔壁上,逐渐堵塞支架的孔道。合适的微观结构和孔径,能够提供迁移细胞、运输营养物质和代谢物、信号分子和细胞废物[11-12]。

图2 SF-CS-Gel-nHap多孔支架电镜图像
2.1.3 XRD晶型分析
通过XRD对SF-CS-Gel-nHap多孔支架的晶型结构进行了分析,SF-CS-Gel-nHap支架的XRD图谱如图3所示。由图3可见,2θ在25.7°、32.2°、33.0°、34.3°、40.3°、46.6°和49.6°附近能观察到羟基磷灰石的特征峰。对比低质量分数和高质量分数Hap的复合支架材料的XRD图谱,还可以观察到羟基磷灰石少量水解和新的磷酸钙化合物生成。这是因为冰乙酸溶解壳聚糖为溶液提供了酸性环境,微酸条件下部分羟基磷灰石发生水解,从而形成新的磷酸钙化合物(2θ=28.4°和29.1°),有研究指出磷酸钙化合物的存在不会干扰支架的生物活性或生物相容性[10,13]。
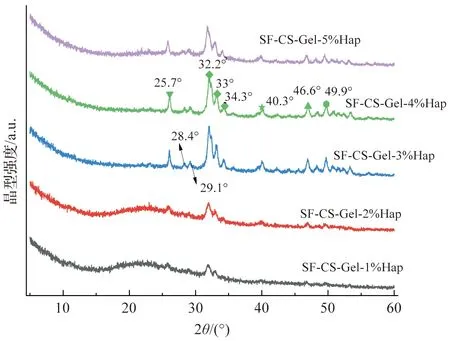
图3 SF-CS-Gel-nHap支架XRD图谱
2.1.4 元素分析
电镜扫描和XRD晶型分析证实,在多孔复合材料表面沉积层中存在结晶簇聚集体,如图2(f)所示。为了确保添加的Hap颗粒确实存在于复合材料中,本研究对SF-CS-Gel-nHap多孔支架进行了元素分析。X射线能谱分析仪(Energy Dispersive Analysis of X-rays,EDAX)元素检测的结果表明,结晶簇的主要元素是Ca和P,如图4所示。检测到的结晶簇聚集体内的Ca/P比值约为1.74,其值与化学计量羟基磷灰石中的Ca/P比值1.67接近[14-15],据文献报道稳定的Hap相对应的Ca/P比值在1.3~1.8[16],表明Hap在支架基质内能够稳定存在。
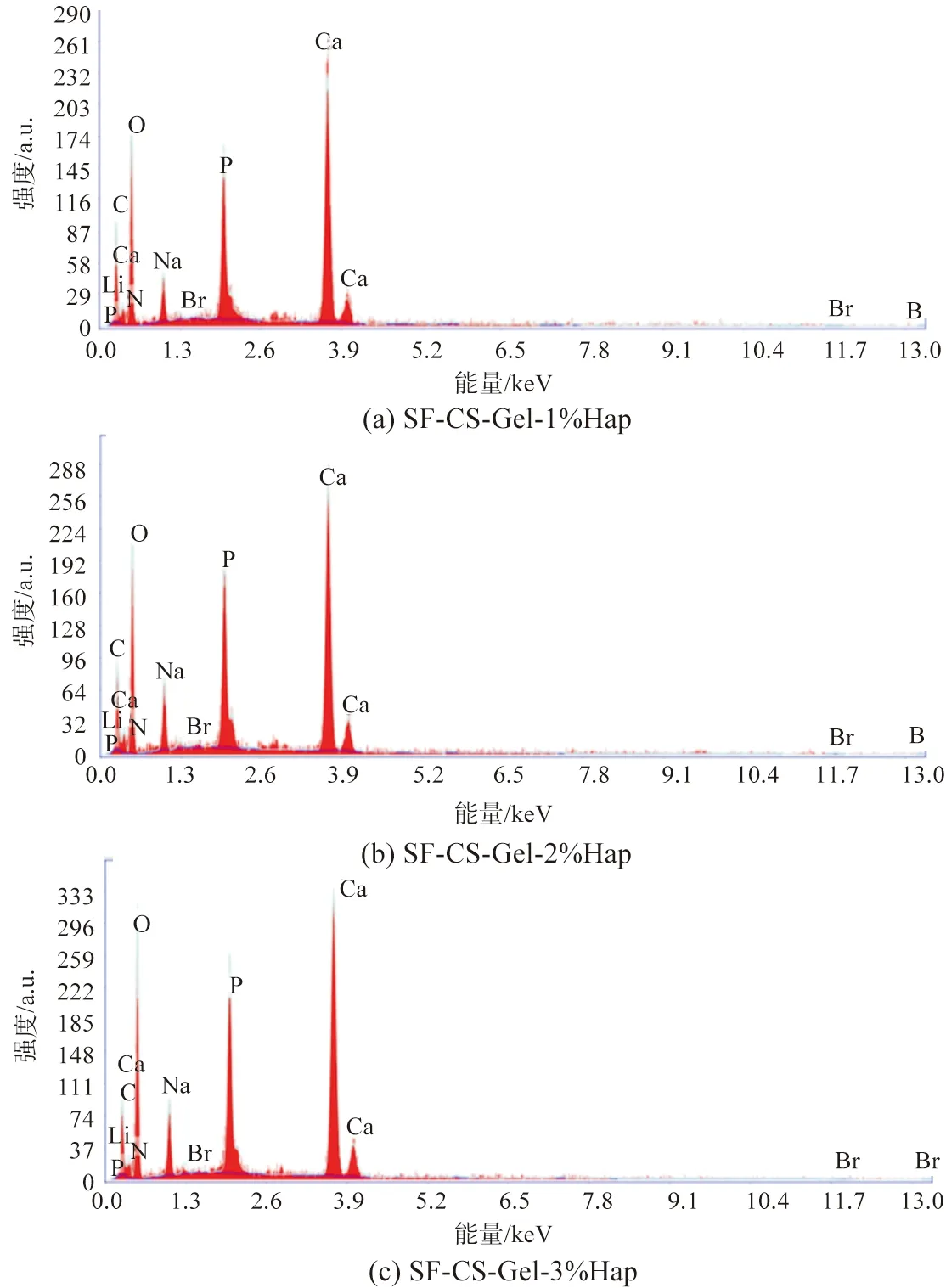
图4 SF-CS-Gel-nHap多孔支架元素分析
2.1.5 吸水溶胀率
支架的保水性能对组织工程有重要意义,吸水溶胀率影响细胞的迁移、增殖和分化,也影响营养物质的运输和机械性能[17]。SF-CS-Gel-nHap多孔支架的吸水溶胀率如图5所示,5组支架吸水溶胀率之间的差异有统计学意义(p<0.05)。Hap-1%支架和Hap-2%支架的吸水溶胀率最高,分别为1 466%±179%和1 286%±114%;Hap-5%支架的吸水膨胀率最低,为771%±89%。随着SF-CS-Gel-nHap复合支架内羟基磷灰石质量分数的增加,支架的吸水溶胀率明显降低,即使是Hap-5%支架的平均溶胀率依然大于700%。
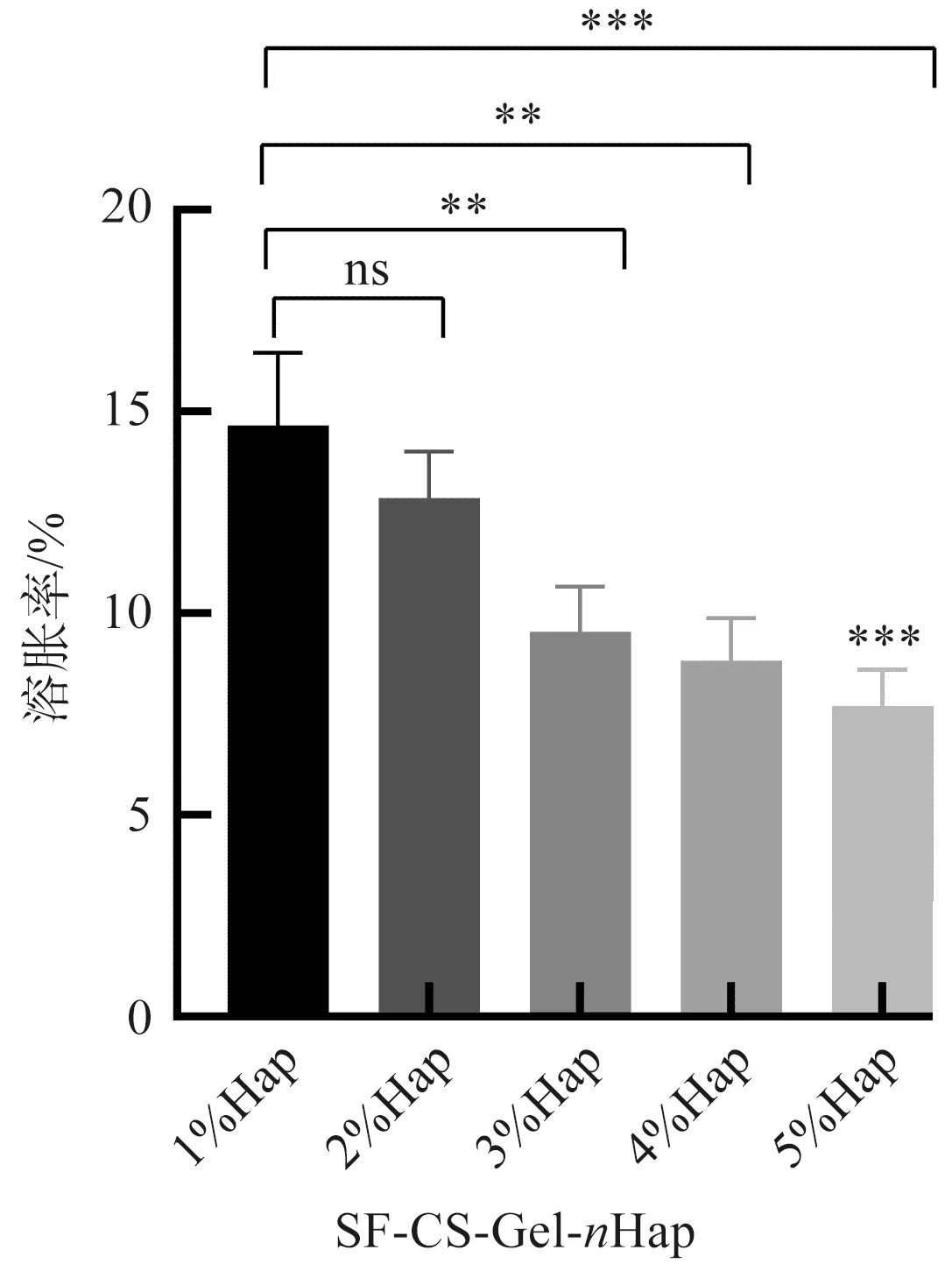
图5 SF-CS-Gel-nHap多孔支架溶胀率比较
2.1.6 孔隙率
多孔复合支架的营养运输能力除了受材料本身亲水性能的影响外,还与支架的孔隙率、孔径大小及孔道联通性密切相关[17-18]。因此孔隙率也是组织工程支架的重要特征之一。SF-CS-Gel-nHap复合支架的孔隙率如图6所示,5组支架孔隙率之间的差异有统计学意义(p<0.05)。SF-CS-Gel-1%Hap支架的孔隙率最高,约为87.25%±2.28%。Hap-2%的支架和Hap-3%的支架具有相似的孔隙率,分别为76.52%±2.31%和72.27%±2.28%。Hap-5%支架的孔隙率最低,只有49.41%±5.92%,多孔支架的孔隙率随着支架内部Hap质量分数的增加而明显降低。分析认为,这是随着复合支架内羟基磷灰石质量分数的增加,过量的羟磷灰石会沉积在多孔支架的孔壁内,堵塞孔径,使多孔支架结构通道的联通性降低,从而导致支架的孔隙率下降。孔隙率大于70%的多孔支架被认为是细胞生存的良好空间和维持细胞生长的营养运输通道[18],高度多孔的结构可以提供足够的营养和气体交换,以及足够的空间供细胞增殖和附着[19-20]。掺杂低质量分数Hap的SF-CS-Gel-nHap的多孔支架,不仅可以提供高度多孔的结构,为细胞的黏附、迁移和生长提供了很大的表面积,还能兼顾保持Hap的生物活性和促成骨作用,也许更适合骨软骨缺损的修复。
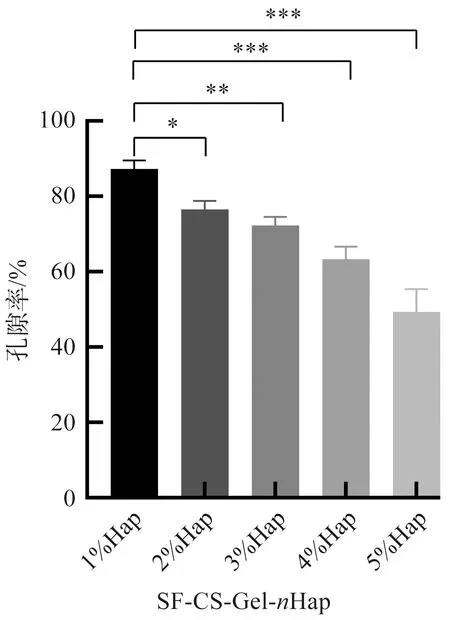
图6 SF-CS-Gel-nHap多孔支架孔隙率比较
2.1.7 生物降解率
本研究使用溶菌酶对SF-CS-Gel-nHap多孔支架进行了体外降解实验,如图7所示,5组支架生物降解率之间的差异有统计学意义(p<0.05)。Hap-1%支架降解率最高41.8%±2.47%,Hap-5%支架的降解率最低24.89%±1.16%,支架生物降解率随着羟基磷灰石质量分数的增加而降低。这一结果与软骨下骨层多孔支架孔隙率结果一致,这可能是因为低质量分数Hap的复合支架具有较高的孔隙率,多孔结构提供了较大的比表面积,导致溶菌酶更容易渗透进支架内部与壳聚糖、明胶等有机材料发生反应;另一个可能的原因是羟基磷灰石是天然骨骼的矿物质成分,本身具有优良的结合能力和原位降解缓慢等优势[14-15],因此适当添加Hap可以改善多孔复合支架降解速度快的缺点,从而使多孔支架的生物降解速度与组织的再生重建相匹配。
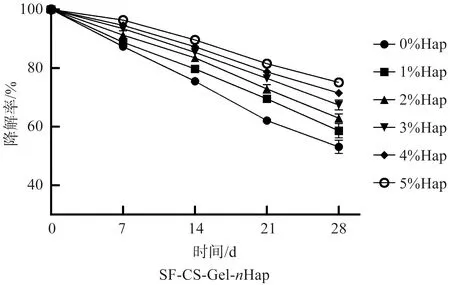
图7 SF-CS-Gel-nHap多孔支架的生物降解率(p<0.05)
2.1.8 机械性能
机械强度也是评估软骨修复生物材料性能的最关键因素之一,SF-CS-Gel-nHap支架的应力-应变曲线如图8所示。这次实验通过比较多孔支架的弹性模量(线性应力-应变部分的斜率)和20%形变量的抗压强度评价多孔支架的力学性能,SF-CS-Gel-1%Hap支架的抗压强度最低(14.44 kPa),SF-CS-Gel-5%Hap支架的抗压强度最高(40.28 kPa),SF-CS-Gel-nHap多孔支架抗压强度随Hap的质量分数增加而增大,高质量分数的Hap的有助于提高支架的抗压强度。然而SF-CS-Gel-nHap支架的弹性模量变化与抗压强度变化并不完全一致,此次实验结果显示SF-CS-Gel-1%Hap支架的弹性模量最低,Hap质量分数在2%~5%的多孔支架拥有相似的弹性模量,并不随Hap质量分数的增加而发生明显改变。支架的机械性能影响细胞的增殖和分化,在较硬结构上生长的细胞比在较软基质上的细胞增殖更快,迁移更慢[20]。因此用于软骨修复的支架需要足够坚固、有弹性和坚韧,以容纳种子细胞或从宿主组织迁移的细胞,同时具有足够的容量以抵抗反复的动态冲击而不会倒塌或压碎[21-22]。

图8 SF-CS-Gel-nHap多孔支架的应力-应变曲线
2.2 生物性能
理想组织工程支架需要具备多种能力,如高度水合的三维结构和高含水量、合适的孔径和孔隙率、材料交换能力、良好的生物降解性和优越的机械性能,并能提供合适的微环境和高效的生物相容性和高强度[22]。综合本研究的物理性能检测结果,SF-CS-Gel-2%Hap支架更符合全层软骨缺损修复的要求。该支架具有(212.89±62.22) μm大小的孔径结构、76.52%±2.31%的孔隙率、良好的吸水溶胀率1 286%±114%及37.09%±1.41%生物降解速率与良好的机械性能。因此将SF-CS-Gel-2%Hap支架与骨关节炎患者的软骨细胞共培养,以进一步检测支架材料的生物性能。
2.2.1 软骨细胞的培养和鉴定
原代软骨细胞形态大多为梭形和多角形,细胞在贴壁2 d后开始较好地附着在细胞培养瓶表面并开始增殖,并在7~9 d后达到90%的汇合状态。传代细胞表现出相似的形态,绝大数细胞表现为多角形,表面多树突状突起,随着培养时间增加,树突状突起伸展为细长触丝,如图9所示。使用甲苯胺蓝对提取的原代细胞进行染色,细胞核被染成紫蓝色,胞核偏向一侧,未见肥大样细胞,符合软骨细胞的特征,如图9(c)所示。
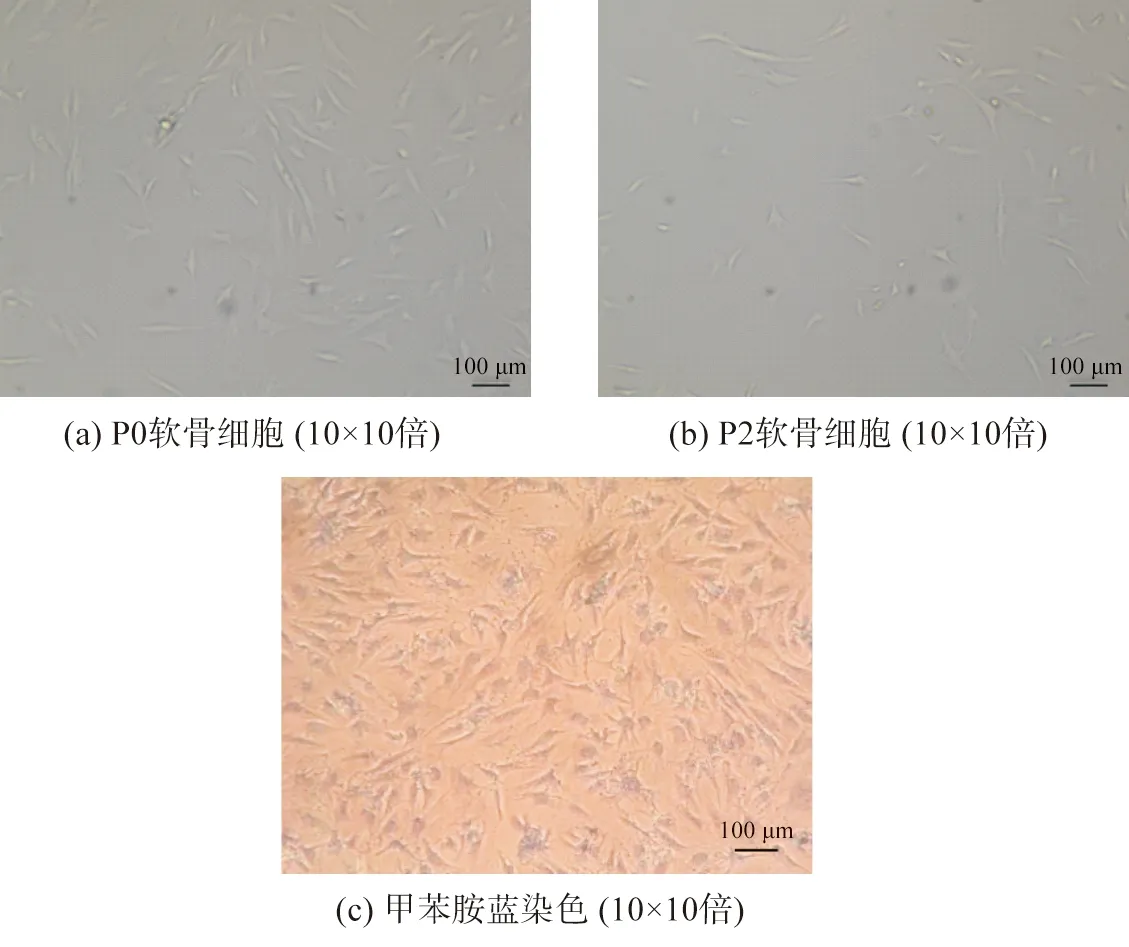
图9 软骨细胞的培养及鉴定
2.2.2 黏附率
理想的生物支架可以改善细胞黏附、细胞分化和与周围天然组织的整合[10]。本研究比较了SF-CS-Gel-2%Hap支架在接种细胞2、4、6 h后的黏附率,如图10所示。由图10可见,软骨细胞能与支架良好黏附,细胞种板后6 h内可成功黏附于支架网状纤维上,表明SF-CS-Gel-2%Hap支架很好地保持材料优良的生物活性。

图10 细胞黏附率
2.2.3 增殖率
本研究使用CCK-8法检测软骨细胞在SF-CS-Gel-2%Hap支架的增殖表达,如图11所示。由图11可见,单纯软骨细胞组增殖曲线呈S形,而仿生支架共培养组软骨细胞在连续共培养10 d后,生长增殖曲线仍然呈明显上升趋势,保持有良好的细胞活力,未观察到明显的接触抑制效应。这主要是因为软骨细胞在普通培养皿表面贴壁生长,细胞增殖存在明显的接触抑制效应,但是三维立体培养可以避免这种效应。结果表明,本研究制备的SF-CS-Gel-2%Hap多孔支架具有良好细胞相容性,能够为种子细胞提供良好的生长微环境,三维立体培养比二维平面扩展生长具有更大的增殖效率。
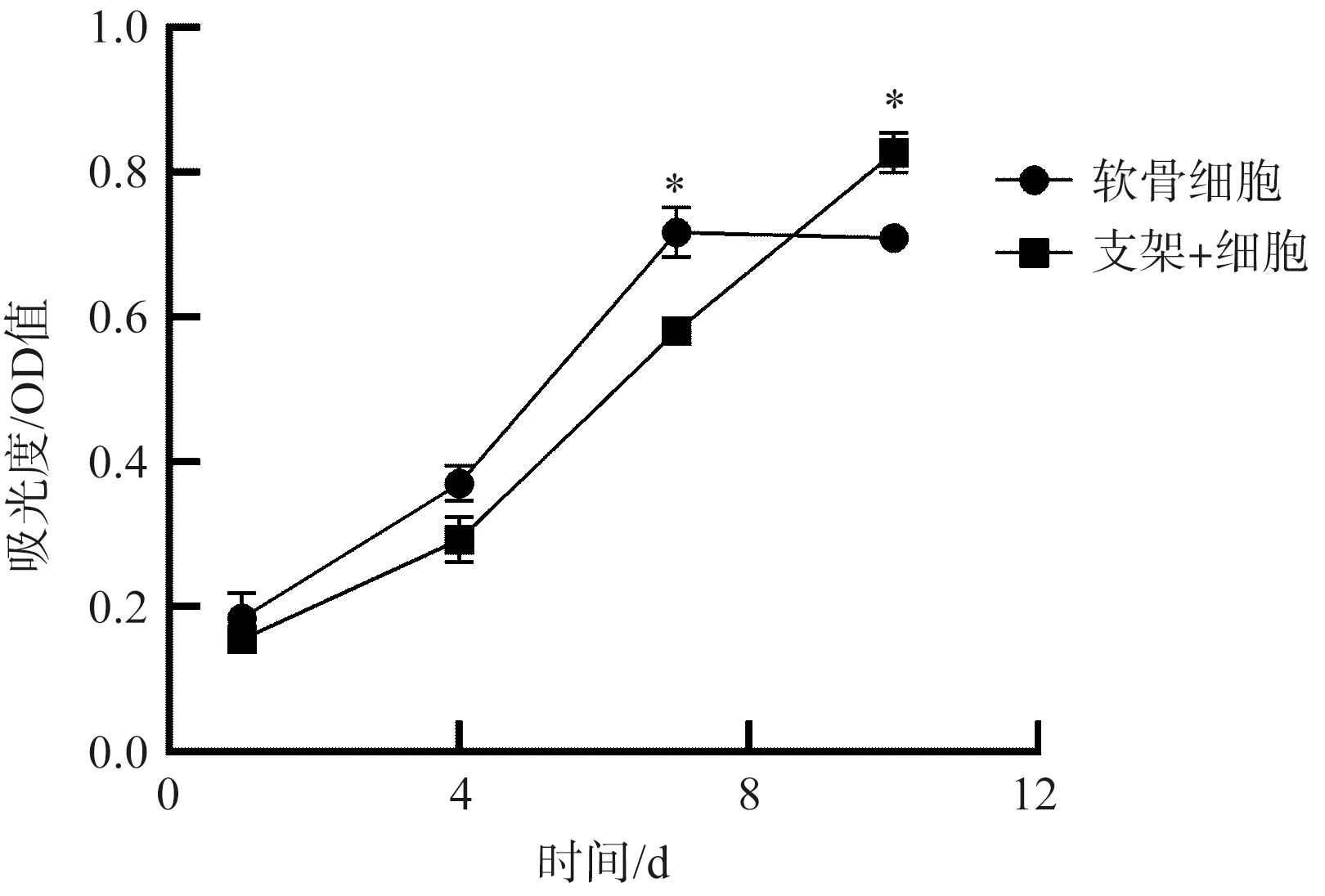
图11 细胞增殖率
2.2.4 活死染色
为了直观地观察细胞在支架上的状态和活性,共培养一段时间后使用Live/Dead试剂盒进行染色,然后通过荧光显微镜观察(10×10倍),如图12所示,绿色代表活细胞,而红色代表死细胞。由图12可见,SF-CS-Gel支架上的大部分细胞呈现绿色荧光,少见死细胞,支架上细胞表现出高存活率和低细胞毒性,表明本研究所制备的多孔支架具有良好的生物相容性。
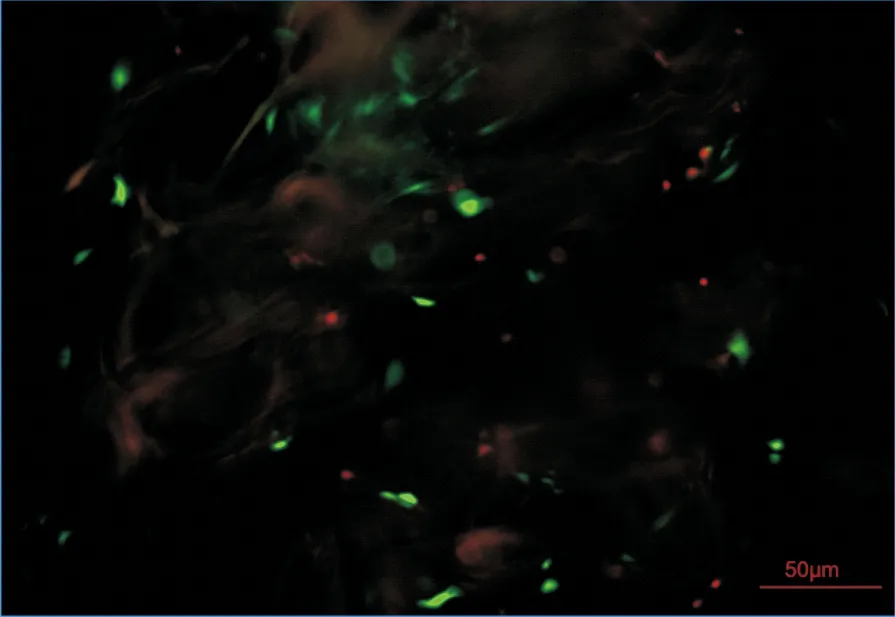
图12 活/死细胞染色
3 结 论
基于明胶、壳聚糖、丝素蛋白和纳米羟基磷灰石制备的SF-CS-Gel-nHap三维多孔复合支架不仅可以模拟天然骨软骨的ECM,而且具有良好的生物相容性,能够为营养物质的转运和细胞附着、增殖和立体生长提供良好的网状骨架,从而为全层软骨缺损的治疗提供新的选择。

《丝绸》官网下载

中国知网下载
