鸦胆子油乳对大鼠体内紫杉醇药代动力学的影响*
2023-11-14雷珍珍薛春苗朱宝琛曹俊岭
雷珍珍,薛春苗,梁 艳,朱宝琛,曹俊岭,3△
(1.北京中医药大学中药学院,北京 100029; 2.北京中医药大学东直门医院,北京 100700; 3.北京中医药大学东直门医院洛阳医院,河南 洛阳 471934)
紫杉醇是一种广谱抗肿瘤药,主要作用机制为通过使肿瘤细胞微管蛋白和组成微管的微管蛋白二聚体失去动态平衡,诱导与促进微管蛋白聚合、微管装配、防止解聚,进而使细胞周期阻断至G2/M 期,导致细胞停止分裂并死亡[1-4]。目前,紫杉醇已被广泛应用于卵巢癌、非小细胞肺癌、乳腺癌等实体瘤的化学治疗(简称化疗)[5-7],其在体内的主要代谢酶包括P - 糖蛋白(P-gp)、细胞色素P450酶(CYP450)中的CYP3A4和CPY2C8[8]。鸦胆子油乳是由苦木科植物鸦胆子的干燥成熟果实提取的有效抗肿瘤成分[9],为细胞周期非特异性抗肿瘤药物,对G0期、G1期、S 期、G2期、M 期的肿瘤细胞均有杀伤和抑制作用,能明显抑制肿瘤细胞DNA 和RNA 及蛋白质的合成,干扰肽键形成[10]。近年来,抗肿瘤中药注射剂在肿瘤治疗中的优势明显[11],临床常将中药注射剂作为辅助化疗的药物应用于多种肿瘤的治疗,可增强疗效,减少化疗引起的不良反应[12]。临床常联用鸦胆子油乳和紫杉醇治疗非小细胞肺癌、直肠癌、食管癌、恶性胸腔积液等,可提高疗效,提升患者的生活质量,减轻不良反应[13-19]。同时,鸦胆子油乳对肿瘤多药耐药有一定逆转作用[20]。治疗剂量的鸦胆子油乳对CYP3A4 有较强的抑制作用,半数抑制浓度(IC50)为0.78%[21],提示鸦胆子油乳与紫杉醇可能存在药物相互作用,但两药产生相互作用的机制尚不明确。本研究中探讨了鸦胆子油乳对大鼠体内紫杉醇药代动力学的影响,为临床的两药联用提供依据。现报道如下。
1 仪器、试药与动物
仪器:UPLC I- Class 型超高效液相色谱仪,XEVO TQS - Micro 型质谱仪,均购自美国Waters 公司;900 SERIES 型超低温冰箱(美国Thermo 公司);Sepatech biofuge 28RS型离心机(德国Heraeus公司);AL204型电子天平(梅特勒-托利多仪器<上海>有限公司,精度为万分之一)。
试药:鸦胆子油乳注射液(沈阳药大雷允上药业有限责任公司,批号为120120811,规格为每支10 mL);紫杉醇注射液(北京协和药厂有限公司,批号为191202,规格为每支5 mL∶30 mg);紫杉醇标准品(上海源叶生物科技有限公司,货号为B21695,含量不低于98%);盐酸普萘洛尔(内标,上海贝万塔生物科技有限公司,批号为BCP-100783,纯度不低于99%)。
动物:SPF 级雄性SD 大鼠20 只,7 周龄,体质量(210 ± 10)g,由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2016—0006。置昼夜光照规律条件下,自由进食进水,适应性喂养7 d,饲养温度为20.4~25.4 ℃,相对湿度为50%~70%。本研究方案经北京中医药大学东直门医院实验动物福利与伦理委员会审批,伦理审批号为SYXK(京)2020—0013。
2 方法与结果
2.1 分组与给药
大鼠适应性喂养7 d 后,取16 只,随机分为紫杉醇联用鸦胆子油乳组(PTX + BJOE 组)和紫杉醇组(PTX 组),各8 只。PTX+BJOE 组大鼠腹腔注射鸦胆子油乳注射液2.7 mL/kg,PTX 组大鼠腹腔注射等量生理盐水,连续5 d,每天1 次;最后1 d 给药30 min 后,两组大鼠均腹腔注射紫杉醇注射液3.5 mL/ kg。给药后0,0.083,0.5,1,2,4,8,24,48 h,经大鼠眼眶静脉采血0.2 mL,置肝素抗凝离心管中,离心(转速为3 000 r/min)10 min,分离血浆,- 80 ℃冻存,备用。其余4 只大鼠经腹主动脉采血,制备空白血浆,-80 ℃冻存,备用。
2.2 血浆样品处理
常温解冻血浆样品,取100 μL 置1.5 mL EP 管中,加300 μL甲醇,振荡10 min,离心(转速为3 000 r/min)10 min,取上层血浆,分装冻存,备用。
2.3 超高效液相色谱-质谱法测定大鼠血浆中紫杉醇含量
2.3.1 色谱条件
色谱柱:Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相:A 为1 mmol / L 乙酸铵- 0.04%乙酸水溶液,B 为乙腈- 异丙醇(1∶1,V/V),梯度洗脱(程序见表1);流速:0.26 mL / min;柱温:40 ℃;进样量:5 μL。

表1 流动相梯度洗脱程序(%)Tab.1 Gradient elution program of the mobile phase(%)
2.3.2 质谱条件
离子源:电喷雾电离(ESI);离子源温度:500 ℃;检测模式:正离子、多重反应模式;毛细管电压:3.0 kV;离子源电压:10 V;离子源温度:150 ℃;雾化温度:500 ℃;雾化氮气流量:1 000 L/h。
2.3.3 溶液制备
紫杉醇标准溶液:取紫杉醇标准品5 mg,精密称定,加1 mL 甲醇使溶解,置50 mL 容量瓶中,加甲醇定容,即得质量浓度为100 μg/ mL 的紫杉醇标准品贮备液。取标准品贮备液,加甲醇稀释为质量浓度分别为0.5,1,2,5,10,20,50,100,200,500,2 000 ng/mL 的系列紫杉醇标准溶液。
内标工作液:取盐酸普萘洛尔10 mg,精密称定,置10 mL容量瓶中,加甲醇定容,即得质量浓度为1 000 μg/mL的内标贮备液。取内标贮备液,加甲醇多次稀释并定容至100 mL,即得,质量浓度为0.005 μg/mL。
紫杉醇标准样品溶液:取空白血浆样品,室温解冻,按2.2项下方法处理,加入系列紫杉醇标准溶液,即得。
质控样品溶液:取空白血浆样品,室温解冻,按2.2 项下方法处理,加入质量浓度分别为5,50,500 ng/mL的紫杉醇标准溶液,即得低、中、高质量浓度质控样品溶液,室温放置。另取1份于-80 ℃冻存,备用。
内标样品溶液:取空白血浆样品,室温解冻,按2.2 项下方法处理,精密吸取50 μL,转移至2 mL 离心管中,加内标工作液50 μL和甲醇200 μL,振荡10 min,离心(转速为3 000 r / min)10 min,滤过,取上清液,即得。
2.3.4 方法学考察
专属性试验:取空白血浆样品和PTX 组大鼠血浆样品,室温解冻,分别加紫杉醇标准溶液。取空白血浆、空白血浆+ 紫杉醇标准溶液、PTX 组大鼠血浆+ 紫杉醇标准溶液,按上述色谱与质谱条件进样测定,考察紫杉醇出峰处是否有杂质干扰,以及样品与血浆中内源性杂质是否完全分离。结果紫杉醇的保留时间为3.24 min,血浆中内源性杂质无干扰,分离度大于1.5。色谱图见图1。
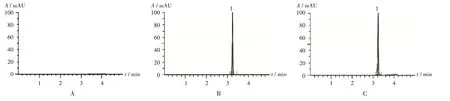
1.紫杉醇A.空白血浆 B.空白血浆+紫杉醇标准溶液 C.PTX组大鼠血浆+紫杉醇标准溶液图1 专属性试验超高效液相色谱图1.PaclitaxelA.Blank plasma B.Blank plasma + paclitaxel standard solution C.Rats' plasma in the PTX group + paclitaxel standard solutionFig.1 UPLC chromatogram of the specificity test
线性关系考察:精密吸取内标样品溶液和紫杉醇标准样品溶液各适量,按上述色谱与质谱条件进样测定,以紫杉醇和内标峰面积的比值(Y)为纵坐标、紫杉醇质量浓度(C,ng / mL)为横坐标进行加权线性回归分析,权重为W=1/C2,回归方程为Y=3 478X+10 330(R2=0.999 3,n=11)。结果表明,紫杉醇的质量浓度在0.5~2 000 ng/mL 范围内与紫杉醇和内标峰面积的比值线性关系良好。定量下限为0.5 ng/mL。
精密度试验:取低、中、高质量浓度质控样品溶液,按上述色谱与质谱条件于同1 d 内平行测定5 次,按标准曲线计算血浆中紫杉醇的质量浓度。结果见表2,表明仪器精密度良好。
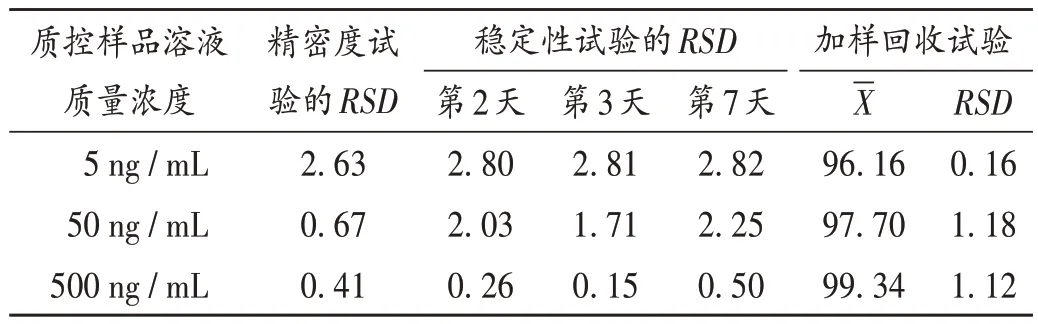
表2 精密度、稳定性、加样回收试验结果(%,n=5)Tab.2 Results of the precision,stability,recovery tests(%,n = 5)
稳定性试验:取- 80 ℃冻存低、中、高质量浓度质控样品溶液,分别于第2,3,7天室温解冻,按上述色谱与质谱条件于同1 d内平行测定5次,按标准曲线计算血浆中紫杉醇的质量浓度。结果见表2,表明样品在-80 ℃冰箱放置2,3,7 d 的稳定性均良好。
加样回收试验:取低、中、高质量浓度质控样品溶液适量,按上述色谱与质谱条件进样测定,计算血浆中紫杉醇的质量浓度,即得实测质量浓度;取质量浓度分别为5,50,500 ng/mL 的紫杉醇标准溶液,各平行5份,同法测定,即得理论质量浓度。回收率(%)=实测质量浓度/理论质量浓度×100.00%。结果见表2。
2.4 统计学处理[22]
采用GraphPad Prism 7.04 软件绘制血药浓度-时间曲线;采用DAS 2.0软件分析各组大鼠血药浓度随时间的变化,计算药代动力学参数;采用SPSS 22.0 统计学软件分析各组间的差异,结果以±s表示,符合正态分布的数据两组间比较行独立样本t检验。P<0.05 为差异有统计学意义。
2.5 鸦胆子油乳对大鼠体内紫杉醇血药浓度的影响
与PTX 组比较,PTX + BJOE 组大鼠给药后0.5,4,8,24 h 时紫杉醇的血药浓度均显著升高(P<0.05)。结果见图2和表3。

图2 两组大鼠体内紫杉醇的血药浓度-时间曲线(n=8)Fig.2 Blood concentration - time curve of PTX in rats in the two groups(n = 8)
表3 两组大鼠给药后各时间点的血药浓度(±s,ng/mL,n=8)Tab.3 Blood drug concentrations of PTX at different time points after administration in two groups(±s,ng/mL,n=8)

表3 两组大鼠给药后各时间点的血药浓度(±s,ng/mL,n=8)Tab.3 Blood drug concentrations of PTX at different time points after administration in two groups(±s,ng/mL,n=8)
注:与PTX组比较,*P <0.05,**P <0.01。表4同。Note:Compared with those in the PTX group,*P < 0.05,**P <0.01(for Tab.3 - 4).
PTX+BJOE组7.44±3.69 84.37 ±8.20**141.04±22.95 627.49±163.94 518.83±41.86**457.13±53.23**82.68±23.93*7.58±0.88时间0.083 h 0.5 h 1 h 2 h 4 h 8 h 24 h 48 h PTX组5.88±2.40 35.56±9.34 106.97± 32.84 534.30±235.18 276.50±121.65 178.99±51.08 50.30±19.73 11.97±4.90
2.6 鸦胆子油乳对大鼠血浆中紫杉醇药代动力学参数的影响
两组大鼠达峰时间(tmax)均为(2.40±0.89)min。与PTX 组比较,PTX+BJOE 组大鼠血浆中的0-∞时血药浓度-时间曲线下面积(AUC0-∞)显著升高(P<0.05),半衰期(t1/2)显著缩短(P<0.05);达峰浓度(Cmax)升高,表观分布容积(Vd)降低,但均无显著差异(P>0.05)。结果见表4。
表4 两组大鼠血浆中的药代动力学参数(±s,n=8)Tab.4 Pharmacokinetic parameters of PTX in rat plasma in the two groups(X ± s,n = 8)

表4 两组大鼠血浆中的药代动力学参数(±s,n=8)Tab.4 Pharmacokinetic parameters of PTX in rat plasma in the two groups(X ± s,n = 8)
PTX+BJOE组2.40±0.89 634.49±163.29 7 921.25±2 438.29*0.035±0.028 0.003±0.002 7.520±1.480*参数tmax(h)Cmax(ng/mL)AUC0-∞[(h·ng)/mL]Vd(L/g)Cl[(h·g)/h]t1/2(h)PTX组2.40±0.89 576.59±184.51 4 835.92±933.44 0.065±0.014 0.004±0.001 10.100±1.300
3 讨论
中西药联用抗肿瘤在临床应用普遍[23],联用方案能提高总有效率,改善化疗药物的多药耐药,减少不良反应,提高患者的生活质量[24-26]。鸦胆子油乳联用紫杉醇抗肿瘤在临床十分常见,但中药所含成分复杂,具有多靶点、多信号通路等特点[27-28],两药联用可能存在相互作用。不良的相互作用会导致疗效降低或不良反应增加,故明确中西药间的相互作用,发掘其作用机制,是当前研究的热点与难点[29]。
本研究中探讨了鸦胆子油乳对紫杉醇药代动力学的影响,鸦胆子油乳对CYP3A4 有较强的抑制作用,紫杉醇主要经肝脏CYP3A4 代谢。结果显示,鸦胆子油乳可提高紫杉醇的Cmax和AUC0-∞,减小Vd,缩短t1/2。鸦胆子油乳为CYP3A4 抑制剂,紫杉醇主要通过该酶代谢,推测t1/2应延长,但结果不一致。闫加庆[22]研究艾迪注射液对大鼠体内紫杉醇药代动力学的影响发现,艾迪注射液提高紫杉醇的Cmax和AUC0-∞可能与其抑制CYP3A4 活性从而抑制紫杉醇的代谢有关,联用的t1/2显著短于单用,认为t1/2的大小取决于Vd和Cl的比值。故推测鸦胆子油乳联用紫杉醇存在药物相互作用,鸦胆子油乳可影响紫杉醇AUC0-∞和Cmax的提升,可增强临床疗效,t1/2的降低可能加快紫杉醇的代谢,减轻其不良反应。预测鸦胆子油乳可能会通过抑制CYP3A4而抑制紫杉醇代谢,改变紫杉醇药代动力学参数。
本研究中初步明确了鸦胆子油乳对紫杉醇药代动力学的影响,两药联用可能存在相互作用,鸦胆子油乳可能会使紫杉醇的血药浓度增大、药效增强,临床应用时需减小紫杉醇的剂量。本研究存在以下局限性。1)紫杉醇在体内主要经肝脏CYP3A4 和CYP2C8 代谢,且是P - gp 底物,需进一步考察鸦胆子油乳对CYP2C8 和P-gp的影响,评价鸦胆子油乳是否通过肝药酶、P-gp对紫杉醇药代动力学参数产生影响,鸦胆子油乳对紫杉醇的影响及其作用机制还需进一步探讨;2)本研究中以SD大鼠为给药实验模型,临床应用中受试者为人,存在种属间的差异,会导致某些药物在代谢行为和特异性方面与大鼠有差异,其相互作用的机制仍需进一步深入研究。
